Similar presentations:
Молекулярный уровень жизни химический состав клетки неорганические вещества
1.
МОЛЕКУЛЯРНЫЙ УРОВЕНЬ ЖИЗНИХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Знать:
элементарный состав клетки:
макро- и микроэлементы
неорганические вещества
клетки, их роль
Уметь:
объяснять роль различных
веществ в клетке
2.
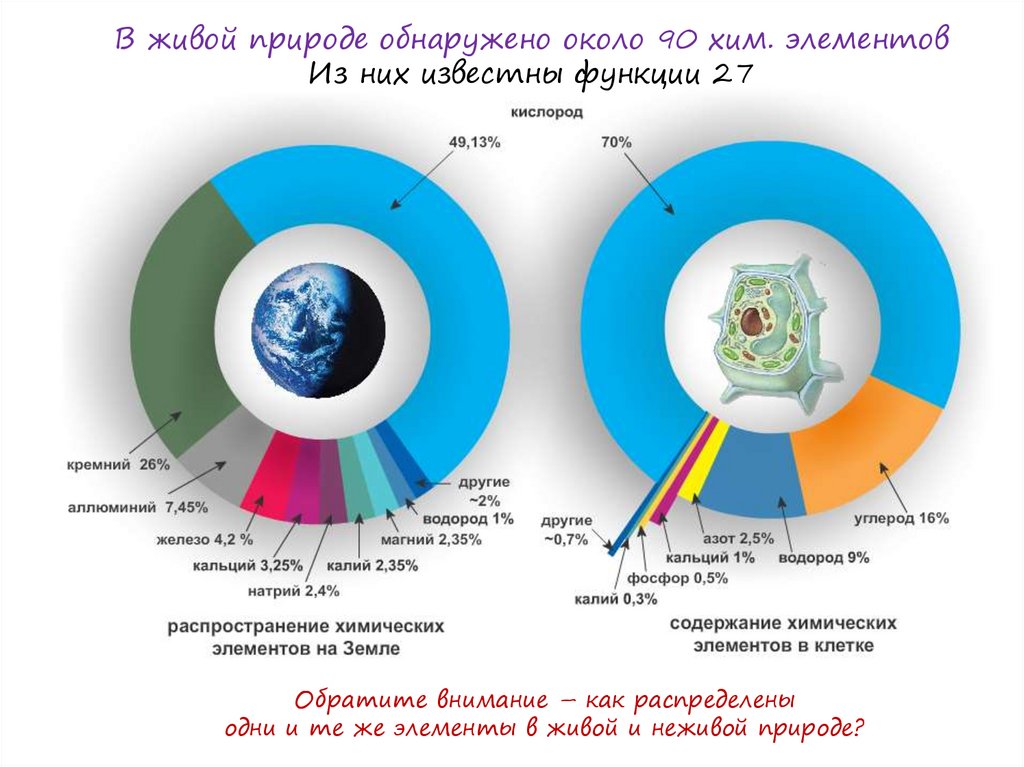
В живой природе обнаружено около 90 хим. элементовИз них известны функции 27
Обратите внимание – как распределены
одни и те же элементы в живой и неживой природе?
3.
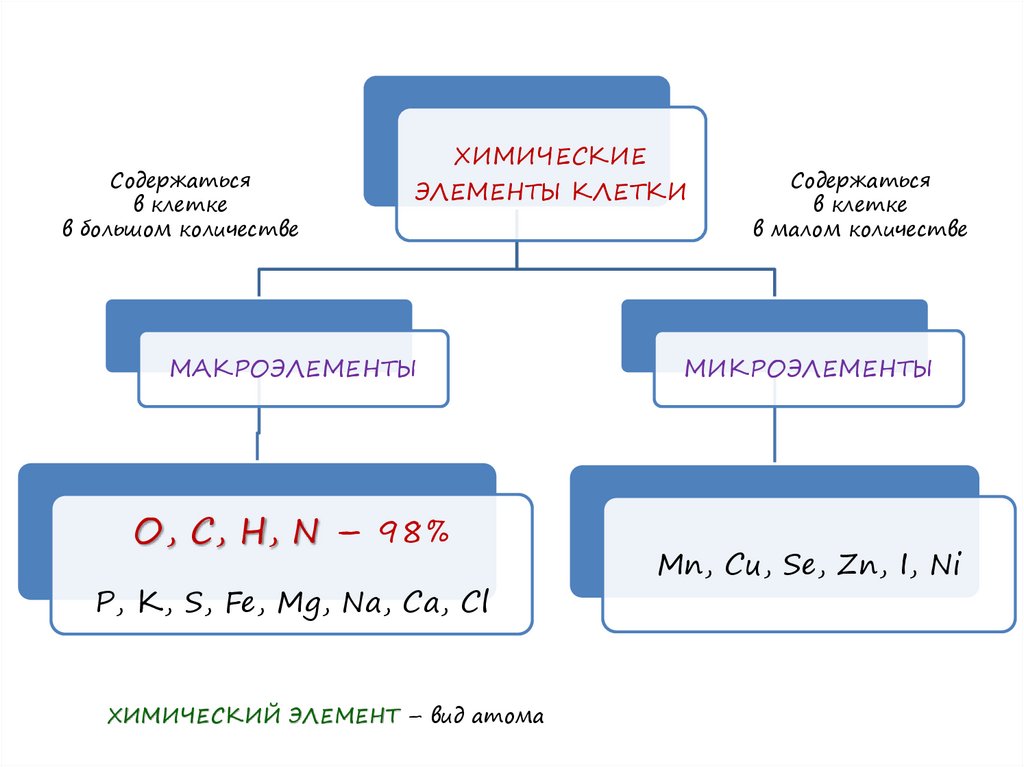
Содержатьсяв клетке
в большом количестве
ХИМИЧЕСКИЕ
ЭЛЕМЕНТЫ КЛЕТКИ
МАКРОЭЛЕМЕНТЫ
О, С, Н, N – 98%
Р, К, S, Fe, Mg, Na, Ca, Cl
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – вид атома
Содержаться
в клетке
в малом количестве
МИКРОЭЛЕМЕНТЫ
Mn, Cu, Se, Zn, I, Ni
4.
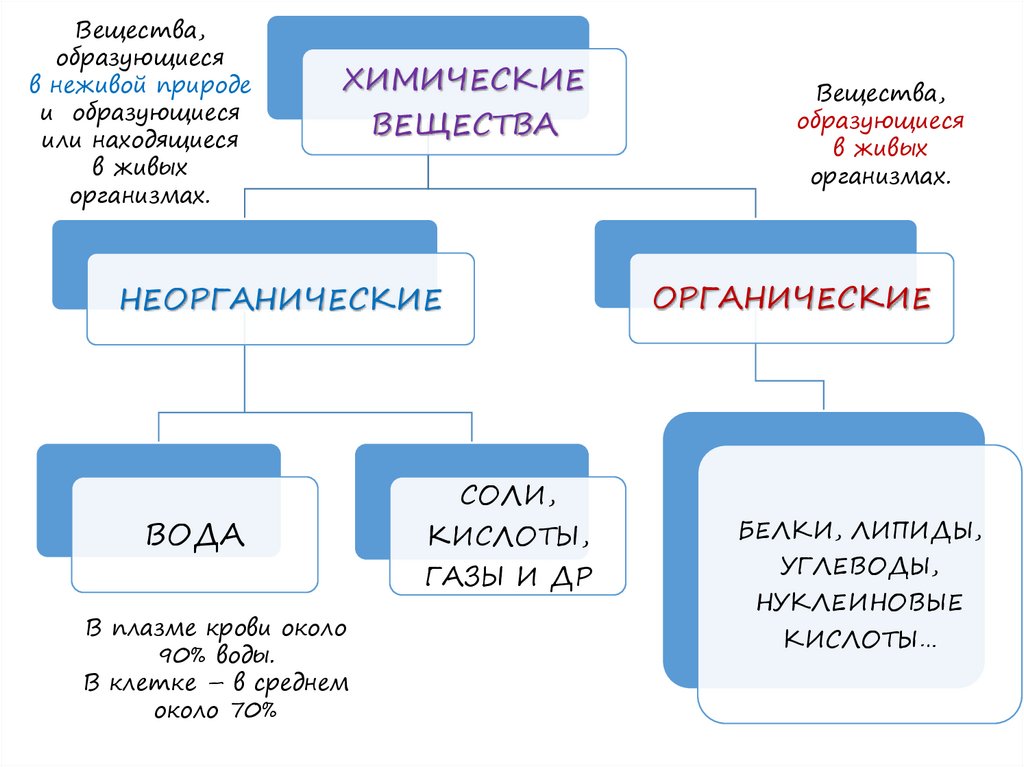
Вещества,образующиеся
в неживой природе
и образующиеся
или находящиеся
в живых
организмах.
ХИМИЧЕСКИЕ
ВЕЩЕСТВА
ОРГАНИЧЕСКИЕ
НЕОРГАНИЧЕСКИЕ
ВОДА
CОЛИ,
КИСЛОТЫ,
ГАЗЫ И ДР
В плазме крови около
90% воды.
В клетке – в среднем
около 70%
Вещества,
образующиеся
в живых
организмах.
БЕЛКИ, ЛИПИДЫ,
УГЛЕВОДЫ,
НУКЛЕИНОВЫЕ
КИСЛОТЫ…
5.
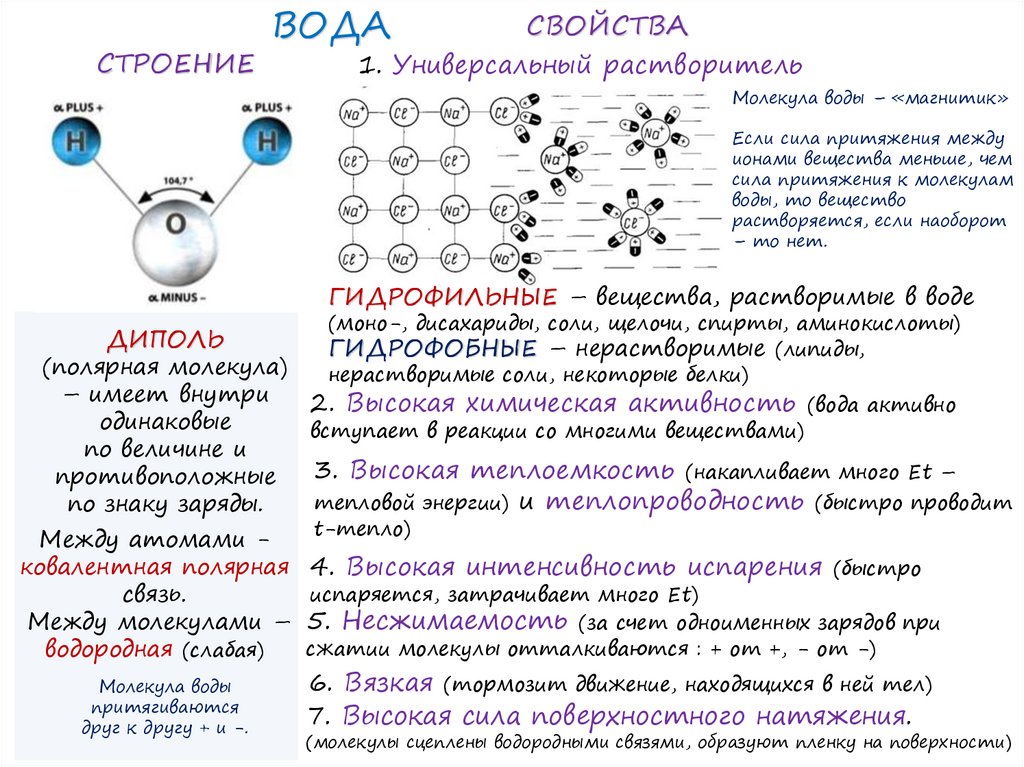
СТРОЕНИЕВОДА
СВОЙСТВА
1. Универсальный растворитель
Молекула воды – «магнитик»
Если сила притяжения между
ионами вещества меньше, чем
сила притяжения к молекулам
воды, то вещество
растворяется, если наоборот
– то нет.
ГИДРОФИЛЬНЫЕ – вещества, растворимые в воде
(моно-, дисахариды, соли, щелочи, спирты, аминокислоты)
ДИПОЛЬ
ГИДРОФОБНЫЕ – нерастворимые (липиды,
(полярная молекула)
нерастворимые соли, некоторые белки)
– имеет внутри
2. Высокая химическая активность (вода активно
одинаковые
вступает в реакции со многими веществами)
по величине и
3. Высокая теплоемкость (накапливает много Еt –
противоположные
тепловой энергии) и теплопроводность (быстро проводит
по знаку заряды.
t-тепло)
Между атомами ковалентная полярная 4. Высокая интенсивность испарения (быстро
испаряется, затрачивает много Еt)
связь.
Между молекулами – 5. Несжимаемость (за счет одноименных зарядов при
сжатии молекулы отталкиваются : + от +, - от -)
водородная (слабая)
Молекула воды
притягиваются
друг к другу + и -.
6. Вязкая (тормозит движение, находящихся в ней тел)
7. Высокая сила поверхностного натяжения.
(молекулы сцеплены водородными связями, образуют пленку на поверхности)
6.
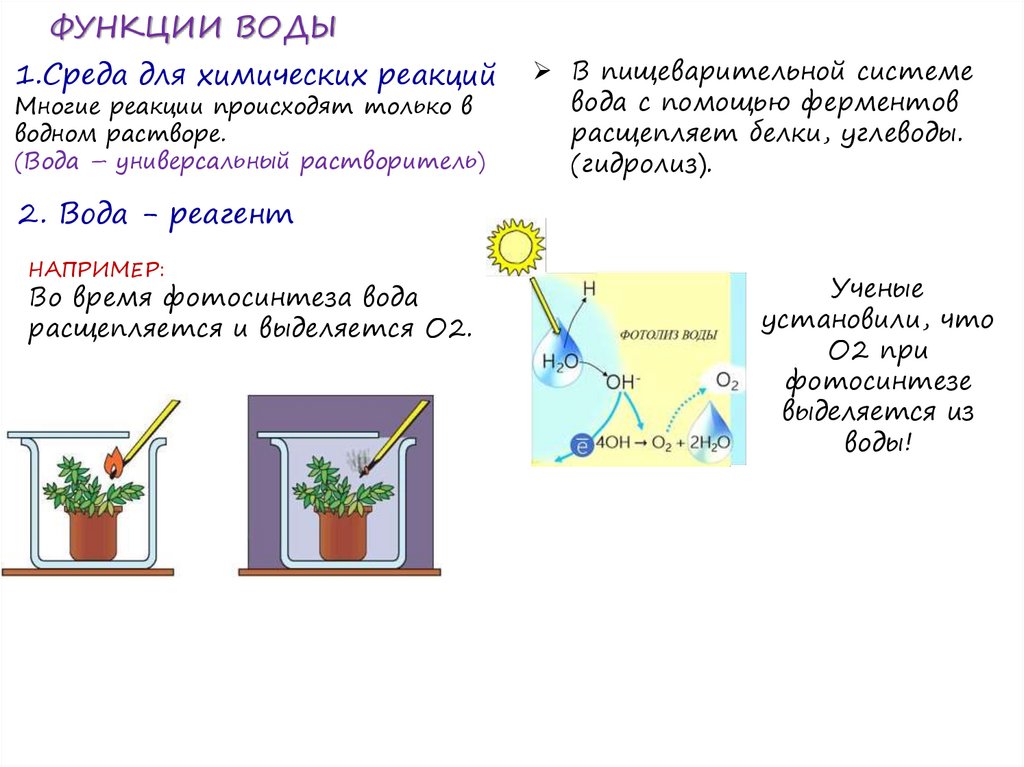
ФУНКЦИИ ВОДЫ1.Среда для химических реакций
Многие реакции происходят только в
водном растворе.
(Вода – универсальный растворитель)
В пищеварительной системе
вода с помощью ферментов
расщепляет белки, углеводы.
(гидролиз).
2. Вода - реагент
НАПРИМЕР:
Во время фотосинтеза вода
расщепляется и выделяется О2.
Ученые
установили, что
О2 при
фотосинтезе
выделяется из
воды!
7.
3. ТерморегуляцияПри испарении воды из тела выходит избыток тепловой Е и оно
охлаждается.
Обладая большой теплоемкостью, вода долго сохраняет тепло в
теле.
Облажая высокой теплопроводностью – быстро распределяет тепло
по телу.
Испарение – эндотермический процесс. Для
того, чтобы молекулы воды «оторвались» друг
от друга и разлетелись требуется Е. При
перегреве – на это используется лишняя
тепловая Е.
4. Транспорт
веществ по
организму
За счет
водородных связей
молекулы воды,
цепляясь друг за
друга
поднимаются
вверх по
растению.
Сверху, испаряясь
(отрываясь),
подтягивают
нижние.
С кровью по
организму
животного
переносятся
различные вещества
С током воды в
растении
перемещаются
минеральные соли и
органические
вещества.
5. Поддерживает форму клеток, выполняет роль гидроскелета
(за счет несжимаемости)
8.
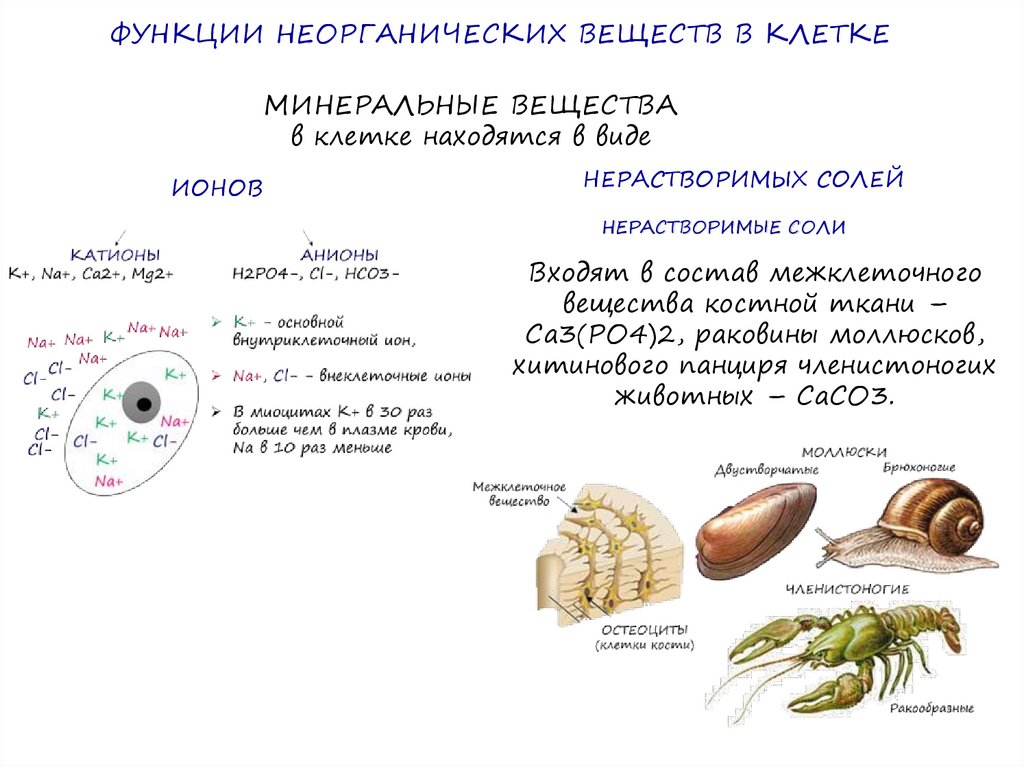
ФУНКЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ В КЛЕТКЕМИНЕРАЛЬНЫЕ ВЕЩЕСТВА
в клетке находятся в виде
ИОНОВ
НЕРАСТВОРИМЫХ СОЛЕЙ
НЕРАСТВОРИМЫЕ СОЛИ
Входят в состав межклеточного
вещества костной ткани –
Са3(РО4)2, раковины моллюсков,
хитинового панциря членистоногих
животных – СаСО3.
9.
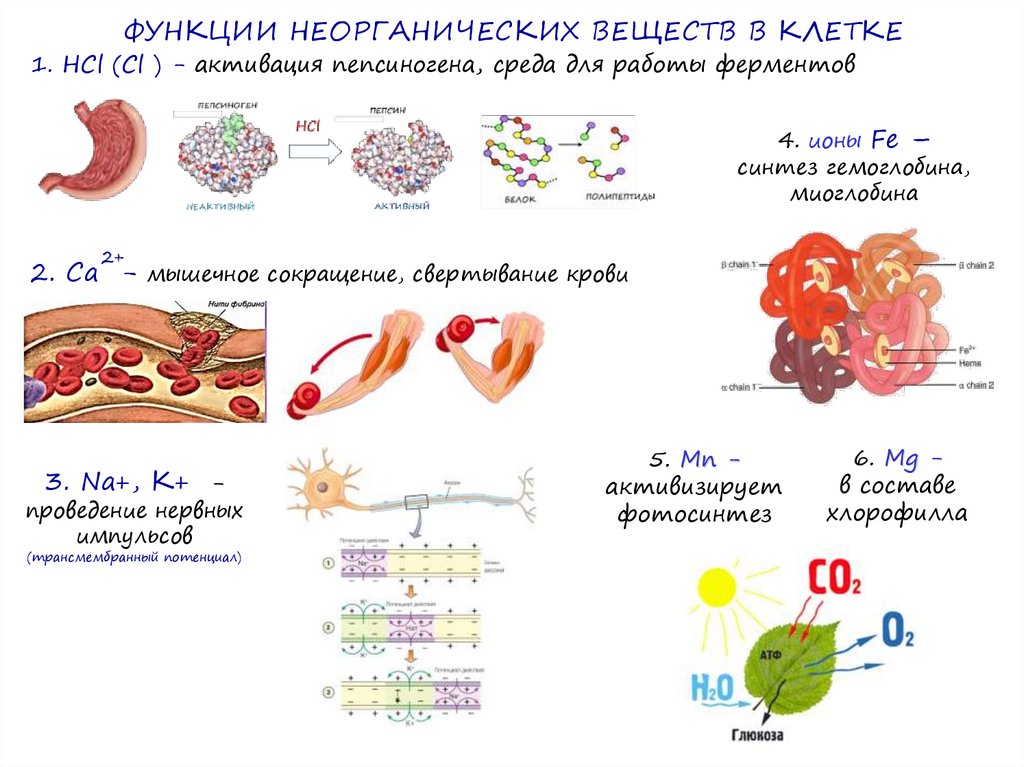
ФУНКЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ В КЛЕТКЕ1. НCl (Cl ) - активация пепсиногена, среда для работы ферментов
4. ионы Fe –
синтез гемоглобина,
миоглобина
2+
2. Са - мышечное сокращение, свертывание крови
3. Na+, К+ -
проведение нервных
импульсов
(трансмембранный потенциал)
5. Mn активизирует
фотосинтез
6. Mg в составе
хлорофилла


 chemistry
chemistry








