Similar presentations:
Металлы – простые вещества
1. Металлы – простые вещества
2. Физические свойства
кроме ртутитвёрдые вещества
ковкие,
пластичные,
тягучие вещества
имеют
металлический
блеск
тепло- и
электропроводны
3. Металлическая химическая связь
М0 – n еМn+
атомы
металла
ионы
металла
•связь в металлах и сплавах
между атом-ионами
посредством
обобществлённых электронов
называют металлической
•металлическая связь не обладает направленностью
и насыщаемостью.
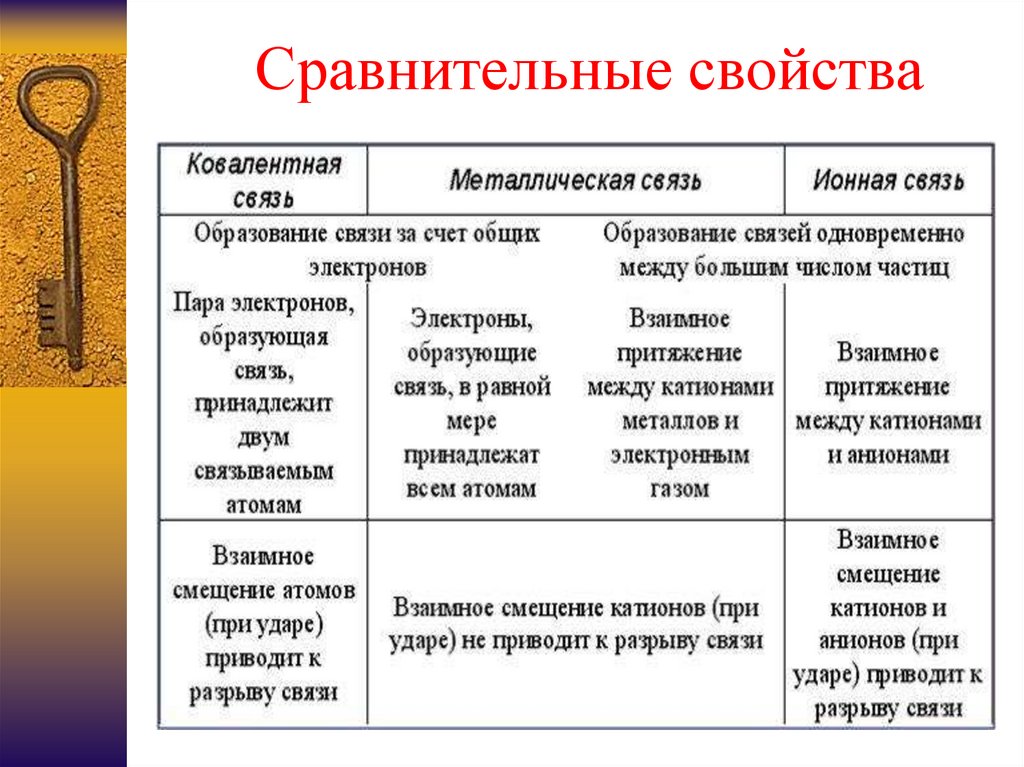
4. Сравнительные свойства
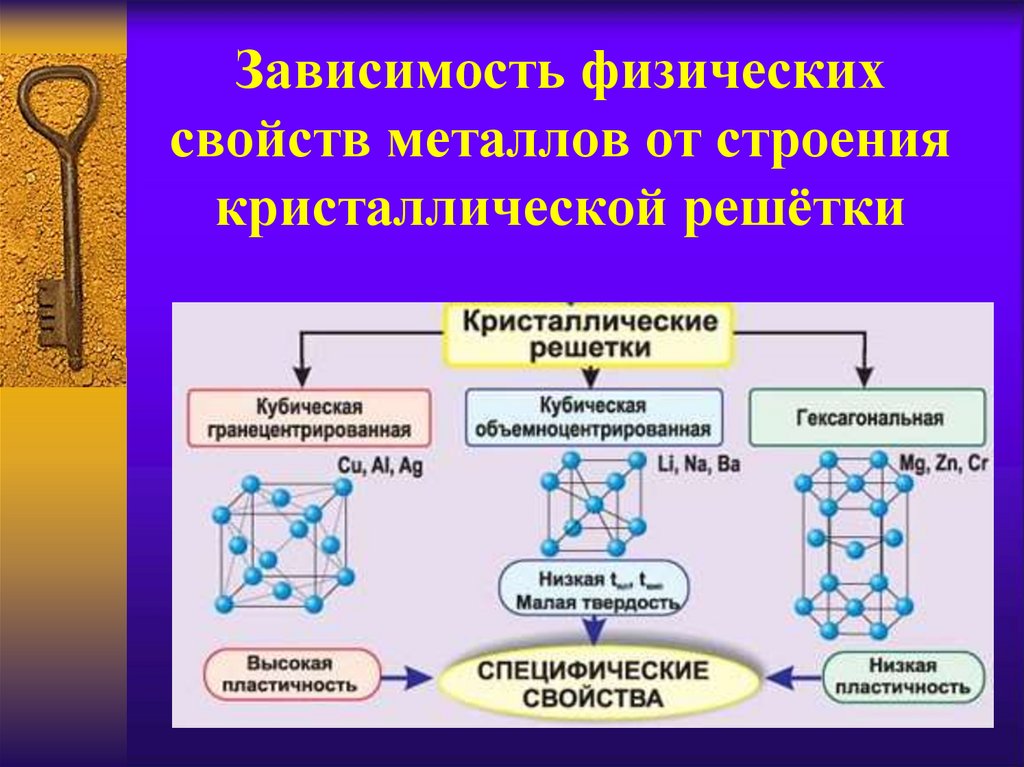
5. Кристаллические решётки металлов
кубическаягранецентрированная –
железо (медь,
никель,серебро и др.)
кубическая
объёмноцентрированная
- натрий (вольфрам,
хром,ванадий и др.)
гексагональная – ртуть
(магний,титан,цинк и
др.)
6. Зависимость физических свойств металлов от строения кристаллической решётки
7. Металлический блеск
металлическийблеск
–
электроны,
заполняющие
межатомное
пространство
отражают световые лучи, а не пропускают как
стекло.
Поэтому
все
металлы
в
кристаллическом
состоянии
имеют
металлический блеск.
8. Ковкость и пластичность
Механическое воздействие на кристалл сметаллической решеткой вызывает только
смещение слоев атомов и не сопровождается
разрывом
связи,
и
поэтому
металл
характеризуется высокой пластичностью
9. Обладают тепло- и электропроводностью
Хаотически движущиеся электроны поддействием
электрического
поля
приобретают направленное движение, в
результате чего возникает электрический
ток.
10. Классификация металлов по физическим свойствам
СвойствоКлассификационные группы
Примеры
Электропро
водность
С высокой электропроводностью
Ag, Cu, Au, Al, Mg
С низкой электропроводностью
Mn, Pb, Hg
Температура
плавления
Легкоплавкие
Hg, Ga, Cs, In, Bi
tпл(Hg) =-38,9°С
Тугоплавкие
W, Mo,V,Cr
tпл (W) = 3420 °С
Лёгкие
Li, K, Mg, Na
ρ (Li) =0,53 г/см3
Тяжёлые
Os, Ir, Pb
ρ (Os) =22,6 г/см3
Мягкие
In, Na, K, Rb
(режутся ножом)
Твёрдые
Mo, Cr
(царапают стекло)
Плотность
Твёрдость
11. Магнитные свойства металлов
Ферромагнетики– металлы способные
сильно намагничиваться и долго сохранять
это свойство (Fe, Co, Ni).
Парамагнетики – слабо намагничиваются и
не сохраняют это состояние вне магнитного
поля (щелочные, щелочно-земельные и
большая часть переходных металлов).
Диамагнетики – металлы, выталкиваемые
магнитным полем (Cu, Аg, Au, Bi).
12. Это интересно…
плотность самоголёгкого металла
лития равна 0,53
г/см3;
литий настолько
лёгок, что плавает в
керосине;
плотность самого
тяжёлого металла
осмия равна 22,6 г/см3
13. Вопросы для самоконтроля
Какое положение в периодической системезанимают металлы и почему?
Какую химическую связь называют
металлической?
Какими общими физическими свойствами
обладают простые вещества металлы? Почему?
Назовите самый тугоплавкий и легкоплавкий
металлы?
Назовите самый лёгкий и тяжёлый металлы?
Какие металлы являются лучшими проводниками
электрического тока?
Как можно использовать общие физические
свойства металлов?
14.
Тест1) Электронная формула кальция.
а) 1S² 2S² 2P 3S¹
б) 1S² 2S²2P 3S²
в) 1S² 2S² 2P 3S² 3P 4S¹
г) 1S² 2S² 2P 3S ²3P 4S²
2) Электронную формулу 1S²2S² 2P 3S² 3P 4S² имеет атом:
а)Na
б)Са
в)Cu
г)Zn
3) Электронная формула наиболее активного металла:
а) 1S² 2S²
б) 1S² 2S² 2P 3S²
в) 1S² 2S² 2P 3S² 3P 3d 4S²
г) 1S² 2S² 2P 3S² 3P 4S²
4) Металлы при взаимодействий с неметаллами
проявляют свойства:
а) окислительные;
б) восстановительные;
в) и окислительные, и восстановительные;
г) не участвуют в окислительно-восстановительных реакциях.
5) В периодической системе типичные металлы расположены в:
а) верхней части
б) нижней части
в) правом верхнем углу
г) левом нижнем углу












 chemistry
chemistry








