Similar presentations:
Окислительно-восстановительные реакции в школьном курсе неорганической и органической химии при подготовке к ЕГЭ
1.
Работу выполнил: учитель химииМОУ «Красногвардейской средней
общеобразовательной школы №1»
Уткин Е. А.
2.
Al2(SO3)3 - найдите степень окисления серы?Расставляем нам известные степени окисления. Неизвестную с.о.
обозначим за Х.
+3 х -2
Al2(SO3)3
Мы знаем, что сумма с.о. в простом веществе =0. Получаем уравнение с
одной неизвестной. +3•2+(х+(-2) •3) •3=0
х=+4
3.
1.Степень окисления любого элемента в простом веществе равна 0.2.Сумма степеней окисления всех атомов, входящих в состав частицы
(молекул, ионов и т. Д. ) равна заряду этой частицы. В частности, сумма
степеней окисления всех атомов в составе нейтральной молекулы равна
0. (К2МnО4 – определите степень окисления марганца. (+1)• 2 + Х + (2)• 4 = 0 Х=+6, NH4+ – определите степень окисления азота. Х+(+1)
4 = +1 Х=-3
3.Если соединение образовано двумя элементами, то у элемента с большей
электроотрицательностью степень окисления меньше нуля, а у элемента с
меньшей электроотрицательностью – больше нуля. (Ca+2,N-3, C+4, S-2, I+1,
Cl-1 ).
4.Максимальная положительная степень окисления любого элемента равна
номеру группы в периодической системе элементов, а минимальная
отрицательная равна N – 8, где N – номер группы.
4.
5.Для простых ионов их заряд совпадает со степеньюокисления атома Al2(SO4)3 - заряд иона алюминия+3,
степень окисления
6.Степень окисления фтора в соединениях равна-1.
7.Степень окисления щелочных металлов (лития, натрия,
калия, рубидия, цезия) равна +1, металлов главной
подгруппы II группы периодической системы (магния,
кальция, стронция, бария) равна +2, степень окисления
алюминия равна +3.
8.Степень окисления водорода в соединениях равна
+1(исключение – соединения с металлами NaH, CaH2, в
этих соединениях степень окисления у водорода равна -1).
9.Степень окисления кислорода равна –2 (исключения –
перекиси H2O2, Na2O2, BaO2 в них степень окисления
водорода равна -1, а в соединении с фтором - +2).
5.
Схема присоединения или отдачи электроновОтдача электронов, окисление, -ne
Присоединение электронов, восстановление, +nе
Х
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
6.
Группа окислителейЭлектрический ток на аноде
Галогены в высших положительных
степенях окисления
Галогены в промежуточных
положительных степенях окисления
Халькогены и другие неметаллы в
положительных степенях окисления
Неметаллы – простые вещества
(нулевая степень окисления)
Неметаллы в промежуточных
отрицательных степенях окисления
Металлы в высших положительных
степенях окисления
Металлы в промежуточных
положительных степенях окисления
Химические элементы
+ 7 +7 +7
CI, Br, I
+ 1 +3 +5 +5 +5
CI, CI, Cl, Br, I.
+6 + 4 +5
S,
S, N
0 0 0 0 0
F, С, О, S, Вг
-1 -2
O, N
+ 7 +6 +4
Mn, Cr, Sn
+2
Fe,
+1
Cu,
+2
Sn
Примеры веществ
НClO4, HBr04,HJO4
КClO3, HClO, NaBr03
H2S04, S02, HN03
F2, Cl2, 03, 02, S, Br2
H202, Ba02, N2H4
KMn04, K2Cr04, H2Cr207,
SnCl4
FeCl2, Cu2Cl2, SnS04
7.
Группа восстановителейХимические элементы
Электрический ток на катоде
Металлы – простые вещества
0 0 0
(нулевая степень окисления)
Na, Ba, Fe
Неметаллы в низшей
-1 -3 -2
отрицательной степени окисления
Cl, N, S
Металлы в промежуточных
+2 +2 +1
положительных степенях окисления
Fe, Cr, Cu
Неметаллы в промежуточных
- 1 -2
отрицательной степени окисления
О, N
Неметаллы – простые вещества
0 0 0 0
(нулевая степень окисления)
S, P, C, I
Неметаллы в промежуточных
+3 +4 +2
положительных степенях окисления
Р, S, C
Примеры веществ
Na, Ba, Fe
НCl, NH3, ZnS
FeSO4, CrCl2, Cu2Cl2
H2O2, N2H4
S, P4, C, I2
PCl3, SO2, CO
8.
Любая окислительно–восстановительная реакцияпротекает в сторону образования более слабого
окислителя, и более слабого восстановителя.
По сравнительной способности принимать
электроны вещества располагаются в ряд
окислителей:
KМnO4 → H2O2 → Cl2 → K2Cr2O7 → Br2 →
KIO3 → HNO3 → I2
По сравнительной способности отдавать электроны
вещества располагаются в ряд восстановителей:
H2S → SnCl2 → HI → HBr → FeSO4 → Cr2(SO4)3
→ HCl → MnSO4
9.
Составить схему реакции.Mg + H2SO4 → MgSO4 + H2S + Н2О
Определить степени окисления элементов в реагентах и продуктах реакции.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 +Н2+1О-2
Определить, является реакция окислительно-восстановительной или она протекает без
изменения степеней окисления элементов.
Подчеркнуть элементы, степени, окисления которых изменяются.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + Н2+1О-2
Определить, какой элемент окисляется, (его степень окисления повышается) и какой
элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Mg0 → Mg+2 окисляется
S+6 → S-2 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение
электронов от атома элемента) и процесс восстановления (смещение электронов к атому
элемента)
Mg0 – 2 ē → Mg+2 окисление
S+6 + 8 ē → S-2
восстановление
10.
Определить восстановитель и окислитель.Mg0 – 2 ē → Mg+2 восстановитель
S+6 + 8 ē → S-2
окислитель
Сбалансировать число электронов между окислителем и восстановителем.
Mg0 – 2 ē → Mg+2
8
S+6 + 8 ē → S-2
Определить коэффициенты для окислителя и восстановителя, продуктов
окисления и восстановления.
Mg0 – 2 ē → Mg+2
4
8
S+6 + 8 ē → S-2
1
Расставить коэффициенты перед формулами окислителя и восстановителя.
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
Проверить уравнение реакции. Посчитаем количество атомов кислорода
справа и слева, если их будет равное количество – уравнение мы уравняли.
5 • 4 = 20
4 • 4 + 4 = 20
11.
12.
Окислительно-восстановительные реакции зависят:От водородного показателя:
Например:
КМnО4 в кислой среде восстанавливается до Mn2+
(бесцвет)
в нейтральной среде до MnO2 (бурокоричневый)
в щелочной среде до MnO42- (зеленый)
К2Сr2O7
в кислой среде восстанавливается до Cr3+
в нейтральной среде до Сr2O3
в щелочной среде до CrO42-
13.
Окислительно-восстановительные реакции ворганической химии связано либо с
образованием связей по кислороду, либо с
отщеплением водорода.
Правило образование связей:
- ОН → -1е
=О → -2е
отщепление 1атома Н → -1е
14.
Пример 1: C2H5OH + KMnO4 + H2SO4 → C2H4O +K2SO4 + MnSO4 + H2O
C – 2e → C
2 5 восстановитель
Mn+7 + 5e → Mn+2 5 2 окислитель
углерод потерял один атом водорода
и образовалась еще 1связь с кислородом
5C2H5OH + 2KМnO4 + 3H2SO4 → 5C2H4O + K2SO4
+ 2MnSO4 + 8H2O
15.
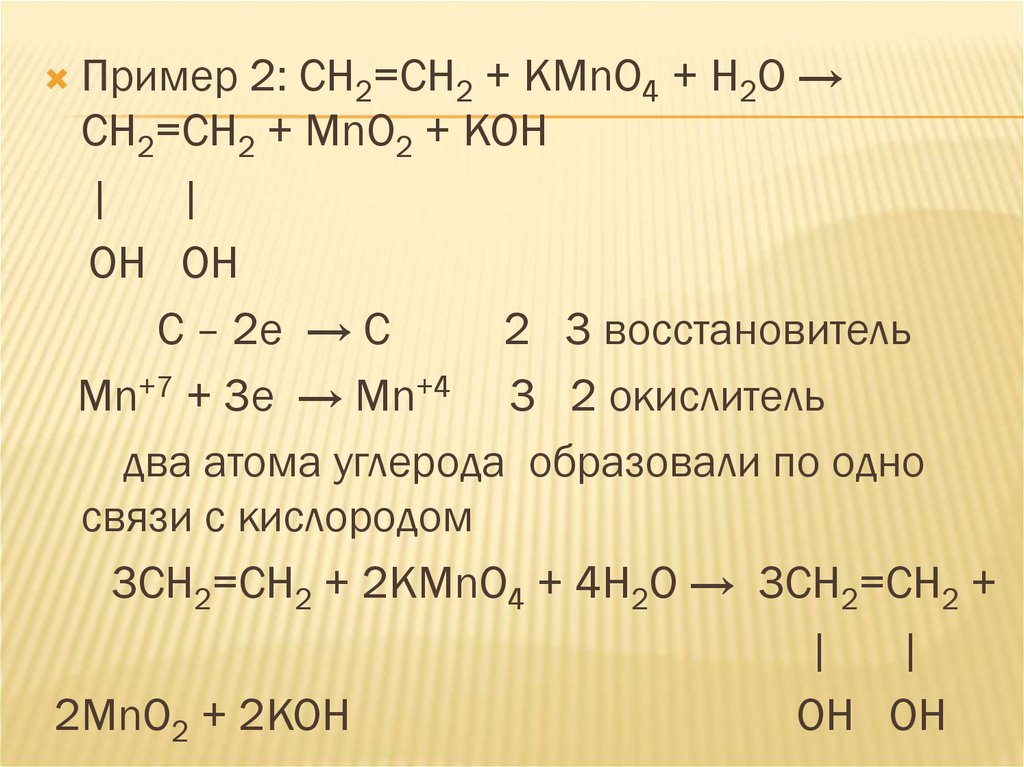
Пример 2: СН2=СН2 + KМnO4 + Н2О →СН2=СН2 + MnO2 + KOH
| |
ОН ОН
C – 2e → C
2 3 восстановитель
Mn+7 + 3e → Mn+4 3 2 окислитель
два атома углерода образовали по одно
связи с кислородом
3СН2=СН2 + 2KМnO4 + 4Н2О → 3СН2=СН2 +
| |
2MnO2 + 2KOH
ОН ОН
16.
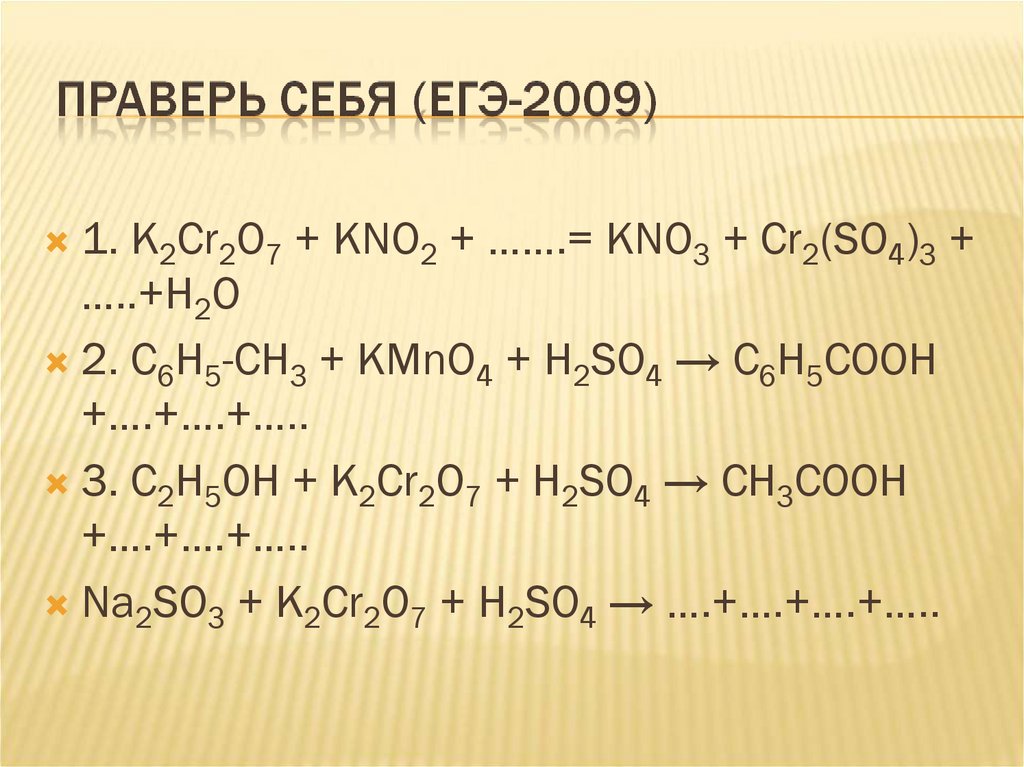
1. K2Cr2O7 + KNO2 + …….= KNO3 + Cr2(SO4)3 +…..+H2O
2. C6H5-CH3 + KMnO4 + H2SO4 → C6H5COOH
+….+….+…..
3. С2Н5ОН + К2Сr2O7 + H2SO4 → CH3COOH
+….+….+…..
Na2SO3 + К2Сr2O7 + H2SO4 → ….+….+….+…..













 chemistry
chemistry








