Similar presentations:
Химическая кинетика
1.
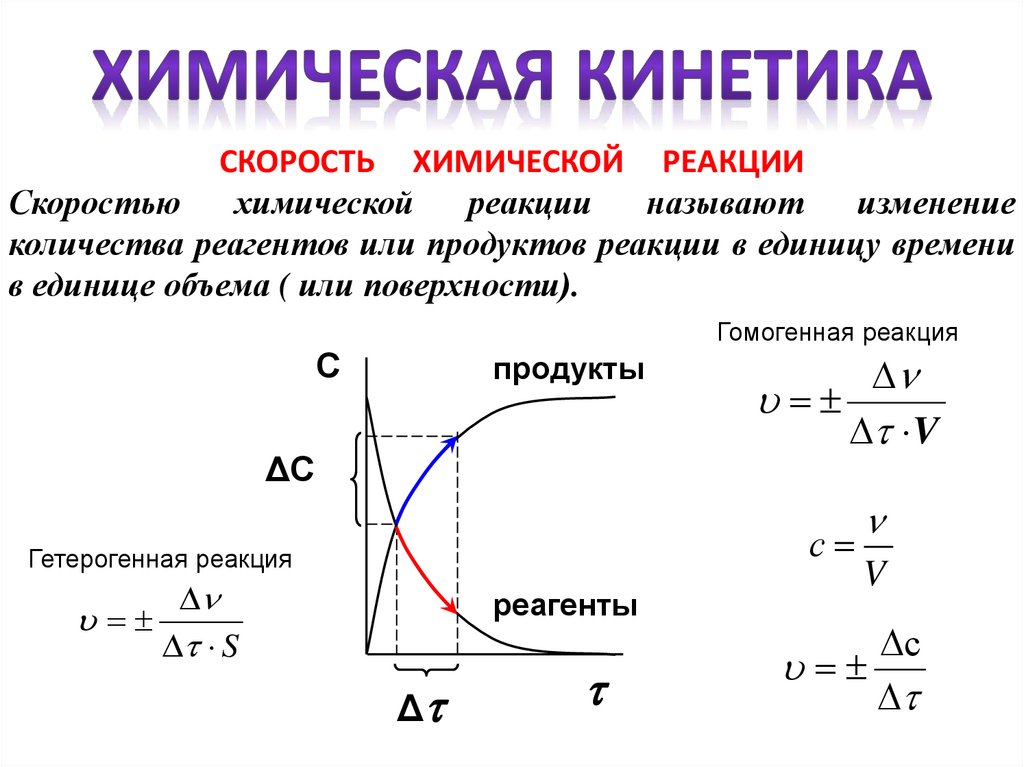
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИСкоростью
химической
реакции
называют
изменение
количества реагентов или продуктов реакции в единицу времени
в единице объема ( или поверхности).
Гомогенная реакция
С
продукты
ΔС
с
Гетерогенная реакция
V
S
реагенты
Δ
V
с
2.
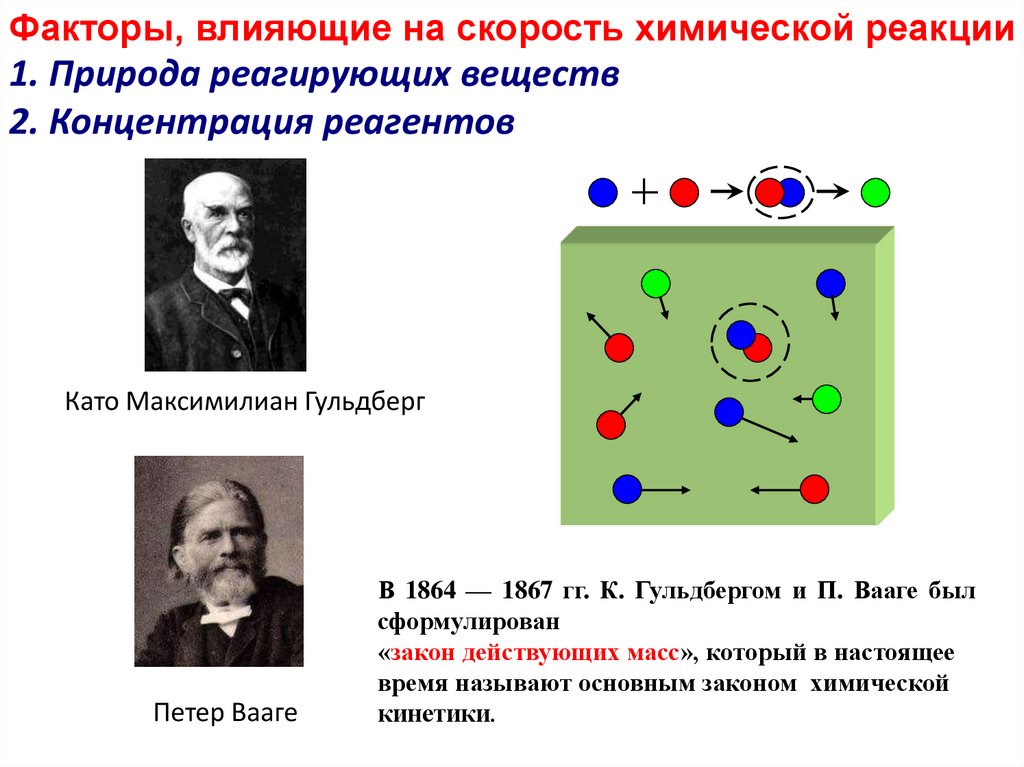
Факторы, влияющие на скорость химической реакции1. Природа реагирующих веществ
2. Концентрация реагентов
Като Максимилиан Гульдберг
Петер Вааге
В 1864 — 1867 гг. К. Гульдбергом и П. Вааге был
сформулирован
«закон действующих масс», который в настоящее
время называют основным законом химической
кинетики.
3.
Скорость химической реакции прямопропорциональна произведению концентраций
реагирующих веществ в степенях, равных их
стехиометрическим коэффициентам.
Концентрации твердых веществ в выражении закона
действующих масс приравниваются к единице
mM+ nN =rR+qQ ,
m
n
=k·cM ·cN ,
v
где k – константа скорости реакции,
v-скорость реакции
4.
3. ТемператураЯкоб Хендрик Вант-Гофф - первый
лауреат Нобелевской премии по химии
(1901 год)
«В знак признания огромной важности
открытия законов химической
динамики и осмотического давления в
растворах».
Сванте Август Аррениус
Является одним из основателей новой
науки - физической химии.
Больше всего он занимался изучением
поведения электролитов в растворах, а
также исследованием скорости
химических реакций.
5.
Правило Вант-Гоффа: При повышении температуры на каждыедесять градусов скорость химической реакции возрастает в 2-4
раза:
γ- температурный коэффициент Вант-Гоффа, Т1, Т2 – значения
температуры.
Уравнение Аррениуса устанавливает строгую функциональную
зависимость константы скорости реакции от температуры и
энергии активации реакции.
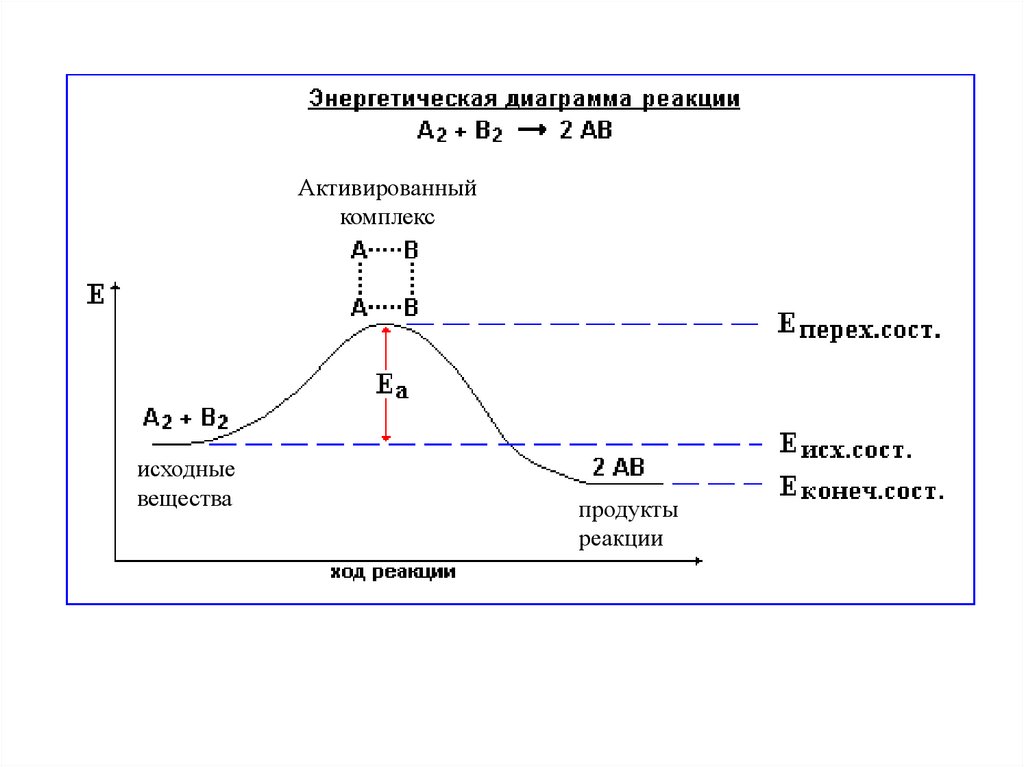
Энергия активации Ea - минимальная энергия, которой должны
обладать молекулы реагирующих веществ, чтобы вступить во
взаимодействие.
A –предэкспоненциальный множитель, R – универсальная газовая
постоянная.
6.
Активированныйкомплекс
исходные
вещества
продукты
реакции
7.
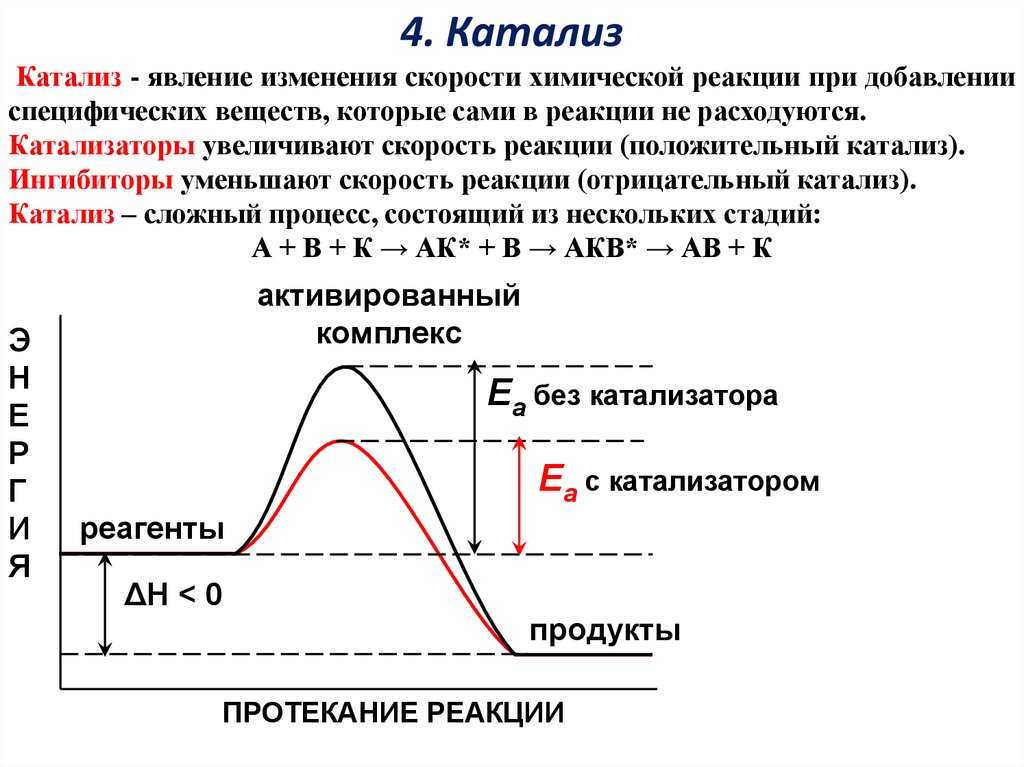
4. КатализКатализ - явление изменения скорости химической реакции при добавлении
специфических веществ, которые сами в реакции не расходуются.
Катализаторы увеличивают скорость реакции (положительный катализ).
Ингибиторы уменьшают скорость реакции (отрицательный катализ).
Катализ – сложный процесс, состоящий из нескольких стадий:
А + В + К → АК* + В → АКВ* → АВ + К
Э
Н
Е
Р
Г
И
Я
активированный
комплекс
Еа без катализатора
Еа с катализатором
реагенты
ΔН < 0
продукты
ПРОТЕКАНИЕ РЕАКЦИИ
8.
5. ДавлениеВлияние давления проявляется только по отношению к
системам, содержащим газообразные компоненты.
6. Степень дисперсности (раздробленности) компонентов
Гомогенной называется система, в которой составные части
находятся в одном фазовом состоянии.
Гетерогенной называется система, в которой составные части
находятся в разных фазовых состояниях.
Фаза – это однородная часть системы, ограниченная
поверхностью раздела.
9.
ХИМИЧЕСКОЕРАВНОВЕСИЕ
Химические реакции, протекающие одновременно в
прямом и обратном направлениях, называют обратимыми.
СА,Б
СВ
τ
Состояние системы, когда скорости прямой и обратной реакций
равны, называют химическим равновесием.
Для системы, находящейся в химическом равновесии,
концентрации веществ, температура и другие параметры системы не
изменяются со временем.
Концентрации веществ в этом состоянии называют равновесными и
обозначают с помощью квадратных скобок:
сA = [A].
10.
aA + bBlL +mM
В состоянии химического равновесия:
a
b
l
m
k A B k L M
Преобразуя равенство, получим выражение для
константы равновесия K
l
m
k L M
K
a
b
k A B
11.
Смещение химического равновесия происходит при изменениискорости прямой или обратной реакции.
Анри Луи
Ле Шателье
В 1884г. Ле Шателье сформулировал термодинамический принцип
подвижного равновесия:
Если на систему, находящуюся в состоянии химического равновесия,
воздействовать извне, изменяя какое-нибудь из условий
(температура, давление, концентрация), то равновесие смещается
таким образом, чтобы уменьшить данное воздействие.







 chemistry
chemistry








