Similar presentations:
Металлы в природе. Общие способы получения металлов. 11 класс
1.
Методические рекомендациик уроку химии в 11 классе
по теме: «Металлы в природе. Общие способы
получения металлов»
(номинация - педагогические идеи и технологии:
среднее образование)
Автор: учитель химии
МБОУСОШ№2 с. Дивное
Апанасенковский район
Дьяченко Елена Николаевна
1
2.
Актуализация опорных знанийКакую тему начали изучать на прошлом уроке?
В каком виде металлы встречаются в природе, чем это
определяется?
Что вы знаете о металлургии?
Что называют рудами и какими способами из руды
извлекают металлы?
2
3.
Тема урока:« Металлы в природе.
Способы получения
металлов»
3
4.
С развитием производства металлов исплавов связано возникновение
цивилизаций:
■Медный век
■Бронзовый век
■Железный век
5.
Самые известныепамятники Древнего
мира египетские
пирамиды – огромные
каменные гробницы
фараонов
Каменные пирамиды являются творениями
медного века, так как для сооружения пирамид
использовали медные орудия труда
5
6.
Обратите внимание,медь – первый металл, который стали использовать для
изготовления орудий труда и оружия.
6
7.
Почему медь, а не железо?Железо более распространенный
в природе металл, чем медь.
Массовая доля железа
4,1%.
Меди всего лишь
0,005%.
Объясняется это двумя факторами
Подумайте: какими факторами это объясняется?
Во-первых, медь встречается в природе в самородном состоянии
Во-вторых, медь можно легко получить из медной руды.
7
8.
Представьте,как древние люди на костре могли
получить медь из медной руды
Минералы куприт и малахит
содержат сульфидную медь(II)
Напишите уравнение обжига минерала
с целью перевода сульфида меди (II) в оксид меди(II)
Напишите уравнение восстановления
металлической меди из оксида меди (II)
8
9.
Проверьте правильность составления уравненийреакций
t
2CuS + 3O2 = 2CuO + 2SO2
(1 балл)
CuO + C = Cu + CO
(1 балл)
9
10.
Получение металлическоймеди восстановлением оксида меди(II) углем
Лабораторный опыт 1.
I). Лабораторный опыт
проводится учениками
предварительно, потому что
процесс нагревания занимает
длительное время.
II). На уроке демонстрируются
результаты лабораторного опыта.
10
11.
Насыпаем в фарфоровую чашкучерный порошок оксида меди(II)
и активированный уголь
Нагревание производим
длительное время без доступа
воздуха
Нагреваем до тех пор пока
порошок не станет красным
11
12.
Лабораторный опыт 1. Получение металлической медивосстановлением оксида меди(II) углем
III). Укажите признаки
протекающей реакции.
IV). Составьте уравнение
реакции данного процесса.
12
13.
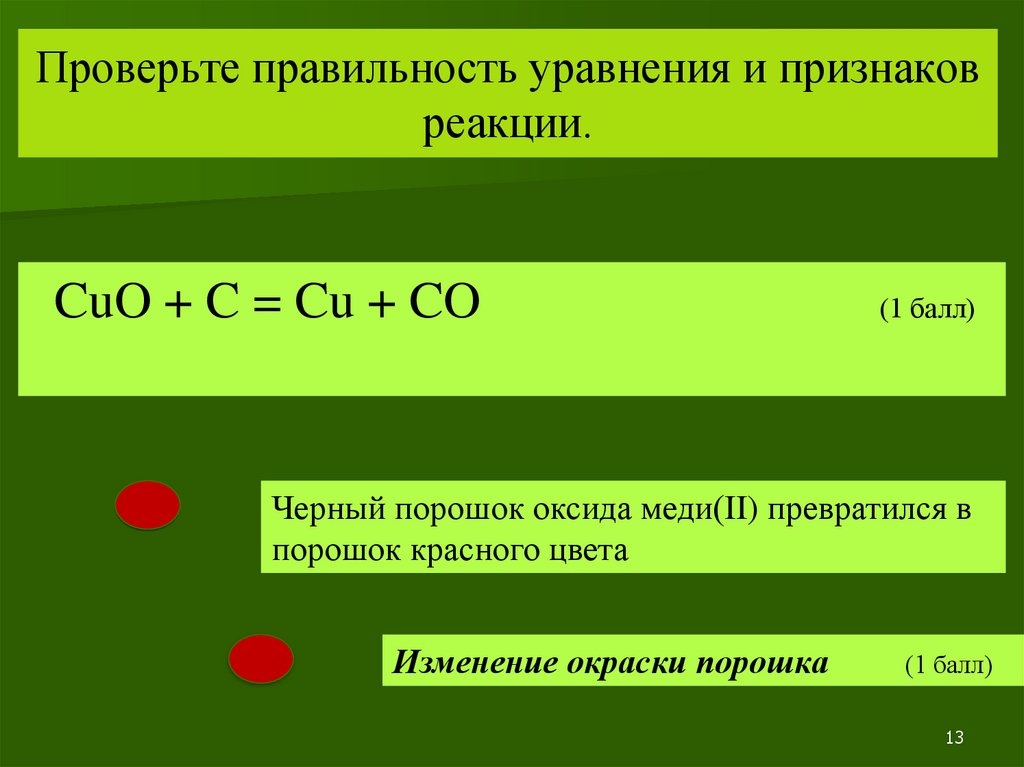
Проверьте правильность уравнения и признаковреакции.
CuO + C = Cu + CO
(1 балл)
Черный порошок оксида меди(II) превратился в
порошок красного цвета
Изменение окраски порошка
(1 балл)
13
14.
Этимология слова«металл»
14
15.
Происхождение термина «металл»В начале XXVII века
М. В. Ломоносов
насчитывал семь
металлов. (Au, Ag, Cu,
Sn, Fe, Pb,Hg) и
определял «металл
как светлое
тело, которое
ковать можно..»
15
16.
В природе металлы могут встречаться■Только в свободном (самородном) виде (благородные
металлы - Au золото, Pt платина);
В самородном виде и в виде соединений
(Ag серебро, Cu медь, Hg ртуть, Sn
олово и малоактивные металлы );
Только в виде соединений (металлы, стоящие в ряду
напряжений до Sn олова).
16
17.
1718.
Нахождение железа в природе18
19.
Минералы и горные породы,содержащие металлы или их
соединения
и пригодные для промышленного
получения металлов, называются
рудами
19
20.
В состав руд металлывходят в виде
Солей
Оксидов
20
21.
Способы получения металловМеталлургия
Пирометаллургия
Пирометаллургия
Электрометаллургия
Гидрометаллургия
Металлотермия
Электрометаллургия
21
22.
ПирометаллургияВ XIX веке русским
учёным Н. Н. Бекетовым
был научно обоснован и
предложен
пирометаллургический
метод получения
металлов.
22
23.
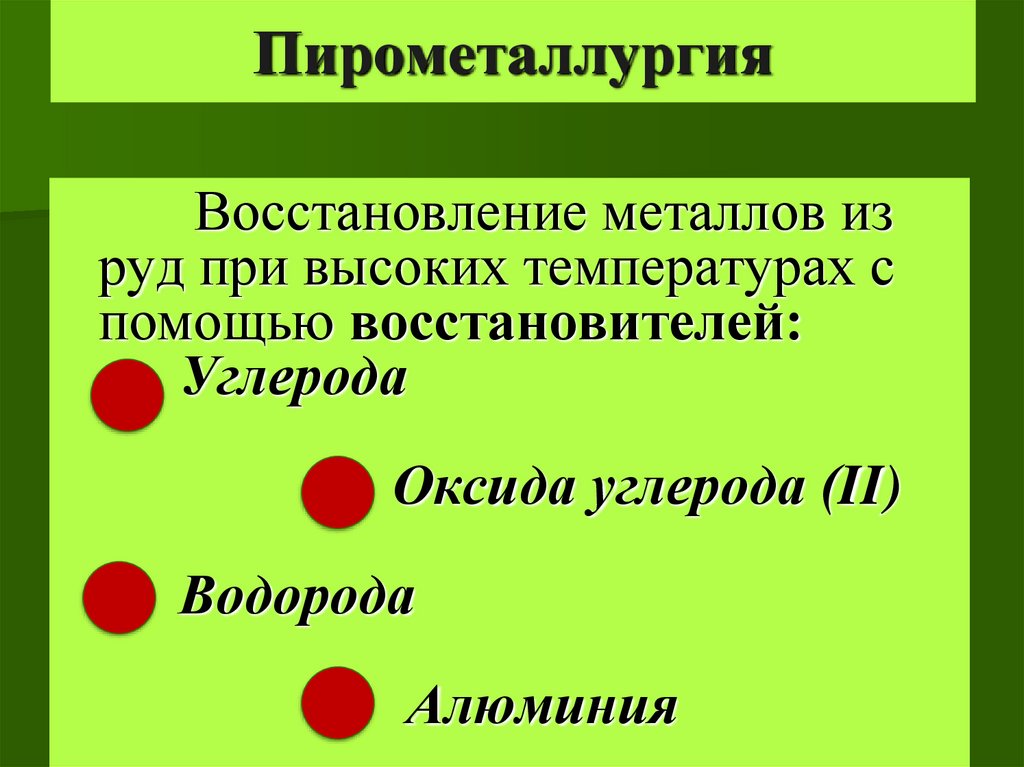
ПирометаллургияВосстановление металлов из
руд при высоких температурах с
помощью восстановителей:
Углерода
Оксида углерода (II)
Водорода
Алюминия
23
24.
ПирометаллургияЛабораторный опыт 1
« Получение
металлической меди
восстановлением оксида
меди(II) углем»
демонстрирует
пирометаллургический
способ получения металлов.
24
25.
В 1863 году Н. Н. Бекетов составил «вытеснительный ряд»,который является прототипом электрохимического ряда
напряжений металлов.
Впервые осуществил
металлотермические
опыты получения металлов
Открыл процесс вытеснения
металлов из растворов солей под
действием других металлов
Установил закономерность «…каждый
предыдущий металл активнее последующего и
вытесняет менее активные металлы из
растворов солей или расплавов оксидов
БЕКЕТОВ Николай
Николаевич
(1827-1911)
25
26.
1 стадия: обжиг с цельюперевода сульфидов в
оксиды
ZnS + O2 → ZnO + SO2
2 стадия:
восстановление
металлов из оксидов
ZnO + CO → Zn + CO2
26
27.
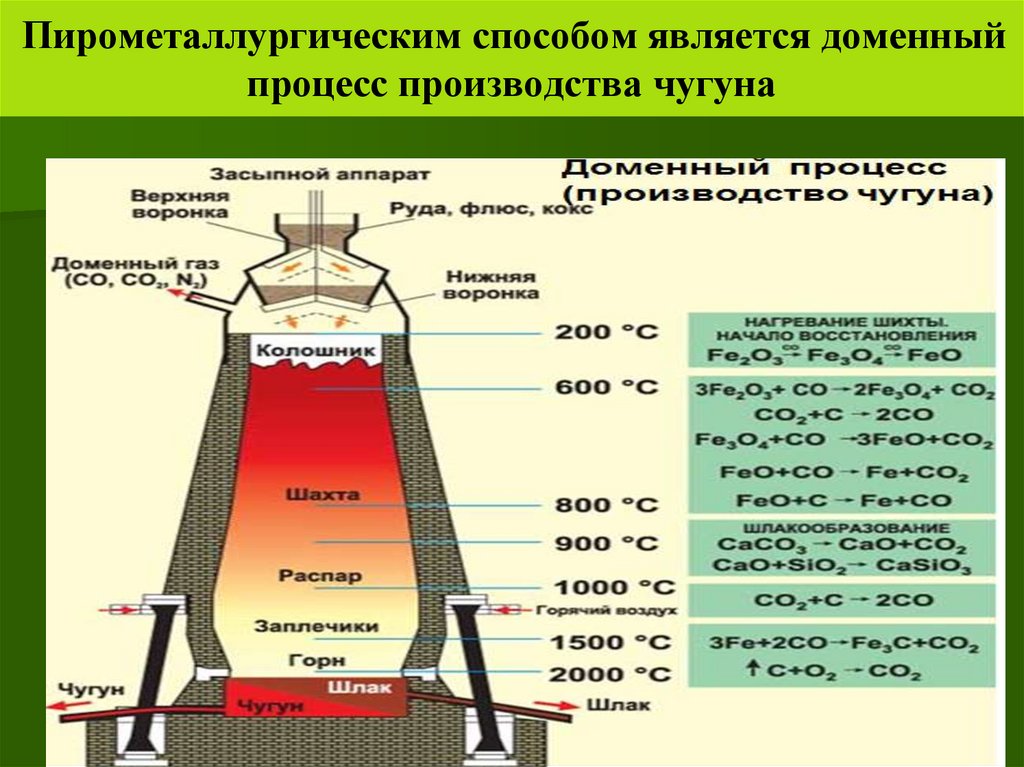
Пирометаллургическим способом является доменныйпроцесс производства чугуна
27
28.
Металлотермияметод полученияметаллов, основанный на
выделении металлов из
оксидов более активными
металлами Al, Mg
2 Cr2 О3 + 4 Al → 4 Cr+ 4 Al2O3
(1 балл)
алюминотермия
28
29.
Гидрометаллургияметоды получения металлов,основанных на химических
реакциях, происходящих в растворах:
1 стадия: перевод из руд в раствор
СuS + 2HCl → CuCl2 + H2S
2 стадия: выделение из растворов более
активными металлами
CuCl2 + Fe → Cu + FeCl2
29
30.
Лабораторный опыт 2. Получение металлической медигидрометаллургическим способом
■Вспомните главное правило ТБ при выполнении
лабораторных опытов.
■Налейте в пробирку 1 мл раствора сульфата меди(II).
■Опустите в раствор железную пластинку.
■Выдержите в растворе некоторое время железную пластинку.
■Выньте железную пластинку из раствора.
■Какой металл находится на поверхности пластинки?
■Объясните процесс согласно положения металлов в ряду
активности металлов.
■Составьте уравнение реакции данного
гидрометаллургического процесса.
■Укажите признаки реакции.
30
31.
Проверьте правильность уравнений и признаковреакции.
CuSO4 + Fe == Cu + FeSO4
Cu восстанавливается
Fe окисляется
(1 балл)
На железной пластине оседает
красная металлическая медь. Раствор
зеленеет.
Появление осадка и изменение
окраски раствора.
(1 балл)
31
32.
Электрометаллургияметоды получения металлов,
основанные на выделении металлов
из растворов или расплавов их
соединений под действием
электрического тока.
2Аl2 О3 Эл.тк
→ 4Al + 3O2
(раствор в криолите)
ЭЛЕКТРОЛИЗ
32
33.
Домашнее задание:Домашнее
задание:
I) § 19,
II) с.88, упр. 5,6, зад.1 (с.88) (по учебнику
Г.Е.Рудзитис Ф.Г.Фельдмана Химия 11);
III) задание 29 по тестам ЕГЭ.
Задание по желанию: подготовить небольшое сообщение на тему:
«Микробиологические способы получения металлов»
33
34.
3435.
О каком способе получения металлов упоминаетГеорг Агриколь в своем фундаментальном труде
«12 книг о металлах»?
«Подвергая руду нагреванию,
обжигу и прокаливанию, удаляют
этим часть веществ, примешанных
к металлу…»
«…плавка необходима, так как только посредством
ее горные породы отделяются от металлов. Которые
приобретают свойственный им цвет, очищаются и
становятся во многих отношениях полезными
человеку».
35
(Г.Агриколь, XVI век, «12 книг о металлах»).
36.
Ответ:Пирометаллургический
36
37.
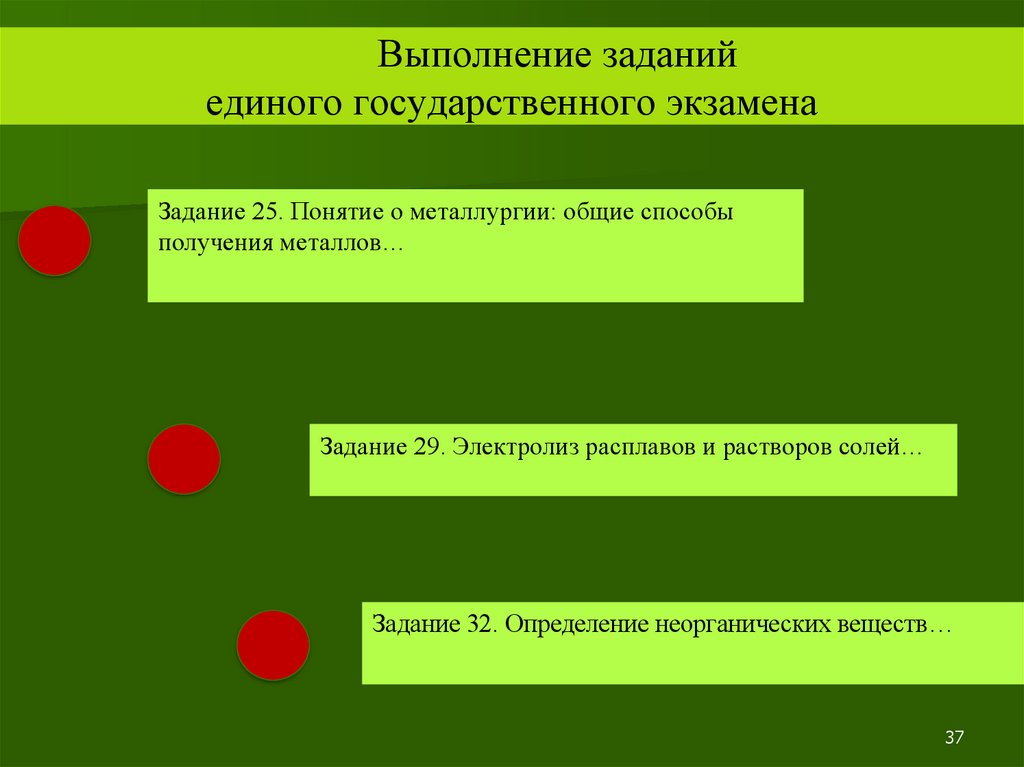
Выполнение заданийединого государственного экзамена
Задание 25. Понятие о металлургии: общие способы
получения металлов…
Задание 29. Электролиз расплавов и растворов солей…
Задание 32. Определение неорганических веществ…
37
38.
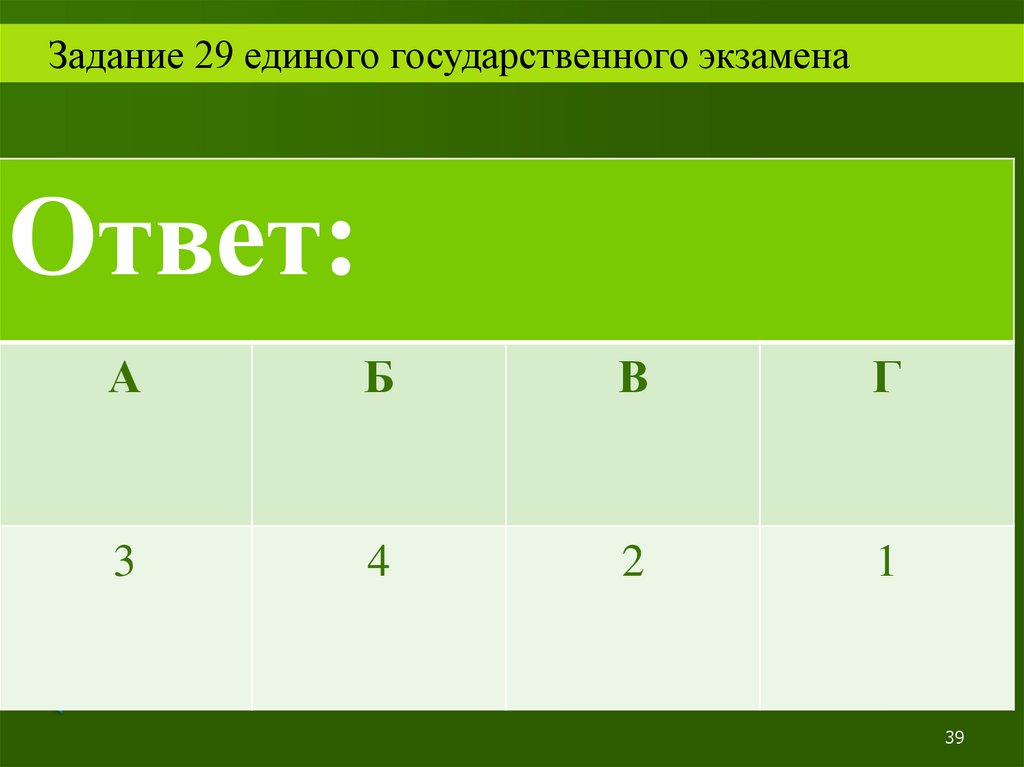
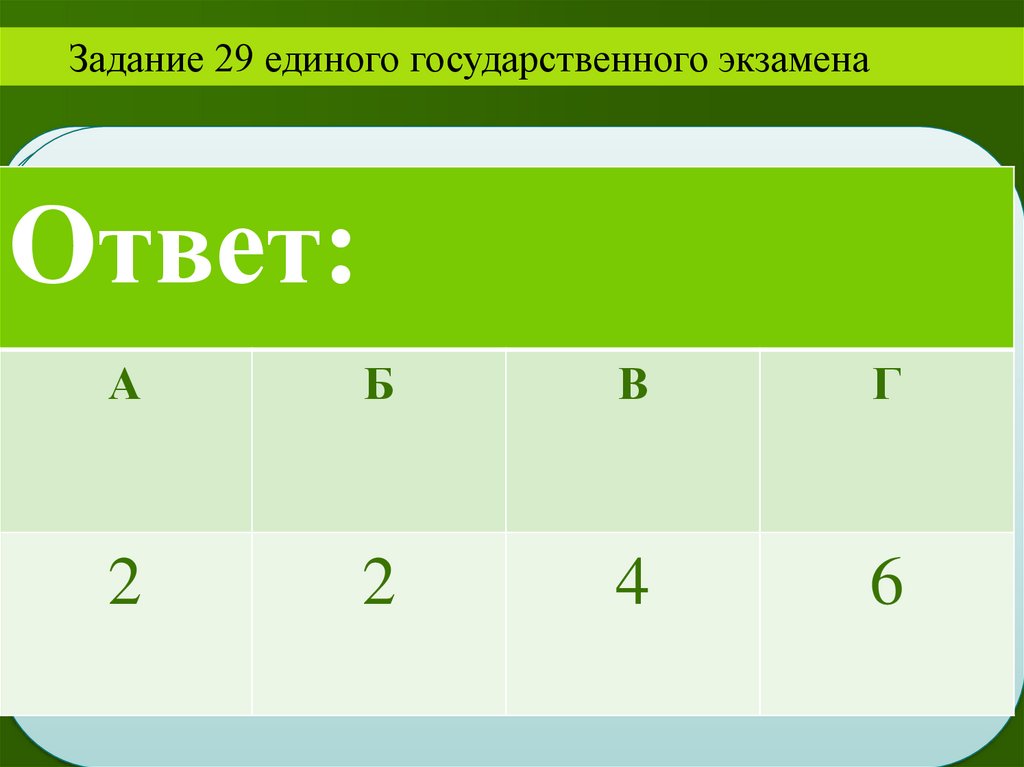
Задание 29 единого государственного экзаменаУстановить соответствие между
названием вещества
Способом его получения получение в
промышленности:
А) Цинк
1)
Б) Алюминий
2) Металлотермический
B) Хром
3)
II
Г) Медь
4)
38
39.
Задание 29 единого государственного экзаменаОтвет:
А
3
II
Б
В
Г
4
2
1
Узнать больше
39
40.
Задание 25 единого государственного экзаменаПродуктами обжига пирита FeS2 являются
1) FeO и SO2
3) Fe2O3 и SO2
2) FeO и SO3
4) Fe2O3 и SO3
II
Узнать больше
40
41.
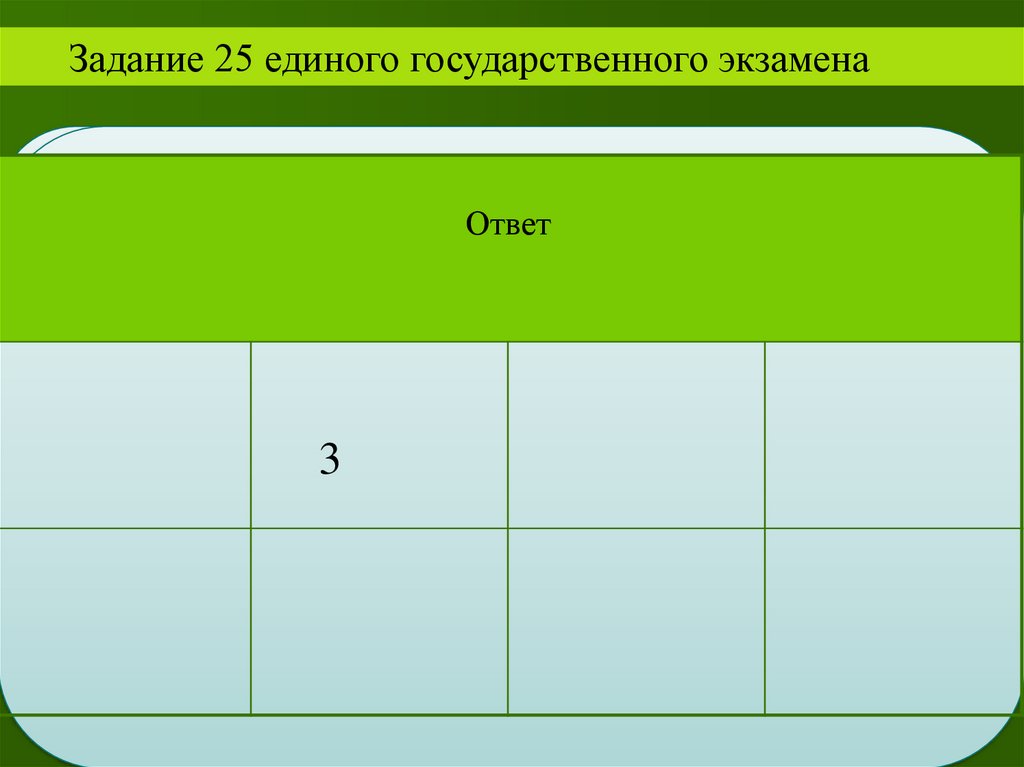
Задание 25 единого государственного экзаменаОтвет
3
II
Узнать больше
41
42.
Задание 25 единого государственного экзаменаЧугун в промышленности получают в
1) Конвертерах
3) Доменных печах
2) Мартеновских печах
4) Контактный аппарат
II
Узнать больше
42
43.
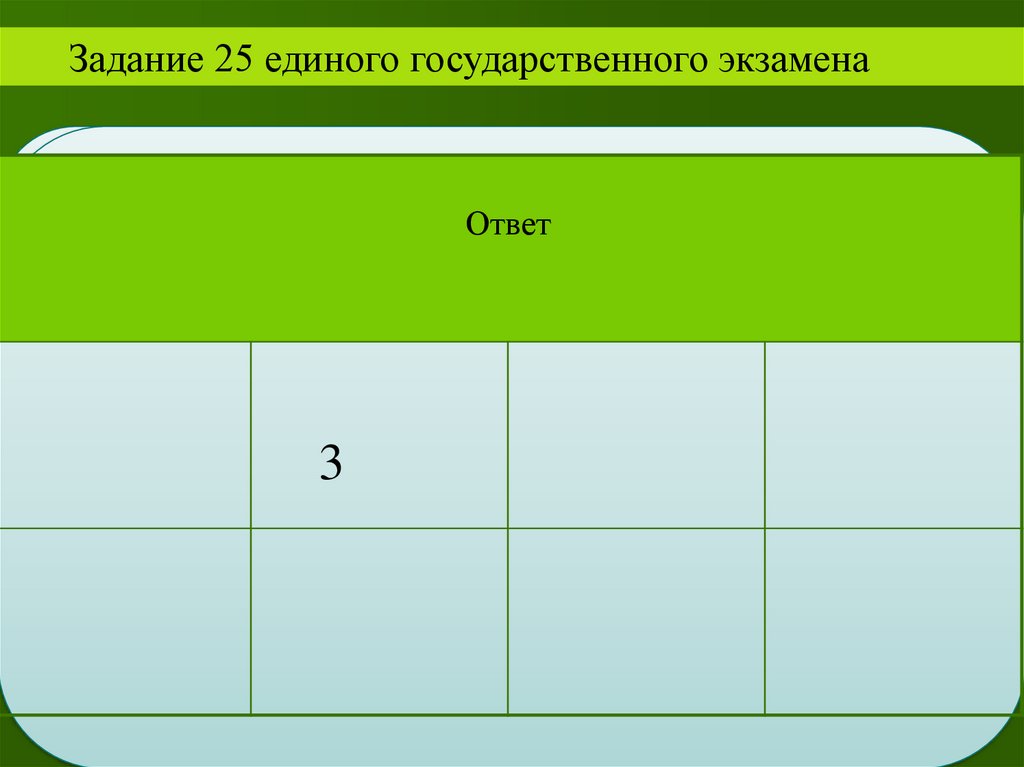
Задание 25 единого государственного экзаменаОтвет
3
II
Узнать больше
43
44.
Задание 29 единого государственного экзаменаУстановить соответствие между
названием вещества
Способом его получения в
промышленности
Название вещества:
Получение электролизом:
А) Литий
1) Раствора LiF
Б) Фтор
2) Расплава LiF
3) Раствора MgCl2
B) Серебро
II
Г) Магний
4) Раствора AgNO3
5) Расплава Ag2O
Узнать больше
6) Расплава MgCl2
44
45.
Задание 29 единого государственного экзаменаОтвет:
А
2
II
Б
В
Г
2
4
6
Узнать больше
45
46.
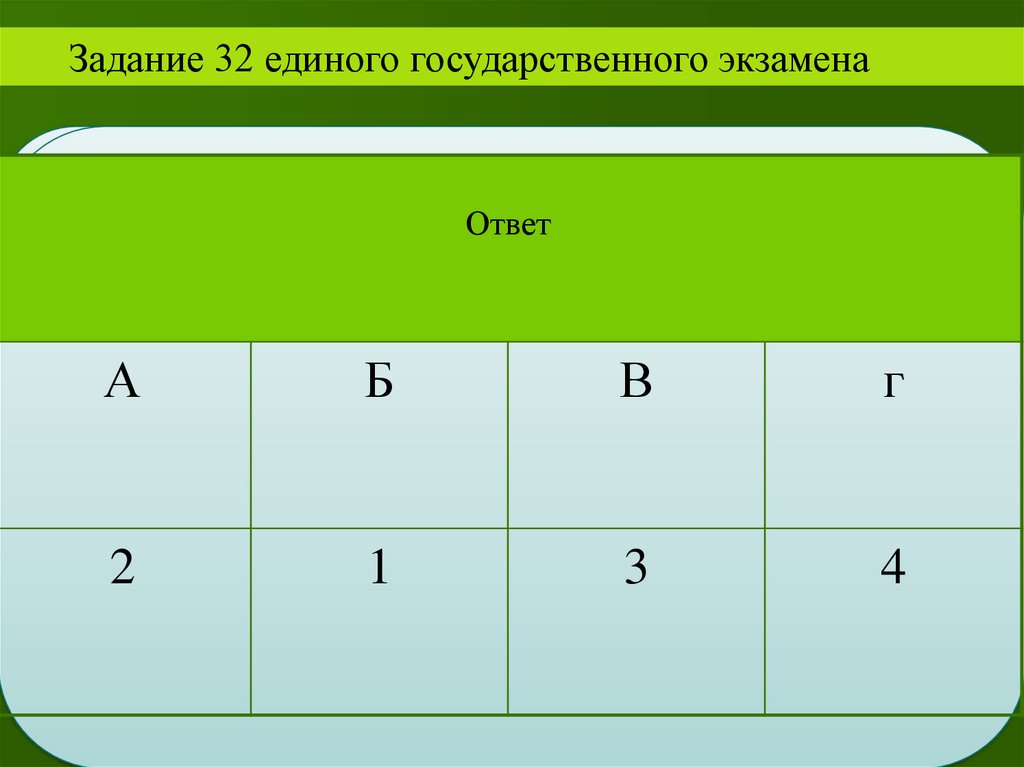
Задание 32 единого государственного экзаменаУстановите соответствие между реагирующими веществами и признаком протекающей
реакции
Вещества
Признак реакции
А) Fe + CuSO4
1) Появление резкого запаха
Б) CuS + O2
2) Появление осадка и изменение окраски
раствора
3) Изменение окраски вещества
B) CuO + C
Г) Fe + CrCl3
II
4) Видимых признаков реакции нет
Узнать больше
5) Растворение осадка
46
47.
Задание 32 единого государственного экзаменаОтвет
А
2
II
Б
В
г
1
3
4
Узнать больше
47
48.
Задание 29 единого государственного экзаменаУстановить соответствие между
названием вещества
Способом его получения получение в
промышленности:
Название вещества:
Получение электролизом:
А) Натрий
1) водного раствора солей
Б) Алюминий
2) водного раствора гидроксида
B) Серебро
3) расплава поваренной соли
4) расплавленного оксида
Г) Медь
II
5) раствора оксида в расплавленном криолите
6) расплавленного нитрата
Узнать больше
48
49.
Задание 29 единого государственного экзаменаОтвет:
А
Б
В
5
1
Г
II
3
Узнать больше
1
49
50.
• Человек должен верить, чтонепонятное можно понять:
иначе он не стал бы
размышлять о нём.
• Единственный путь, ведущий к
знанию, - это деятельность.
50








































 chemistry
chemistry








