Similar presentations:
Физико-химические особенности строения и функции биополимеров
1.
Физико-химическиеособенности строения и
функции биополимеров
2.
Отличия биополимеровИмеют цепное строение (гомополимеры, гетерополимеры).
2. Обладают информацией: I (ДНК)=2n бит; I (белка)= 1,44n бит.
3. Способны к вращательно-поворотной изомерии, образуют
конформеры (ротамеры) за счет вращения вокруг одинарных связей.
4. Биополимерам свойственны электрон-конформационные взаимодействия (ЭКВ) – участие в процессах за счет внутреннего взаимодействия своих элементов.
5. Наблюдаются объемные взаимодействия, т.е. взаимодействия звеньев
цепи, линейно удаленных друг от друга, но сближающихся при
образовании конформации.
6. Сочетают статистический (определяет размеры и форму) и механический (определяет функцию) характер поведения.
7. Растворы биополимеров сочетают в себе свойства истинных и
коллоидных растворов.
1.
3.
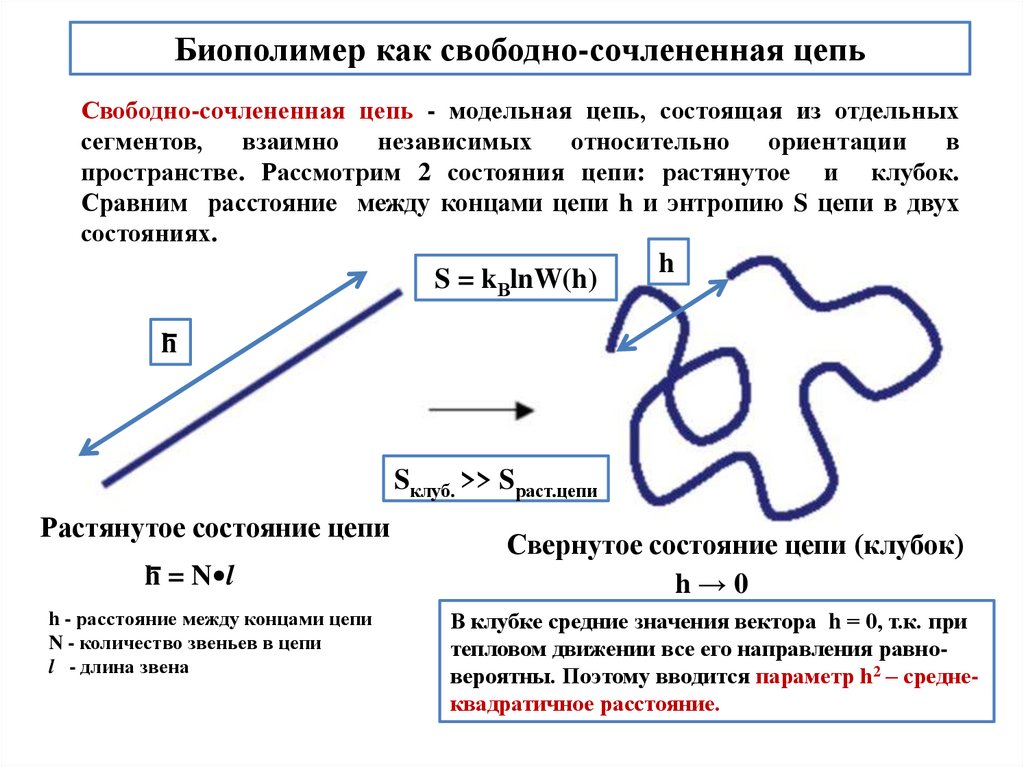
Биополимер как свободно-сочлененная цепьСвободно-сочлененная цепь - модельная цепь, состоящая из отдельных
сегментов,
взаимно независимых
относительно
ориентации
в
пространстве. Рассмотрим 2 состояния цепи: растянутое и клубок.
Сравним расстояние между концами цепи h и энтропию S цепи в двух
состояниях.
S = kВlnW(h)
h
h
Sклуб. >> Sраст.цепи
Растянутое состояние цепи
h = N•l
h - расстояние между концами цепи
N - количество звеньев в цепи
l - длина звена
Свернутое состояние цепи (клубок)
h→0
В клубке средние значения вектора h = 0, т.к. при
тепловом движении все его направления равновероятны. Поэтому вводится параметр h2 – среднеквадратичное расстояние.
4.
Свободно-сочленённая цепь биополимераCвободно-сочлененная цепь биополимера - цепь, состоящая из отдельных
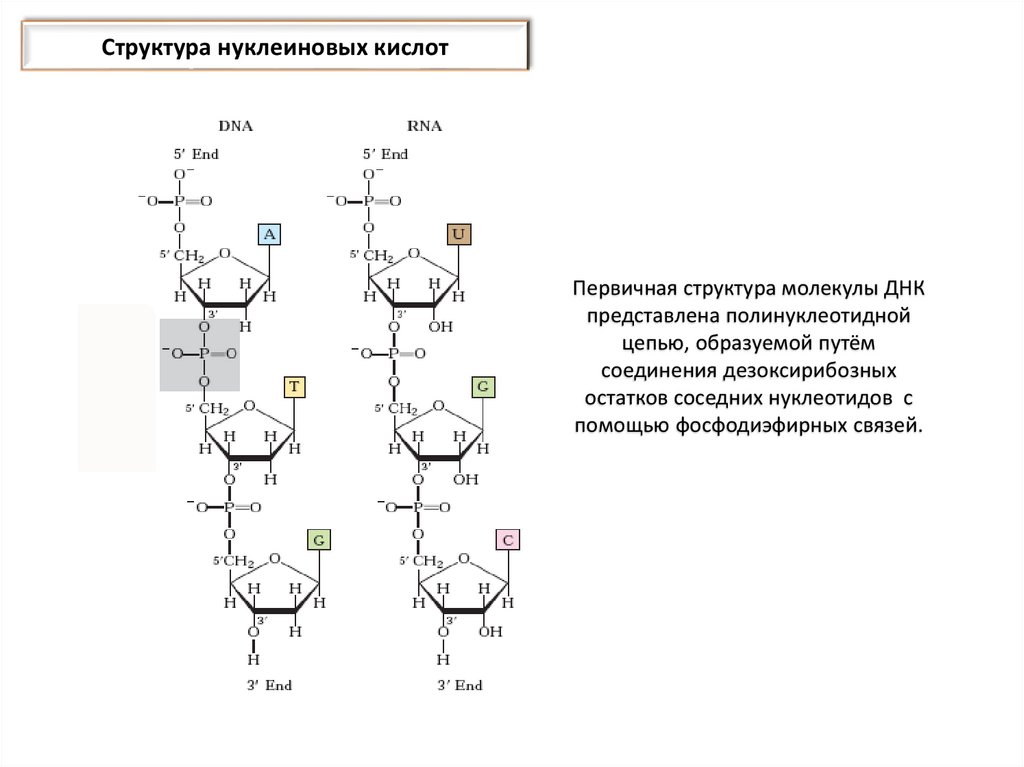
звеньев, которые взаимно независимы относительно расположения в
пространстве.
В молекуле биополимера из N звеньев,
каждое из которых имеет длину l, расстояние
между концами биополимера
h
будет
составлять:
h = N•l
Реальная цепь биополимера принимает
огромное число конформаций.
h принимает значения в диапазоне:
h = 0 (концы цепи совпали)
h = N•l (вытянутая цепь)
В клубке эти разные значения h
принимаются с разной вероятностью.
5.
Гибкость биополимеровСворачивание цепи биополимера в клубок определяется ее
термодинамической гибкостью:
чем больше гибкость, тем меньше h2 при заданных N и l
h 2 = N • l2
h2 - среднеквадратичное расстояние между концами
полимера в клубке
В растворе наиболее вероятная конформация биополимера свернутый клубок, в котором энтропия системы
максимальна. При растяжении полимера происходит
развертывание клубка и уменьшение числа возможных
конформаций, что сопровождается уменьшением энтропии.
S = kB lnW (h)
6.
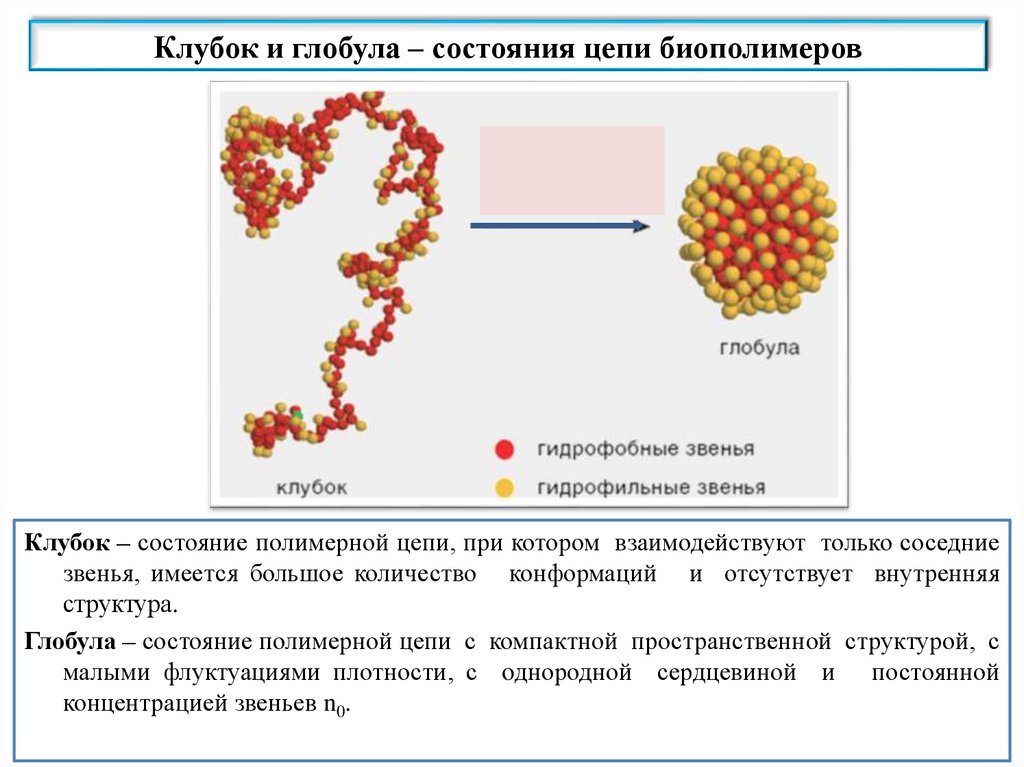
Клубок и глобула – состояния цепи биополимеровКлубок – состояние полимерной цепи, при котором взаимодействуют только соседние
звенья, имеется большое количество конформаций и отсутствует внутренняя
структура.
Глобула – состояние полимерной цепи с компактной пространственной структурой, с
малыми флуктуациями плотности, с oднородной сердцевиной и постоянной
концентрацией звеньев n0.
7.
Различия между клубком и глобулойКлубок
Глобула
Не имеет структуры
Имеет структуру: в центре
гидрофобное ядро, по
периферии – гидрофильный
слой; S→0
Нет объемных взаимодействий
Имеются объемные
взаимодействия
Имеется корреляция
плотности и радиуса клубка:
Rкор= Rклубка
Нет корреляции плотности:
Rкор<<Rклубка
Однофазная система
Двухфазная система
8.
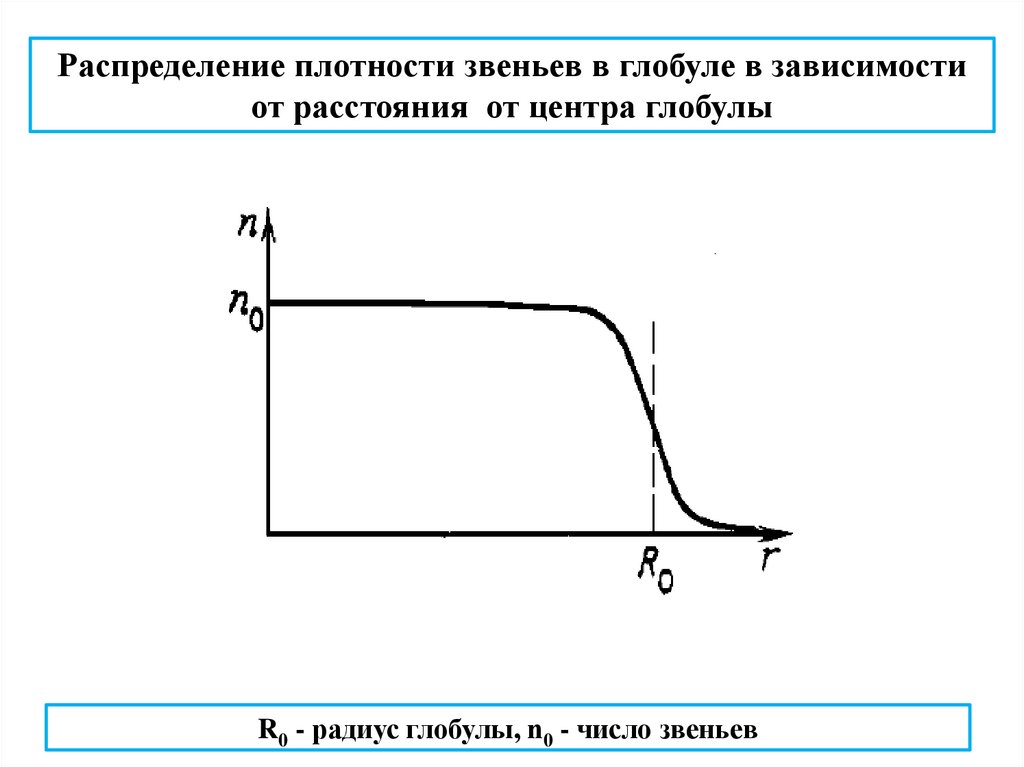
Распределение плотности звеньев в глобуле в зависимостиот расстояния от центра глобулы
R0 - радиус глобулы, n0 - число звеньев
9.
Условия существования клубка и глобулы1. За счет объемных взаимодействий звенья биополимера могут
притягиваться или отталкиваться.
Повышение температуры приводит к увеличению отталкивания
между звеньями, а понижение температуры - к сближению мономеров.
2. Существует температура, при которой отталкивание мономеров
полностью компенсируется их взаимным притяжением. Эта
температура называется θ-точкой или θ-температурой.
3. Θ-точка – температура, при которой отталкивание мономеров
полностью компенсируется их взаимным притяжением, объёмные
взаимодействия отсутствуют и макромолекула представляет собой
клубок с размерами R = l • N1/2
4. Если Т > Θ, преобладает отталкивание между звеньями биополимера
и реализуется клубок.
5. Если Т < Θ, преобладает притяжение между звеньями биополимера и
реализуется глобула.
10.
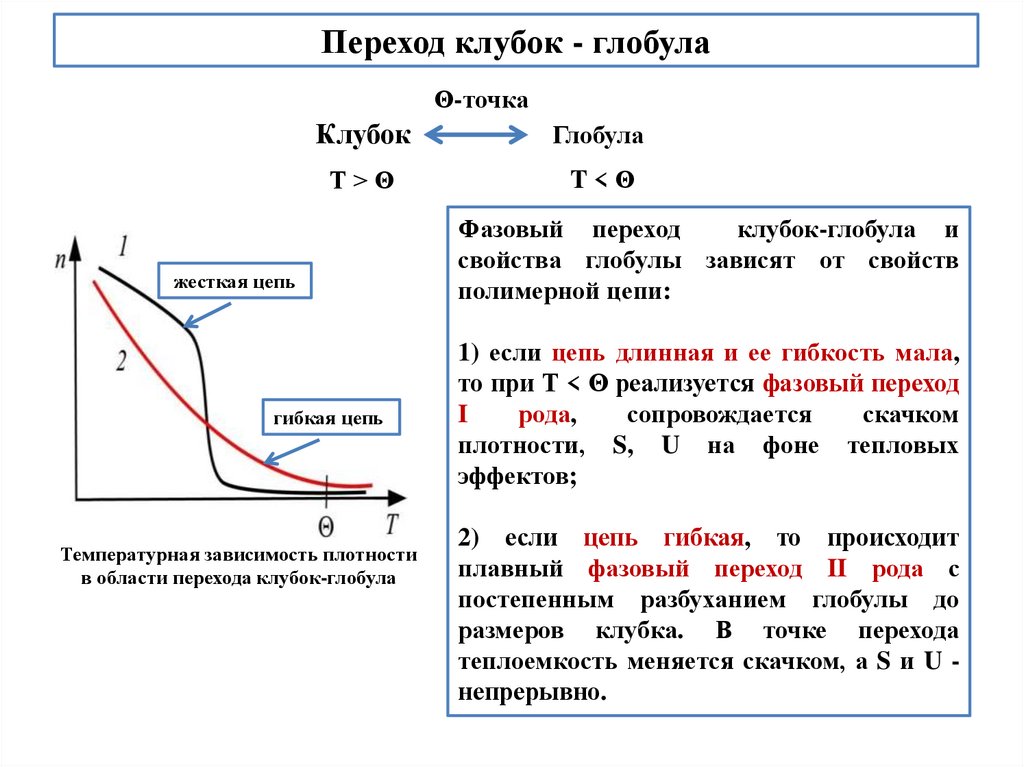
Переход клубок - глобулаΘ-точка
Клубок
Глобула
Т>Θ
T<Θ
жесткая цепь
гибкая цепь
Температурная зависимость плотности
в области перехода клубок-глобула
Фазовый переход
клубок-глобула и
свойства глобулы зависят от свойств
полимерной цепи:
1) если цепь длинная и ее гибкость мала,
то при Т < Θ реализуется фазовый переход
I
рода,
сопровождается
скачком
плотности, S, U на фоне тепловых
эффектов;
2) если цепь гибкая, то происходит
плавный фазовый переход II рода с
постепенным разбуханием глобулы до
размеров клубка. В точке перехода
теплоемкость меняется скачком, а S и U непрерывно.
11.
Поворотно-вращательная изомерия биополимеровВ 1951 г. М.В.Волькенштейн предложил теорию поворотно-изомерного строения
биополимеров.
1.Конформация цепи определяется углами поворота звеньев цепи вокруг
одинарных связей или внутренним вращением.
2.Энергия конформации U (φ, ψ) зависит от энергии взаимодействия
соседних групп или от соседних углов вращения.
3. При близком расположении валентно несвязанные атомы начинают
отталкиваться, и возникает тормозящий энергетический потенциал,
препятствующий вращению атомных групп.
4. Энергия вращения атомных групп вокруг одинарных связей дает
основной вклад в общую конформационную энергию полимерной
цепи.
5.Зная энергии различных поворотных изомеров, можно вычислить
вероятность конформации молекулы.
12.
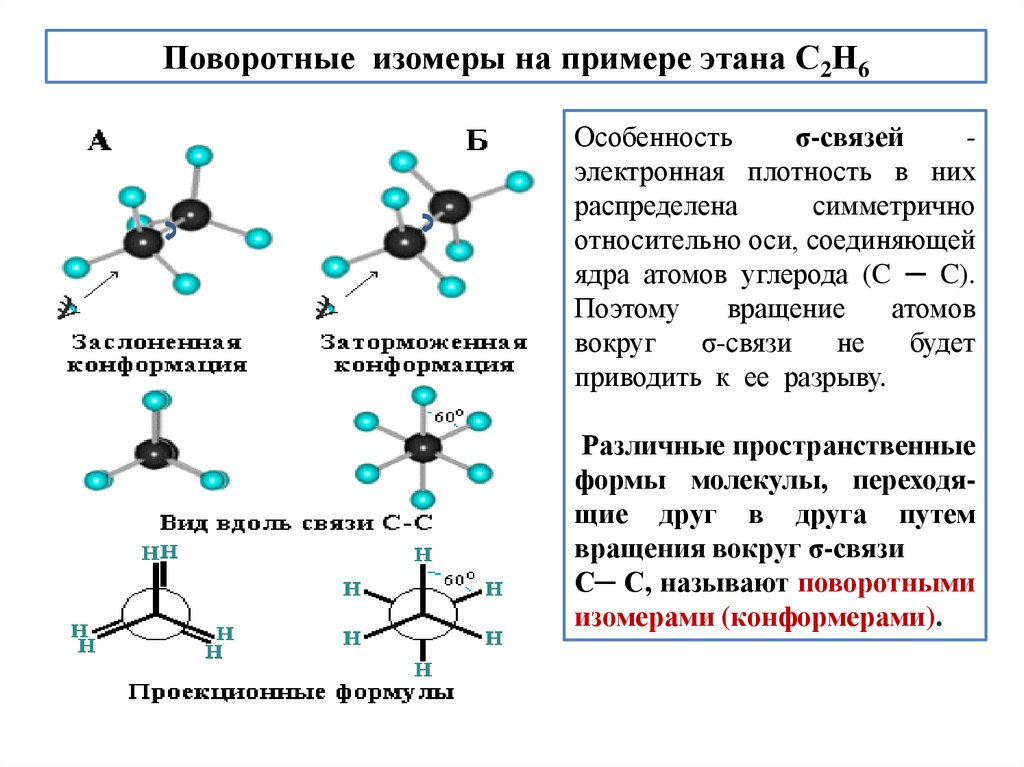
Поворотные изомеры на примере этана С2Н6Особенность
σ-связей
электронная плотность в них
распределена
симметрично
относительно оси, соединяющей
ядра атомов углерода (C ─ C).
Поэтому
вращение
атомов
вокруг
σ-связи
не
будет
приводить к ее разрыву.
Различные пространственные
формы молекулы, переходящие друг в друга путем
вращения вокруг σ-связи
С─ С, называют поворотными
изомерами (конформерами).
13.
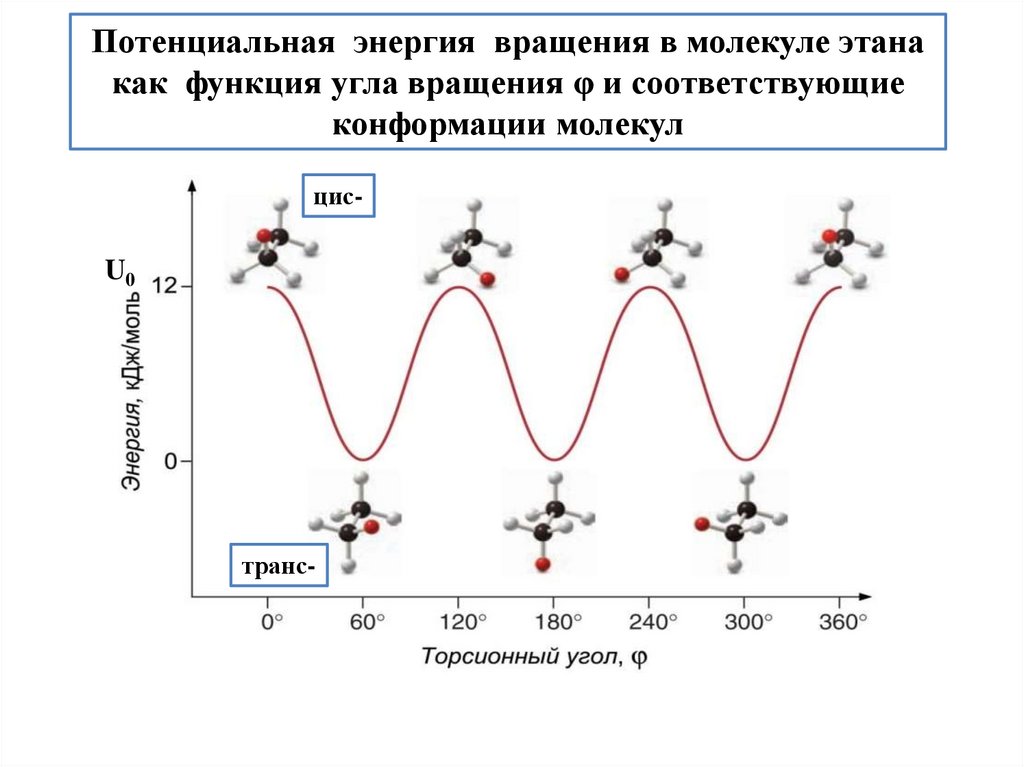
Потенциальная энергия вращения в молекуле этанакак функция угла вращения φ и соответствующие
конформации молекул
цис-
U0
транс-
14.
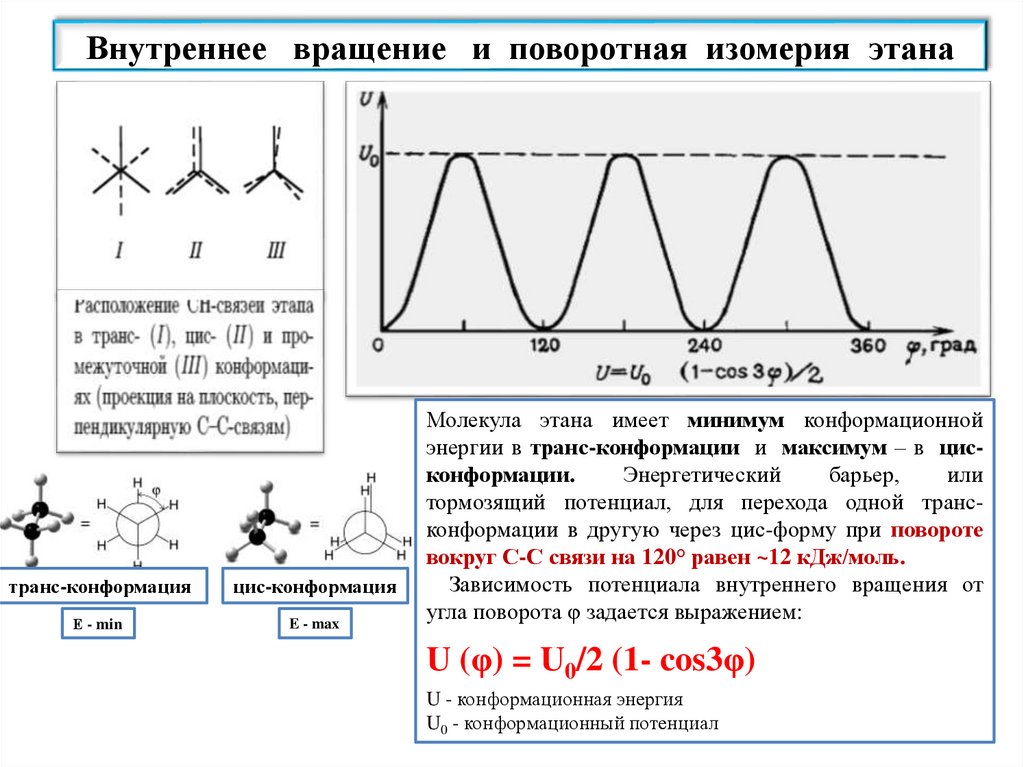
Внутреннее вращение и поворотная изомерия этанатранс-конформация
цис-конформация
Е - min
E - max
Молекула этана имеет минимум конформационной
энергии в транс-конформации и максимум – в цисконформации.
Энергетический
барьер,
или
тормозящий потенциал, для перехода одной трансконформации в другую через цис-форму при повороте
вокруг С-С связи на 120° равен ~12 кДж/моль.
Зависимость потенциала внутреннего вращения от
угла поворота φ задается выражением:
U (φ) = U0/2 (1- cos3φ)
U - конформационная энергия
U0 - конформационный потенциал
15.
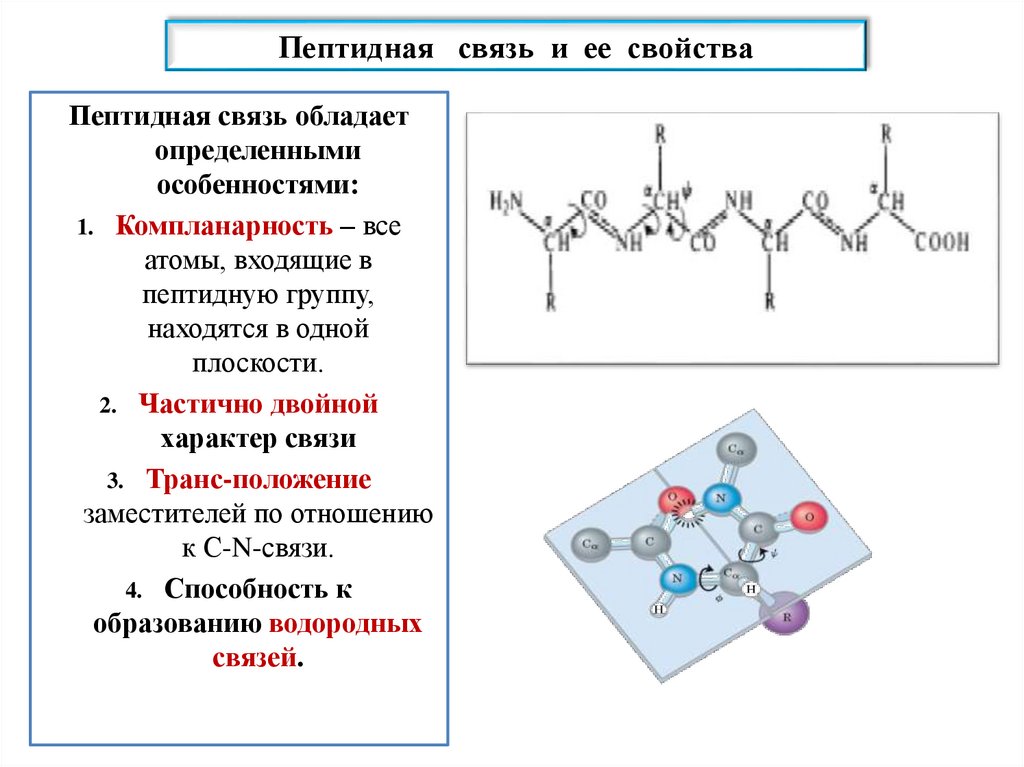
Пептидная связь и ее свойстваПептидная связь обладает
определенными
особенностями:
1. Компланарность – все
атомы, входящие в
пептидную группу,
находятся в одной
плоскости.
2. Частично двойной
характер связи
3. Транс-положение
заместителей по отношению
к С-N-связи.
4. Способность к
образованию водородных
связей.
16.
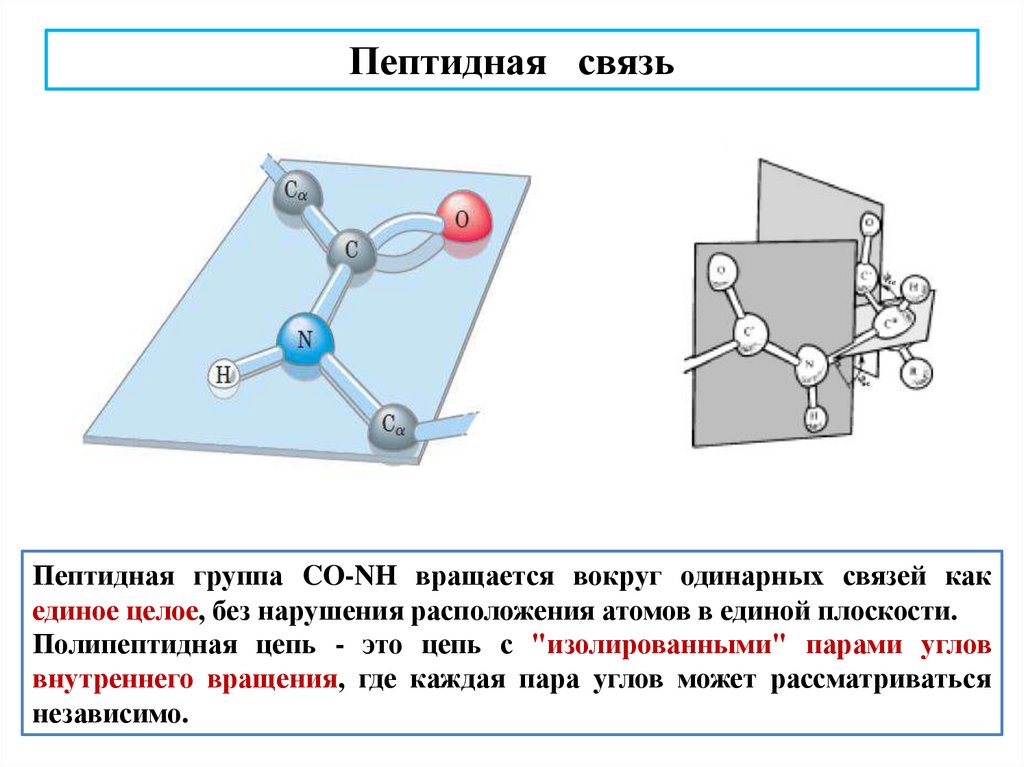
Пептидная связьПептидная группа CO-NH вращается вокруг одинарных связей как
единое целое, без нарушения расположения атомов в единой плоскости.
Полипептидная цепь - это цепь с "изолированными" парами углов
внутреннего вращения, где каждая пара углов может рассматриваться
независимо.
17.
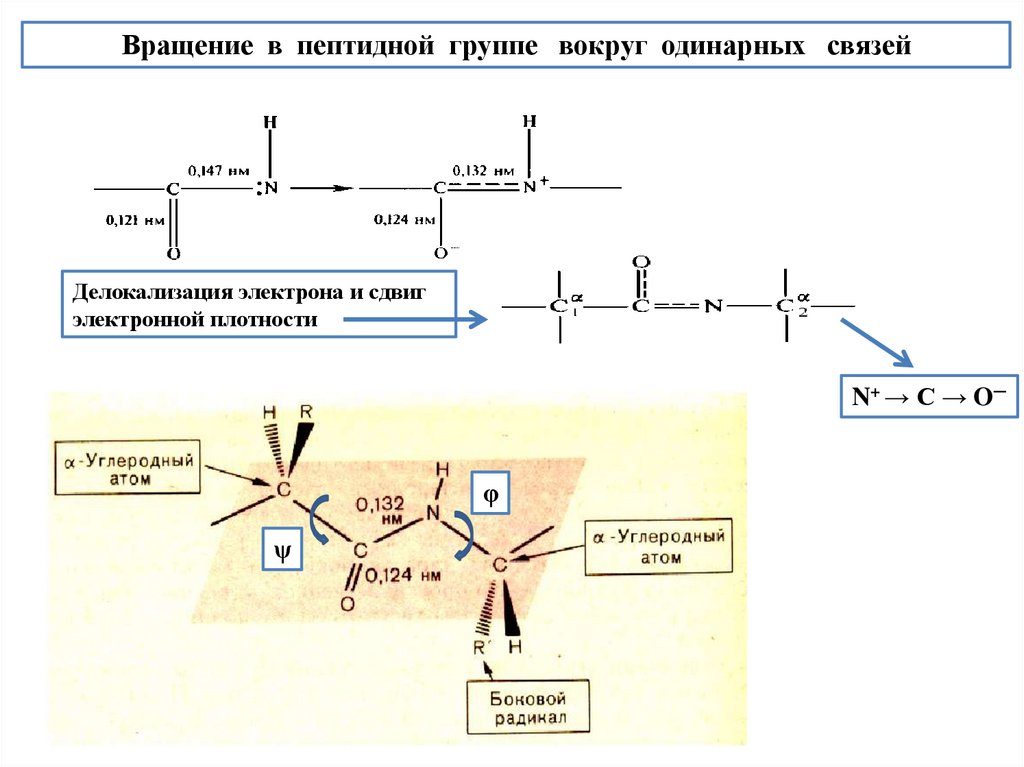
Особенности пептидной группы1. Важнейшая особенность пептидной связи - ее частично двойной характер. Длина
пептидной связи С ─ N меньше величины 0,147 нм - длины одинарной связи - и
составляет 0,132 нм, что немного превышает длину двойной связи (0,125 нм):
С=N
0,125
<
C --- N
0,132
<
C─N
0,147
2. Неподеленная пара электронов атома N обобществляется между атомами С и N, давая примесь
двойной связи между ними. При этом электрон углерода выталкивается из двойной π-связи С=О и
локализуется на атоме кислорода О, превращая связь С=О в частично двойную и увеличивая ее
длину от 0,121 нм до 0,124 нм.
3. Между атомами N, C и О происходит делокализация электрона, сопровождающаяся сдвигом
электронной плотности:
N+ → C → O─
─
+
18.
Вращение в пептидной группе вокруг одинарных связейДелокализация электрона и сдвиг
электронной плотности
N+ → C → O─
φ
ψ
19.
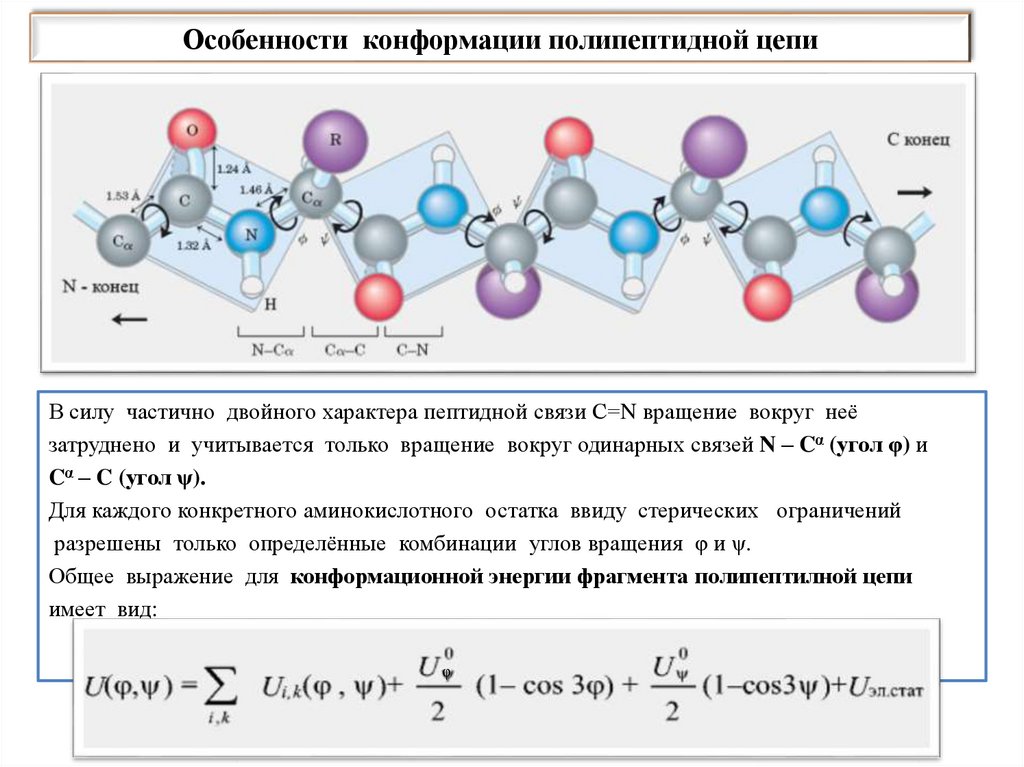
Особенности конформации полипептидной цепиВ силу частично двойного характера пептидной связи С=N вращение вокруг неё
затруднено и учитывается только вращение вокруг одинарных связей N – Cα (угол φ) и
Cα – C (угол ψ).
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений
разрешены только определённые комбинации углов вращения φ и ψ.
Общее выражение для конформационной энергии фрагмента полипептилной цепи
имеет вид:
φ
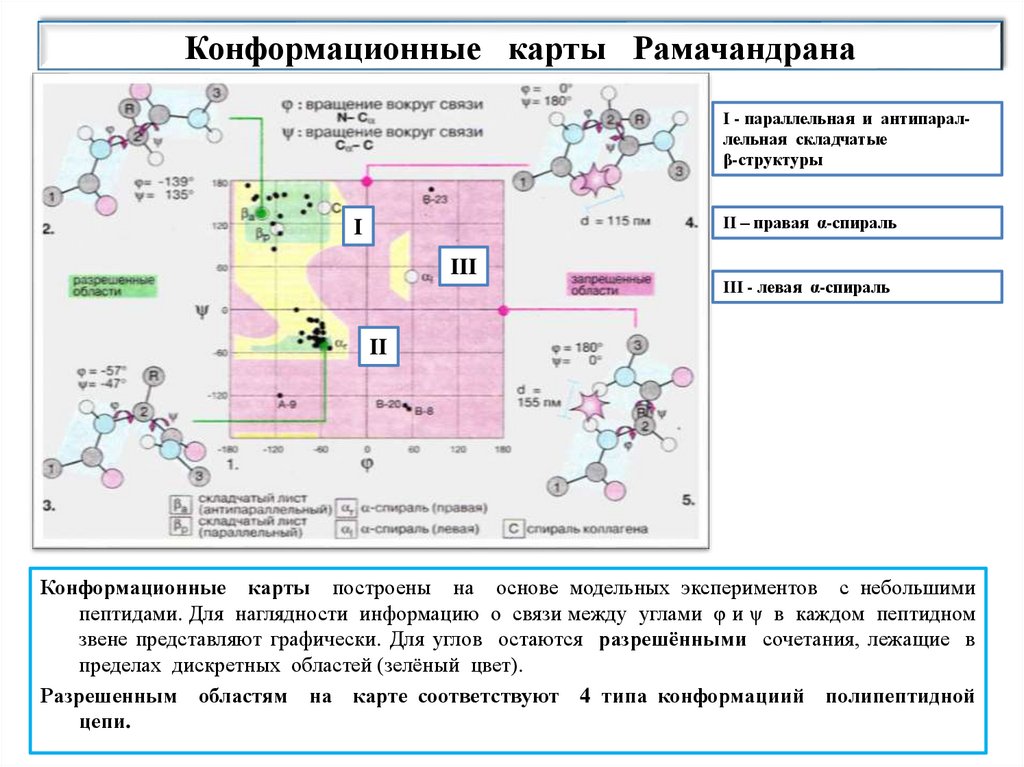
20.
Конформационные карты Рамачандрана1. Полипептидная цепь является цепью с "изолированными" парами углов
внутреннего вращения, где каждая
пара углов
рассматривается
независимо, т.к. при изменении пар φ и ψ отсутствуют стерические
перекрытия атомов пептидной единицы.
2. Это свойство позволяет свести взаимодействие ближнего порядка к
взаимодействиям пептидных звеньев.
3.
На этой основе Рамачандран построил стерические диаграммы,
позволяющие определить допустимые значения углов φ и ψ пептидного
звена, при которых данный остаток не испытывает сильных стерических
перекрытий с другими атомными группами.
4. На карте зеленым цветом обозначены области с разрешенными
сочетаниями углов, которым соответствует 4 типа конформации
полипептидной цепи:
I - параллельная и антипараллельная складчатые β-структуры
II – правая α-спираль
III - левая α-спираль
21.
Конформационные карты РамачандранаI - параллельная и антипараллельная складчатые
β-структуры
II – правая α-спираль
I
III
III - левая α-спираль
II
Конформационные карты построены на основе модельных экспериментов с небольшими
пептидами. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном
звене представляют графически. Для углов остаются разрешёнными сочетания, лежащие в
пределах дискретных областей (зелёный цвет).
Разрешенным областям на карте соответствуют 4 типа конформациий полипептидной
цепи.
22.
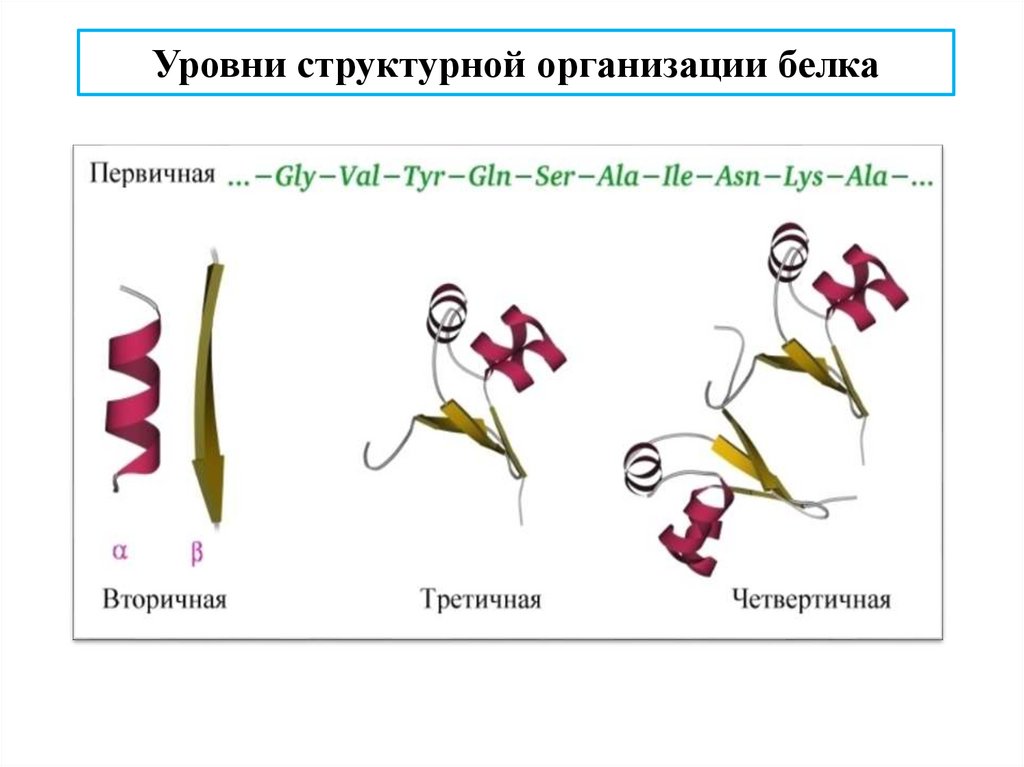
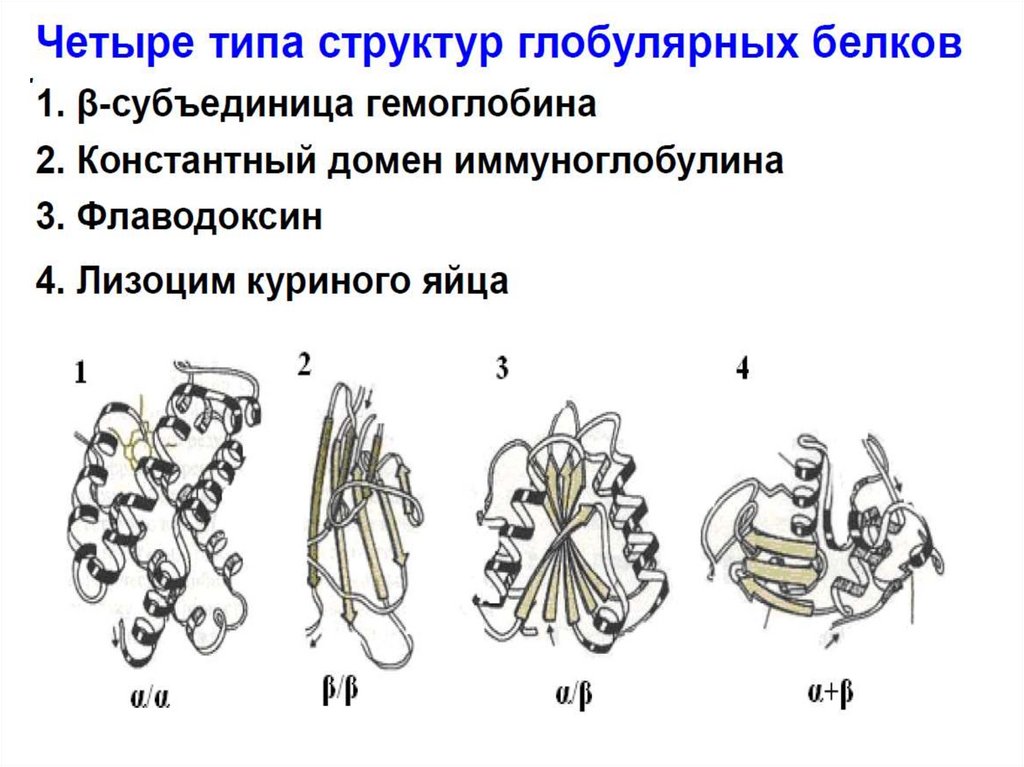
Уровни структурной организации белка23.
Уровни организации белков: α – спиральНаиболее распространенным элементом вторичной структуры является правая α-спираль (αR). Пептидная цепь здесь
Наиболее
распространенным элементом вторичной структуры белка является правая
изгибается винтообразно (ось выделена оранжевым цветом). Ha каждый виток приходится 3,6 аминокислотного
α-спираль
(αR). Пептидная цепь здесь изгибается винтообразно (ось выделена
остатка, шаг винта (т.е. минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. αоранжевым
цветом). Ha каждый виток приходится 3,6 аминокислотного остатка,
Спираль стабилизирована почти линейными водородными связями (красный пунктир) между NH-группой и СОшаг винта (т.е. минимальное расстояние между двумя эквивалентными точками)
группой четвертого по счету аминокислотного остатка. Таким образом, в протяженных спиральных участках каждый
составляет
0,54 нм. α-Спираль стабилизирована почти линейными водородными
аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или
связями (красный пунктир) между NH-группой и СО-группой четвертого по счету
амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах.
аминокислотного
остатка. Таким образом, в протяженных спиральных участках
каждый аминокислотный остаток принимает участие в формировании двух
водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто
обеспечивают заякоривание белков в биологических мембранах.
24.
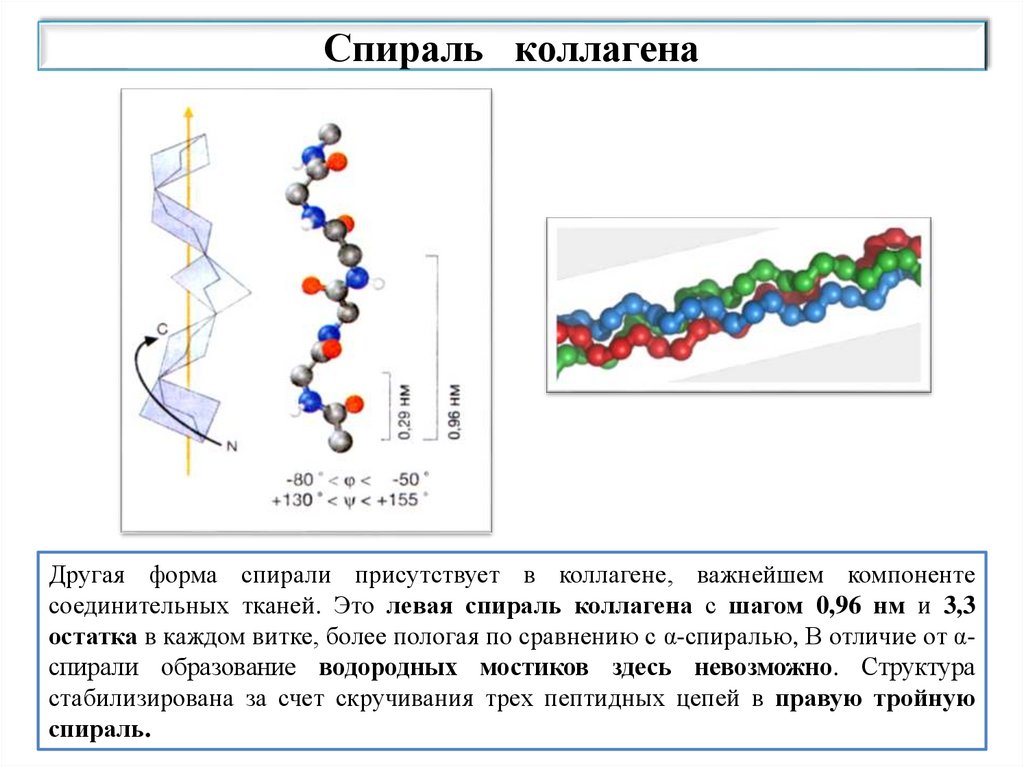
Спираль коллагенаДругая форма спирали присутствует в коллагене, важнейшем компоненте
соединительных тканей. Это левая спираль коллагена с шагом 0,96 нм и 3,3
остатка в каждом витке, более пологая по сравнению с α-спиралью, В отличие от αспирали образование водородных мостиков здесь невозможно. Структура
стабилизирована за счет скручивания трех пептидных цепей в правую тройную
спираль.
25.
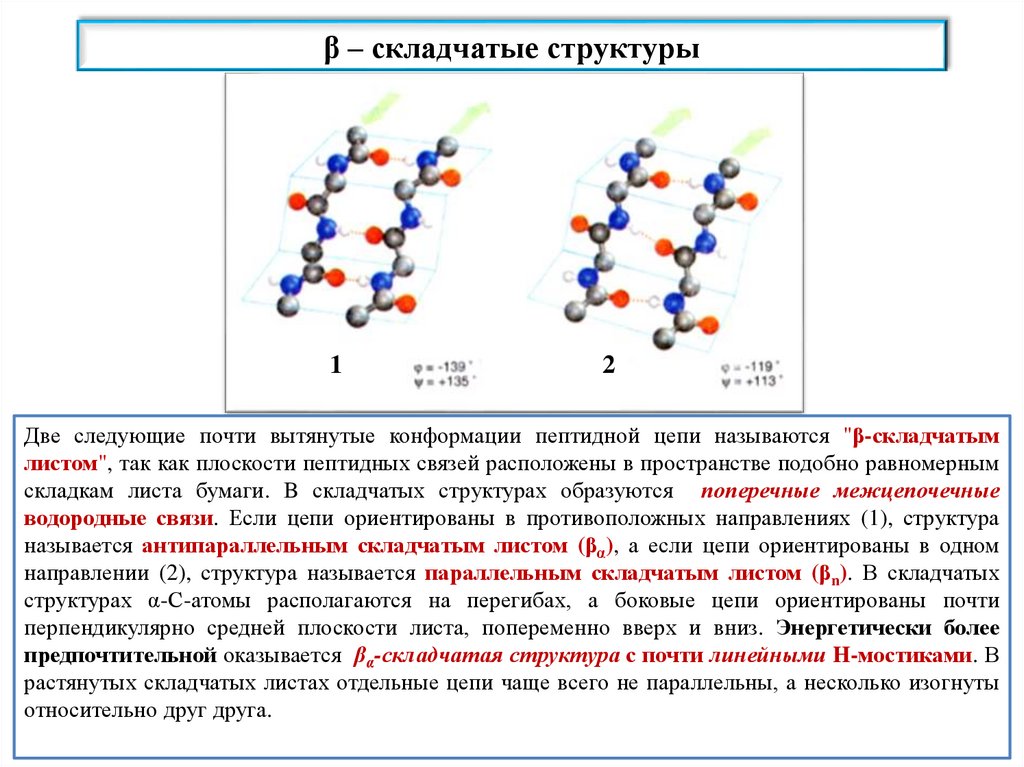
β – складчатые структуры1
2
Две следующие почти вытянутые конформации пептидной цепи называются "β-складчатым листом", так как
Две следующие почти вытянутые конформации пептидной цепи называются "β-складчатым
плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B
листом", так как плоскости пептидных связей расположены в пространстве подобно равномерным
складчатых
структурах
образуются структурах
поперечные межцепочечные
связи. Если
цепи
складкам листа
бумаги.
B также
складчатых
образуютсяводородные
поперечные
межцепочечные
ориентированы
противоположных
направлениях (1), структура
называется антипараллельным
складчатым
водородные
связи. вЕсли
цепи ориентированы
в противоположных
направлениях
(1), структура
(βα), а если цепи ориентированы
в одном направлении
параллельным в одном
называетсялистом
антипараллельным
складчатым
листом (β(2),
а еслиназывается
цепи ориентированы
α),структура
направлении
(2), структура
параллельным
складчатым
листома боковые
(βn). Вцепи
складчатых
складчатым
листом (βn). называется
В складчатых структурах
α-С-атомы располагаются
на перегибах,
структурахориентированы
α-С-атомы
располагаются
на перегибах,
а попеременно
боковые вверх
цепии вниз
ориентированы
почти
почти
перпендикулярно средней
плоскости листа,
(см. с. 77, В).
перпендикулярно средней плоскости
листа, попеременно вверх и вниз. Энергетически более
Энергетически более предпочтительной оказывается
предпочтительной оказывается βα-складчатая структура с почти линейными H-мостиками. В
βα-складчатая структура с почти линейными H-мостиками. В растянутых складчатых листах отдельные цепи
растянутых
складчатых листах отдельные цепи чаще всего не параллельны, а несколько изогнуты
чаще всего не параллельны, а несколько изогнуты относительно друг друга.
относительно друг друга.
26.
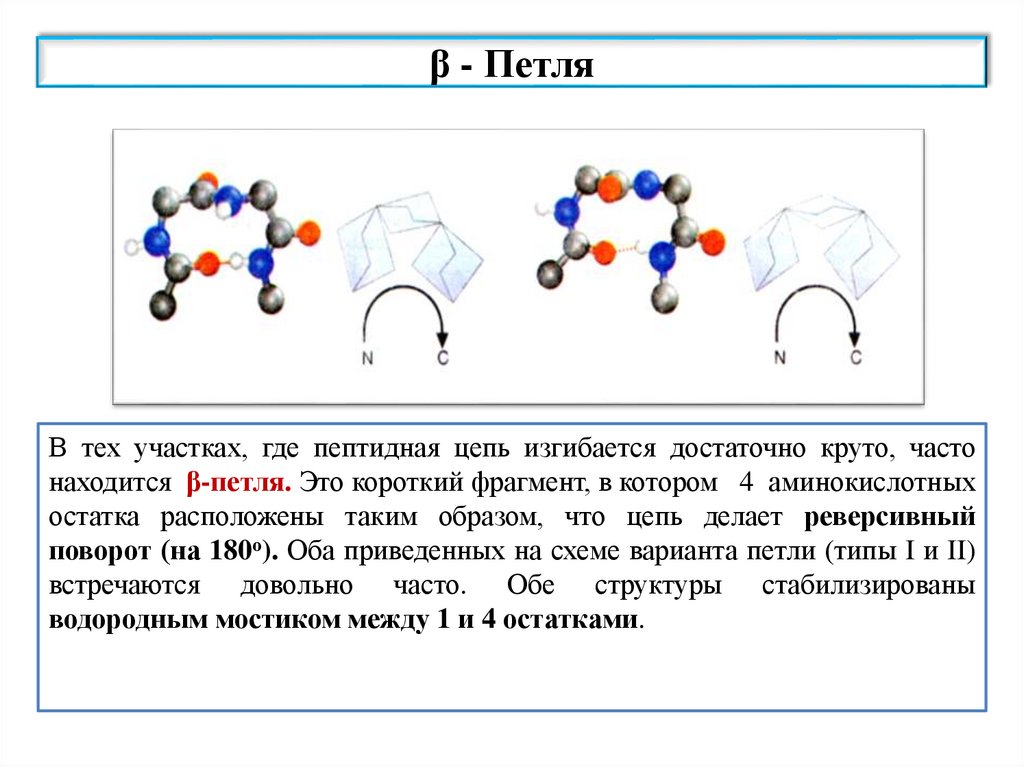
β - ПетляВ тех участках, где пептидная цепь изгибается достаточно круто, часто
В тех участках,
где пептидная
цепь изгибается
достаточно в
круто,
часто находится
β-петля. Это
находится
β-петля.
Это короткий
фрагмент,
котором
4 аминокислотных
короткий
фрагмент, в которомтаким
4 аминокислотных
остатка
расположены
таким образом,
что цепь
остатка
расположены
образом,
что
цепь делает
реверсивный
делает (на
реверсивный
(на 180о). Оба приведенных
на схеме
вариантапетли
петли (типы
I и II)I и II)
поворот
180о).поворот
Оба приведенных
на схеме
варианта
(типы
встречаются довольно
часто. Обе структуры
водородным мостиком
между 1 и 4
встречаются
довольно
часто. стабилизированы
Обе структуры
стабилизированы
водородным мостиком между 1 остатками.
и 4 остатками.
27.
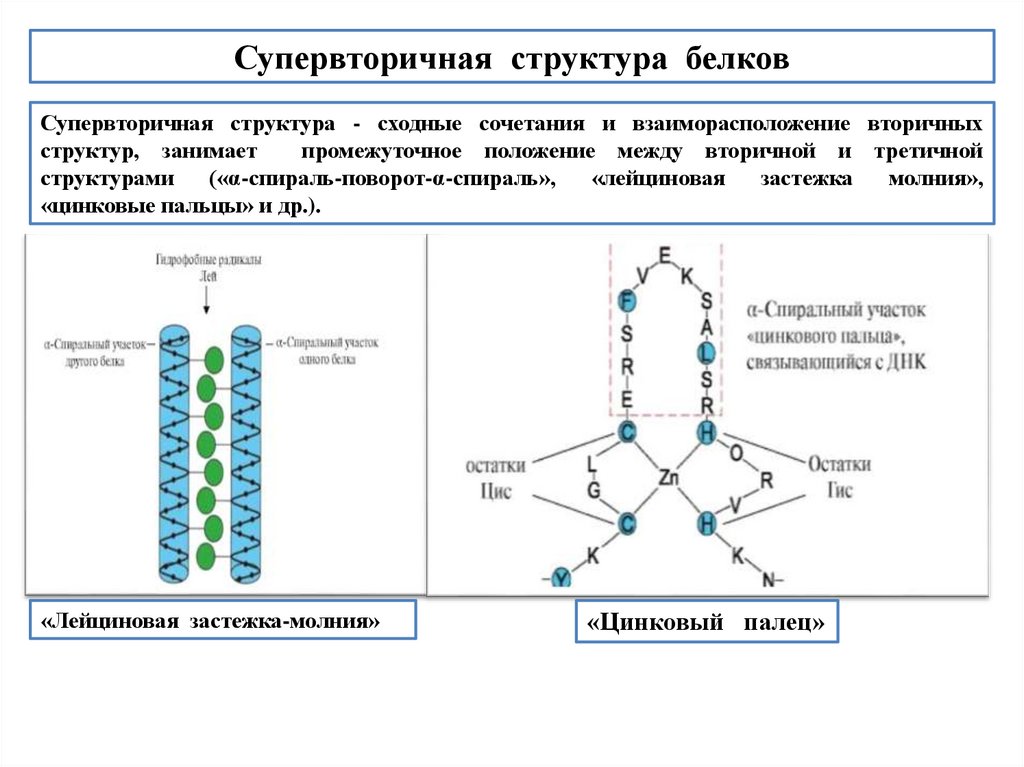
Супервторичная структура белковСупервторичная структура - сходные сочетания и взаиморасположение вторичных
структур, занимает
промежуточное положение между вторичной и третичной
структурами
(«α-спираль-поворот-α-спираль»,
«лейциновая
застежка
молния»,
«цинковые пальцы» и др.).
«Лейциновая застежка-молния»
«Цинковый палец»
28.
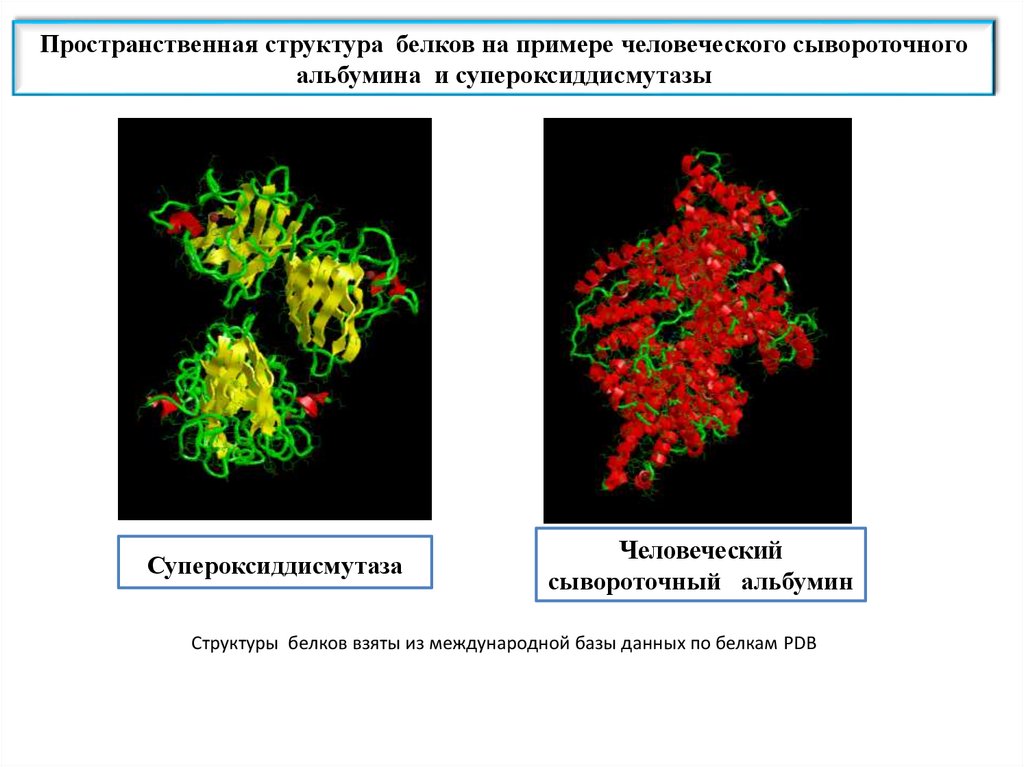
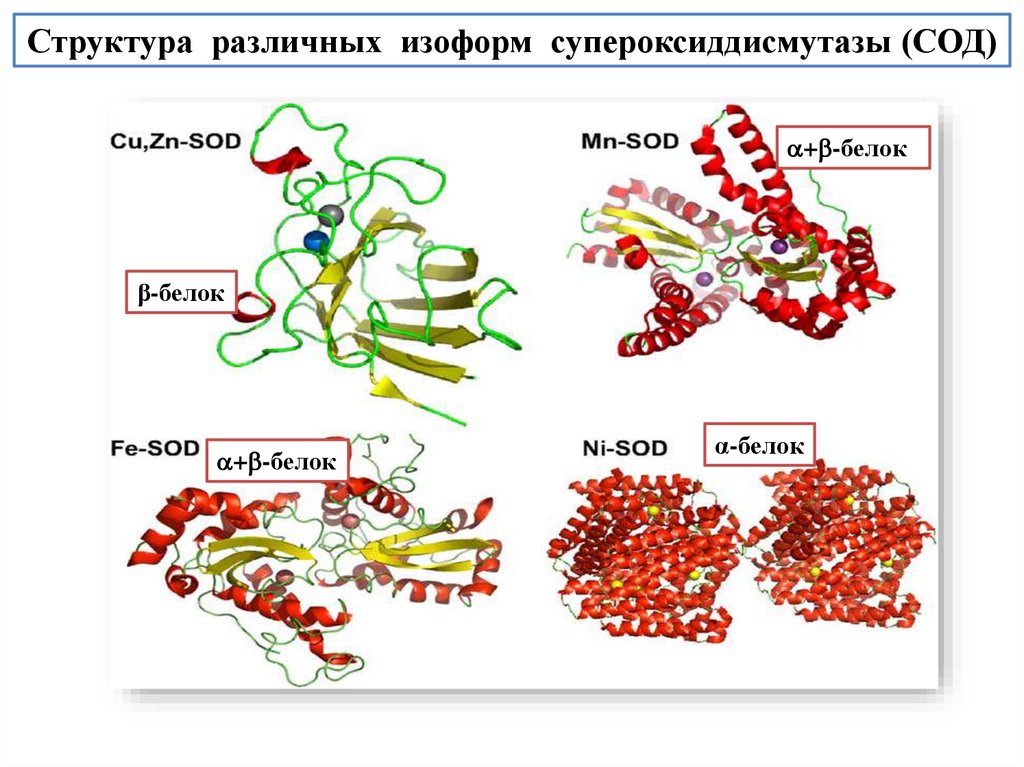
Пространственная структура белков на примере человеческого сывороточногоальбумина и супероксиддисмутазы
Супероксиддисмутаза
Человеческий
сывороточный альбумин
Структуры белков взяты из международной базы данных по белкам PDB
29.
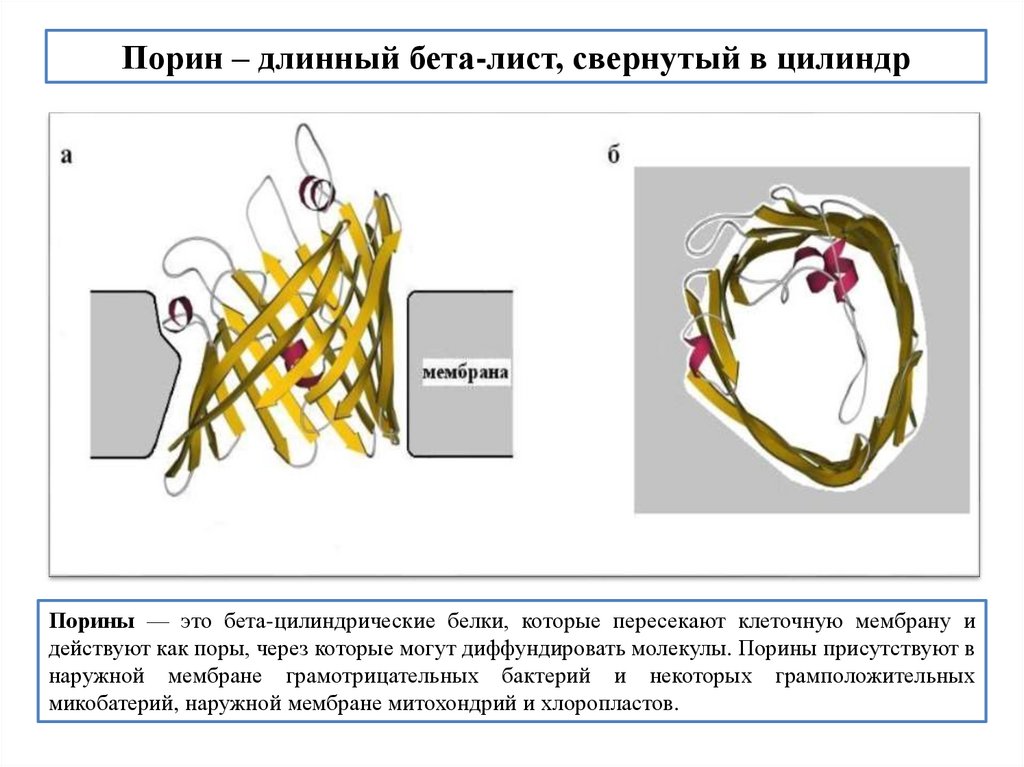
Порин – длинный бета-лист, свернутый в цилиндрПорины — это бета-цилиндрические белки, которые пересекают клеточную мембрану и
действуют как поры, через которые могут диффундировать молекулы. Порины присутствуют в
наружной мембране грамотрицательных бактерий и некоторых грамположительных
микобатерий, наружной мембране митохондрий и хлоропластов.
30.
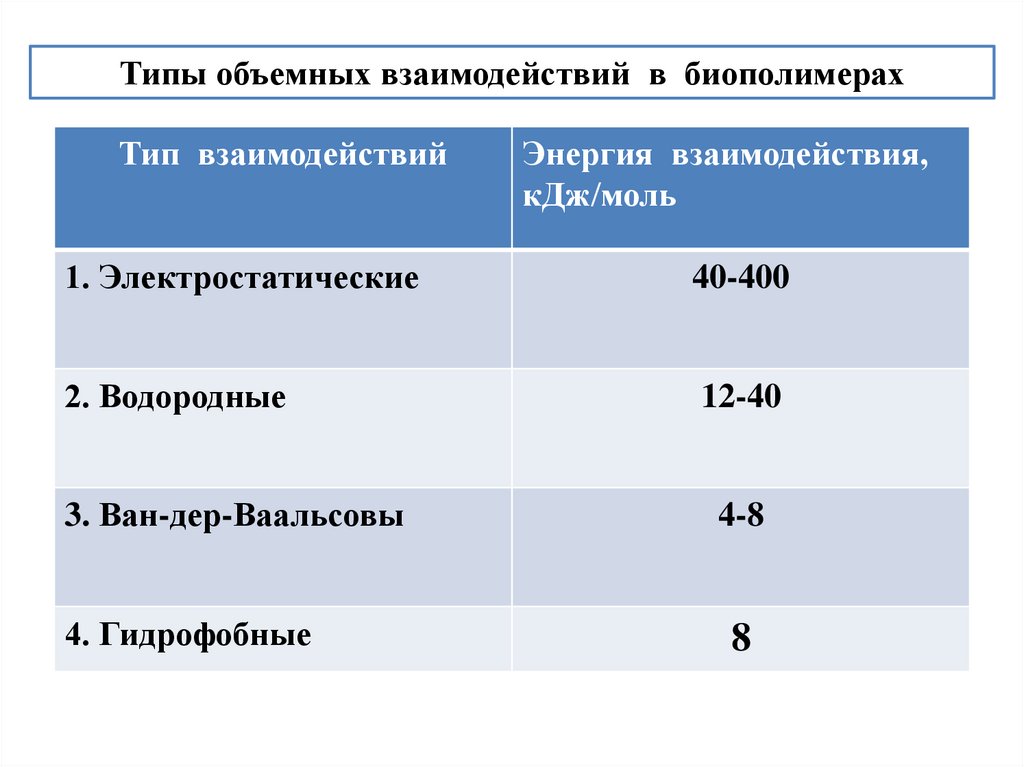
Типы объемных взаимодействий в биополимерахТип взаимодействий
Энергия взаимодействия,
кДж/моль
1. Электростатические
40-400
2. Водородные
12-40
3. Ван-дер-Ваальсовы
4-8
4. Гидрофобные
8
31.
32.
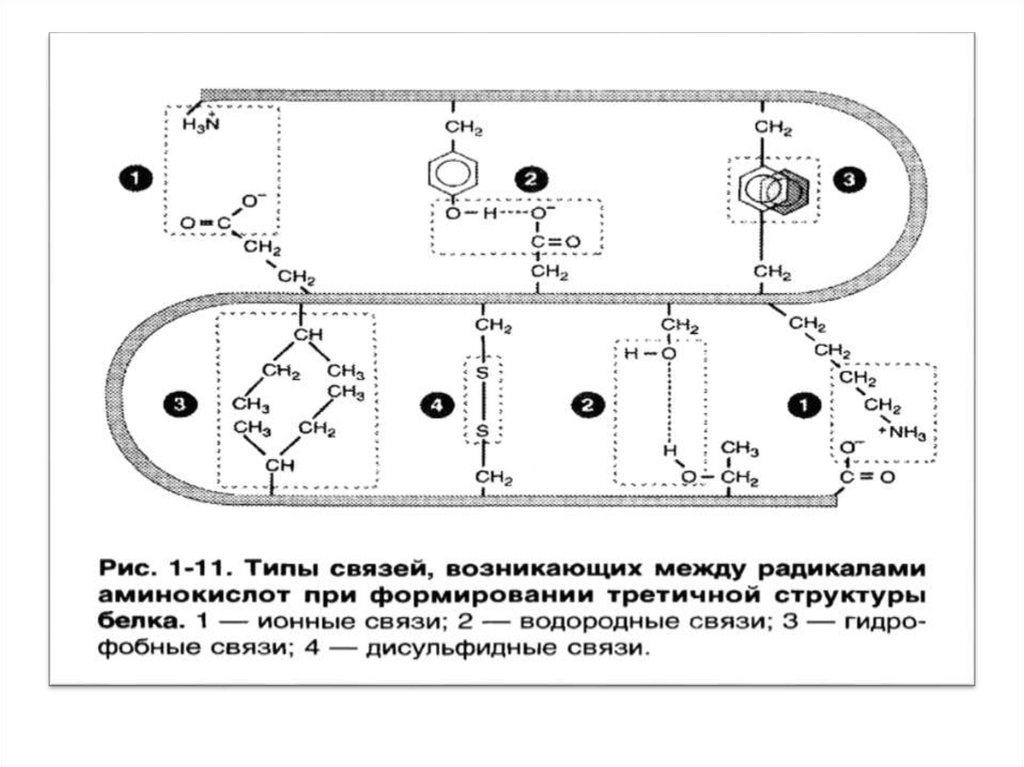
Электростатические (ионные) взаимодействияВзаимодействие между заряженными группами биополимеров:
в белках -NH3+ (Арг, Лиз, Гис) и -СОО▬ (Асп, Глу), в нуклеиновых кислотах
-NH3+ (азотистые основания) и -Н2РО3▬
33.
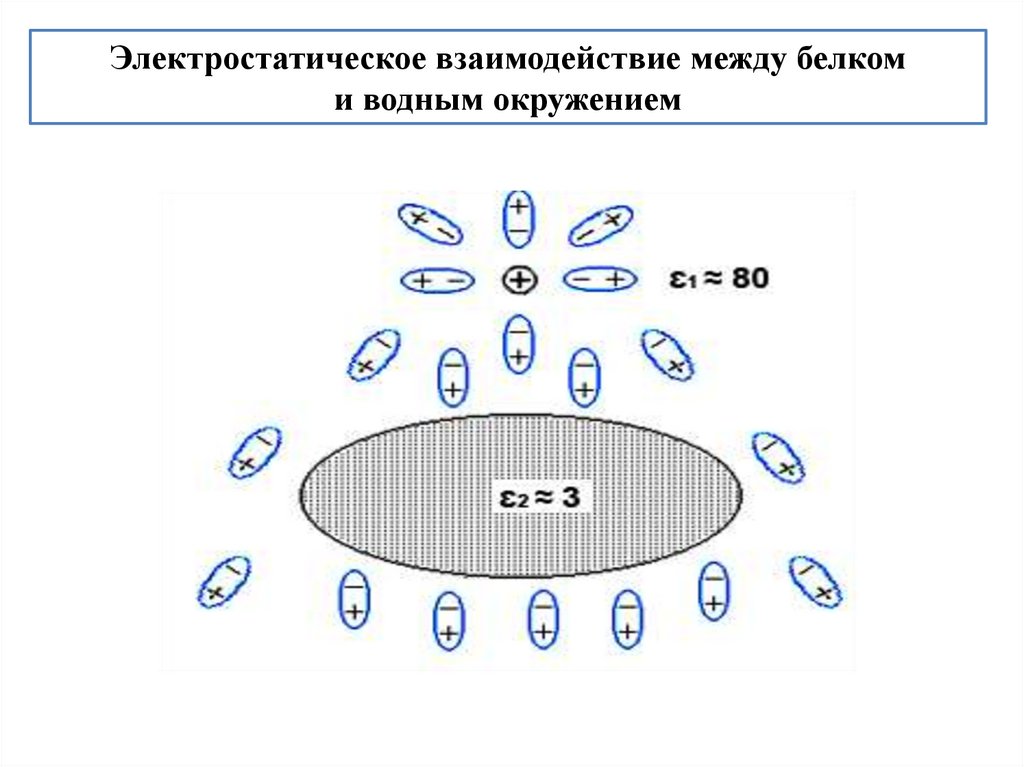
Электростатическое взаимодействие между белкоми водным окружением
34.
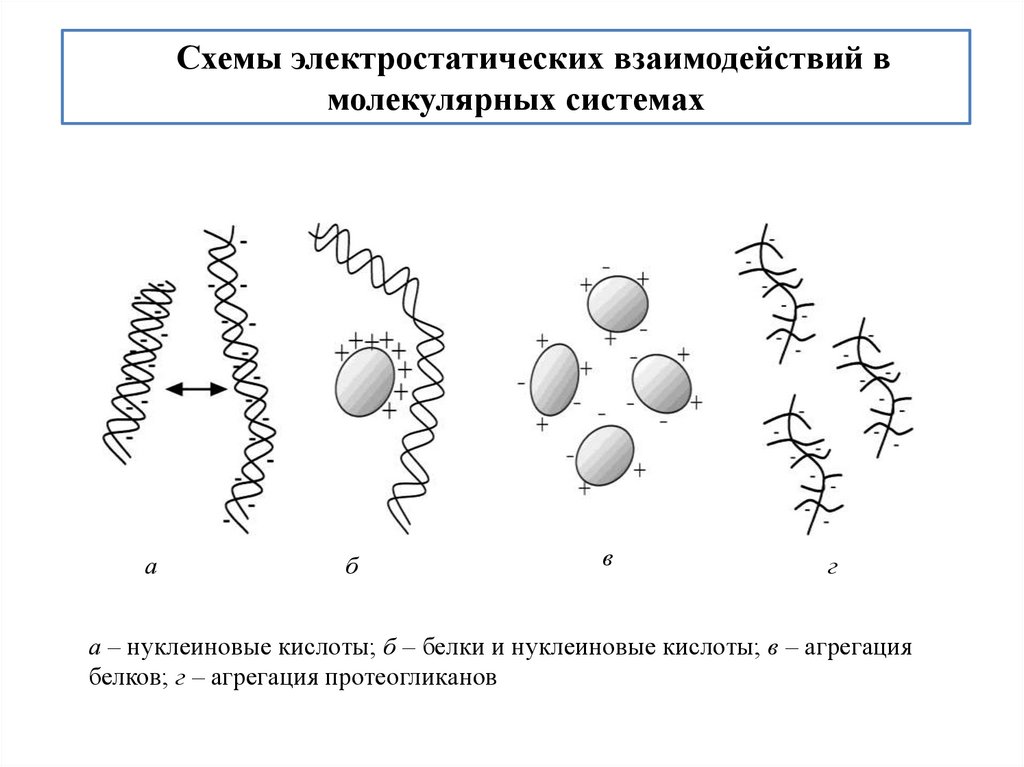
Схемы электростатических взаимодействий вмолекулярных системах
а
б
в
г
а – нуклеиновые кислоты; б – белки и нуклеиновые кислоты; в – агрегация
белков; г – агрегация протеогликанов
35.
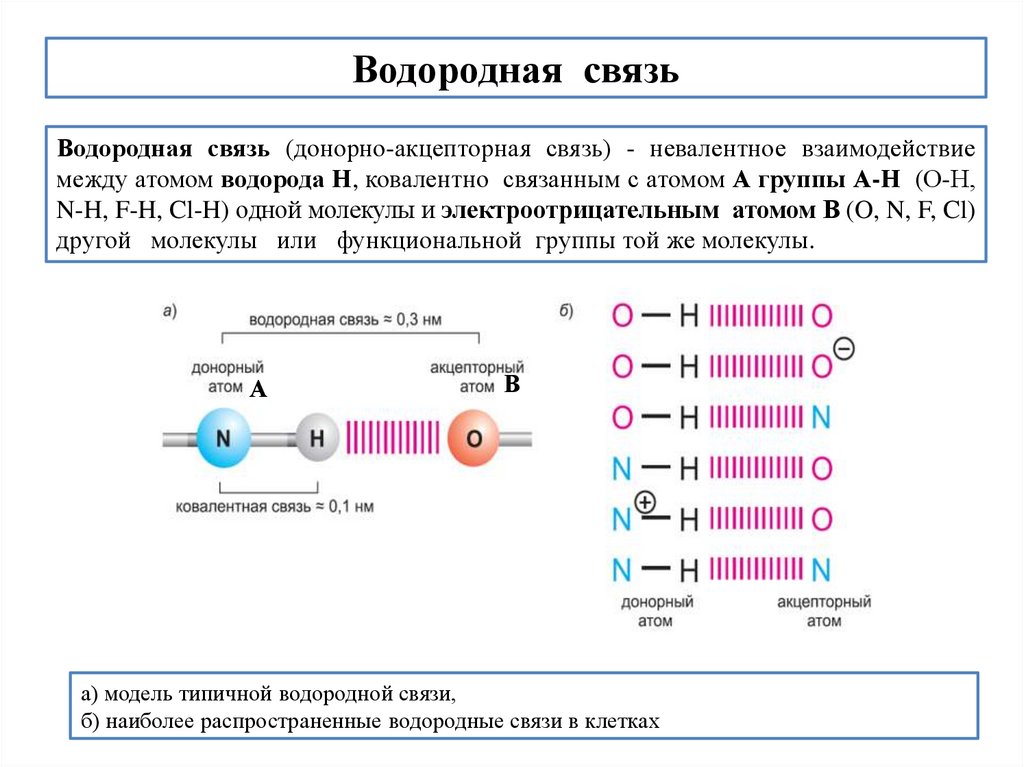
Водородная связьВодородная связь (донорно-акцепторная связь) - невалентное взаимодействие
между атомом водорода Н, ковалентно связанным с атомом А группы А-Н (О-Н,
N-H, F-H, Cl-H) одной молекулы и электроотрицательным атомом В (O, N, F, Cl)
другой молекулы или функциональной группы той же молекулы.
А
В
а) модель типичной водородной связи,
б) наиболее распространенные водородные связи в клетках
36.
Водородная связь1. Само понятие и термин "водородная связь" ввели в 1920 г. Латимер В. и
Родебуш Р., чтобы объяснить высокие температуры кипения воды, жидкого HF и
др. соединений.
«Водородная связь имеет глобальный характер, ее терпкий аромат буквально
пронизывает всю химию. К настоящему времени учение о водородной связи
представляет собой крупную главу в химической науке» (Эпштейн Л.М.,
Шубина Е.С., 2001).
2. Н-связь возникает, когда атом водорода в молекуле соединен с элементом,
имеющим высокую отрицательность (кислородом, азотом, фтором). Водород
при этом приобретает частичный положительный заряд (δ+), благодаря чему
притягивает другую молекулу, также содержащую электроотрицательный
элемент (δ─). Таким образом, в образовании Н-связи участвуют три атома:
два электроотрицательных (А и В) и находящийся между ними атом
водорода - В---Нδ+-Аδ3. Согласно современным представлениям, в образование Н-связи помимо
электростатических сил большой вклад вносит поляризация атомов и
частичный перенос заряда.
37.
Энергия водородной связиА─Н.........В
UН-связи = Uэл-стат + Uдисп + Uделок + Uотт
Uэл-стат - энергия электростатических взаимодействий
Uдисп - энергия дисперсионного взаимодействия
Uделок - энергия делокализации двух электронов связи (А-Н) и
неподеленной пары электронов другого электроотрицательного
атома (В)
Uотт - энергия отталкивания неподеленной пары электронов
другого электроотрицательного атома (В)
38.
Потенциальная функция водородной связиА
В
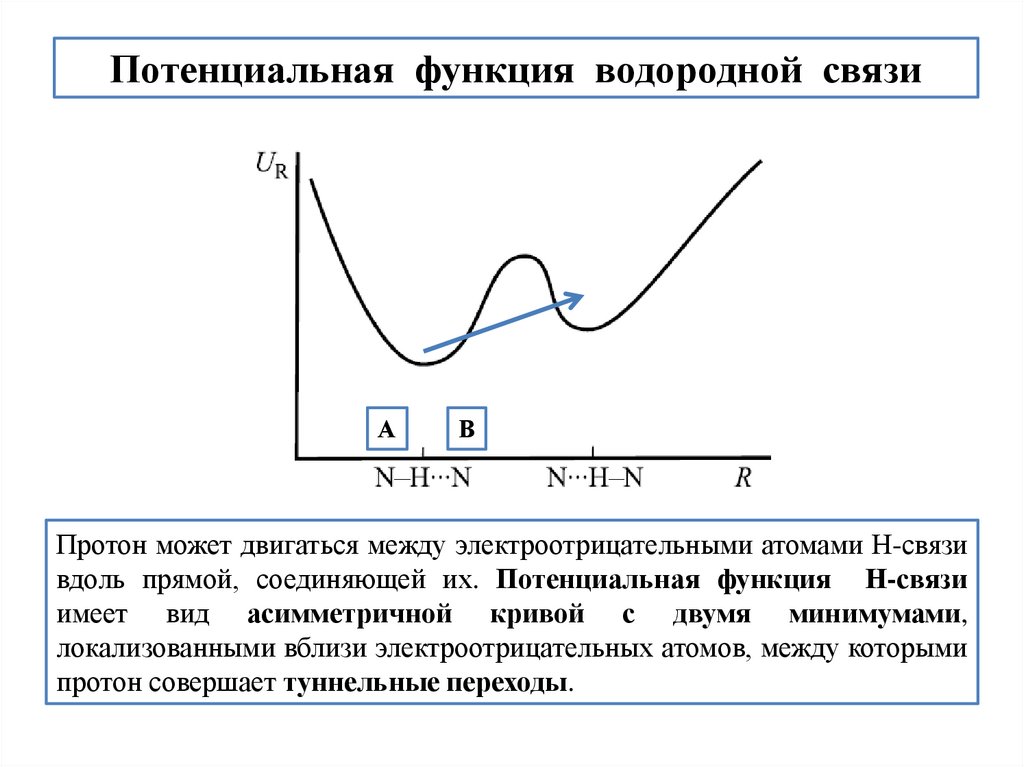
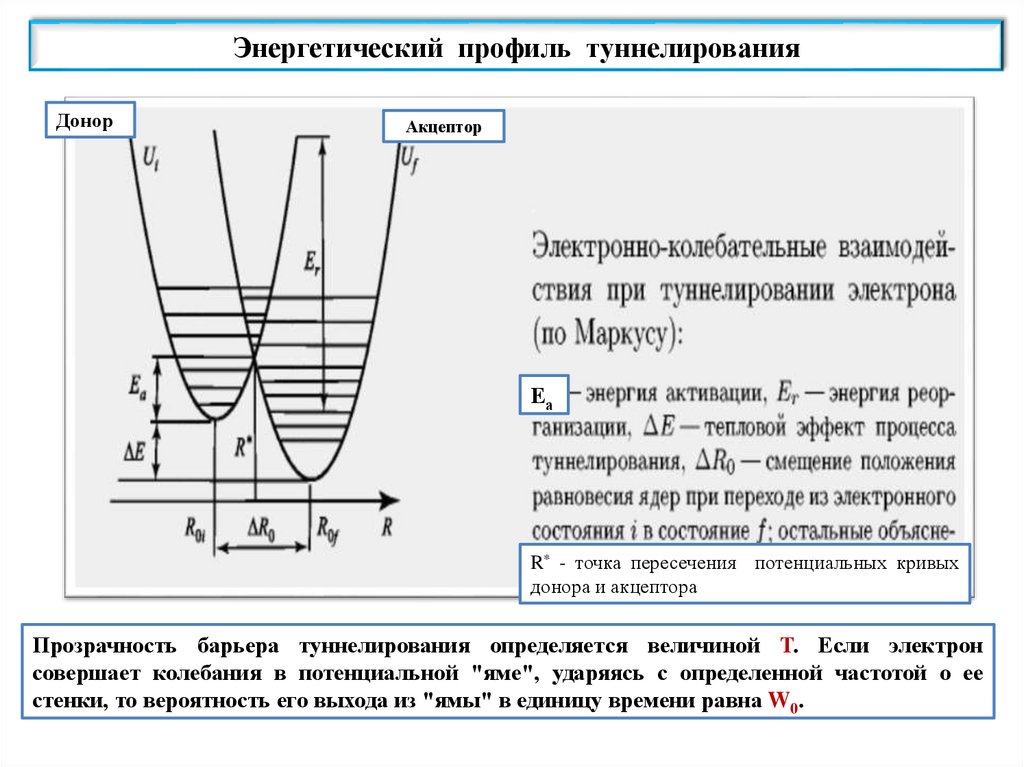
Протон может двигаться между электроотрицательными атомами Н-связи
вдоль прямой, соединяющей их. Потенциальная функция Н-связи
имеет вид асимметричной кривой с двумя минимумами,
локализованными вблизи электроотрицательных атомов, между которыми
протон совершает туннельные переходы.
39.
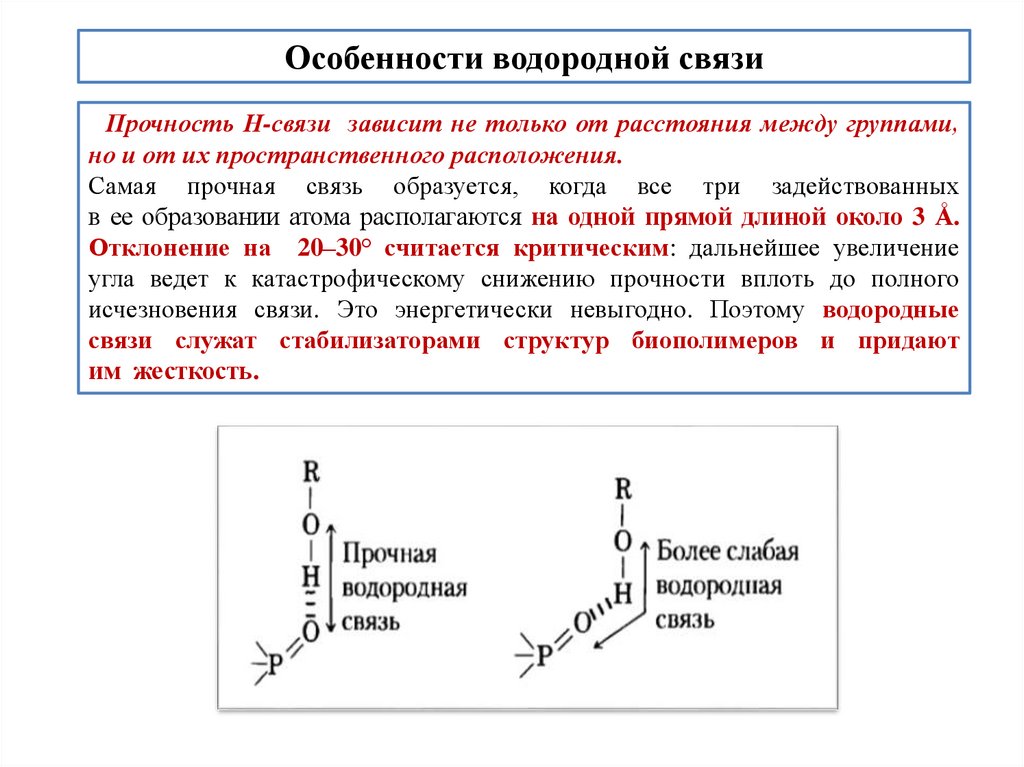
Особенности водородной связиПрочность Н-связи зависит не только от расстояния между группами,
но и от их пространственного расположения.
Самая прочная связь образуется, когда все три задействованных
в ее образовании атома располагаются на одной прямой длиной около 3 Å.
Отклонение на 20–30° считается критическим: дальнейшее увеличение
угла ведет к катастрофическому снижению прочности вплоть до полного
исчезновения связи. Это энергетически невыгодно. Поэтому водородные
связи служат стабилизаторами структур биополимеров и придают
им жесткость.
40.
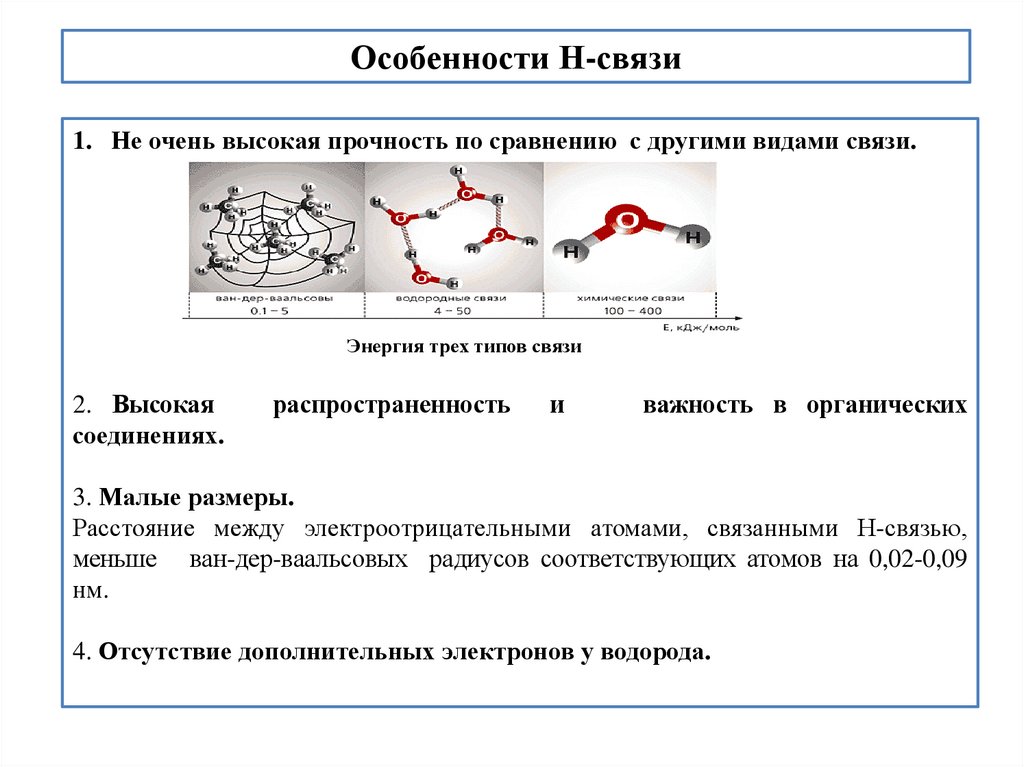
Особенности Н-связи1. Не очень высокая прочность по сравнению с другими видами связи.
Энергия трех типов связи
2. Высокая
соединениях.
распространенность
и
важность в органических
3. Малые размеры.
Расстояние между электроотрицательными атомами, связанными Н-связью,
меньше ван-дер-ваальсовых радиусов соответствующих атомов на 0,02-0,09
нм.
4. Отсутствие дополнительных электронов у водорода.
41.
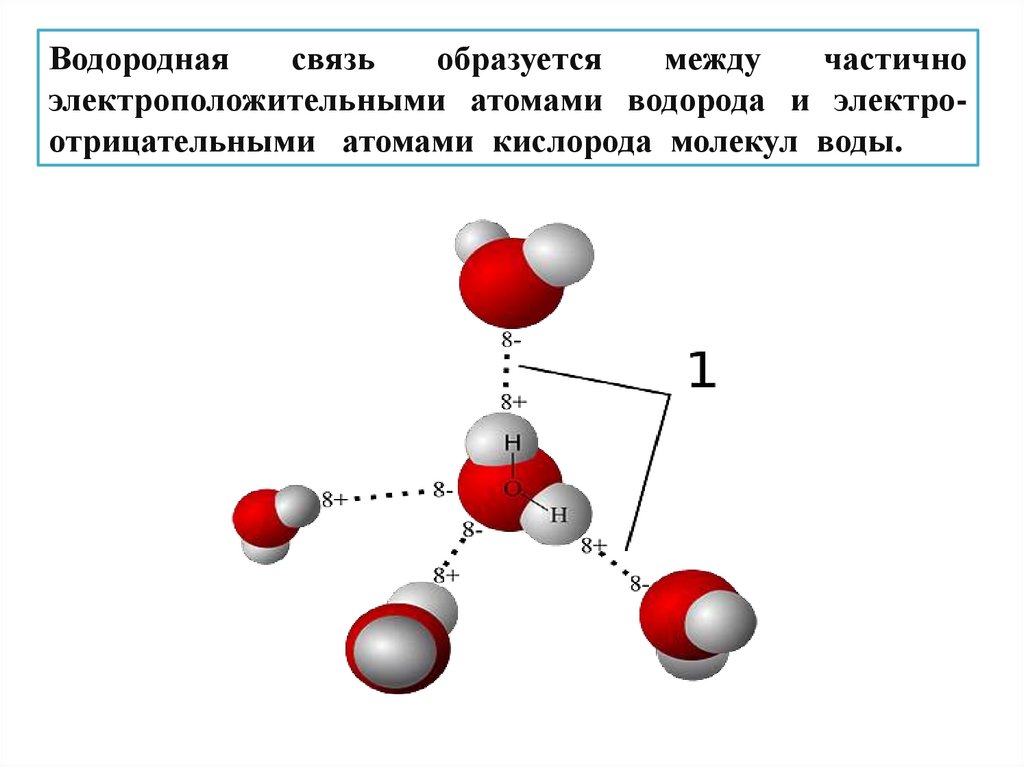
Водороднаясвязь
образуется
между
частично
электроположительными атомами водорода и электроотрицательными атомами кислорода молекул воды.
42.
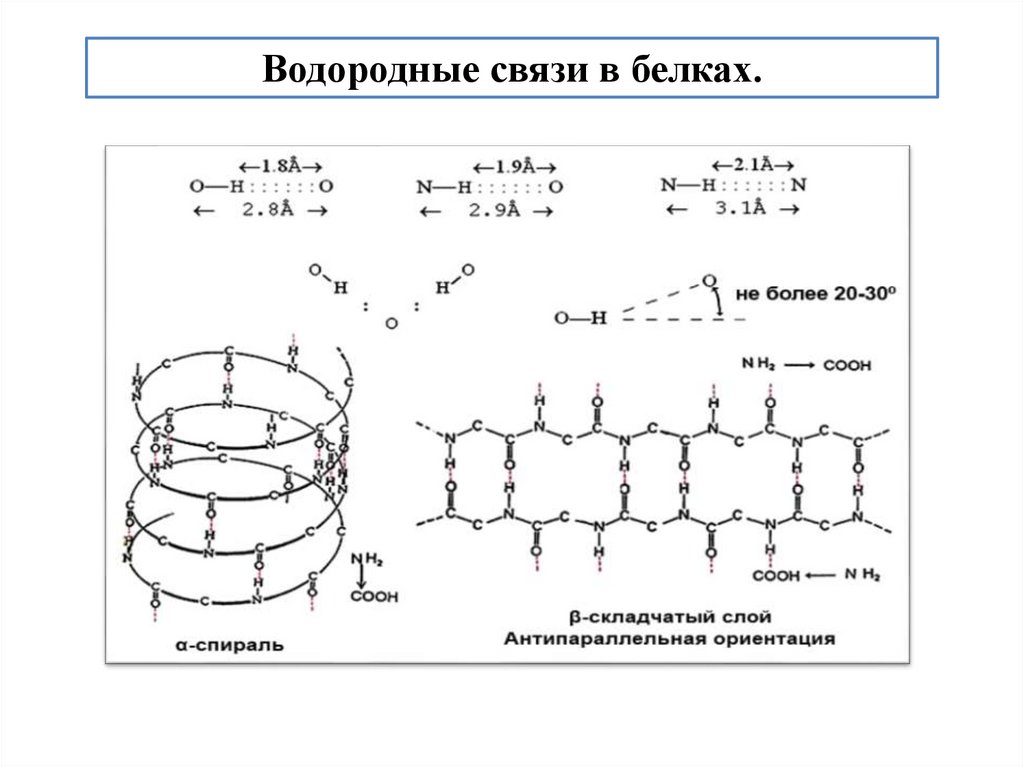
Водородные связи в белках.43.
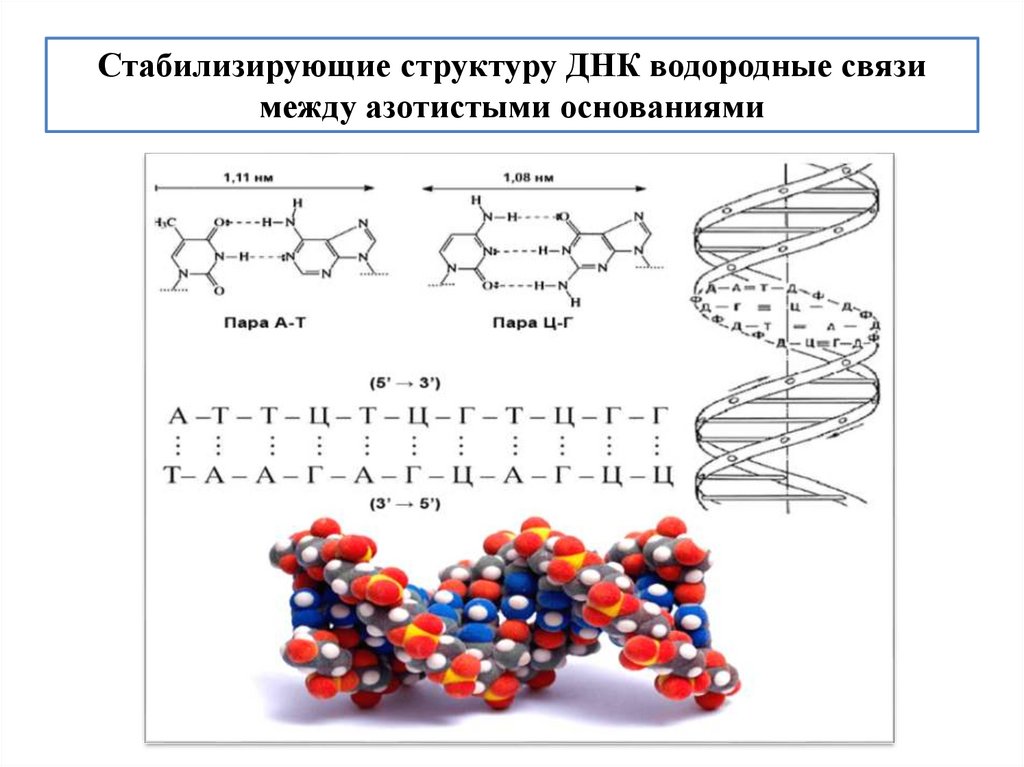
Стабилизирующие структуру ДНК водородные связимежду азотистыми основаниями
44.
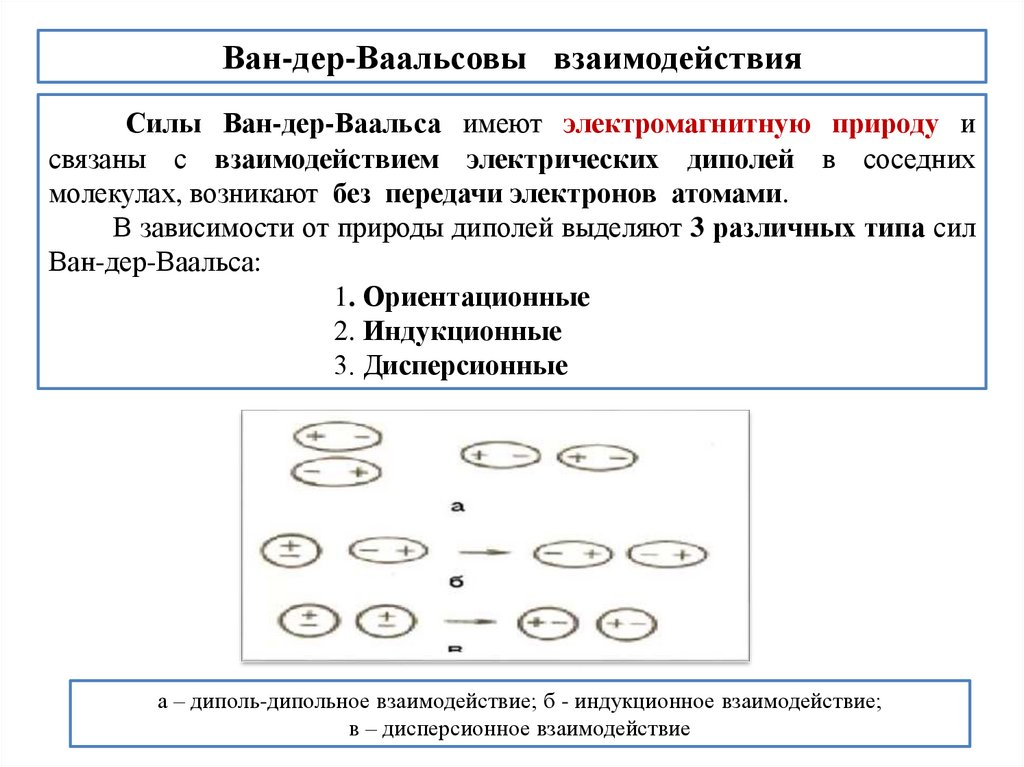
Ван-дер-Ваальсовы взаимодействияСилы Ван-дер-Ваальса имеют электромагнитную природу и
связаны с взаимодействием электрических диполей в соседних
молекулах, возникают без передачи электронов атомами.
В зависимости от природы диполей выделяют 3 различных типа сил
Ван-дер-Ваальса:
1. Ориентационные
2. Индукционные
3. Дисперсионные
а – диполь-дипольное взаимодействие; б - индукционное взаимодействие;
в – дисперсионное взаимодействие
45.
Ван-дер-Ваальсовы взаимодействия1.Ориентационные – диполь-дипольные взаимодействия, возникают
между молекулами с постоянным дипольным моментом.
Uор = - 2/3 Р12 Р22 / kБ TR6
Р1,Р2 - дипольные моменты, kБ - константа Больцмана, R - расстояние между диполями
2. Индукционные - диполь-недипольные взаимодействия, возникают
между постоянным дипольным моментом в одной молекуле и
наведенным им диполем в соседней поляризуемой молекуле.
Uинд = -2α Р12 / R6
Р1 - постоянный диполь первой молекулы, α - коэффициент поляризуемости второй
молекулы
3.
Дисперсионные - недиполь-недипольные взаимодействия,
возникают между молекулами, которые не обладают постоянными
дипольными
моментами.
Природа
этих
сил
носит
квантовомеханический характер.
I1, I2 - ионизационные потенциалы, α1, α2 - поляризуемости молекул
46.
Суммарная энергия Ван-дер-Ваальсовых сил притяжения иотталкивания (U) зависит от расстояния между молекулами (R)
и называется потенциалом Леннарда-Джонса или
потенциалом «6,12»
При удалении молекул проявляются силы притяжения, которые
обратно пропорциональны расстоянию в шестой степени (R6) между
молекулами.
энергия притяжения
энергия отталкивания
При сильном сближении молекул проявляются силы отталкивания,
которые обратно пропорциональны расстоянию в двенадцатой
степени (R12 ) между молекулами.
Ван-дер-Ваальсовы взаимодействия - силы притяжения и
отталкивания - удерживают атомы на некотором расстоянии друг от
друга, что существенно увеличивает стабильность биомолекул.
47.
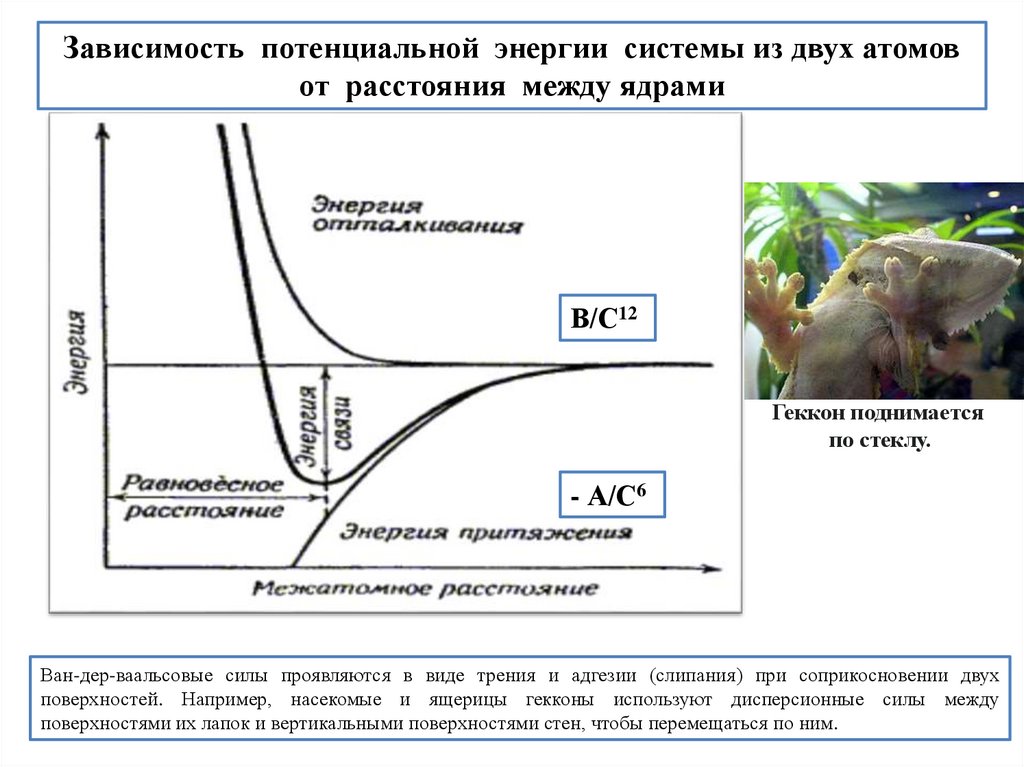
Зависимость потенциальной энергии системы из двух атомовот расстояния между ядрами
В/C12
Геккон поднимается
по стеклу.
- А/C6
Ван-дер-ваальсовые силы проявляются в виде трения и адгезии (слипания) при соприкосновении двух
поверхностей. Например, насекомые и ящерицы гекконы используют дисперсионные силы между
поверхностями их лапок и вертикальными поверхностями стен, чтобы перемещаться по ним.
48.
Гидрофобные взаимодействияГидрофобные взаимодействия (ГВ) – имеют энтропийную природу.
ГВ – это благоприятное сближение и взаимодействие неполярных молекул,
чтобы избежать невыгодных контактов с полярными молекулами Н2О. В
результате ГВ значительно увеличивается S системы и уменьшается свободная
энергия G (это соответствует Второму началу термодинамики).
dG↓ = dН – TdS↑
1.Образование упорядоченного («льдистого») слоя молекул воды вблизи гидрофобной
поверхности необходимо, чтобы молекулы воды могли формировать водородные связи
друг с другом. Но это приводит к падению энтропии, невыгодному в связи со Вторым
законом. Возникает неустойчивое состояние dG↑ = dН – TdS↓.
2.Для увеличения энтропии необходимо снизить площадь контактов гидрофобных
молекул с водой. Поэтому неполярные молекулы или радикалы в биополимерах
взаимодействуют друг с другом, избегая невыгодных контактов с водой. Кроме того,
полярные группы или радикалы аминокислот конкурируют с молекулами воды за
образование Н-связей. Полагают, что гидрофильные радикалы «взламывают»
кластеры упорядоченной воды и повышают энтропию системы. Все это переводит
систему в устойчивое состояние: dG↓ = dН – TdS↑.
49.
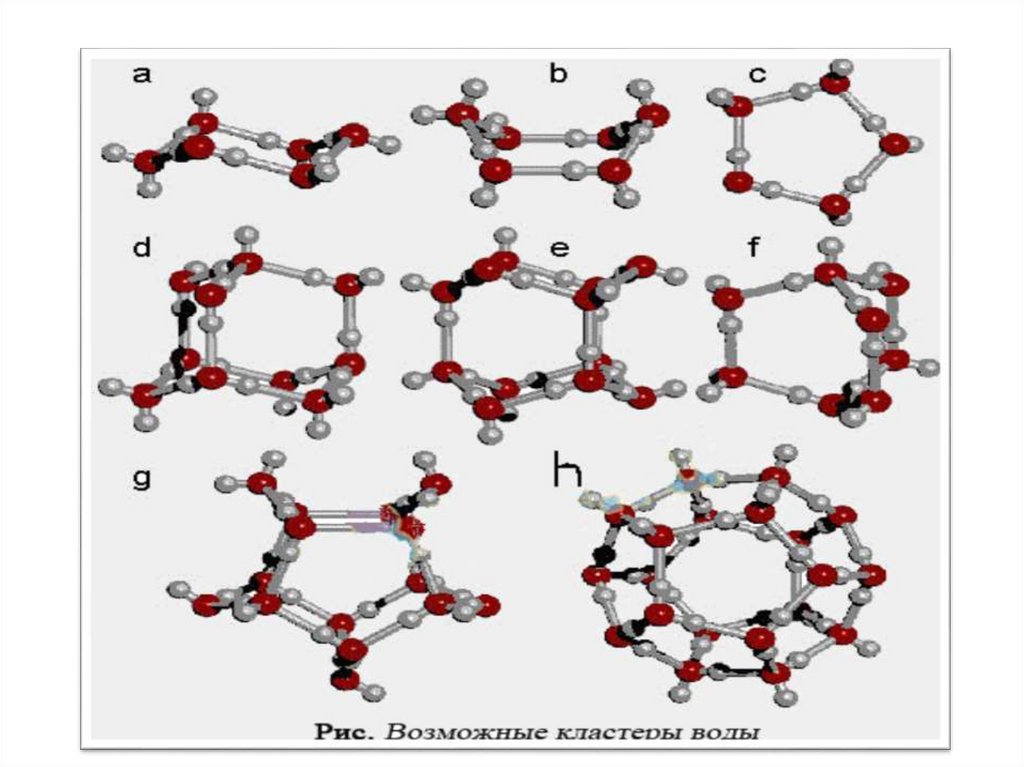
Особенности молекул воды1.
В молекуле Н2О имеется асимметричное распределение зарядов,
Н2О – выраженный диполь.
2.
Н2О образует множество Н-связей, образуя сеть, что придает ей
аномальные свойства (повышенную Т кипения, теплоемкость).
3.
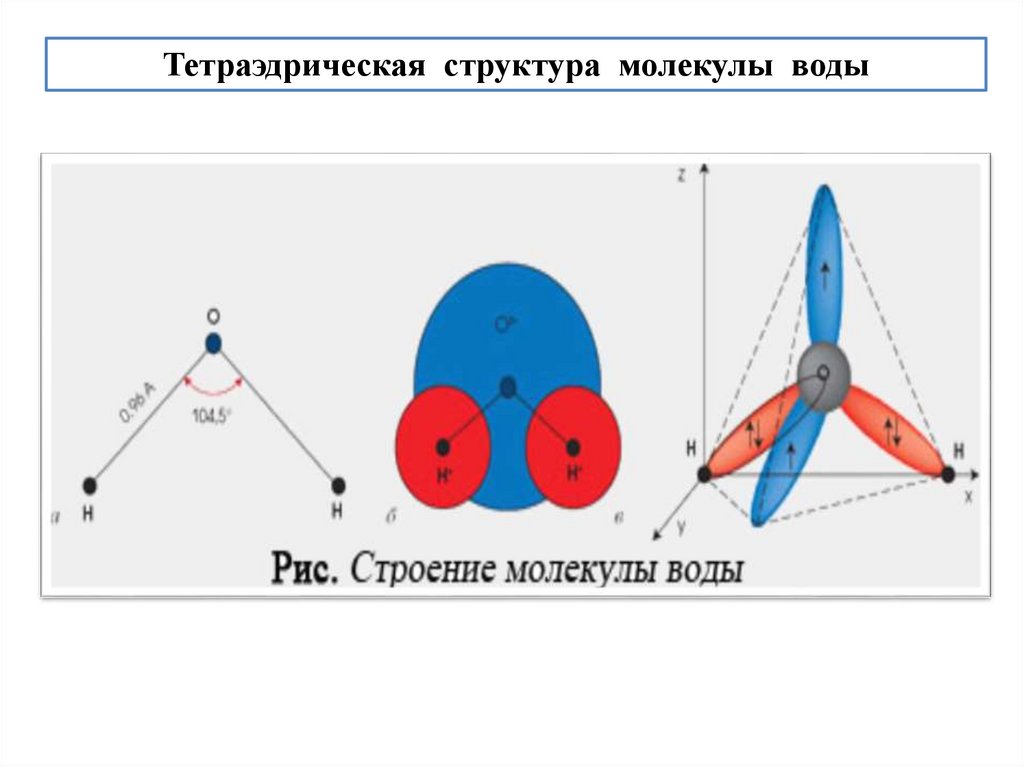
Н2О образует ассоциаты с координационным числом 4.
Атомы О 1-4-ой молекул Н2О расположены в вершинах тетраэдра,
в центре которого - молекула Н2О.
4.
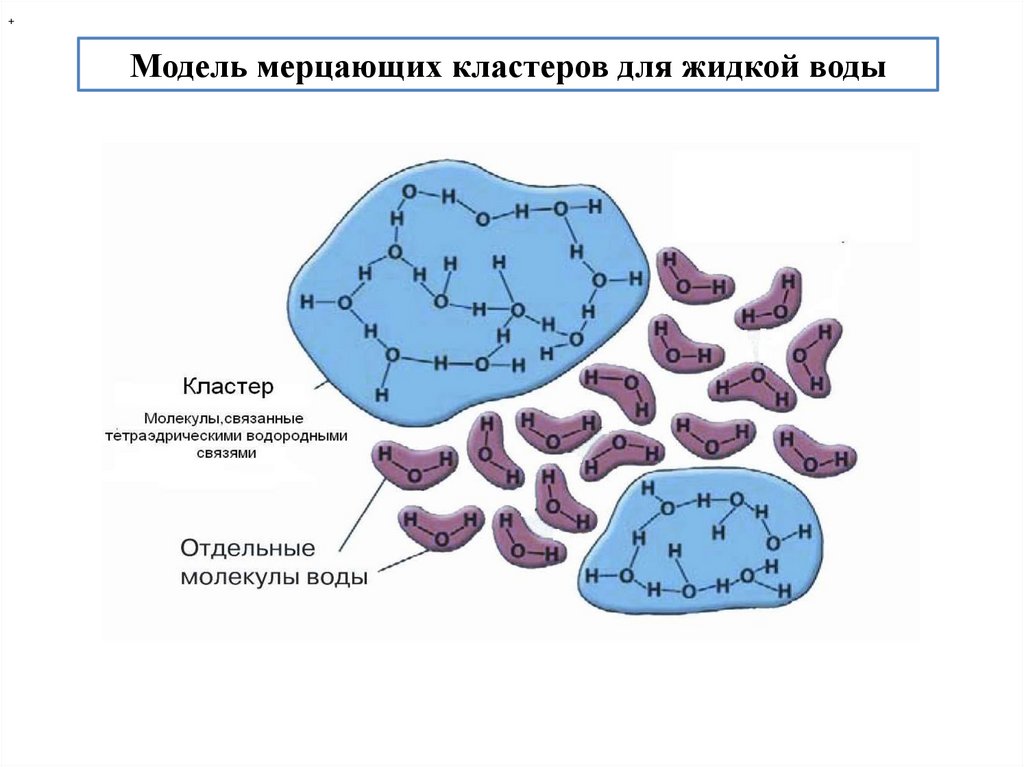
Н2О образует мерцающие кластеры (tж = 10-11 - 10-12 с), которые
динамичны. При 200С 70% молекул воды кластеризовано, 30% свободно.
5. Н2О влияет на конформацию макромолекул: Н2О конкурирует за
места образования Н-связей с полярными аминокислотами,
неполярные аминокислоты избегают контактов с Н2О.
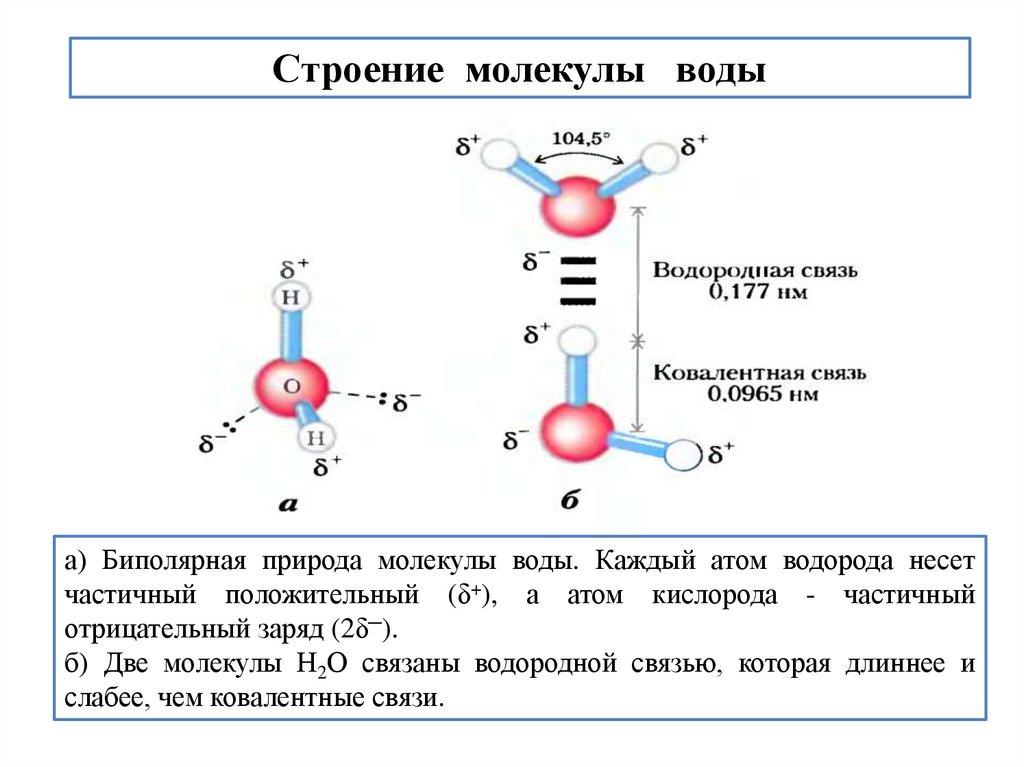
50.
Строение молекулы водыа) Биполярная природа молекулы воды. Каждый атом водорода несет
частичный положительный (δ+), а атом кислорода - частичный
отрицательный заряд (2δ─).
б) Две молекулы Н2О связаны водородной связью, которая длиннее и
слабее, чем ковалентные связи.
51.
Н2О образует ассоциаты с координационным числом 4.52.
Тетраэдрическая структура молекулы воды53.
+Модель мерцающих кластеров для жидкой воды
54.
55.
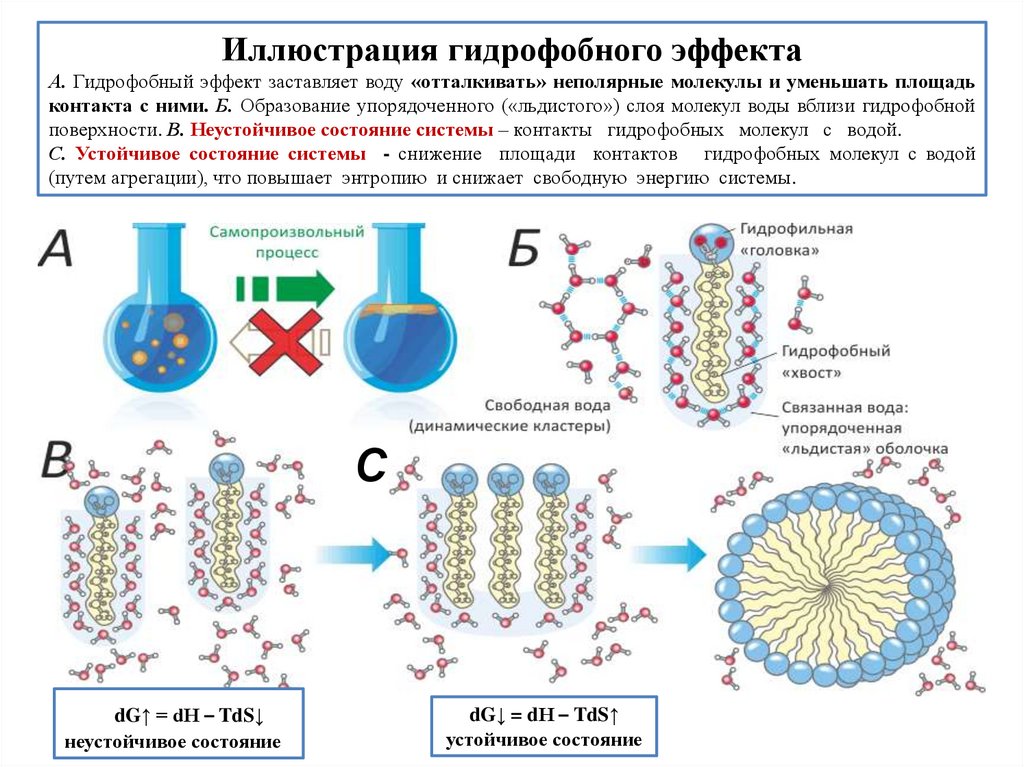
Иллюстрация гидрофобного эффектаА. Гидрофобный эффект заставляет воду «отталкивать» неполярные молекулы и уменьшать площадь
контакта с ними. Б. Образование упорядоченного («льдистого») слоя молекул воды вблизи гидрофобной
поверхности. В. Неустойчивое состояние системы – контакты гидрофобных молекул с водой.
С. Устойчивое состояние системы - снижение площади контактов гидрофобных молекул с водой
(путем агрегации), что повышает энтропию и снижает свободную энергию системы.
С
dG↑ = dН – TdS↓
неустойчивое состояние
dG↓ = dН – TdS↑
устойчивое состояние
56.
Различная конфигурация молекул воды вблизималенькой (а) и большой (б) гидрофобных частиц
Установлено различие в структуре воды вблизи маленькой (<1 нм) и большой
(>>1 нм) гидрофобных частиц.
1) В случае маленькой частицы (а) каждая молекула воды образует четыре
водородные связи.
2) В случае крупной гидрофобной частицы (б) молекулам воды приходится
выстраиваться в «льдистую» оболочку вокруг этой частицы, что снижает
энтропию системы (количество Н-связей уменьшается до трех).
Chandler D., 2005
57.
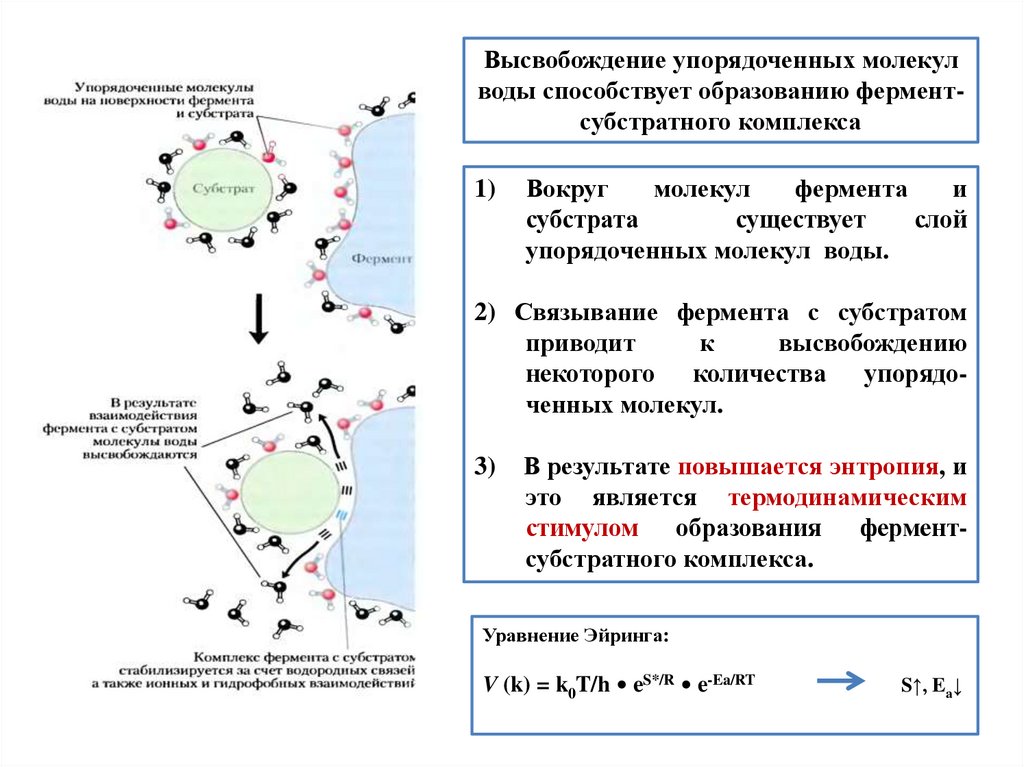
Высвобождение упорядоченных молекулводы способствует образованию ферментсубстратного комплекса
1)
Вокруг
молекул
фермента
и
субстрата
существует
слой
упорядоченных молекул воды.
2) Связывание фермента с субстратом
приводит
к
высвобождению
некоторого количества упорядоченных молекул.
3)
В результате повышается энтропия, и
это является термодинамическим
стимулом образования ферментсубстратного комплекса.
Уравнение Эйринга:
V (k) = k0T/h • eS*/R • e-Ea/RT
S↑, Ea↓
58.
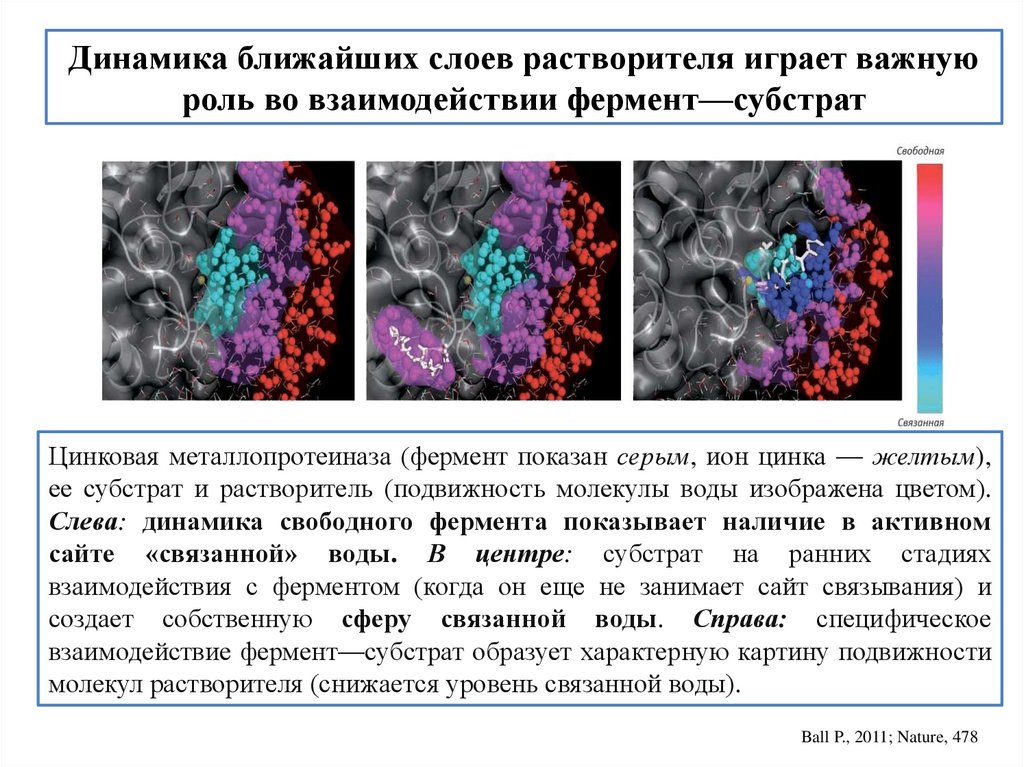
Динамика ближайших слоев растворителя играет важнуюроль во взаимодействии фермент—субстрат
Цинковая металлопротеиназа (фермент показан серым, ион цинка — желтым),
ее субстрат и растворитель (подвижность молекулы воды изображена цветом).
Слева: динамика свободного фермента показывает наличие в активном
сайте «связанной» воды. В центре: субстрат на ранних стадиях
взаимодействия с ферментом (когда он еще не занимает сайт связывания) и
создает собственную сферу связанной воды. Справа: специфическое
взаимодействие фермент—субстрат образует характерную картину подвижности
молекул растворителя (снижается уровень связанной воды).
Ball P., 2011; Nature, 478
59.
Индекс гидрофобностиИндекс
гидрофобности
характеризует
сродство
радикала
к
воде,
т.е.
растворимость в воде.
Положительные значения индекса имеют
гидрофобные
аминокислоты, плохо
растворимые в воде.
Отрицательные значения индекса у
гидрофильных
аминокислот, хорошо
растворимых в воде.
60.
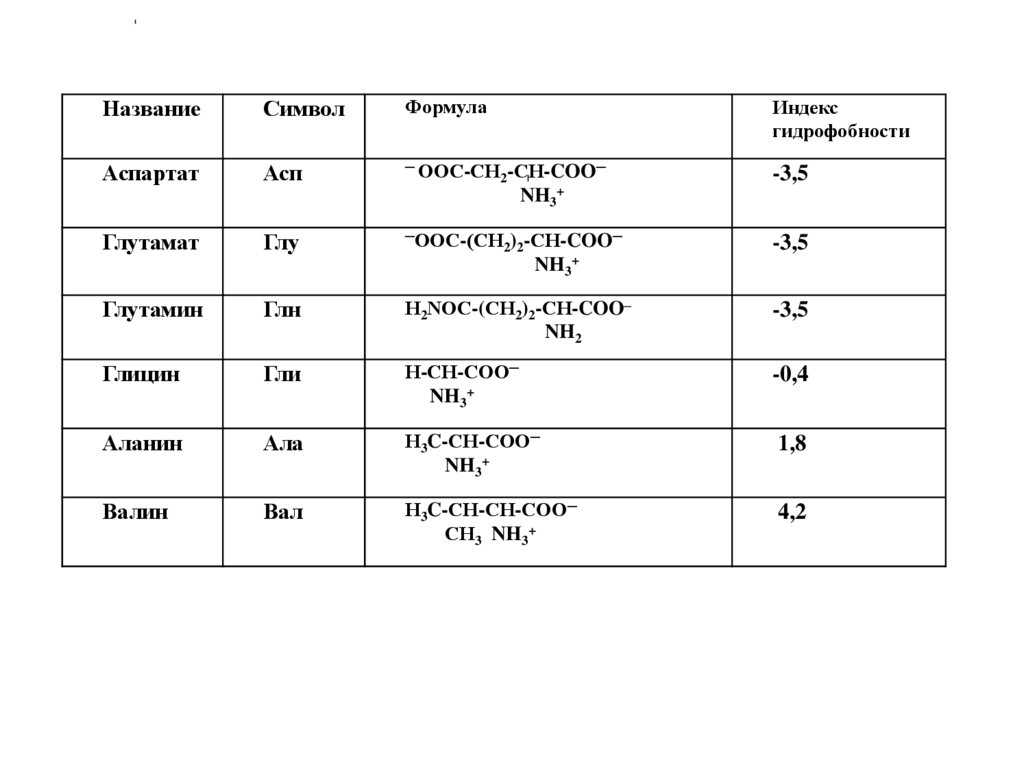
НазваниеСимвол
Формула
Индекс
гидрофобности
Аспартат
Асп
─ ООС-СН -СН-COO─
2
NH3+
-3,5
Глутамат
Глу
─ООС-(СН ) -СН-COO─
2 2
NH3+
-3,5
Глутамин
Глн
Н2NОС-(СН2)2-СН-COO─
NH2
-3,5
Глицин
Гли
Н-СН-СОО─
NH3+
-0,4
Аланин
Ала
Н3C-СН-СОО─
NH3+
1,8
Валин
Вал
Н3C-СН-СН-СОО─
СН3 NH3+
4,2
61.
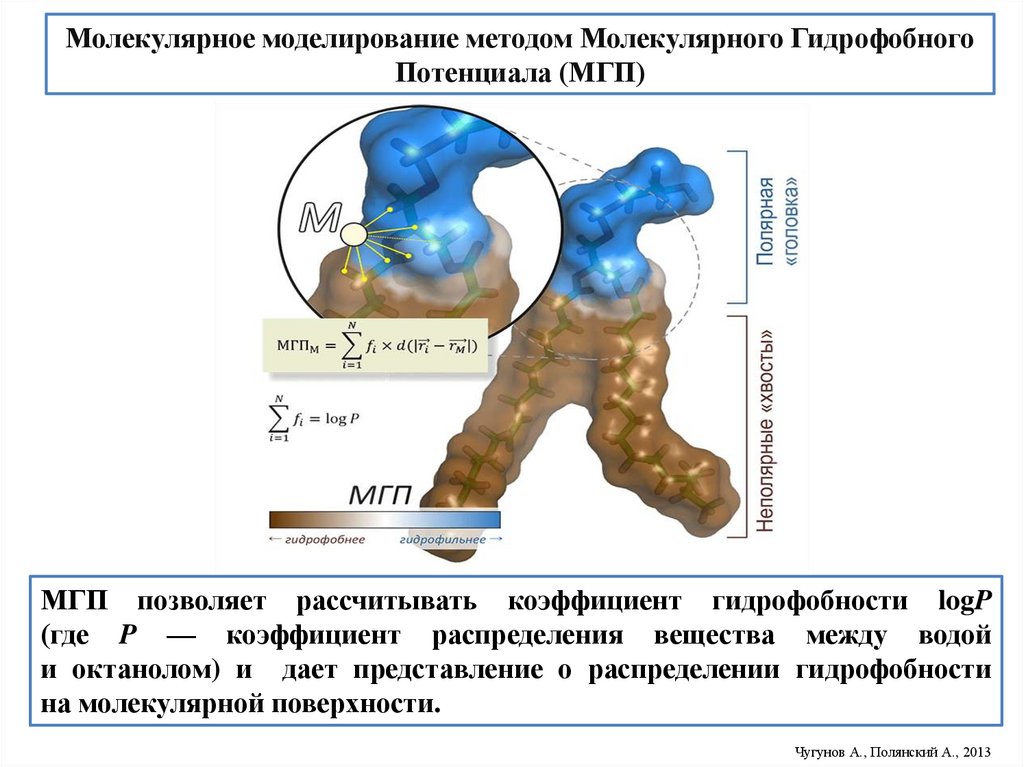
Молекулярное моделирование методом Молекулярного ГидрофобногоПотенциала (МГП)
МГП позволяет рассчитывать коэффициент гидрофобности logP
(где P — коэффициент распределения вещества между водой
и октанолом) и дает представление о распределении гидрофобности
на молекулярной поверхности.
Чугунов А., Полянский А., 2013
62.
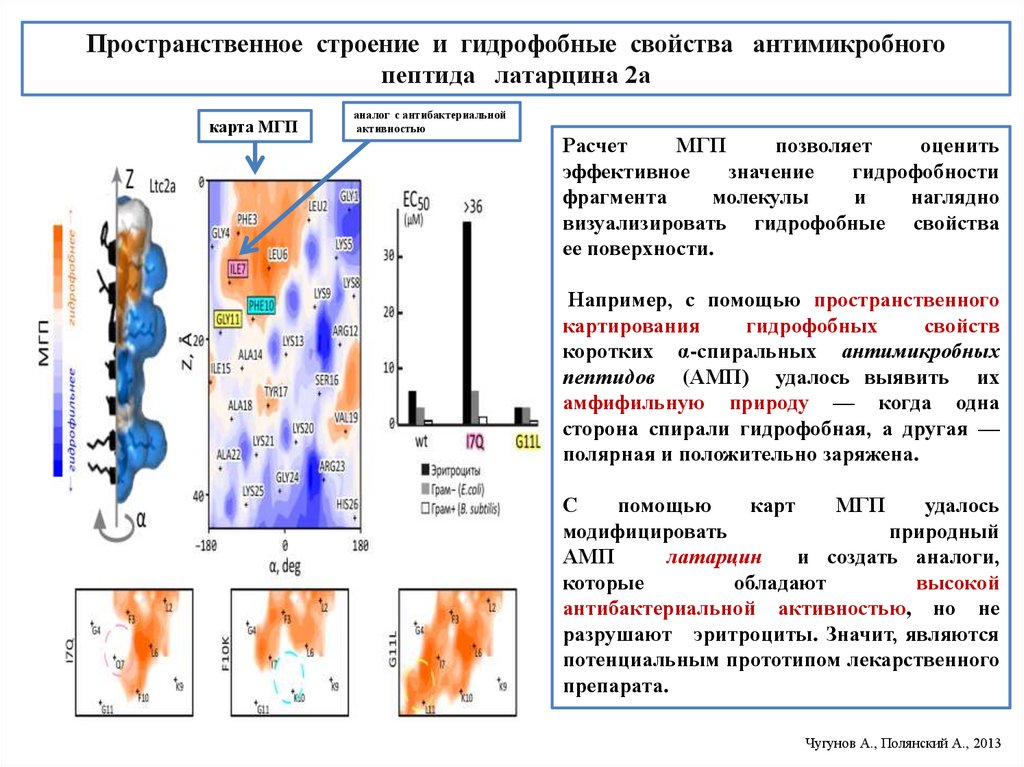
Пространственное строение и гидрофобные свойства антимикробногопептида латарцина 2а
карта МГП
аналог с антибактериальной
активностью
Расчет
МГП
позволяет
оценить
эффективное
значение
гидрофобности
фрагмента
молекулы
и
наглядно
визуализировать гидрофобные свойства
ее поверхности.
Например, с помощью пространственного
картирования
гидрофобных
свойств
коротких α-спиральных антимикробных
пептидов (АМП) удалось выявить их
амфифильную природу — когда одна
сторона спирали гидрофобная, а другая —
полярная и положительно заряжена.
С
помощью
карт
МГП
удалось
модифицировать
природный
АМП
латарцин
и создать аналоги,
которые
обладают
высокой
антибактериальной активностью, но не
разрушают эритроциты. Значит, являются
потенциальным прототипом лекарственного
препарата.
Чугунов А., Полянский А., 2013
63.
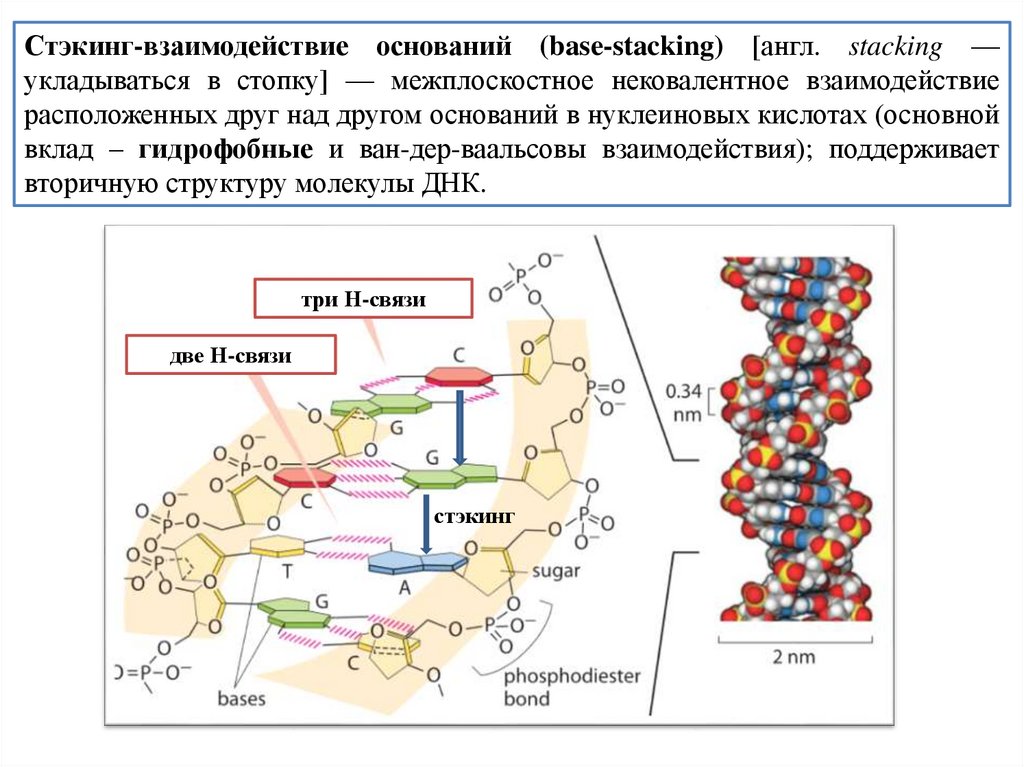
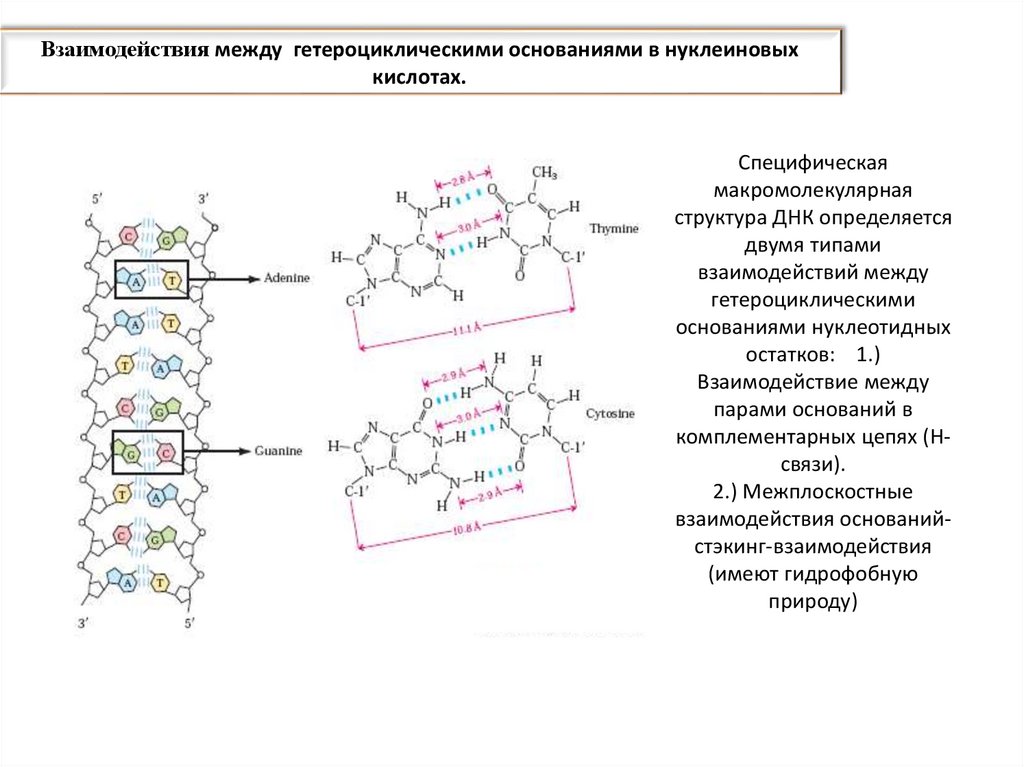
Стэкинг-взаимодействие оснований (base-stacking) [англ. stacking —укладываться в стопку] — межплоскостное нековалентное взаимодействие
расположенных друг над другом оснований в нуклеиновых кислотах (основной
вклад – гидрофобные и ван-дер-ваальсовы взаимодействия); поддерживает
вторичную структуру молекулы ДНК.
три Н-связи
две Н-связи
стэкинг
64.
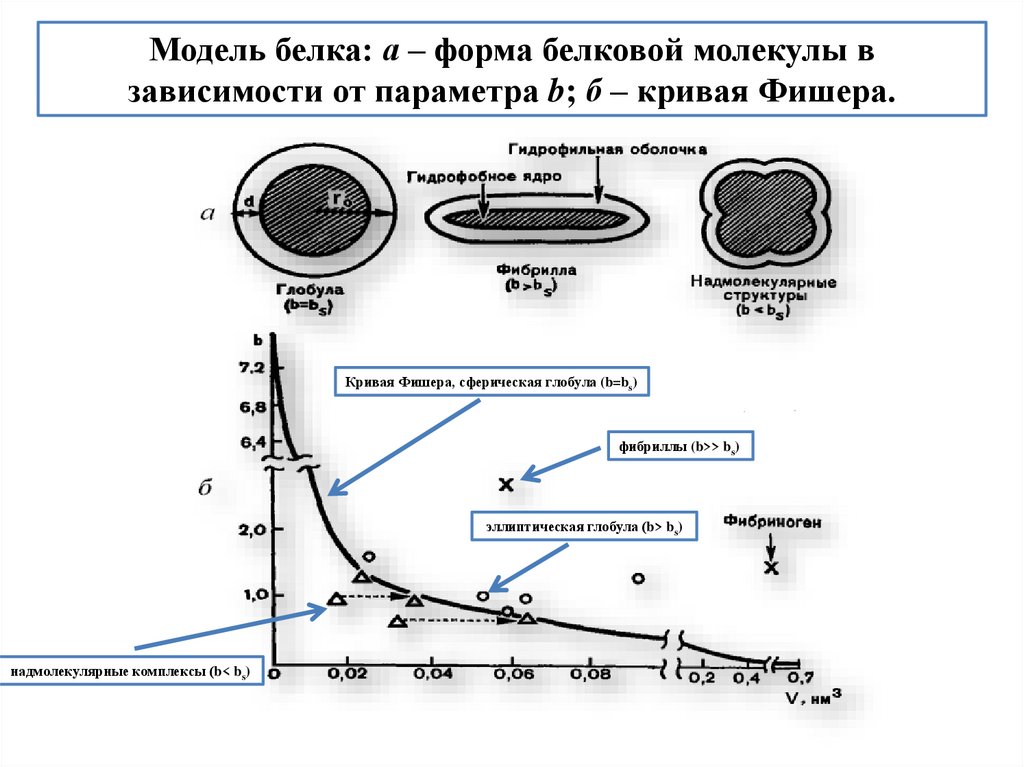
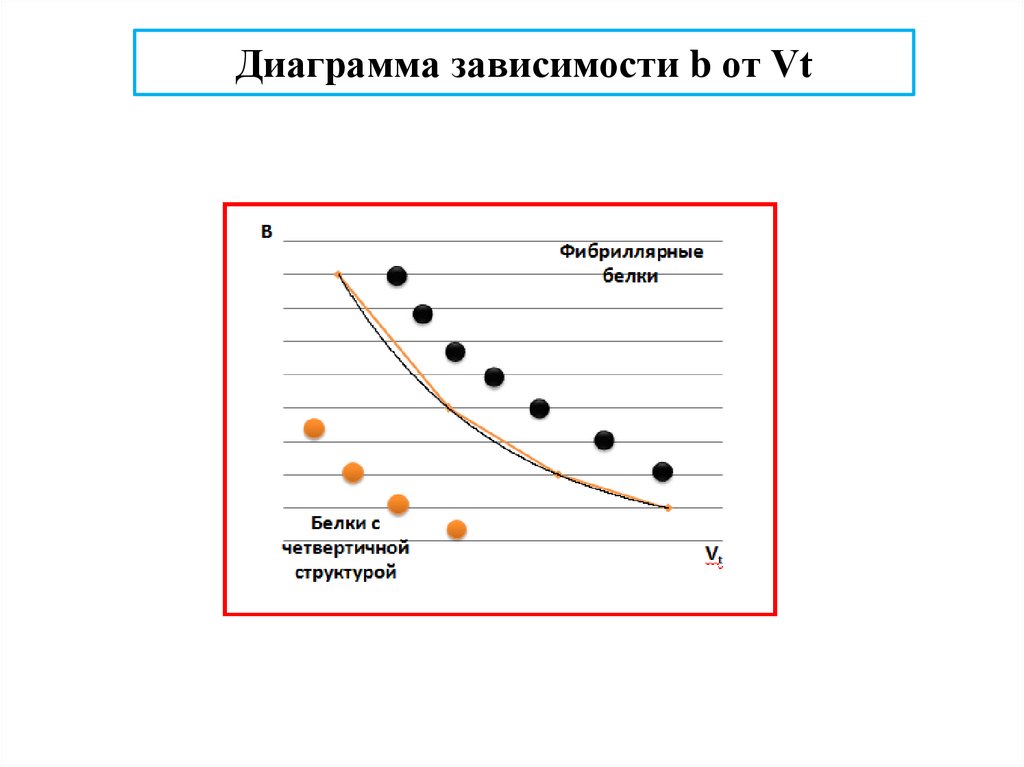
Предсказание формы глобулы белка по Фишеру (1964)d
r
Строение глобулы по Фишеру
b = Ve / Vi – отношение числа гидрофильных остатков (Ve) к числу
гидрофобных (Vi), если все остатки занимают одинаковые объемы
Vt = 4/3






















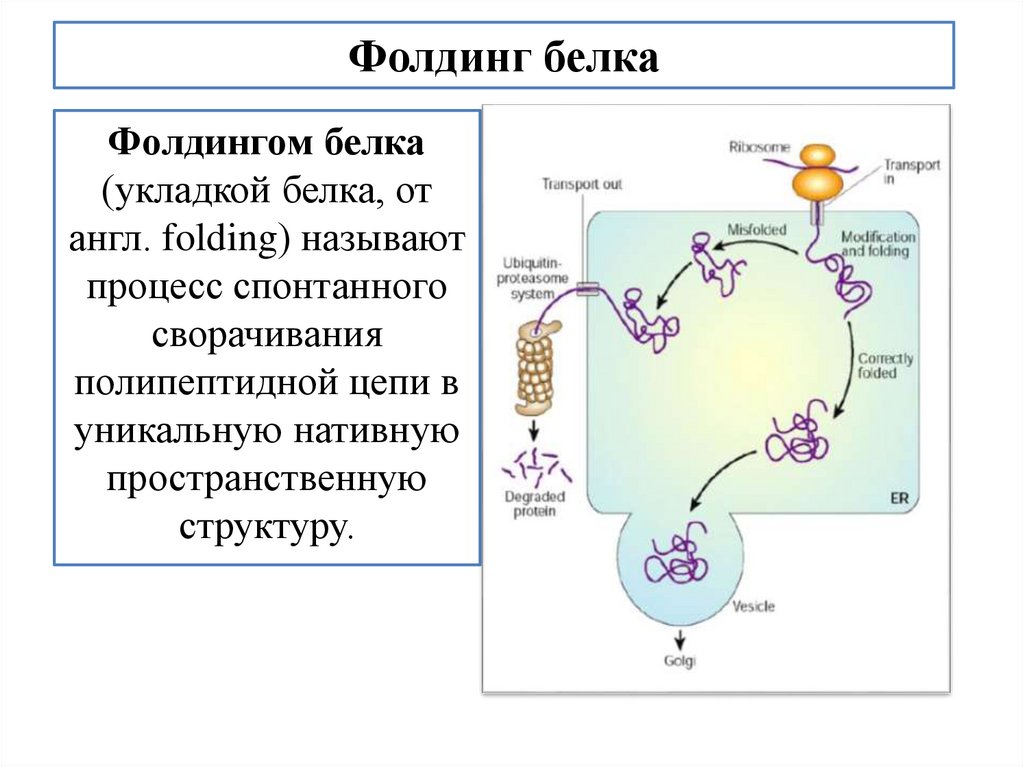

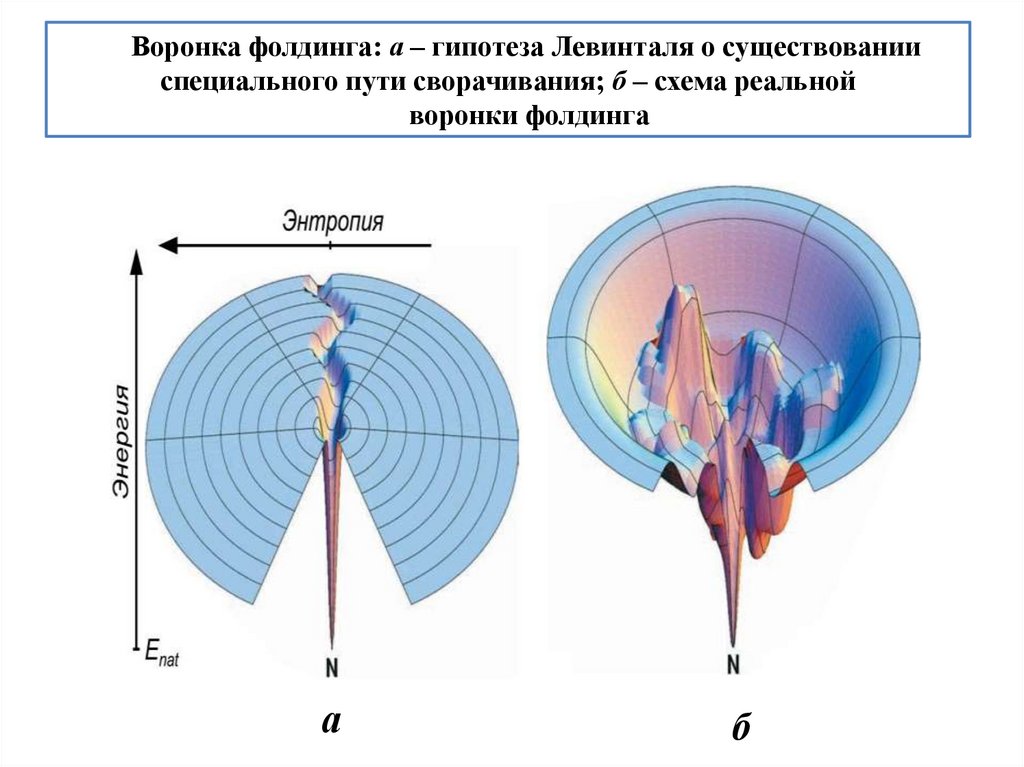
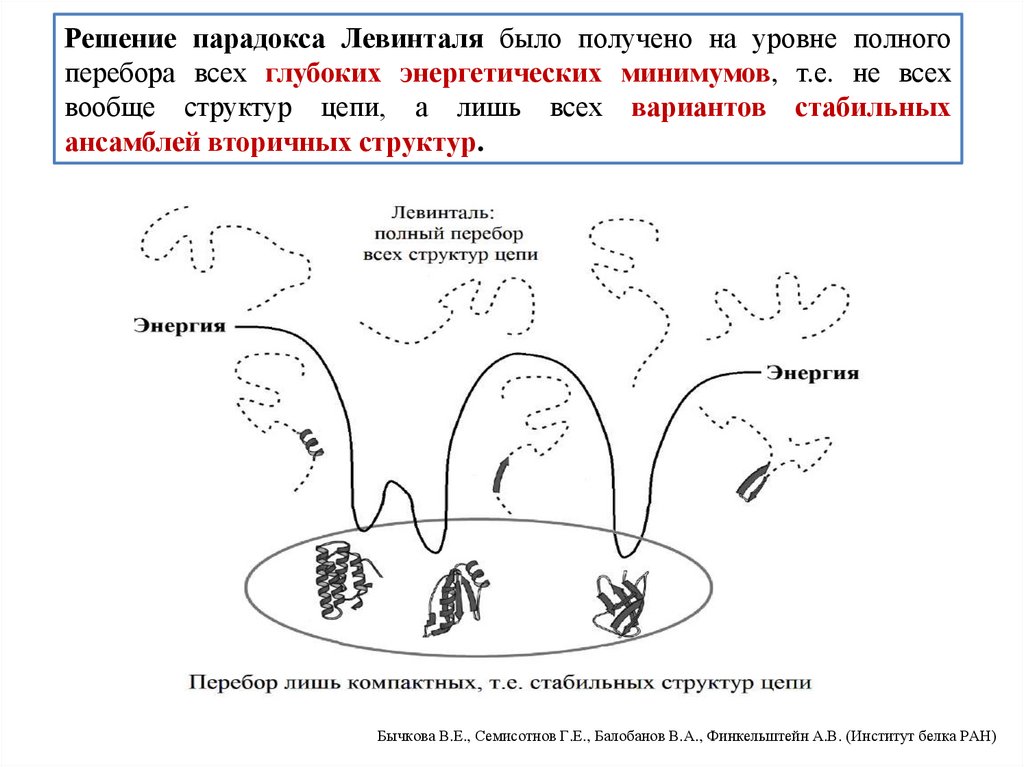



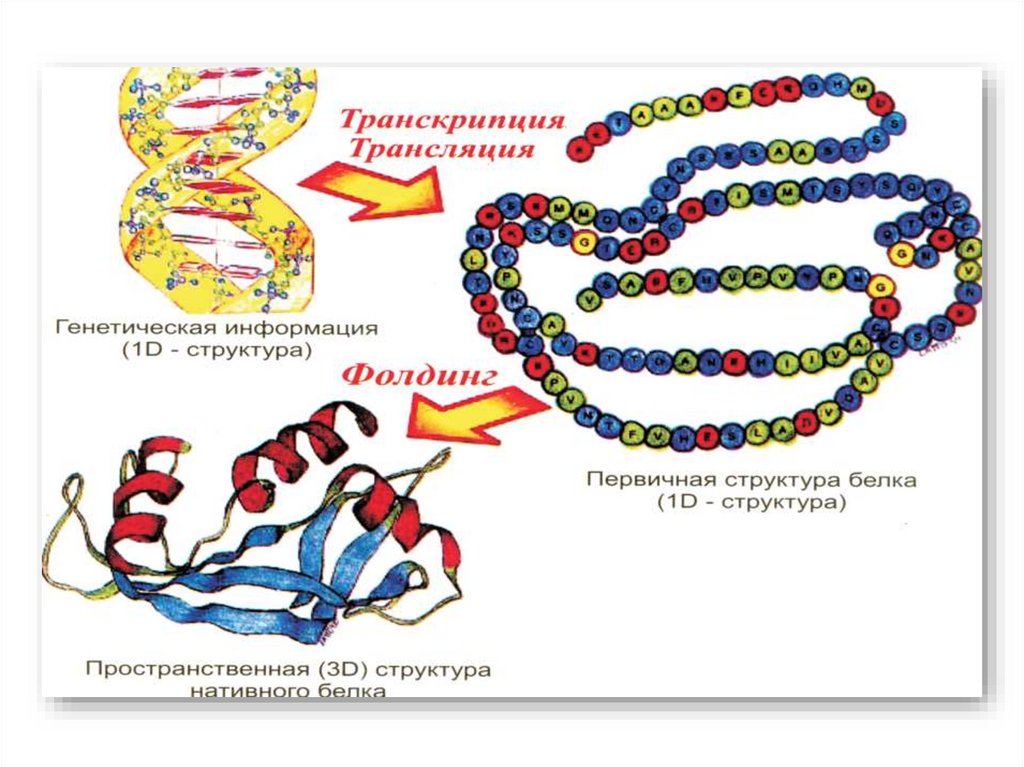



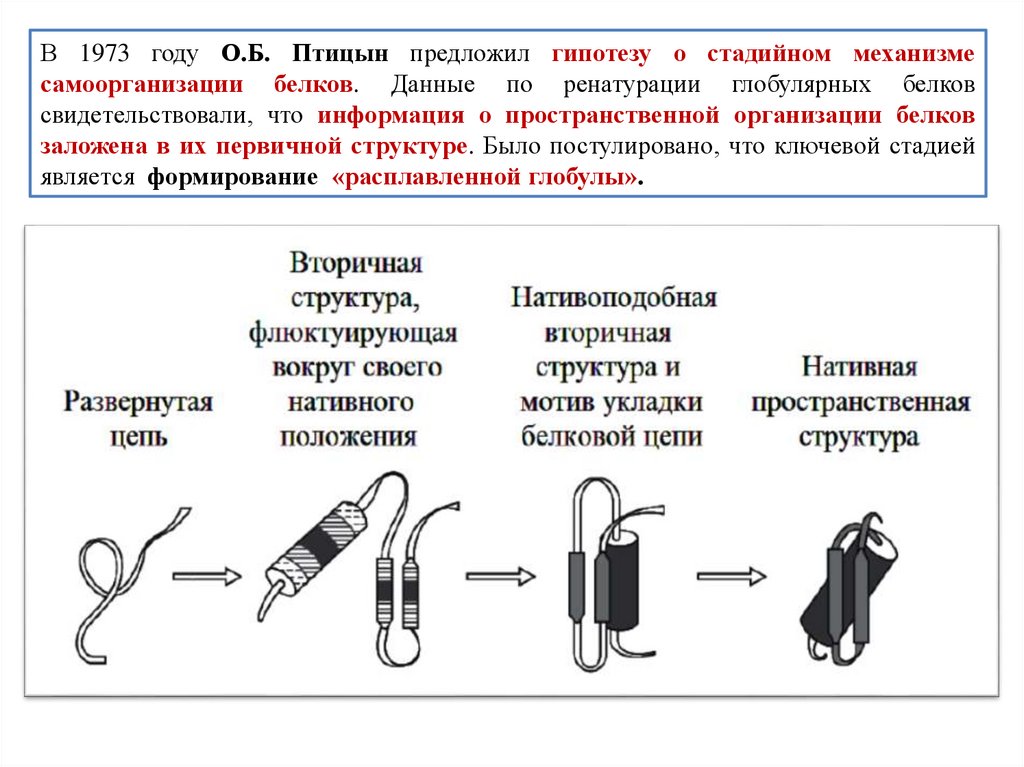
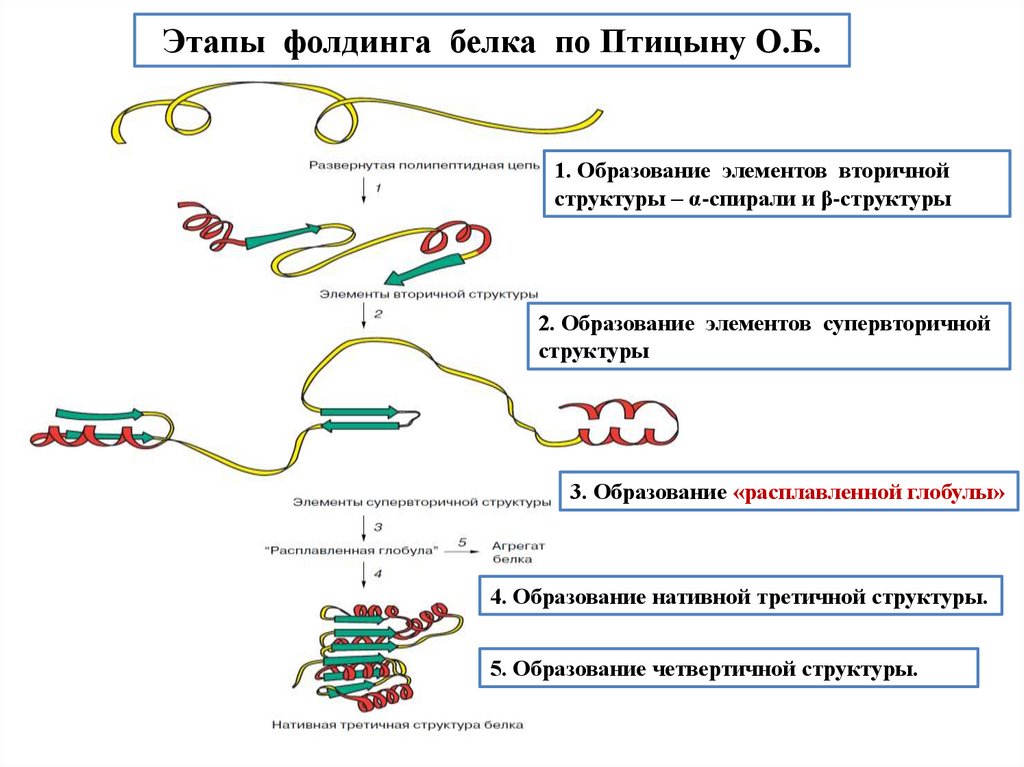
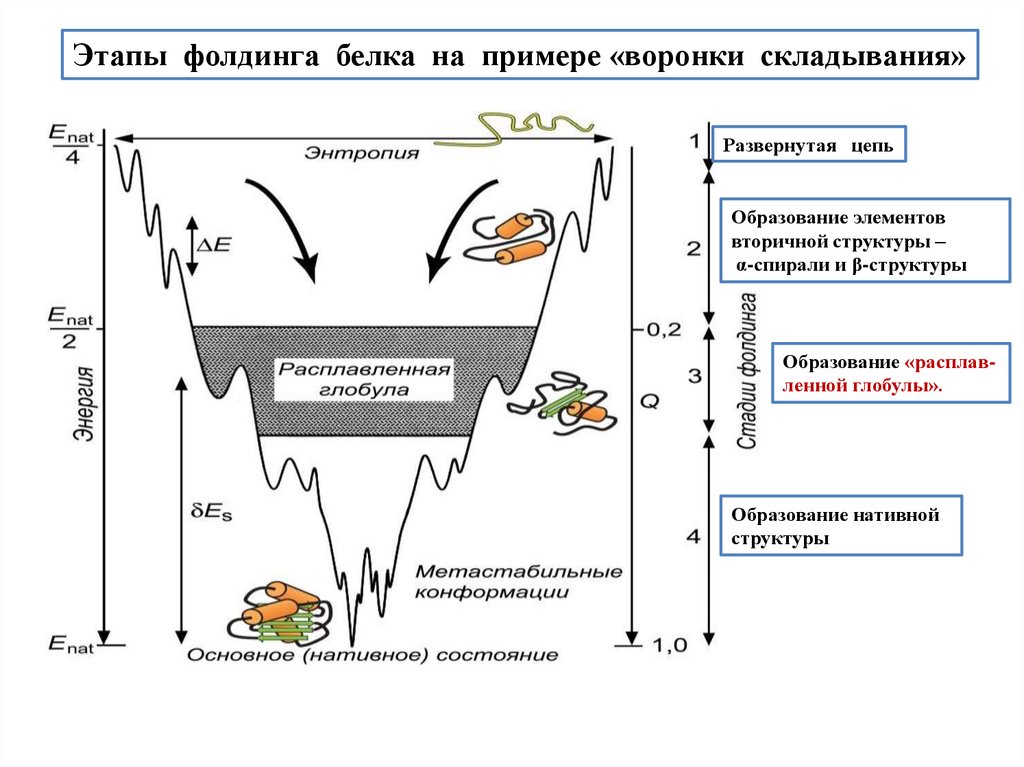
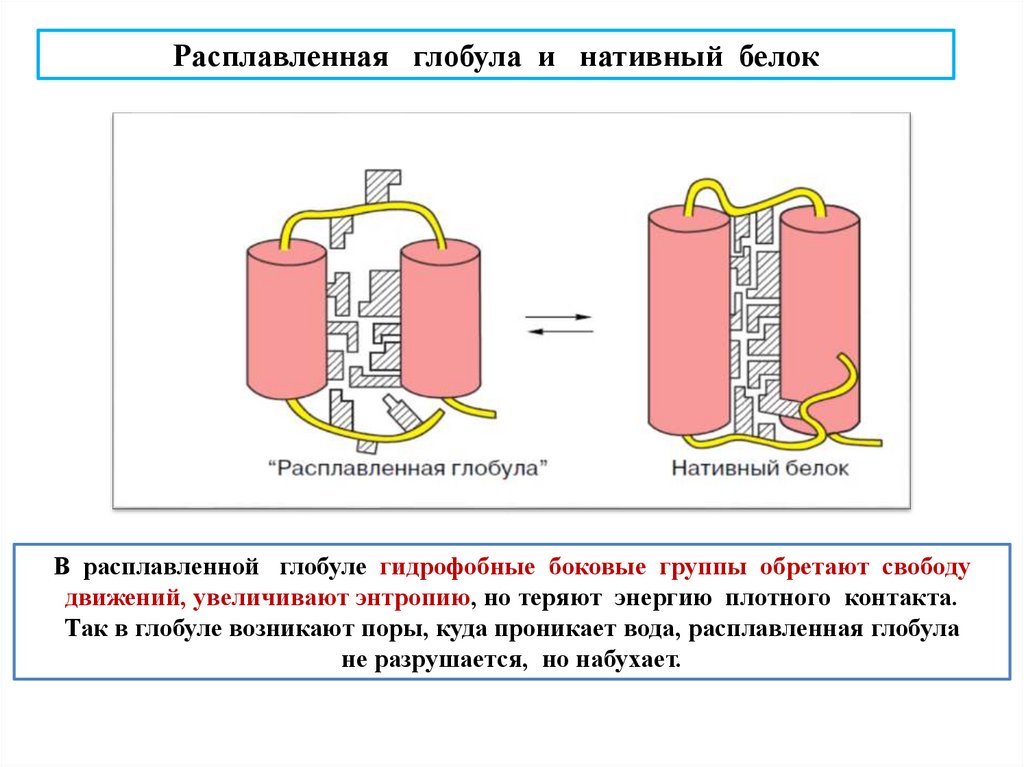







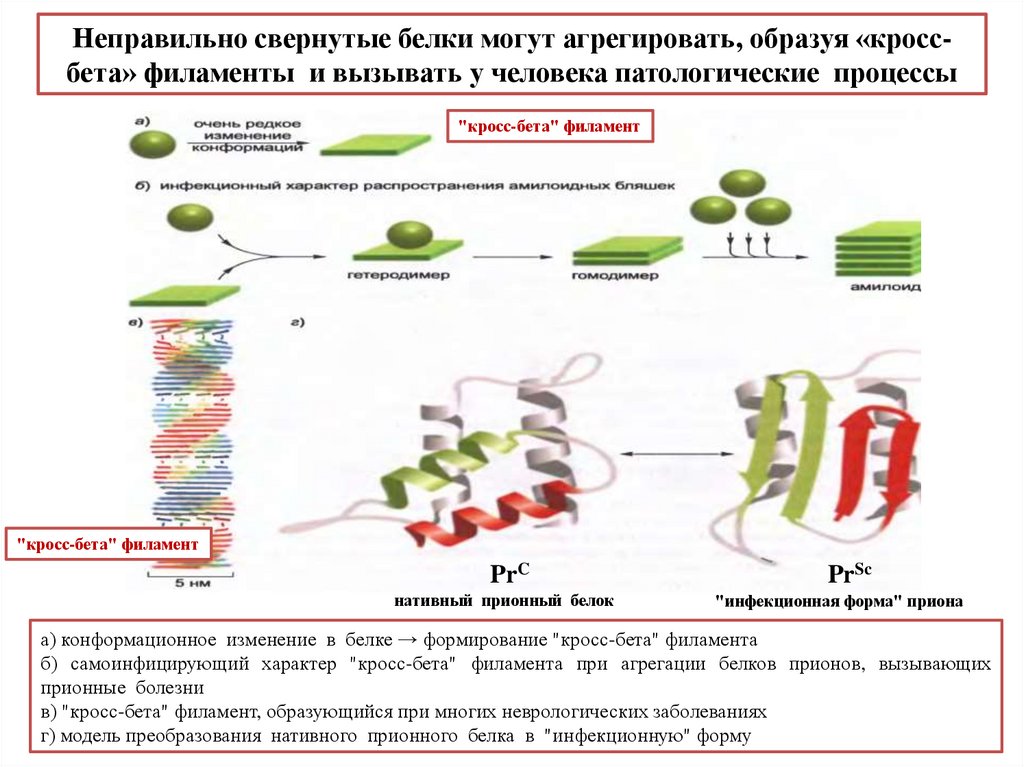
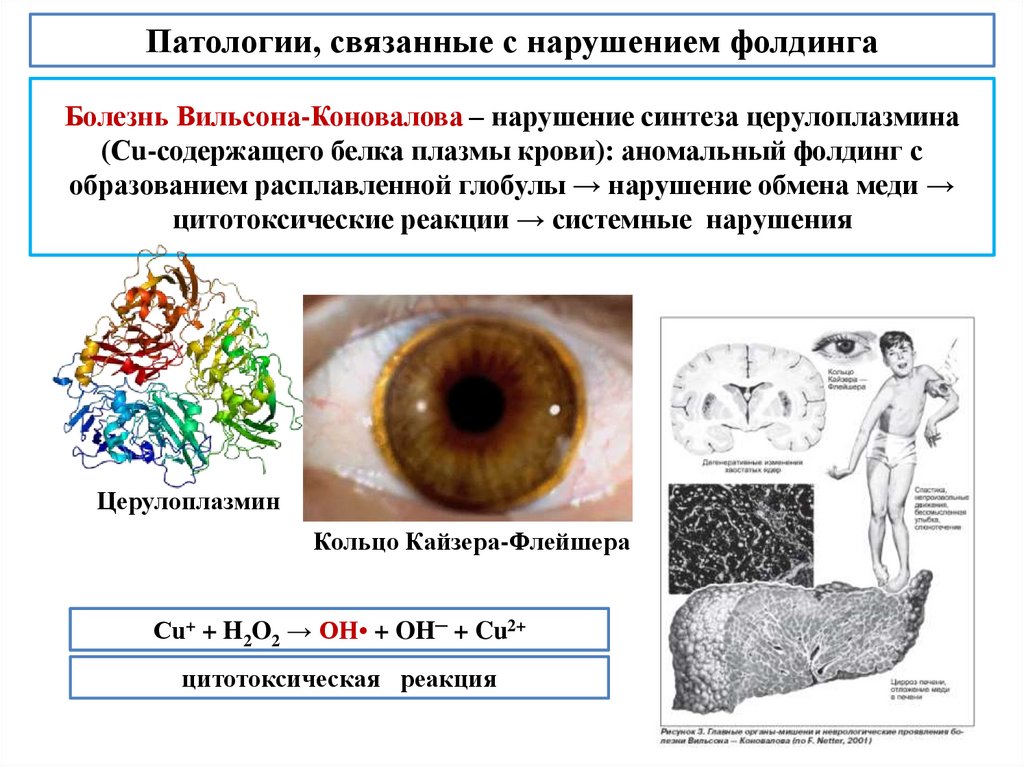
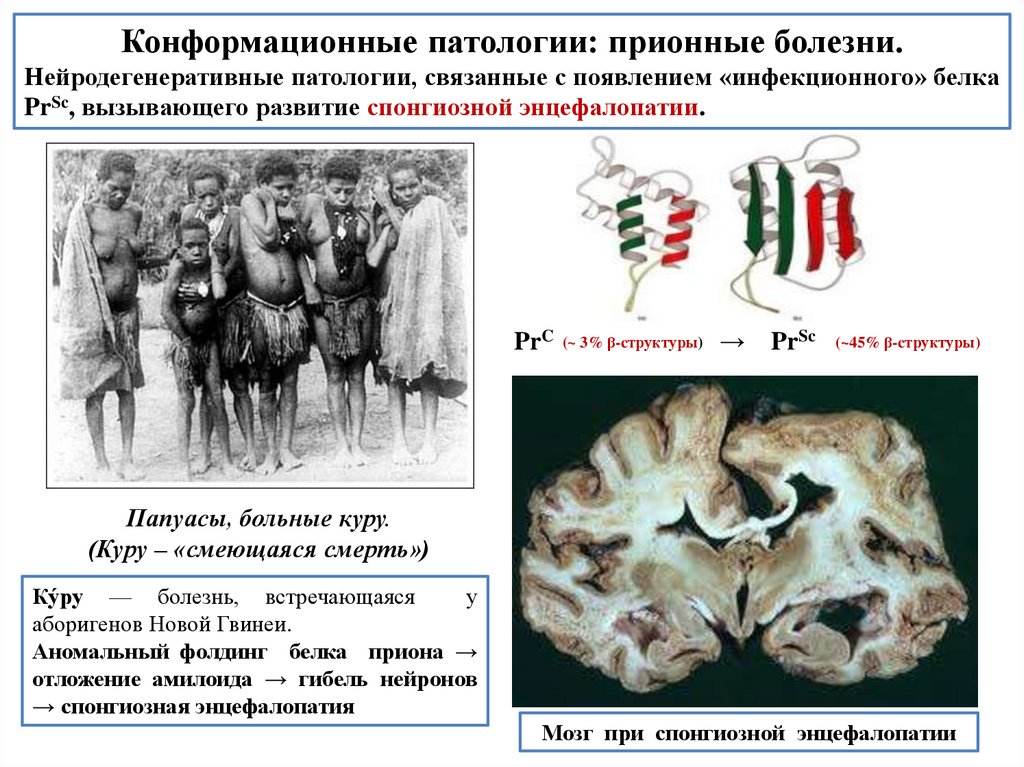
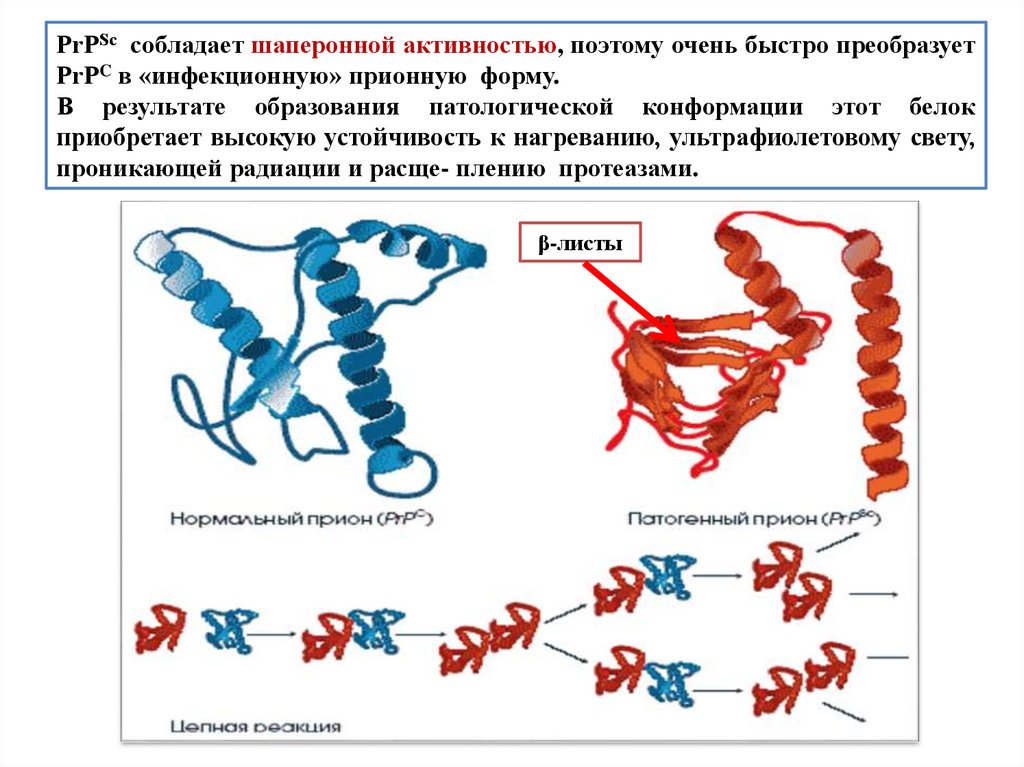



 biology
biology chemistry
chemistry