Similar presentations:
Химический элемент. Атом. Электронная конфигурация атомов
1.
Химический элемент. Атом. Электроннаяконфигурация атомов
2.
Цель урока:Ознакомиться с особенностями электрона
как микрочастицы.
Ввести понятие «орбиталь»,
«энергетический уровень», «энергетический
подуровень».
Сформировать представление о видах
орбиталей и структуре их размещения в
атоме.
Углубить представление о сложном
строении атома.
3.
4.
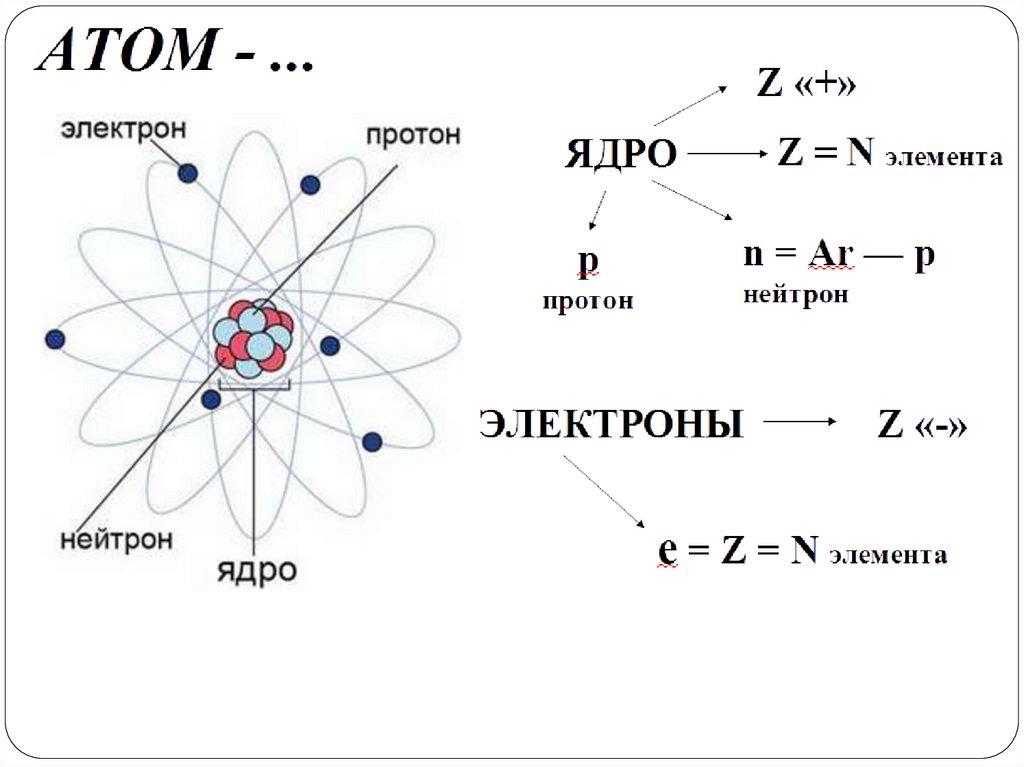
Характеристикаатома химического элемента
НУКЛИД
протонное число
(заряд ядра)
Нуклонное (массовое)число
А
Z
Э
символ
химического элемента
запишите нуклиды: алюминия, кальция
27
13
Al
40
20
Са
5.
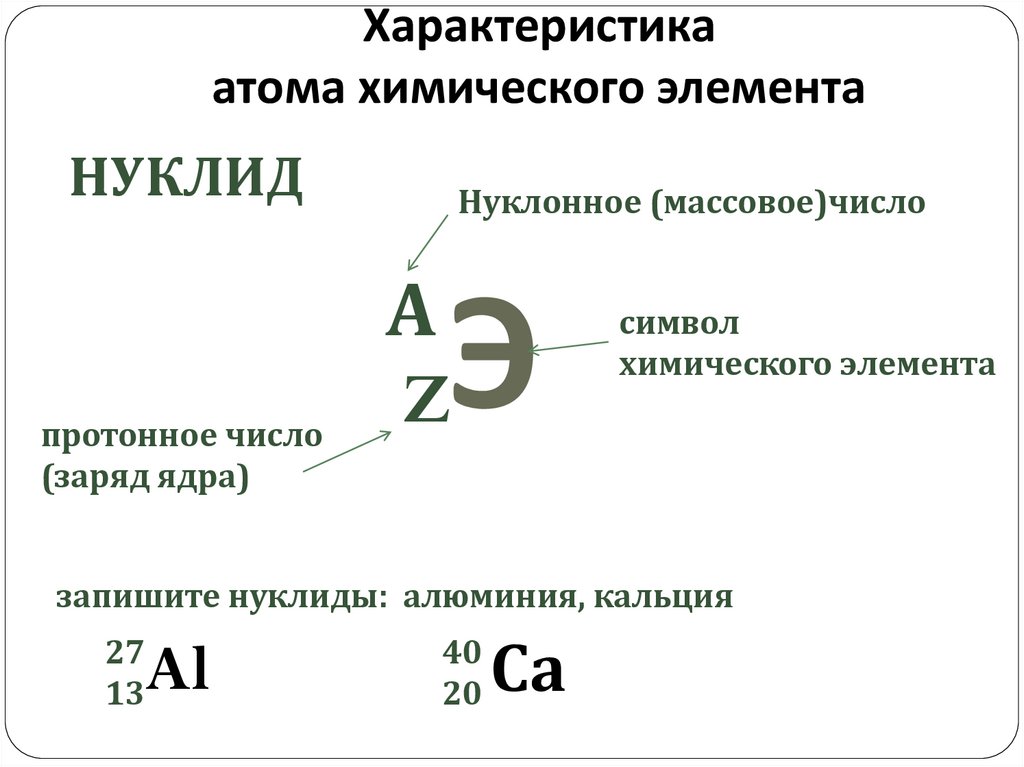
168
17
8
18
8
О О О
35
17
36
18
Cl
37
17
Cl
38
18
ИЗОТОПЫ
40
18
Ar Ar Ar
с. 5
6.
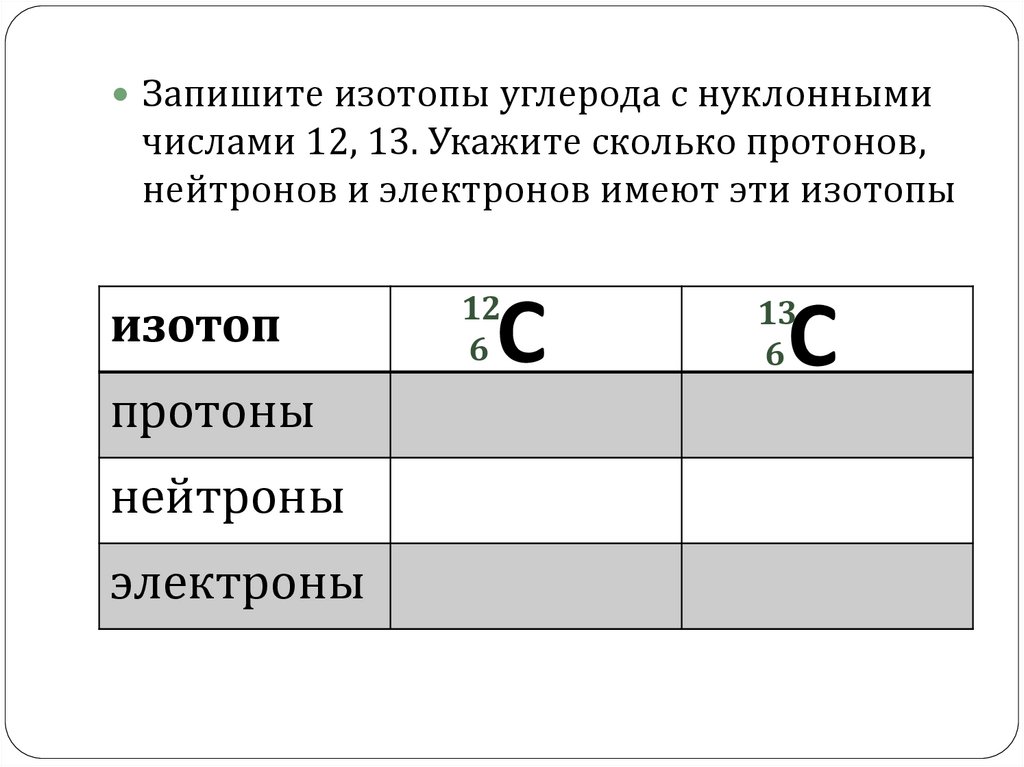
Запишите изотопы углерода с нуклоннымичислами 12, 13. Укажите сколько протонов,
нейтронов и электронов имеют эти изотопы
изотоп
протоны
нейтроны
электроны
12
6
C
13
6
C
7.
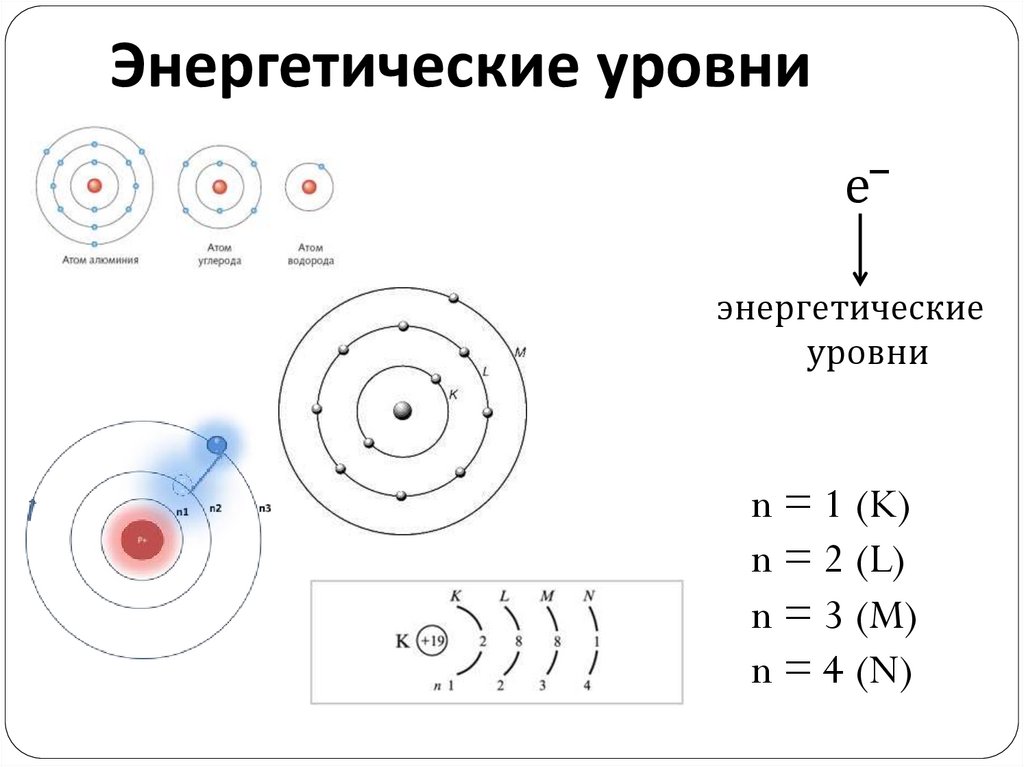
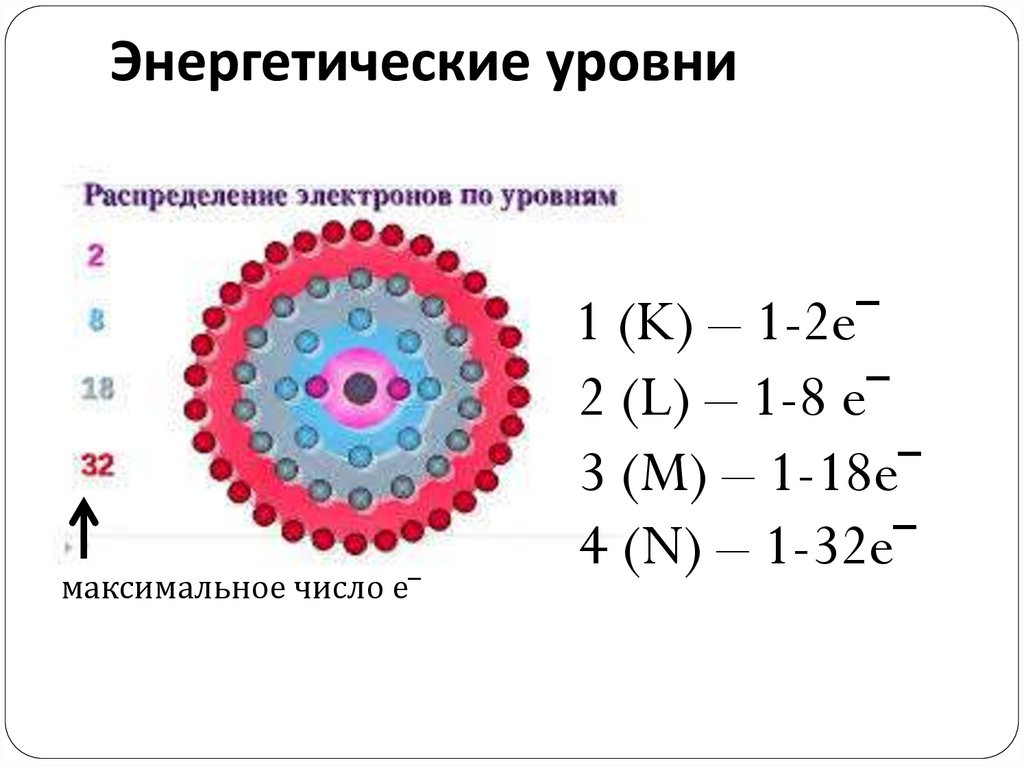
Энергетические уровние‾
энергетические
уровни
n = 1 (K)
n = 2 (L)
n = 3 (M)
n = 4 (N)
8.
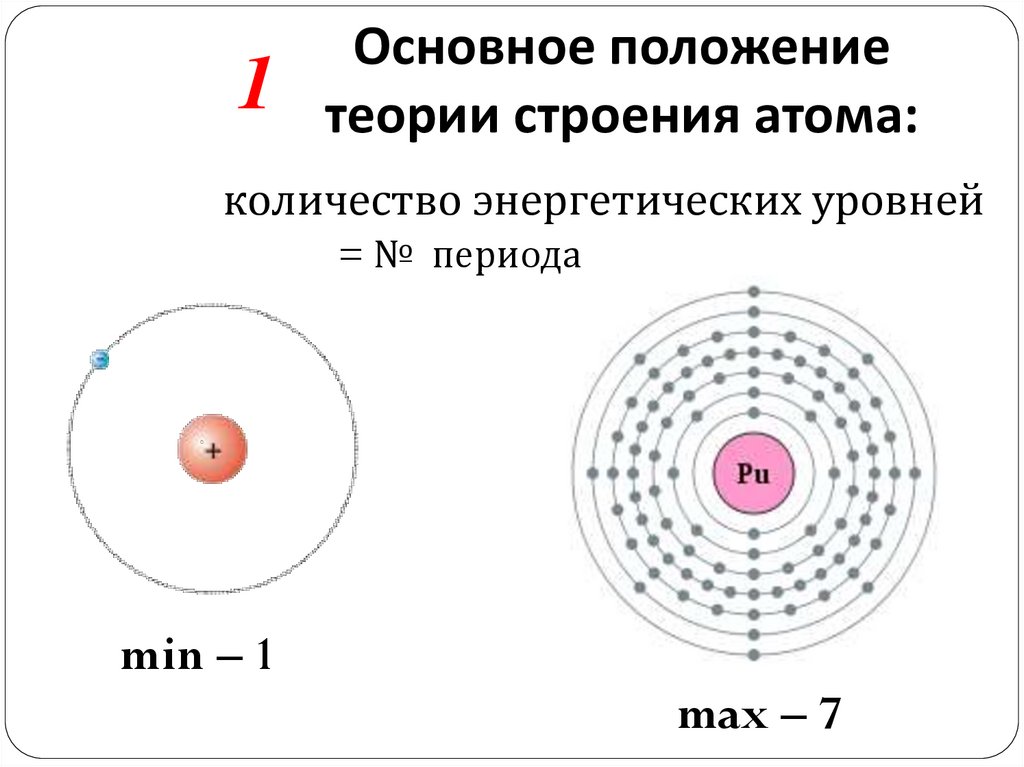
1Основное положение
теории строения атома:
количество энергетических уровней
= № периода
min – 1
max – 7
9.
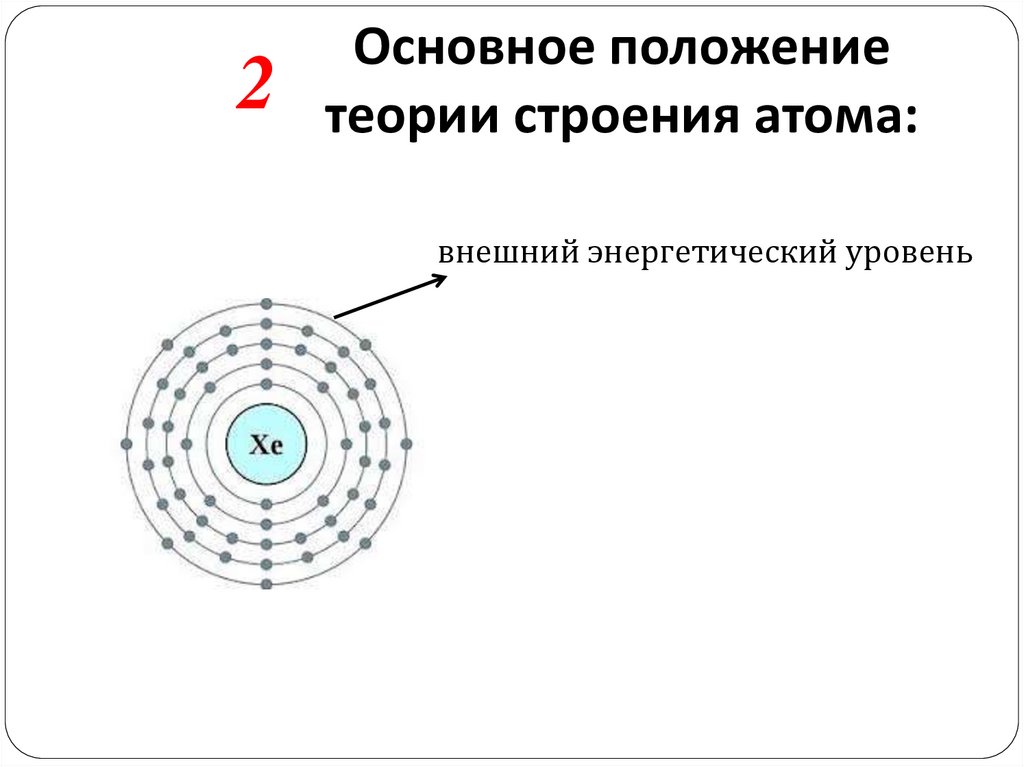
2Основное положение
теории строения атома:
внешний энергетический уровень
10.
Энергетические уровнимаксимальное число е‾
1 (K) – 1-2e‾
2 (L) – 1-8 e‾
3 (M) – 1-18e‾
4 (N) – 1-32e‾
11.
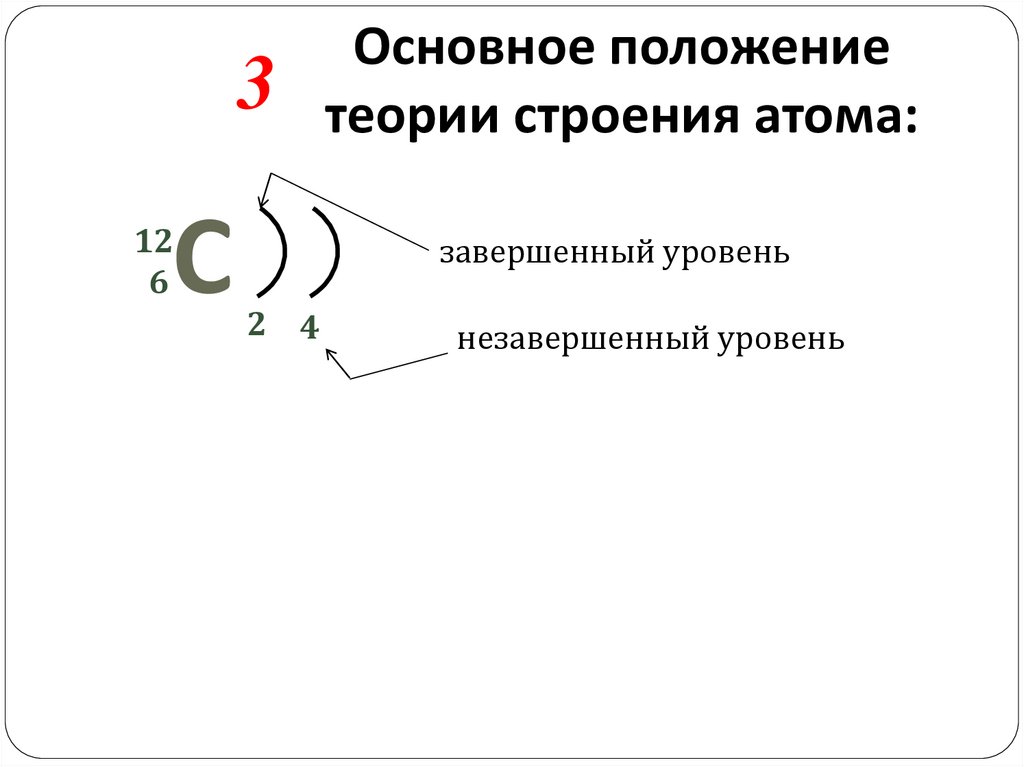
3С
12
6
Основное положение
теории строения атома:
завершенный уровень
2 4
незавершенный уровень
12.
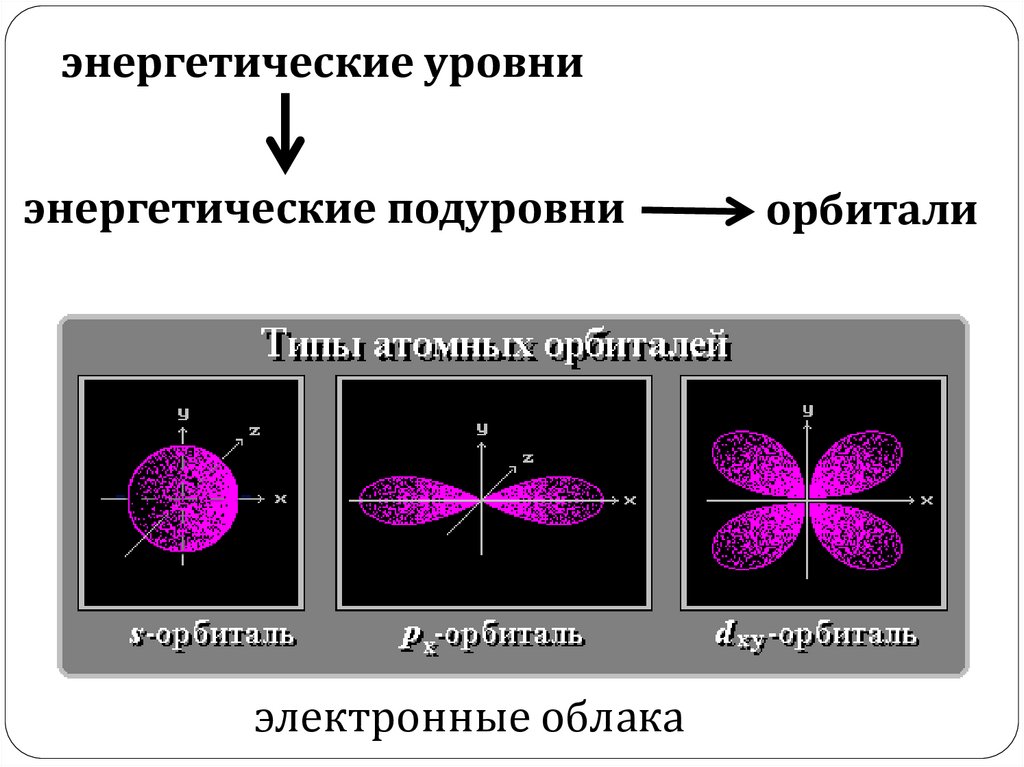
энергетические уровниэнергетические подуровни
электронные облака
орбитали
13.
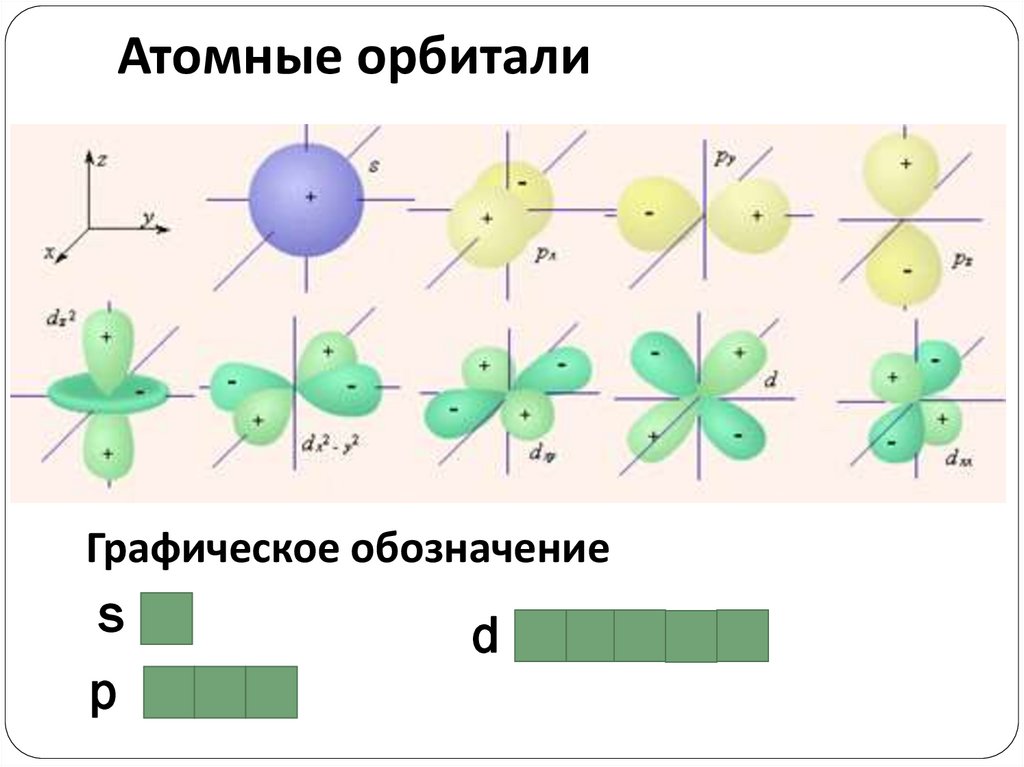
Атомные орбиталиГрафическое обозначение
s
p
d
14.
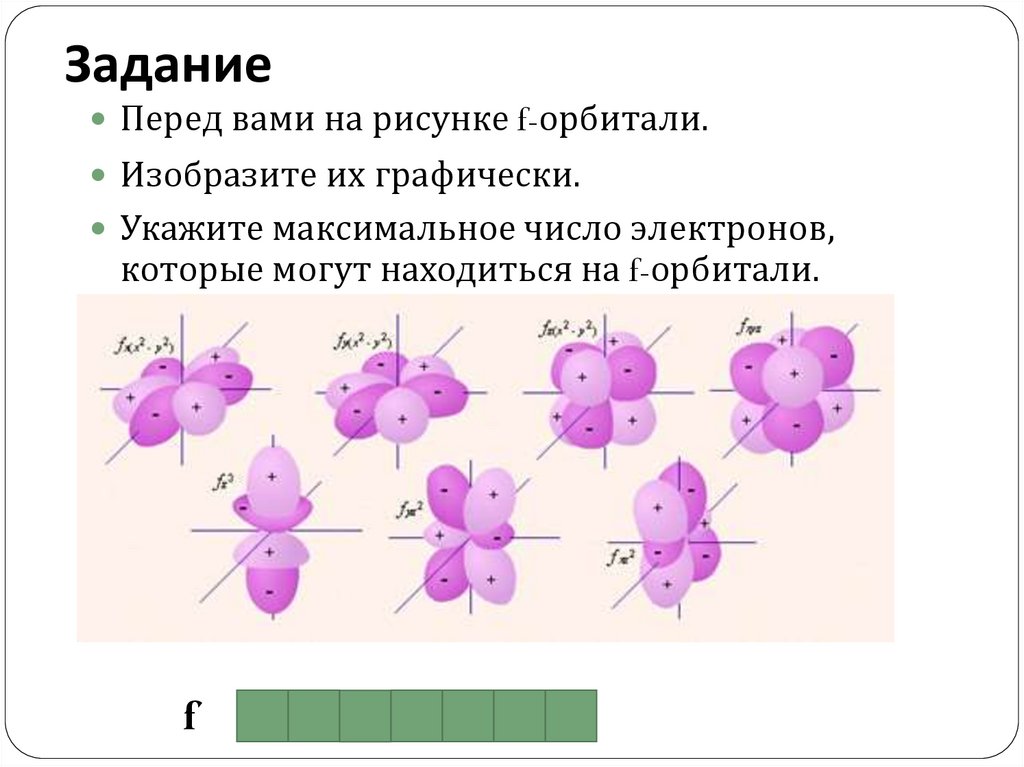
ЗаданиеПеред вами на рисунке f-орбитали.
Изобразите их графически.
Укажите максимальное число электронов,
которые могут находиться на f-орбитали.
f
15.
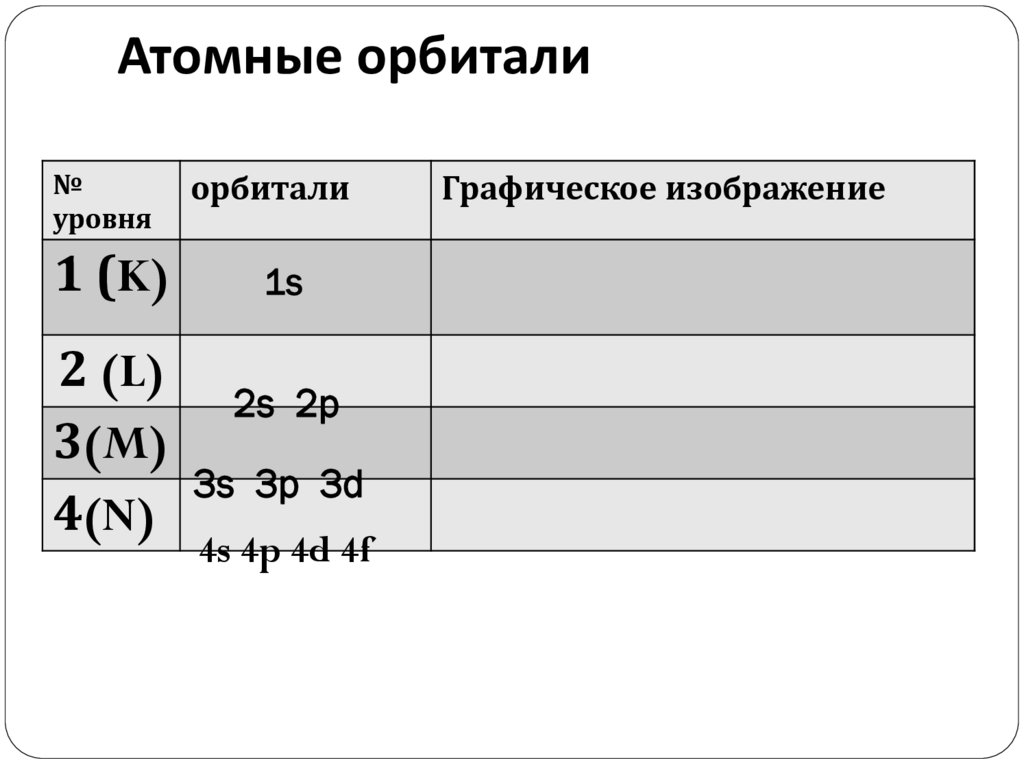
Атомные орбитали№
уровня
орбитали
1 (K)
1s
2 (L)
2s 2p
3(M)
3s 3p 3d
4(N)
4s 4p 4d 4f
Графическое изображение
16.
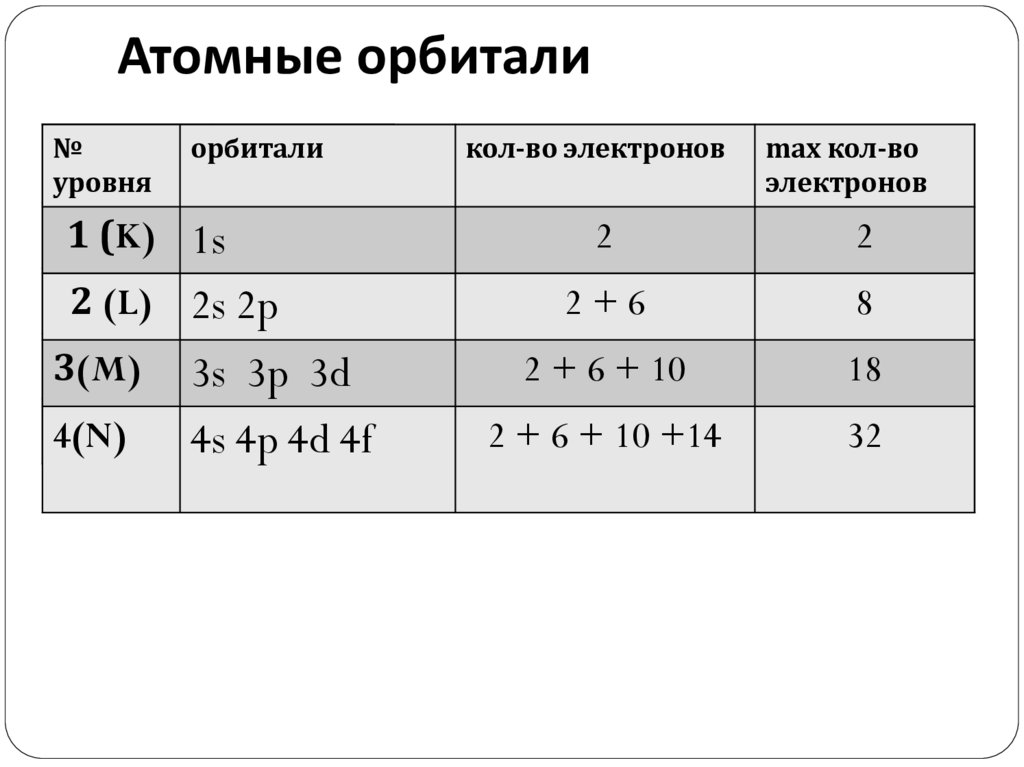
Атомные орбитали№
орбитали
орбитали
кол-во
уровня
электронов
1 (K)
s 1s
2
2 (L)
p 2s 2p 6
d
3(M)
4(N)f
3s 3p103d
4s 4p32
4d 4f
кол-во электронов
max кол-во
электронов
2
2
2+6
8
2 + 6 + 10
18
2 + 6 + 10 +14
32
17.
Строение электронных оболочек атомовхимических элементов.
18.
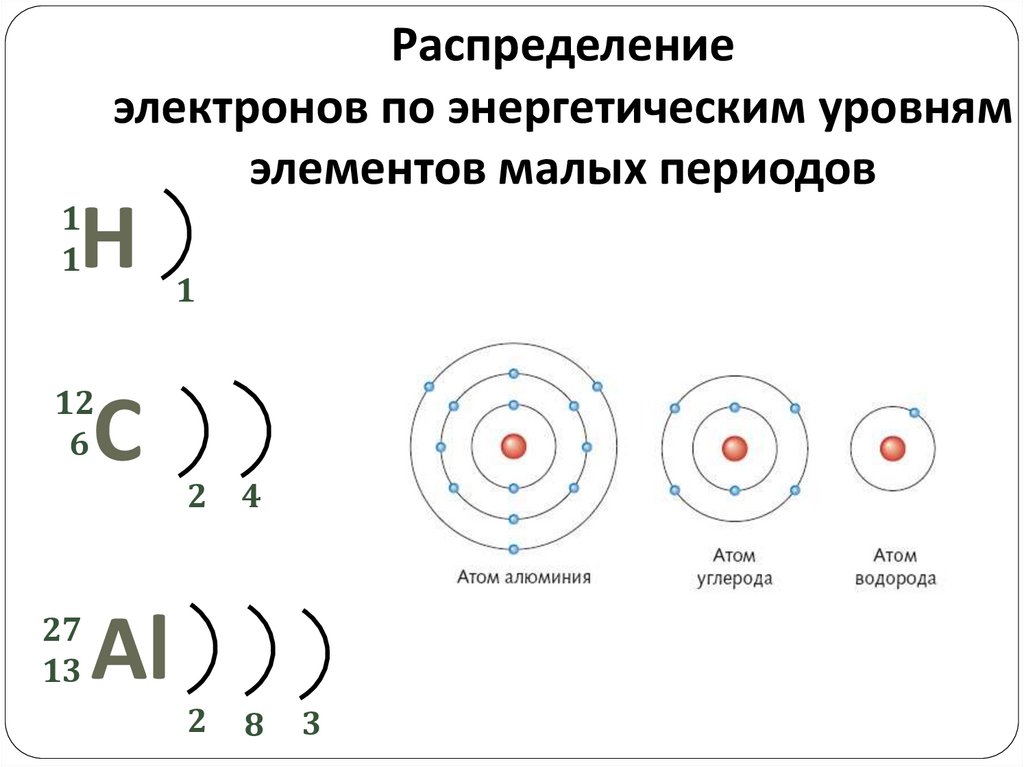
Распределениеэлектронов по энергетическим уровням
элементов малых периодов
Н
1
1
1
12
6
С
27
13
Al
2 4
2
8
3
19.
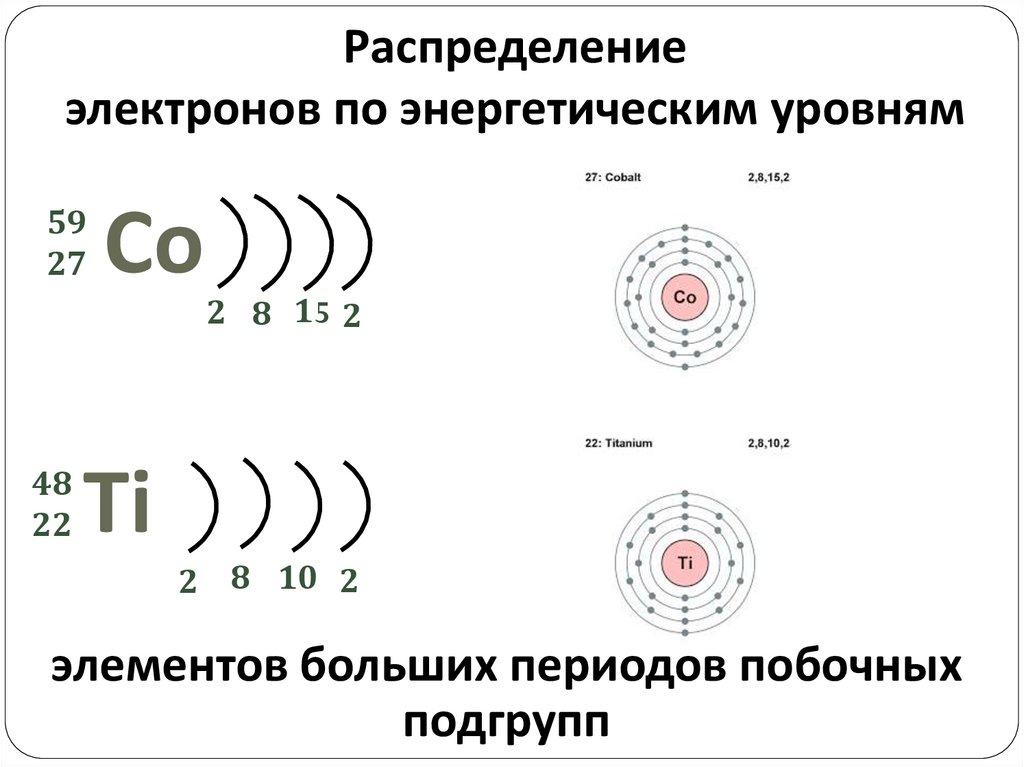
Распределениеэлектронов по энергетическим уровням
59
27
48
22
Со
2 8 15 2
Тi
2 8 10 2
элементов больших периодов побочных
подгрупп
20.
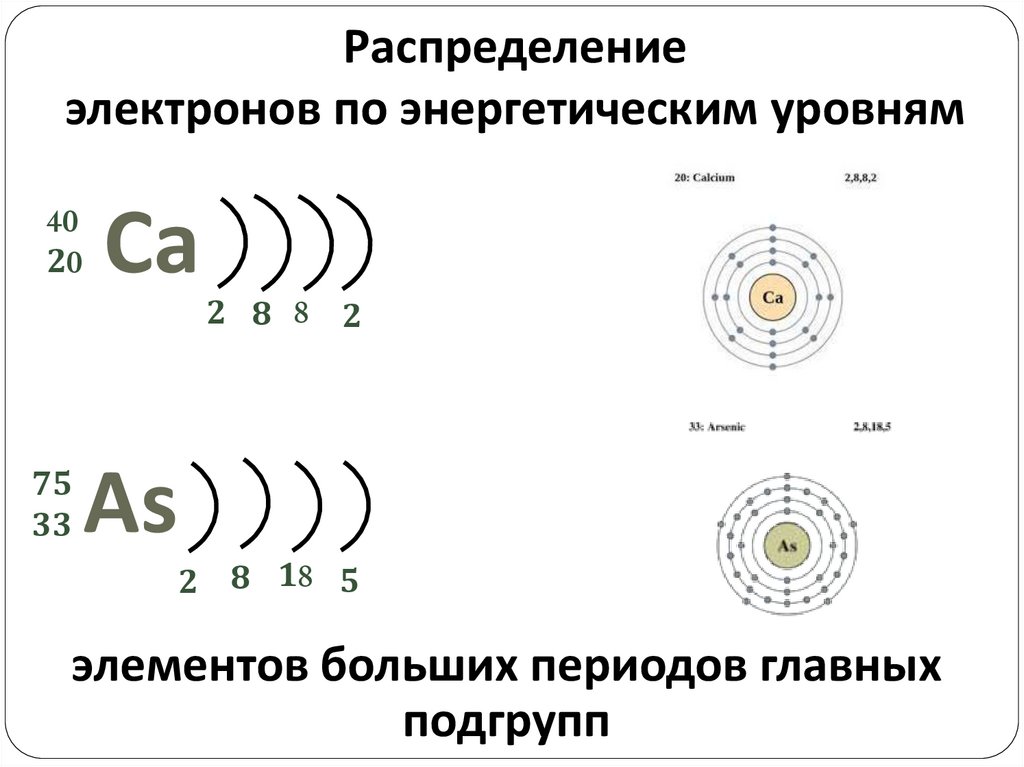
Распределениеэлектронов по энергетическим уровням
40
20
75
33
Сa
As
2 8 8 2
2 8 18 5
элементов больших периодов главных
подгрупп
21.
Задание № 1Составить схемы распределения электронов по
энергетическим уровням элементов с
порядковыми номерами 4, 15, 19, 23, 36
9
4
31
15
Ве
Р
К
39
19
2 2
51
23
2 8 5
2 8 8 1
V
2 8 11 2
84
36
Кr
2 8 18 8
22.
Проверь себя!1. Электроны в атоме находятся на ……….
2. Количество энергетических уровней равно…..
3. Обозначают энергетические уровни … или ….
4. Максимальное число е‾ на
1 уровне - …, 2 уровне - …, 3 уровне - …, 4 уровне - …
5. Может ли:
на 2 уровне находиться 7 электронов
на 3 уровне находится 19 электронов?
6. Электронное облако – это наглядное изображение….
7. Форма s-орбитали, р-орбитали.
8. Графическое изображение орбитали - …
23.
Домашнее задание§ 1,3,4
Тест 1,2 с 6
Тест 1,2 с.15
Упр. 4 с. 22






 chemistry
chemistry