Similar presentations:
Хімічний зв'язок
1.
Хімічний зв’язок2.
Хімічний зв’язокце сила, яка діє між атомами і
забезпечує сполучення їх у молекулу
або кристал
3.
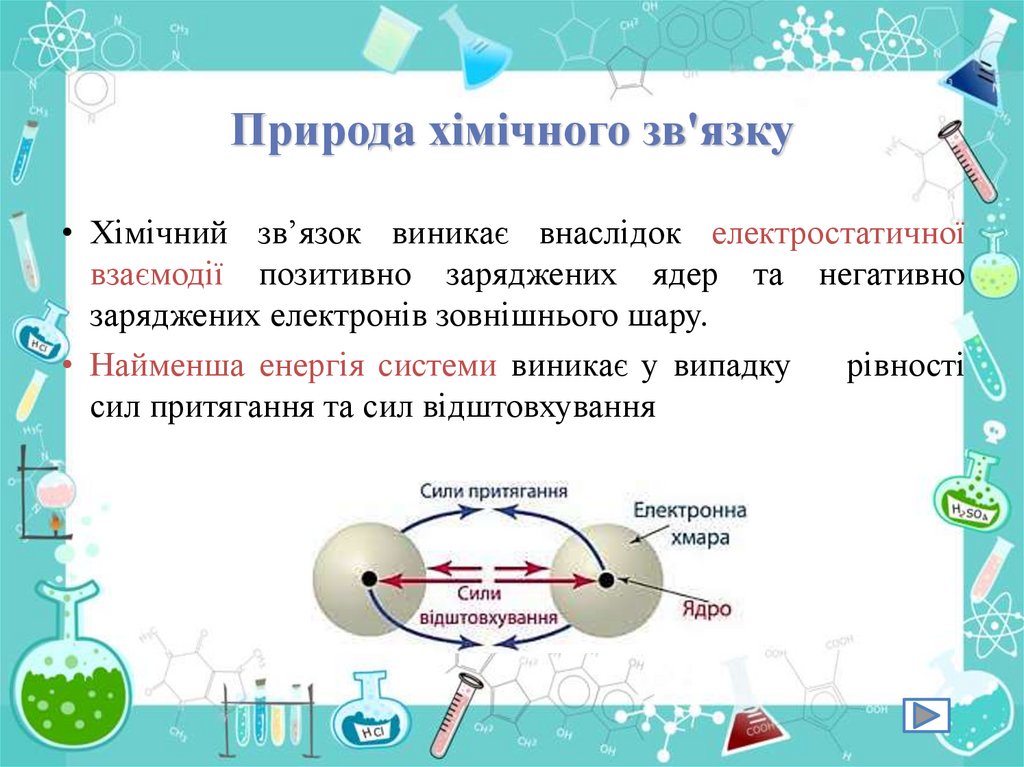
Природа хімічного зв'язку• Хімічний зв’язок виникає внаслідок електростатичної
взаємодії позитивно заряджених ядер та негативно
заряджених електронів зовнішнього шару.
• Найменша енергія системи виникає у випадку
рівності
сил притягання та сил відштовхування
4.
Природа хімічного зв'язкуПричиною утворення хімічного зв'язку є «прагнення»
атомів досягти найбільш стійких електронних конфігурацій,
в яких всі електрони спарені. При такій будові атома
електрони перебувають у стані найменшого перенапруження.
Таку дво- і восьмиелектронну конфігурацію мають атоми
інертних газів.
5.
Природа хімічного зв'язкуЧим більше електронів на останньому енергетичному
рівні і чим менший радіус атома, тим краще такий атом буде
притягувати електрони. Такі властивості проявляють атоми
неметалічних елементів
6.
Природа хімічного зв'язкуЧим менше електронів на останньому енергетичному
рівні і чим більший радіус атома, тим гірше такий атом буде
притягувати електрони. Такі властивості проявляють атоми
металічних елементів.
Na
Mg
Al
7.
Типи хімічного зв’язкуХімічний зв’язок
ковалентний
зазвичай існує між
атомами неметалічних
елементів
йонний
існує у сполуках,
утворених атомами
металічних та
неметалічних елементів
металічний
існує в
металах та їх
сплавах
неполярний
зазвичай існує між атомами
однакових неметалічних
елементів
полярний
зазвичай існує між атомами різних
неметалічних елементів
водневий
існує, зокрема, між
молекулами води
8.
Електронегативністьце здатність атома притягувати спільні
електронні хмари
Електронегативність зростає
Чим більше електронів на зовнішньому рівні та чим менший радіус атома,
тим більша електронегативність елемента
9.
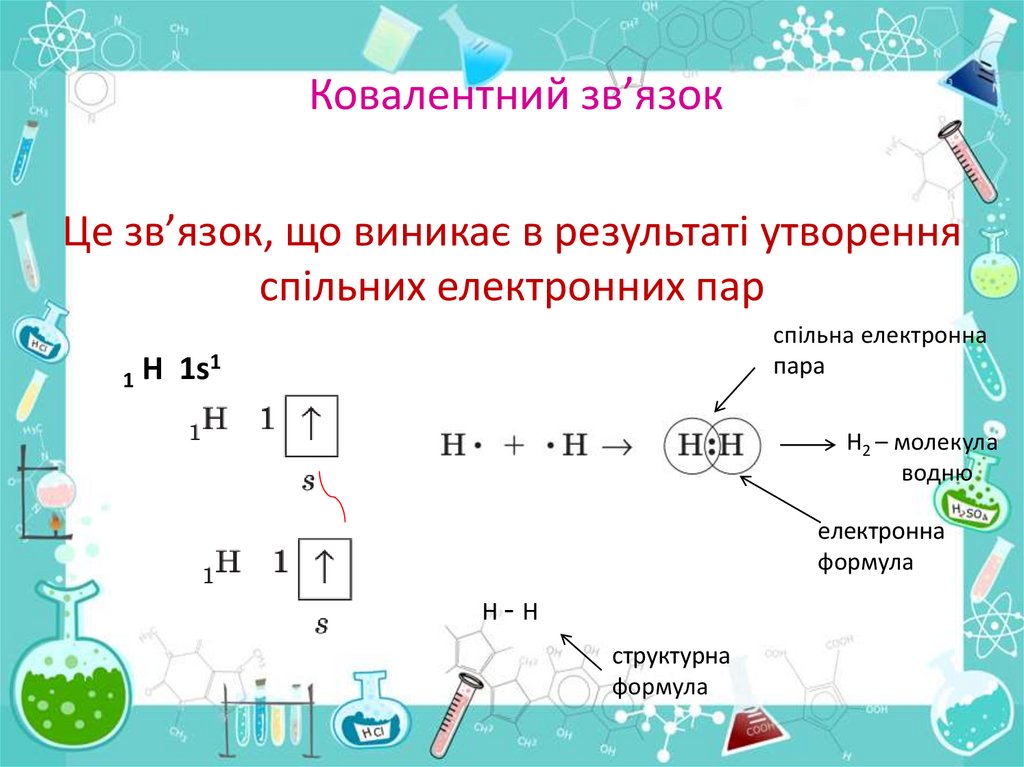
Ковалентний зв’язокЦе зв’язок, що виникає в результаті утворення
спільних електронних пар
спільна електронна
пара
1
Н
1s
1
Н2 – молекула
водню
електронна
формула
Н-Н
структурна
формула
10.
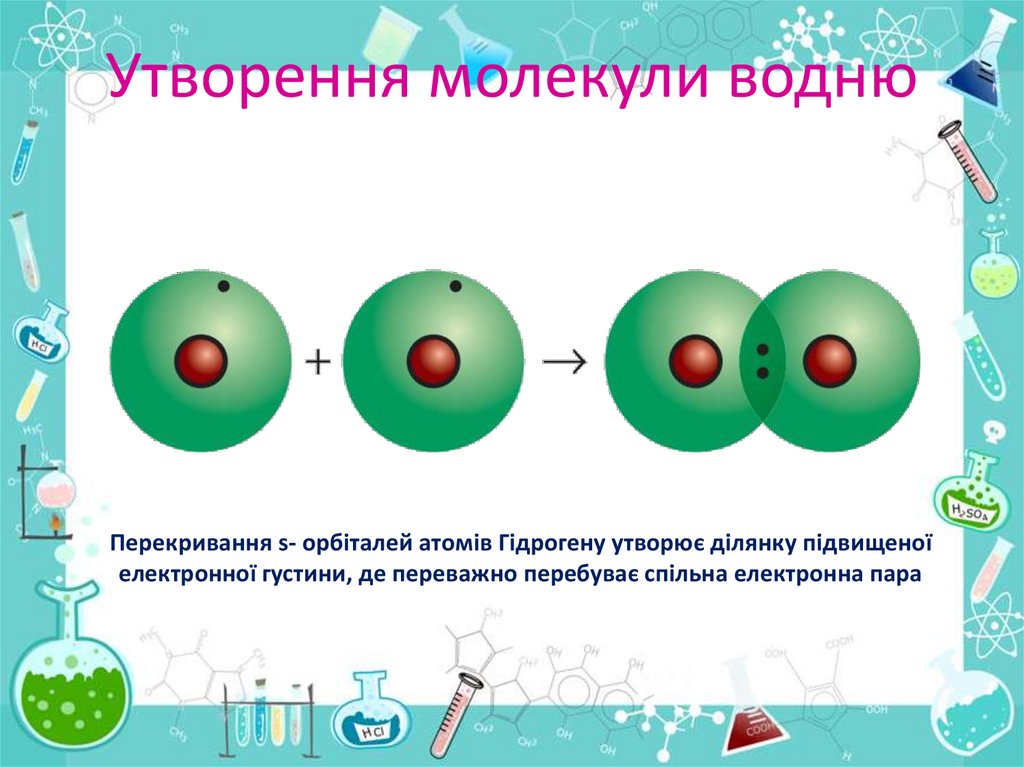
Утворення молекули воднюПерекривання s- орбіталей атомів Гідрогену утворює ділянку підвищеної
електронної густини, де переважно перебуває спільна електронна пара
11.
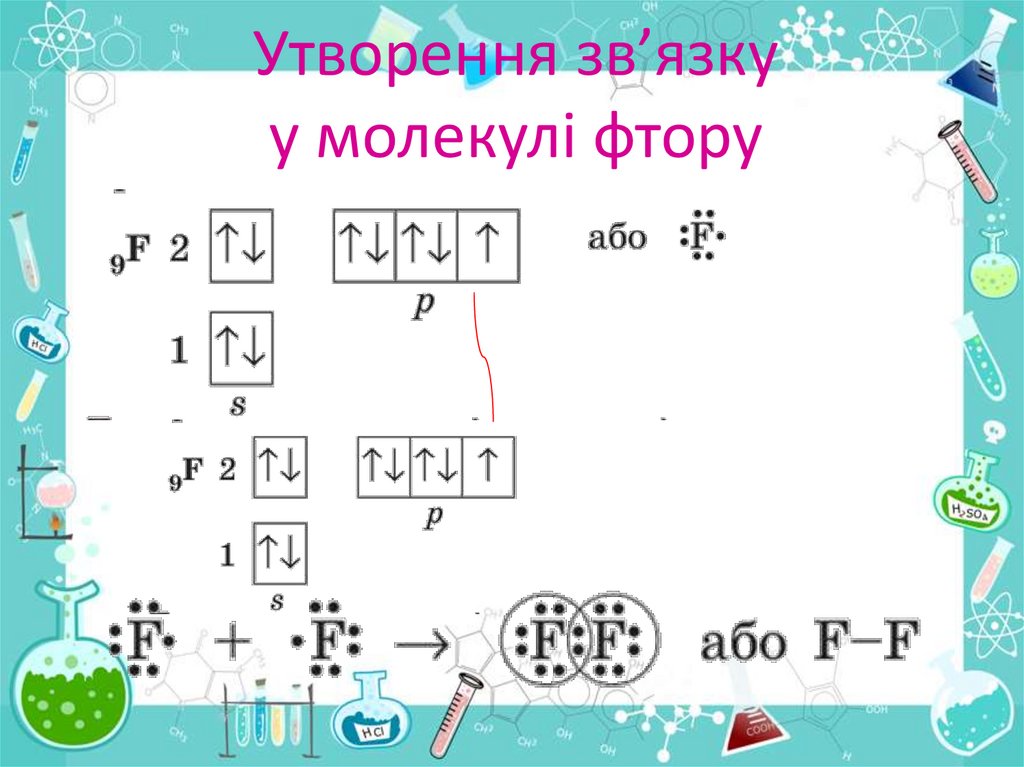
Утворення зв’язкуу молекулі фтору
12.
Утворення молекули фторуПерекривання р- орбіталей атомів Флуору під часутворення молекули
фтору. Інші р- орбіталі , на яких перебувають електронні пари, не беруть
участі в утворенні зв’язку
13.
Утворення зв’язкуу молекулі кисню
подвійний
зв’язок
14.
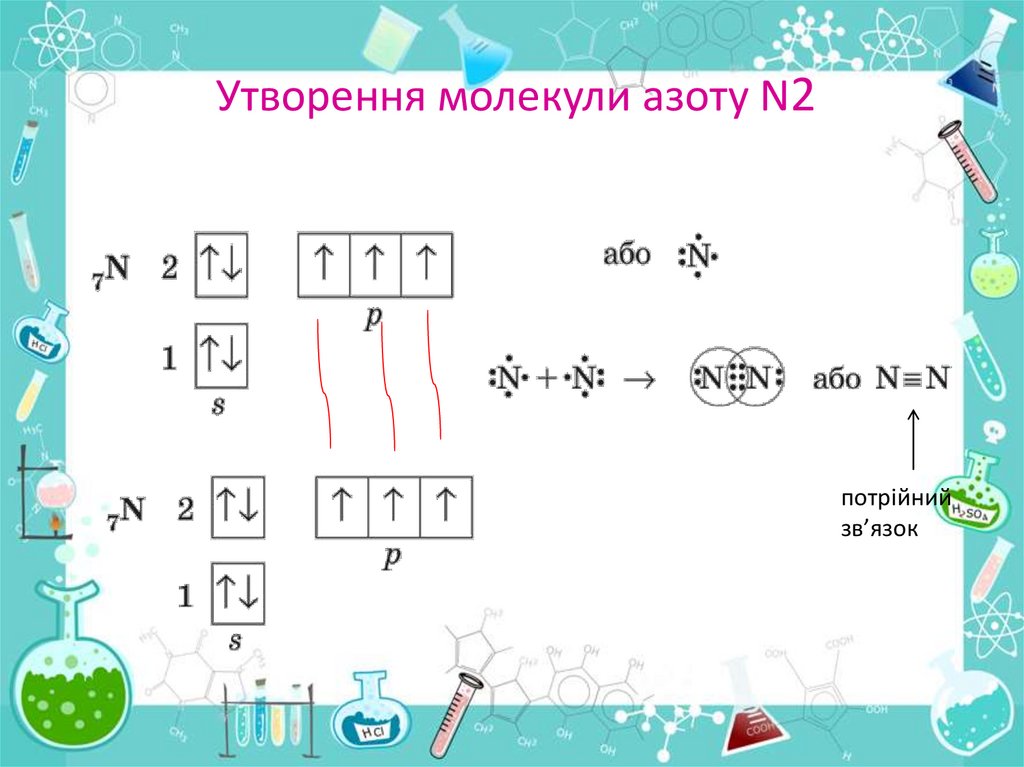
Утворення молекули азоту N2потрійний
зв’язок
15.
Йонний зв’язокЙонний зв’язок – це зв’язок,
що виникає
між катіонами та аніонами
речовини
16.
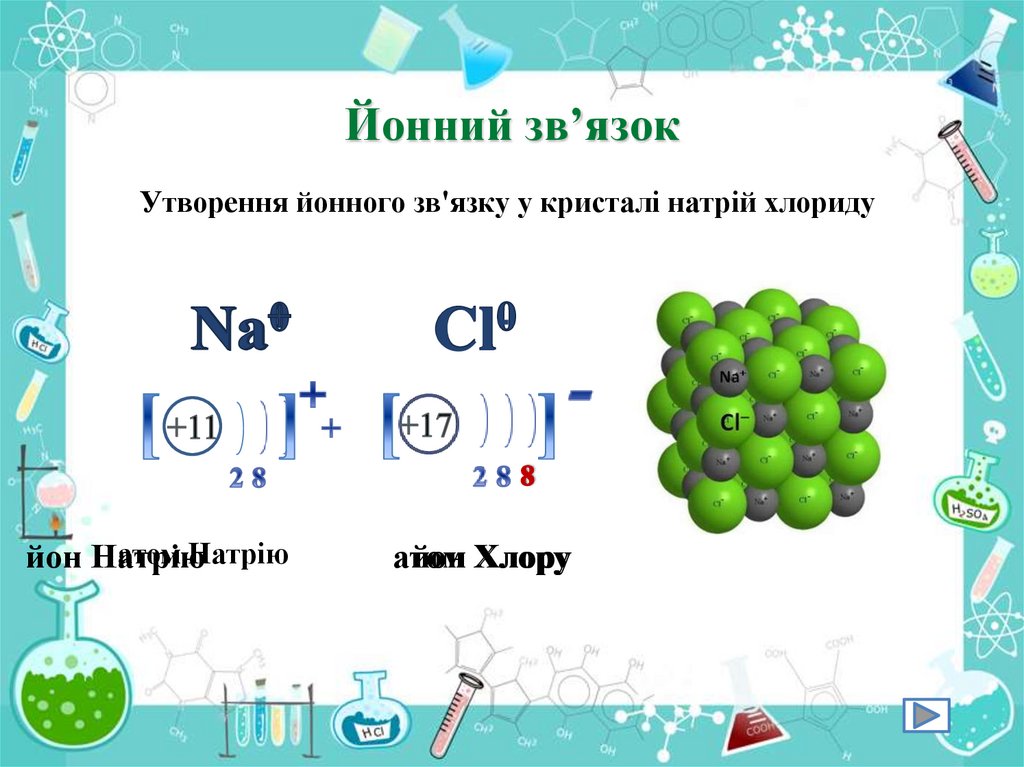
Йонний зв’язокУтворення йонного зв'язку у кристалі натрій хлориду
атом Натрію
атом Хлору
17.
Йонний зв’язокУтворення йонного зв'язку у кристалі натрій хлориду
Cl-
атом Натрію
йон Натрію
атом
йон Хлору
18.
Йонний зв’язокСхема утворення йонного зв’язку
+1ē
_
19.
Йонний зв’язокЙони – це заряджені частинки, на
які перетворюються атоми і
молекули внаслідок приєднання
або втрачання одного або кількох
електронів.
Катіони – позитивні йони.
Аніони – негативні йони.
20.
Йонний зв’язокУтворення хімічного зв'язку між йонами Натрію і Хлору














 chemistry
chemistry








