Similar presentations:
Процесс растворения в воде молекулярных и ионных соединений. Электролитическая диссоциация. Урок №53
1.
Тема № 5. РАСТВОРЫУрок № 53
Тема урока: ПРОЦЕСС РАСТВОРЕНИЯ В ВОДЕ
МОЛЕКУЛЯРНЫХ И ИОННЫХ СОЕДИНЕНИЙ.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
Цель урока: ознакомиться с
процессами электролитической диссоциации
Учебная дисциплина: ОДП.04. Химия.
Группа: СВ-4-18.
Профессия: 15.01.05 Сварщик
(электросварочные и газосварочные работы)
Дата проведения: 06.05.20 г.
Преподаватель: Иванова Л.Н.
2.
Теория электролитической диссоциации была созданашведским ученым С. Аррениусом в 1883 году
Механизм электролитической диссоциации
был подробно изучен русским ученым И. А.
Каблуковым
3.
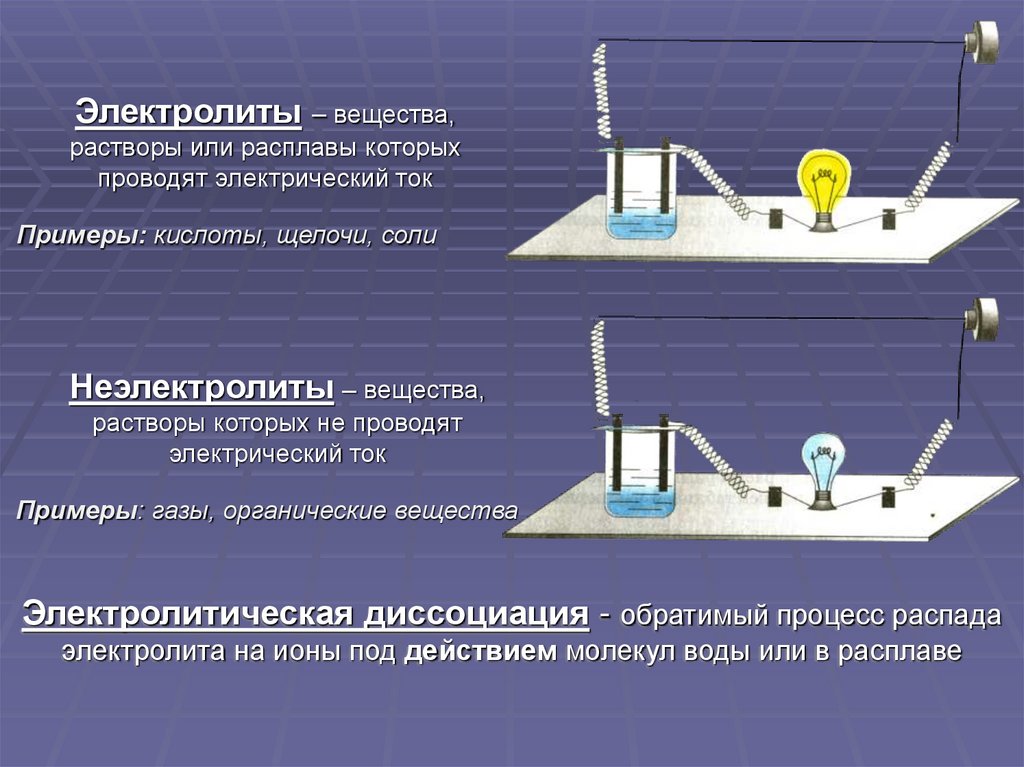
Электролиты– вещества,
растворы или расплавы которых
проводят электрический ток
Примеры: кислоты, щелочи, соли
Неэлектролиты – вещества,
растворы которых не проводят
электрический ток
Примеры: газы, органические вещества
Электролитическая диссоциация - обратимый процесс распада
электролита на ионы под действием молекул воды или в расплаве
4.
Молекулы воды представляют собойдиполи, так как атомы водорода
расположены под углом 104,5
градуса, благодаря чему молекула
имеет угловую форму
5.
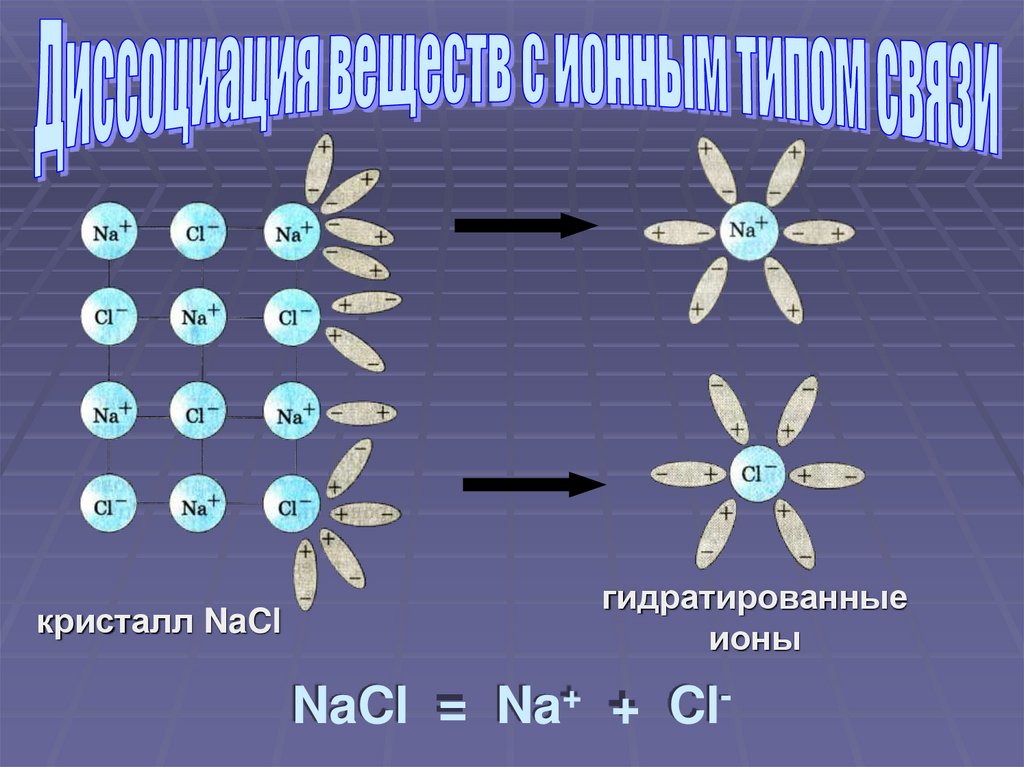
кристалл NaClгидратированные
ионы
NaCl = Na+ + Cl-
6.
Ориентация молекул – диполей водыоколо ионов кристалла
Взаимодействие молекул воды с
противоположно заряженными ионами
поверхностного слоя кристалла
(гидратация)
Распад кристалла электролита на
гидратированные ионы (диссоциация)
7.
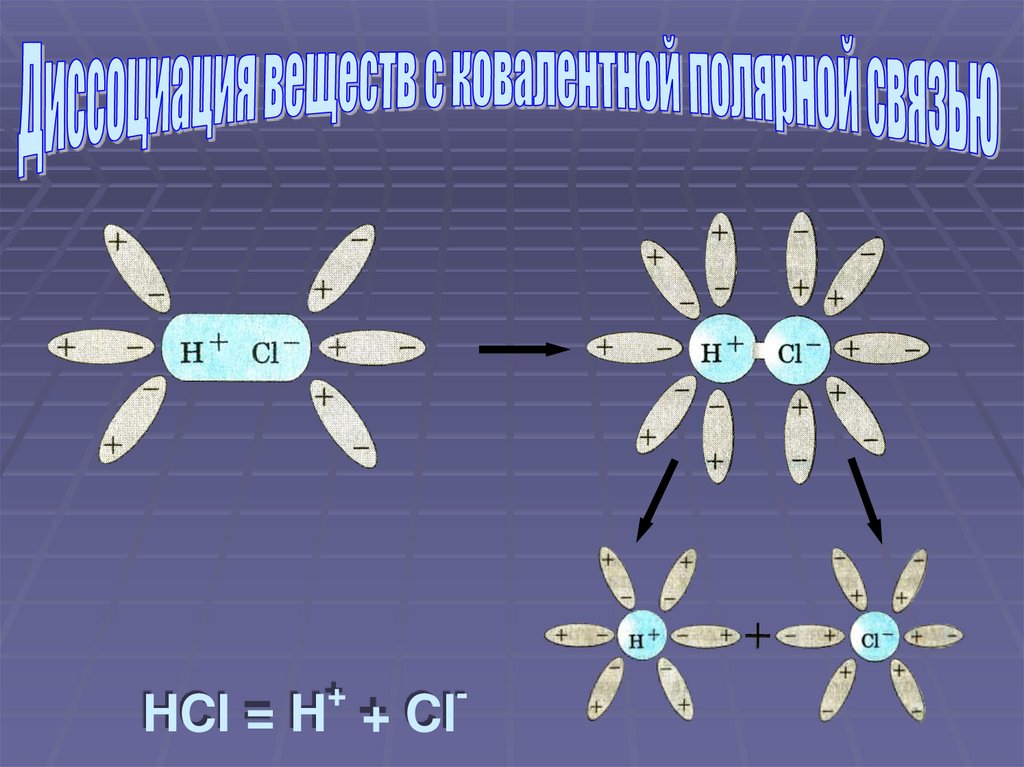
+-
HCl = H + Cl
8.
Ориентация молекул воды вокруг полюсовмолекулы электролита
Взаимодействие молекул воды с
Это нужно
запомнить!
противоположно заряженными ионами
поверхностного слоя кристалла (гидратация)
Превращение ковалентной полярной связи в
ионную (ионизация молекул электролита)
Распад молекул электролита на
гидратированные ионы (диссоциация)
9.
Nдα
100%
Nр
> 30 %
сильные
Соли, щелочи,
кислоты H2SO4,
HNO3, HCl, HBr, HI
2 − 30 %
средней
силы
H3PO4, HF
<2%
слабые
Степень электролитической
диссоциации зависит от
H2O, NH4OH, Me(OH)n ,
H2CO3, H2SiO3, H2S,
CH3COOH
природы электролита и растворителя
температуры
концентрации
10.
При растворении в воде электролиты диссоциируют наположительные и отрицательные ионы
Причиной диссоциации электролита в водном растворе
является его гидратация, то есть взаимодействие
электролита с молекулами воды и разрыв химической связи
в нем
Под действием электрического тока положительно
заряженные ионы движутся к отрицательному полюсу
источника тока – катоду, их называют катионами; а
отрицательно заряженные ионы движутся к положительному
полюсу источника тока – аноду, их называют анионами
Электролитическая диссоциация – процесс обратимый для
слабых электролитов
Химические свойства растворов электролитов
определяются свойствами тех ионов, которые они образуют
при диссоциации
11.
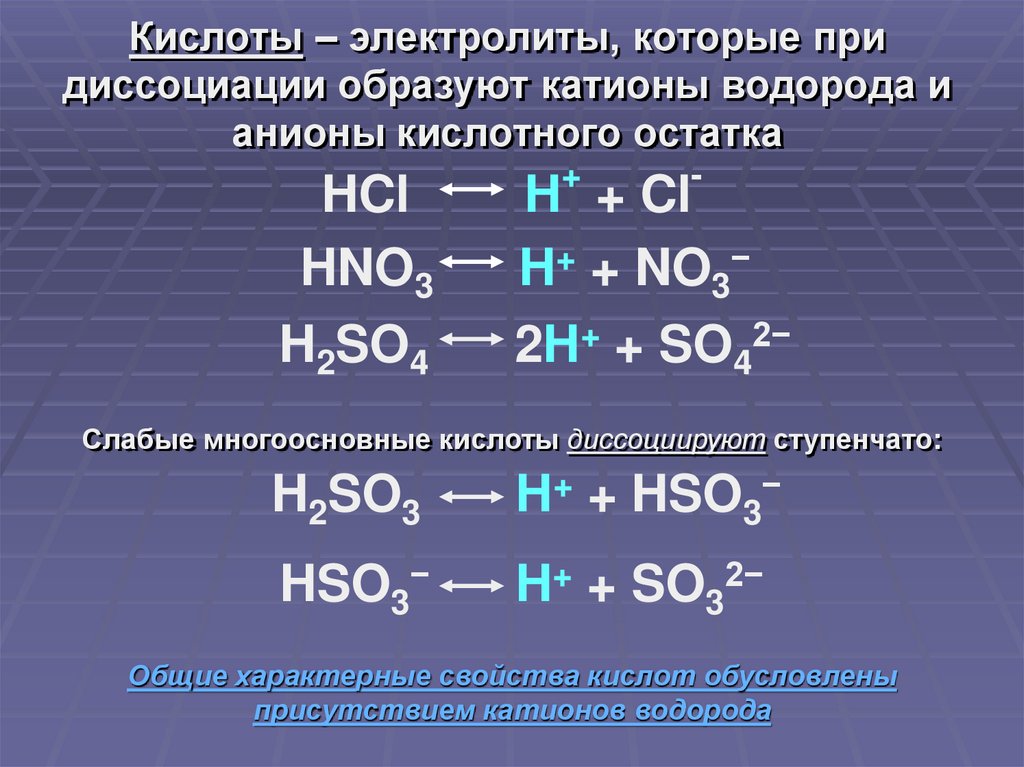
Кислоты – электролиты, которые придиссоциации образуют катионы водорода и
анионы кислотного остатка
HCl
HNO3
H2SO4
+
-
H + Cl
H+ + NO3−
2H+ + SO42−
Слабые многоосновные кислоты диссоциируют ступенчато:
H2SO3
H+ + HSO3−
HSO3−
H+ + SO32−
Общие характерные свойства кислот обусловлены
присутствием катионов водорода
12.
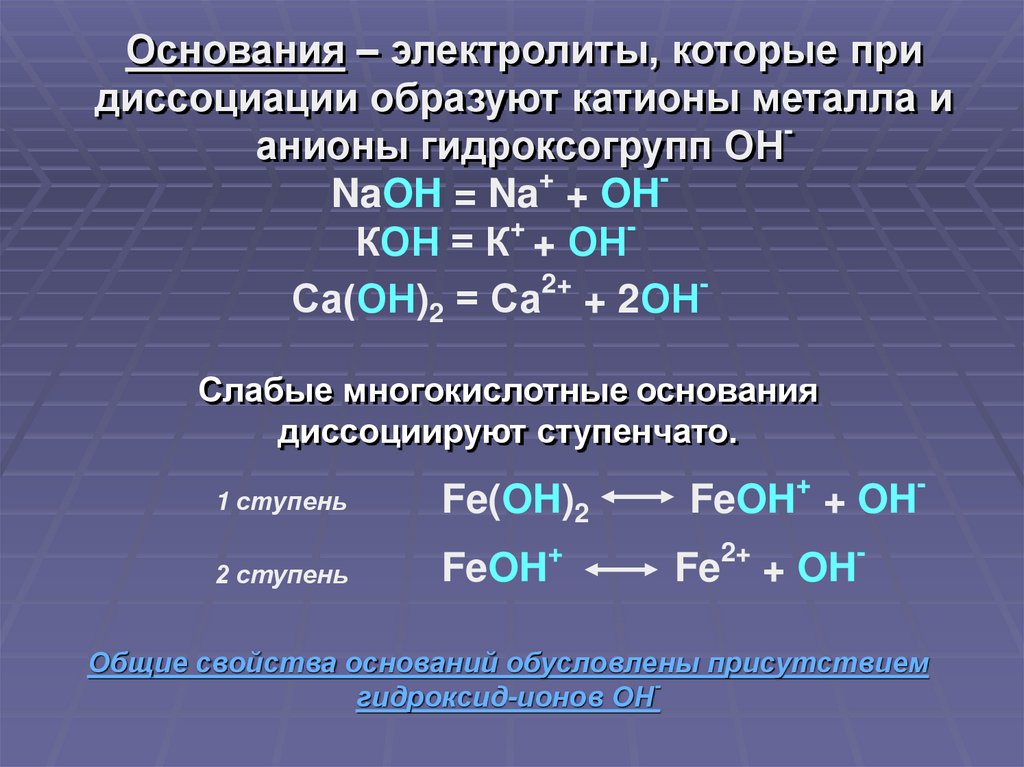
Основания – электролиты, которые придиссоциации образуют катионы металла и
анионы гидроксогрупп ОН
+
NaOH = Na + OH
+
КОН = К + ОН
2+
Са(ОН)2 = Са + 2ОН
Слабые многокислотные основания
диссоциируют ступенчато.
1 ступень
2 ступень
Fe(OH)2
+
FeOH
+
-
FeOH + OH
Fe
2+
-
+ OH
Общие свойства оснований обусловлены присутствием
гидроксид-ионов ОН-
13.
Средние соли – сильные электролиты, которые придиссоциации образуют катионы металла (или аммония
NH4+) и анионы кислотных остатков
К3РО4
3К+ + РО43NH4Cl
NH4+ + Cl−
Кислые соли – электролиты, диссоциирующие на катион
металла и сложный анион, в состав которого входят
атомы водорода и кислотный остаток
NaHCO3
Na+ + HCO3−
α1 >> α2
HCO3−
H+ + CO32−
Основные соли – электролиты, которые при
диссоциации образуют анионы кислотного
остатка и сложные катионы, состоящие из атомов
металла и гидроксогрупп ОН−
(FeOH)2SO4
2FeOH+ + SO42−
FeOH+
Fe2+ + OH−
α1 >> α2
14.
1. Запишите понятия, соответствующие этим определениямВещества, растворы которых проводят электрический ток.
Процесс распада электролита на ионы.
Положительно заряженные ионы.
Отрицательно заряженные ионы
Электролиты, которые при диссоциации образуют катионы
водорода и анионы кислотного остатка.
6. Электролиты, которые при диссоциации образуют катионы
металла и анионы гидроксогрупп ОН−.
7. Электролиты, которые при диссоциации образуют катионы
металла и анионы кислотных остатков.
8. Количественная характеристика электролитической
диссоциации
9. Молекулы, имеющие два электрических заряда, равных по
величине, но противоположных по знаку, и расположенных на
некотором расстоянии друг от друга
10. Автор теории электролитической диссоциации.
2. Создайте презентацию по теме урока.
1.
2.
3.
4.
5.
15.
Отчет о выполнении домашнего задания(в виде сканкопий, фотографий или
документов Microsoft Word и Microsoft PowerPoint)
прислать на электронный адрес:
larisanikolaevna.epgl@yandex.ru
Рудзитис
Г.Е.
Химия
10
класс:
общеобразовательных учреждений / Г.Е.
Фельдман - М.: «Просвещение», 2012. - 192 с.
Учебник
Рудзитис,
для
Ф.Г.
16.
Если интересно…http://www.catalogmineralov.ru – сайт
содержит каталог минералов,
большую коллекцию фотографий и
описание минералов.
http://www.elementy.ru – сайт « Элементы
большой науки», содержит
каталоги и статьи научнопопулярных журналов «Химия и
жизнь», « Наука и жизнь»,
«Природа» и др.
http://www.ovitanah.com - сайт посвящен
витаминам и микроэлементам,
содержит интересную
информацию.
http://www.alhimik.ru – сайт «Алхимик»
содержит самую разнообразную
информацию по химии.











 chemistry
chemistry








