Similar presentations:
Радиолиз воды
1.
Файзрахманов Ф.Ф. к.х.н.(тема 8)
Снежинск
2021г
2.
Радиационно-химический выход(G).Выход определяется по зависимости концентрации
(С) исследуемого продукта от дозы излучения (D). Он
равен абсолютной величине производной функции С
(D) при стремлении дозы к нулю:
где ŋ- переводный множитель, зависящий от выбора
единиц измерения, а ΔС- измерение концентрации
исследуемого продукта. Величина G выражается в
числе молекул (ионов, радикалов), образовавшихся
или распавшихся на 100 эВ поглощенной энергии в
облучаемой среде. Если в формуле концентрация
выражена в микромолях, а доза в Дж/кг, то
переводный множитель ŋ =9,65~10.
3.
Радиационная химия воды и водныхрастворов как наука возникла в ответ на
потребность атомной промышленности (на
первых
стадиях
развития
военной
промышленности) знать, что происходит при
действии излучения с теплоносителями
ядерных реакторов и с водными растворами
- реагентами в технологии выделения
делящихся материалов из облученного
ядерного топлива.
Первые исследования радиолиза воды
были выполнены в США в середине 40-х
годов группами А. О. Аллена и E. Дж. Харта.
4.
В нашей стране первые работы порадиационной химии воды были проведены
в конце 40-х - начале 50-х годов в Институте
физической химии АН СССР ( впоследствии,
в Институте электрохимии АН СССР) и в
Институте
теоретической
и
экспериментальной физики ( тогда ТТЛ АН
СССР , т. е. "Теплотехнической лаборатории
АН СССР" группами Н. А. Бах - В. А.
Медведовского и Б. В. Эршлера - П. И.
Долина.
Радикально-диффузионная
теория,
в
современном ее виде была сформулирована
в США группами Р. Л. Платцмана и Дж. Маги.
5.
Основной постулат теории:в результате действия излучения на воду
образуются
химически-активные
частицы
возбужденные молекулы и ионы, радикалы и ионрадикалы, реакциями которых друг с другом и c
другими растворенными веществами определяются
макроизменения, происходящие с водой при
облучении - выделение радиолитических газов (
водорода и кислорода), образование пероксида
водорода,
окислительно-восстановительные
процессы с участием растворенных веществ и т. д .
Принято суммарный процесс радиолиза жидкой
воды разделять по времени на три стадии:
физическую, физико-химическую и химическую.
6.
Физическая стадия.На этой стадии, длящейся 10-16-10-15с,
происходит взаимодействие частицы или
высокоэнергетического
кванта
с
электронными оболочками молекул воды.
Последние обладают энергией, достаточной
для ионизации еще нескольких молекул воды.
Расстояние, на котором происходит каждая
последующая
ионизация,
прогрессивно
уменьшается,
достигая
нескольких
нанометров
при
потере
вторичным
электроном энергии, меньшей потенциала
ионизации молекул воды, равного 12,6 эВ.
7.
В результате такого процесса происходитобразование "блобов", «коротких треков» и
"шпор" - локальных мест повышенной
ионизации.
Вторичные электроны, не производящие
ионизации, имеют достаточно энергии для
возбуждения молекул воды. На физической
стадии радиолиза образуются возбужденные
Н2О* и сверхвозбужденные Н2О** молекулы
воды (с энергиями около 8 эВ).
Вторичные электроны, энергия которых
Е < 7,4 эВ, называются электронами
недовозбуждения.
8.
Физико-химическая стадия.За время колебания молекул воды ( около
10-14
c
)
происходит
диссоциация
возбужденных
и
автоионизация
сверхвозбужденных молекул воды:
H2O*
H + OH (распад из синглетно
возбужденной молекулы воды в состояние
А1В1 с Е = 8, 4 эВ ) или
Н2О*
Н2 + О (распад из синглетно
возбужденной молекулы воды в состояние
В1А1 с Е=10,1 эВ ),
Н2О** Н2O+ + е- .
За
~10-13с
происходит
термализация
электронов недовозбуждения
9.
Термализованныеэлектроны
за
время
продольной диэлектрической релаксации (<
3.10-13 с) локализуются с образованием
гидратированных
электронов.
Положительные молекулярные ионы воды
вступают в ион-молекулярную реакцию:
Н2О+ + Н2О Н3О+ + ОН.
Образовавшийся
ион
гидроксония
Н3О+ гидратируется за время порядка 10-13 с.
К концу физико-химической стадии (время
порядка 10-11 с ) в ней существуют
гидратированные электроны, радикалы Н, ОН
и О, ионы гидроксония и молекулярный
водород.
10.
Распределениечастиц
в
"шпоре"
неравномерное: атомы О и Н, радикалы ОН и
ионы
гидроксония
распределены
в
пространстве
негомогенно
они
концентрируются в микрообластях в центре
"шпоры", а гидратированные электроны - в
шаровом слое на расстоянии около 4 нм от
центра.
11.
Химическая стадия:С времени порядка ~10-10 с, протекают в
"блобах", "шпорах" и «коротких треках»
химические реакции образовавшихся на
предыдущей стадии продуктов друг с другом,
что приводит к образованию атомов и
молекул водорода, пероксида водорода и
ионов гидроксила. Одновременно имеет
место диффузия этих частиц (и ранее
образовавшихся) из "шпор" в объем
раствора,
следствием
чего
является
размывание
"шпор"
и
выравнивание
концентраций продуктов радиолиза по
объему, т. е установление гомогенного
распределения продуктов.
12.
Времяустановления
такого
распределения составляет порядка 10-7 с. По
прошествии
этого
времени
в
воде
существуют гидратированные электроны,
атомы водорода и кислорода, радикалы ОН,
молекулярный водород, пероксид водорода,
ионы гидроксония и гидроксила.
Радиационно-химические
выходы
их
(первичные
выходы),
составляют
в
нейтральной воде для гамма-излучения,
частица/100 эВ:
G(егидр) = 2,8-2,9; G(H) = 0,6; G(ОH)= 2,8-2,9;
G(O) = 0,0067; G(H2) = 0,45; G(H2O2) = 0,75;
G(H3O+ ) = 3,3 - 3,4; G(OH-) = 0,5 - 0,6.
13.
Таким образом, при прохождении излучениячерез воду образуются ионы и возбужденные
молекулы: γ + Н2О → H2O+ + е,
Далее, за (10-11сек) происходит:
Н2O+ + H2O → H3O+ + OH*
e + H2O → H2O- → H + OHТаким образом, образуются неустойчивые
радикалы Н* и ОН* и новые, устойчивые в
воде ионы - ионы гидроксония H3O+ и
гидроксила ОН-.
За это время движущиеся в воде радикалы Н*
и ОН* успевают вступить во взаимодействие
Н* + Н* → Н2, ОН* + Н* → Н2О,
НО* + ОН* → Н2О2.
14.
Врезультате
этих
реакций
вновь
образуется вода, и появляются новые, уже
устойчивые соединения - молекулярный
водород и перекись водорода.
Их принято называть молекулярными
продуктами радиолиза воды в отличие от
неустойчивых радикальных продуктов Н* и
ОН*. Происходящие при радиолизе воды
процессы можно представить в виде цепочки
последовательных превращений:
вода ==> ионы (H2O+, е) -> радикалы (Н* и ОН*)
-> молекулярные продукты (Н2, Н2О2).
15.
Молекулярные продукты при облученииочень чистой воды накапливаются в очень
малой
концентрации
не
более
десятитысячных
долей
процента
от
количества исходного вещества. Причина
этого
в
разрушении
образующихся
соединений радикалами Н* и ОН* :
Н2О2+ Н* → H2O + ОН*
Н2 + ОН* → Н2О + Н*.
Так что радикалы, порождая молекулярные
продукты, их же и разрушают. Происходит
круговорот:
вода -> продукты радиолиза -> вода.
16.
Файзрахманов Ф.Ф. к.х.н.(тема 9)
Снежинск
2021г
17.
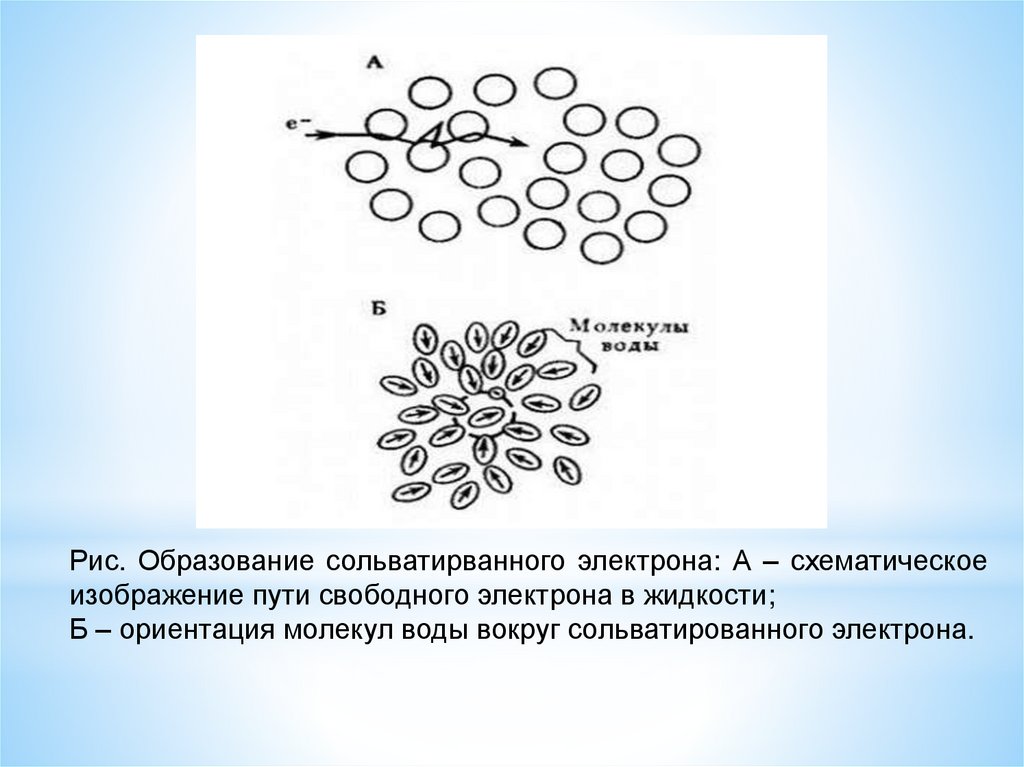
СОЛЬВАТИРОВАННЫЙ(ГИДРАТИРОВАННЫЙ) ЭЛЕКТРОН (eaq).
Электрон, захваченный средой в результате
поляризации им окружающих молекул (если
средой является вода, электрон называется
гидратированным).
Возникает
в
результате
стабилизации
свободного электрона в "потенциальной
яме",
образованной
поляризованными
молекулами воды (рис.). Чаще всего
образование сольватированного электрона
происходит при поляризации молекул воды,
например, электрическим полем.
18.
Рис. Образование сольватирванного электрона: А – схематическоеизображение пути свободного электрона в жидкости;
Б – ориентация молекул воды вокруг сольватированного электрона.
19.
Чаще всего образуется при растворении щелочныхметаллов в аммиаке, аминах и некоторых др.
жидкостях; фотоионизации некоторых жидкостей и
многих веществ, растворенных в воде, спиртах;
радиолизе воды, спиртов, эфиров, аммиака, аминов,
углеводородов и др. жидких и замороженных систем.
Возбужденные молекулы воды разрушаются с
образованием ионов, а электроны захватываются
молекулами воды и становятся сольватированными:
потеряв на возбуждение и ионизацию молекул воды
большую часть энергии, электрон продолжает
взаимодействовать с окружающими его молекулами
воды до тех пор, пока он не окажется в
потенциальной яме, так как не сможет преодолеть
электростатическое
отталкивание
электронного
облака молекулы, через которую он проходит.
20.
Перед стабилизацией электрона егокинетическая энергия в областях с низкой
потенциальной энергией уменьшается до 1
эВ и менее, а скорость падает до 6.10 –7 см/с.
Последовательное
уменьшение
потенциальной энергии стабилизированного
электрона происходит за счет атомной
поляризации,
расширения
полости
"потенциальной ямы" и ориентационной
поляризации окружающих молекул. Выход
электрона
из
потенциальной
ямы
называется туннельным эффектом.
21.
Предлагались различные теоретическиемодели
сольватированного
электрона;
наиболее вероятно, что сольватированный
электрон является
ионным кластером типа [XnXm-]
(где, Х-молекула растворителя, n - число
молекул в кластере, m - число молекул в
ближайших сольватных слоях), причем n
может быть 2, 3, 4, 6 и 8, а m - достигать
больших значений.
Возникновение
кластеров
типа
Xnобнаружено
методом
фотоэлектронной
спектроскопии в парах воды, газообразном
аммиаке и т. п.
22.
Время перехода электрона из свободногосостояния в сольватированное при 295 К
составляет (пс):
0,24 в воде, 5 в этилен-гликоле, 11 в
метаноле, 18 в этаноле, 51 в деканоле, ~0,2 в
аммиаке.
При понижении температуры это время
увеличивается.
Радиацонно-химические
выходы
сольватированных
электронов
при
радиолизе равны:
2,7-2,9 в воде, 1-1,8 в спиртах, 3,1 в аммиаке,
0,1-0,2 в нормальных углеводородах и
до ~ 1 в разветвленных углеводородах.
23.
Сольватированныйэлектрон характеризуетсяширокой интенсивной полосой поглощения в
видимой или ИК-области и узкой одиночной
линией
(синглетом)
в
спектре
ЭПР.
Максимумы
полос
поглощения
сольватированного электрона в воде и
аммиаке соответствуют 720 и 1850 нм, а
ширина линий ЭПР в этих жидкостях порядка
миллионных долей Тл.
В других жидкостях максимумы полос
поглощения
находятся
(нм):
560
в
этиленгликоле, 625 в метаноле, 680 в этаноле,
650 в деканоле, 2300 в диэтиловом эфире,
2180 в тетрагидрофуране, 1800 в диоксане,
1920 в метиламине, 1950 в этиламине.
24.
Подвижность при комнатной температуре[см2/(В·с)]: 1,92·10-3 в воде, 0,019 в аммиаке,
3,7·10-4 в этаноле, 5,1·10-3 в диэтиловом
эфире, 0,8 в диоксане, 0,015 в этиленамине…
В зависимости от природы среды и
условий образования сольватированный
электрон-стабильная или короткоживущая
частица.
В растворах щелочных металлов в
аммиаке
в
отсутствие
кислорода
сольватированный электрон сохраняется
месяцами,
тогда
как
при
радиолизе
жидкостей время его жизни не превышает
тысячных долей секунды.
25.
Сольватированныйэлектрон-мощный
восстановитель; в воде его окислительновосстановительный потенциал равен -2,87В.
Для
сольватированного
электрона
характерны реакции трех типов:
- присоединение к ионам:
Cu2+ + eaq.:Cu+; NO3- + eaq:NO3-,
- присоединение к нейтральным молекулам:
О2 + eaq = О2 - ; (СН3)2СО + eaq = (СН3)2СО-диссоциативное присоединение:
N2O + eaq = N2 + O- ;
С6Н5СН2Сl + eaq = C6H5CH2-+ Cl-.
26.
Многиереакции
сольватированного
электрона
протекают
с
высокими
скоростями.
Сольватированный
электрон
применяется
для
получения
ионов
металлов
в
необычных
состояниях
окисления (например, Со+, Cd+, Zn+),
карбоанионов в растворах (например,
C6H5CH2- в тетрагидрофуране) и др.
Его используют для изучения механизма
реакций
(например,
протекающих
по
туннельному механизму).
27.
Литература:1. Пикаев А. К., Сольватированный электрон
в радиационной химии, М., 1969;
2. Пикаев А. К.,Современная радиационная
химия. Радиолиз газов и жидкостей, М., 1986;
3.Харт Э., Анбар М., Гидратированный
электрон, пер. с англ., М., 1973. А. К. Пикаев.



























 physics
physics chemistry
chemistry








