Similar presentations:
Физика атомного ядра
1.
Муниципальное бюджетное общеобразовательное учреждение«Средняя общеобразовательная школа№3
г. Йошкар-Олы»
Презентация
на тему:
«Физика атомного ядра»
Выполнили: Онучин Сергей, Хакимуллин Ислам,
Абдолгхафуриан Даниал, Богданов Даниил.
ученики 7б класса
Руководитель: Орехова Татьяна Николаевна
г. Йошкар-Ола,
2022
2.
Содержание1.
2.
3.
4.
5.
Протон и нейтрон. История их открытия
Состав атомного ядра
Размер ядра
Заряд ядра
Масса
3.
Протон и нейтрон. История их открытия.История открытия атомного ядра начинается с опытов Резерфорда и его учеников, когда
было доказано существование в атоме массивного центра, названного ядром. Резерфорд,
изучая явление прохождения α-частиц через вещество, обнаружил рассеяние α-частиц на
большие углы вплоть до 180°, т.е. рассеяние назад. Такое рассеяние возможно только от
массивного центра внутри атома.
В докладе «Рассеяние α- и β-лучей и строение
атома» Резерфорд говорил об:
Современное определение
атомного ядра звучит так:
Атомное ядро — центральная
часть атома, в которой
сосредоточена его основная
масса.
Атомное ядро
состоит из
элементарных
частиц:
протонов p;
нейтронов n
«…атоме, который состоит из центрального
электрического заряда, сосредоточенного в
точке и окруженного однородным сферическим
распределением противоположного
электричества равной величины».
Для теоретического описания этих результатов Резерфорд в 1911 г.
формулирует планетарную модель строения атома, согласно которой
- внутри атома имеется положительно заряженное ядро малых
размеров, в котором сосредоточена почти вся масса атома, а
вокруг ядра обращаются электроны.
В рамках этой модели Резерфорд выводит знаменитую формулу
4.
Открытие протонаРезерфорд Эрнест (1871-1937) основоположник ядерной физики. Родился в
Новой Зеландии. Переехав Англию, работал в
1895-1898 в Кавендишской лаб-рии у Дж.Дж.
Томсона. В 1898-1907 работая профессором в
Канаде, делает фундаментальные открытия:
открыл α - β лучи, разработал теорию
радиоактивного распада, установил закон
радиоактивных превращений. Вернувшись в
Англию, стал директором Кавендишской
лаборатории, которая стала ведущим центром
ядерной физики. Установил закон рассеяния ачастиц в 1911, что привело к открытию ядра в
атоме. В 1919 осуществил первую ядерную
реакцию и открыл протон.
Лауреат Нобелевской премии по химии за 1908.
5.
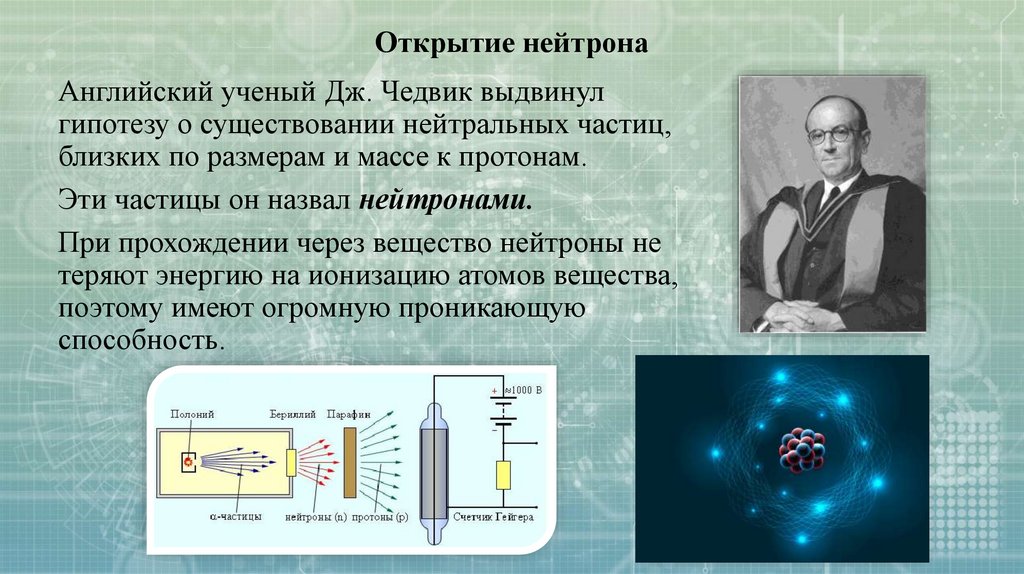
Открытие нейтронаАнглийский ученый Дж. Чедвик выдвинул
гипотезу о существовании нейтральных частиц,
близких по размерам и массе к протонам.
Эти частицы он назвал нейтронами.
При прохождении через вещество нейтроны не
теряют энергию на ионизацию атомов вещества,
поэтому имеют огромную проникающую
способность.
6.
Состав атомного ядраВ состав атомного ядра
входят элементарные
частицы: протоны и
нейтроны. Такая
протонно-нейтронная
модель ядра была
предложена советским
физиком в 1932 г. Д.Д.
Иваненко.
Протон имеет
положительный заряд
е+=1,06·10–19 Кл и массу
покоя mp = 1,673·10–27кг
= 1836me. Нейтрон (n) –
нейтральная частица с
массой покоя mn =
1,675·10–27кг = 1839me
(где масса электрона me,
равна 0,91·10–31кг).
Согласно этой модели:
- ядра всех химических элементов состоят из
нуклонов: протонов и нейтронов;
- заряд ядра обусловлен только протонами;
- число протонов в ядре равно порядковому
номеру элемента;
- число нейтронов равно разности между
атомным числом и числом протонов (N=A-Z).
7.
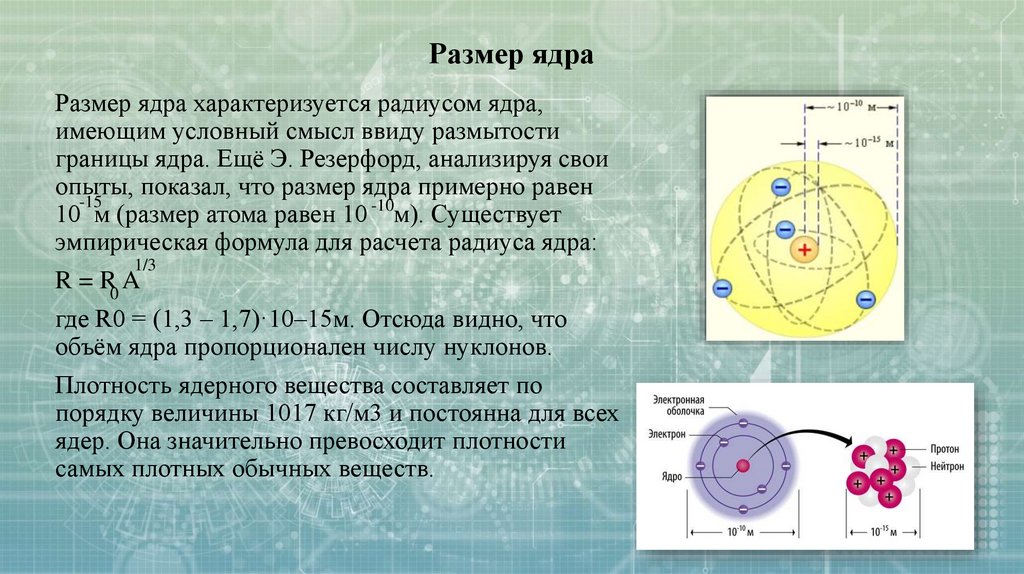
Размер ядраРазмер ядра характеризуется радиусом ядра,
имеющим условный смысл ввиду размытости
границы ядра. Ещё Э. Резерфорд, анализируя свои
опыты,
показал, что размер ядра примерно равен
-15
10 м (размер атома равен 10 -10м). Существует
эмпирическая формула для расчета радиуса ядра:
1/3
R = R0 A
где R0 = (1,3 – 1,7)·10–15м. Отсюда видно, что
объём ядра пропорционален числу нуклонов.
Плотность ядерного вещества составляет по
порядку величины 1017 кг/м3 и постоянна для всех
ядер. Она значительно превосходит плотности
самых плотных обычных веществ.
8.
Заряд ядраЯдро обозначается тем же символом, что
Заряд ядра равен Ze, где e – заряд
протона, Z – зарядовое число,
и нейтральный атом АZX , где X – символ
равное порядковому номеру
химического элемента. Например:
химического элемента в
водород Z = 1 имеет три изотопа:
периодической системе элементов
1
H – протий (Z = 1, N = 0);
Менделеева, т.е. числу протонов в
1
2
ядре. Число нейтронов в ядре
1 H – дейтерий (Z = 1, N = 1);
3
обозначается N. Как правило Z > N.
1 H – тритий (Z = 1, N = 2);
В настоящее время известны ядра с
Олово имеет 10 изотопов и т.д. В
Z = 1 до Z = 107 – 118.
подавляющем большинстве изотопы
Число нуклонов в ядре A = Z + N
называется массовым числом.
одного химического элемента обладают
Ядра с одинаковым Z, но
одинаковыми химическими и близкими
различными А называются
физическими свойствами.
изотопами.
Ядра, которые при одинаковом A
имеют разные Z, называются
изобарами.
9.
Масса12
В 1962 г. физики и химики приняли за массовое число углерода 6 С величину,
равную точно1212,00000 и рассчитали атомные массы всех остальных элементов
относительно 6 С. Хотя массовое число изотопа обычно приводится целым
числом, на самом деле оно «не совсем» целое.
41
18
235
Так, например, массовые числа кислорода 8 О , калия 8 К и урана 92U равны,
соответственно, 18, 41, 235. Методами масс-спектроскопии удалось с очень
большой 12точностью измерить18массы отдельных изотопов. По отношению
к
41
углероду 6 C масса кислорода
8 O равна m =17,99916 а.е.м., калия 8 K — m
K
O
235
=40,96184 а.е.м., урана92 U — mU =235,04393 а.е.м. Масса протона m p =1,007276
а.е.м., нейтрона — m n = 1,008665 а.е.м .
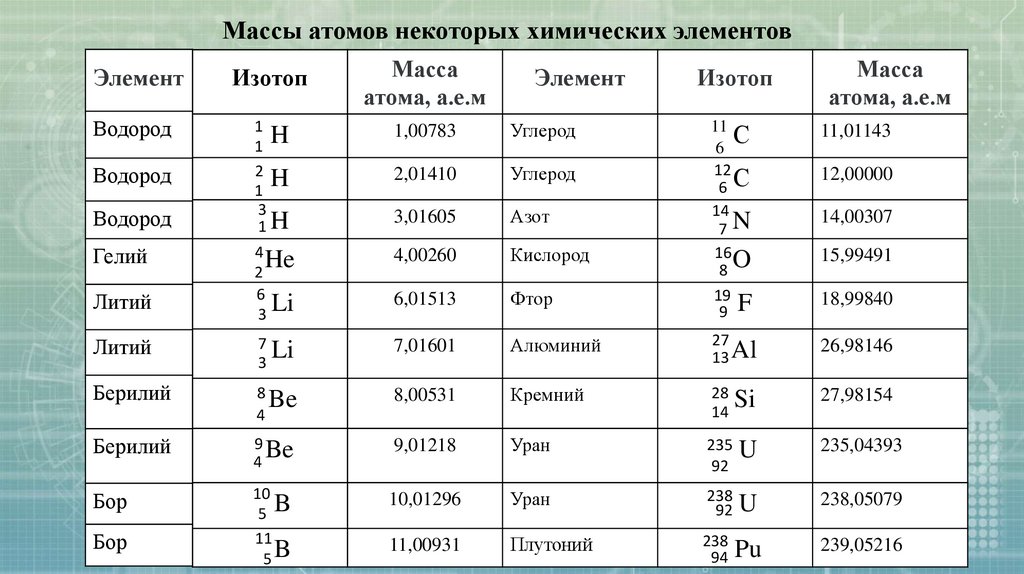
Массы некоторых атомов приведены в таблице
10.
Массы атомов некоторых химических элементовМасса
атома, а.е.м
Элемент
Изотоп
Водород
1
H
1
2
H
1
3
1H
1,00783
Углерод
2,01410
Углерод
3,01605
Азот
4
He
2
6
Li
3
4,00260
Кислород
6,01513
Фтор
Литий
7
Li
3
7,01601
Берилий
8
Be
4
Берилий
Бор
Водород
Водород
Гелий
Литий
Бор
Элемент
Изотоп
Масса
атома, а.е.м
11
С
6
12
6С
14
7N
16
8O
19
9 F
11,01143
Алюминий
27
13 Al
26,98146
8,00531
Кремний
28
Si
14
27,98154
9 Be
4
9,01218
Уран
235 U
92
235,04393
10
5 B
11
5B
10,01296
Уран
238
92 U
238,05079
11,00931
Плутоний
238
94 Pu
239,05216
12,00000
14,00307
15,99491
18,99840
11.
В физике за атомную единицу массы (1 а.е.м.)1
принимается величина, равная массы изотопа
12
12
углерода 6 С:
1
-27
.
1 а.е.м. = m OC =1,66054 10 кг.
12
12.
Таким образом, на основании всех известных к началу XX векаэкспериментальных фактов можно было сделать вывод о том, что
атомы вещества имеют сложное внутреннее строение. Они
представляют собой электронейтральные системы, причем
носителями отрицательного заряда атомов являются легкие
электроны, масса которых составляет лишь малую долю массы
атомов. Основная часть массы атомов связана с положительным
зарядом.
13.
Источники1. http://profil.adu.by/mod/book/view.php?id=3884&chapterid=11642
2. https://studfile.net/preview/7627667/page:21/
3. https://kpfu.ru/docs/F421475575/Uchebnik.po.YaF.pdf
4. https://pptcloud.ru/fizika/fizika-atomnogo-yadra











 physics
physics








