Similar presentations:
Podstawy racjonalnej antybiotykoterapii
1.
Podstawy racjonalnejantybiotykoterapii
lek. Grzegorz Jakubiak
Katedra i Zakład Farmakologii w Zabrzu
Wykład dla Członków Koła Naukowego
2018/2019
2.
3.
4.
5.
Podstawy racjonalnejantybiotykoterapii
Racjonalna antybiotykoterapia wymaga wiedzy
na temat trzech aspektów infekcji:
1. Człowiek
2. Lek
3. Drobnoustrój (bakteria)
6.
Podstawy racjonalnejantybiotykoterapii
Tym aspektom
lekarskie:
odpowiadają
specjalności
1. Właściwa dziedzina medycyny klinicznej
2. Farmakologia kliniczna
3. Mikrobiologia lekarska
7.
Odpowiedzialne ordynowanieantybiotyku
1. Odpowiedzialność za konkretnego chorego
2. Odpowiedzialność
za
zachowanie
antybiotyków dla przyszłych pacjentów
8.
Czy racjonalne ordynowanieantybiotyków przez lekarzy wystarczy?
• Weterynaria
• Rolnictwo
• Przemysł kosmetyczny
• Obecność antybiotyków w środowisku
• Dostępność antybiotyków bez recepty
w krajach słabo rozwiniętych
9.
Narodowy Program OchronyAntybiotyków
• Program rządowy, który funkcjonuje od 2004 r.
• Angażuje instytucje zaangażowane w różne sektory,
związane ze stosowaniem antybiotyków –
środowiska lekarskie, farmaceutyczne, przemysł
farmaceutyczny, rolnictwo, przemysł kosmetyczny
i in.
• Pod jego auspicjami powstają rekomendacje
dotyczące diagnostyki i leczenia infekcji
• W 2018 r. z budżetu Ministra Zdrowia przeznaczono
ok. 2 mln 200 tys. zł
10.
Narodowy Program OchronyAntybiotyków
• Jednostką stanowiącą nadzór merytoryczny nad
programem jest Narodowy Instytut Leków, Zakład
Epidemiologii i Mikrobiologii Klinicznej
• Zespół
Koordynujący,
Rada
Programowa,
Podzespoły, m.in. Podzespół Medycyny, Podzespół
Weterynarii Środowiska i Żywności, Podzespół
Monitorowania Oporności, Podzespół Edukacji
i Promocji, Podzespół Informacji o Lekach
Przeciwdrobnoustrojowych i Relacji z Przemysłem
Farmaceutycznym
11.
Oporność bakterii na antybiotyki• Oporność
naturalna
–
jest
cechą
charakterystyczną dla danego gatunku bakterii
• Oporność nabyta – może być uwarunkowana
mutacją w obrębie chromosomalnego DNA
(oporność pierwotna) (np. gen mecA u MRSA
lub uwarunkowana ruchomymi elementami
genomu (plazmidy, integrony, transpozony)
(oporność wtórna).
12.
Przykłady oporności naturalnej• Bakterie tlenowe – metronidazol
• Bakterie beztlenowe – aminoglikozydy
• Enterococcus sp. – aminoglikozydy, linkozamidy,
cefalosporyny
• Pseudomonas aeruginosa – cefalosporyny I i II
generacji, aminopenicyliny, kotrimoksazol
• Klebsiella sp. – ampicylina
13.
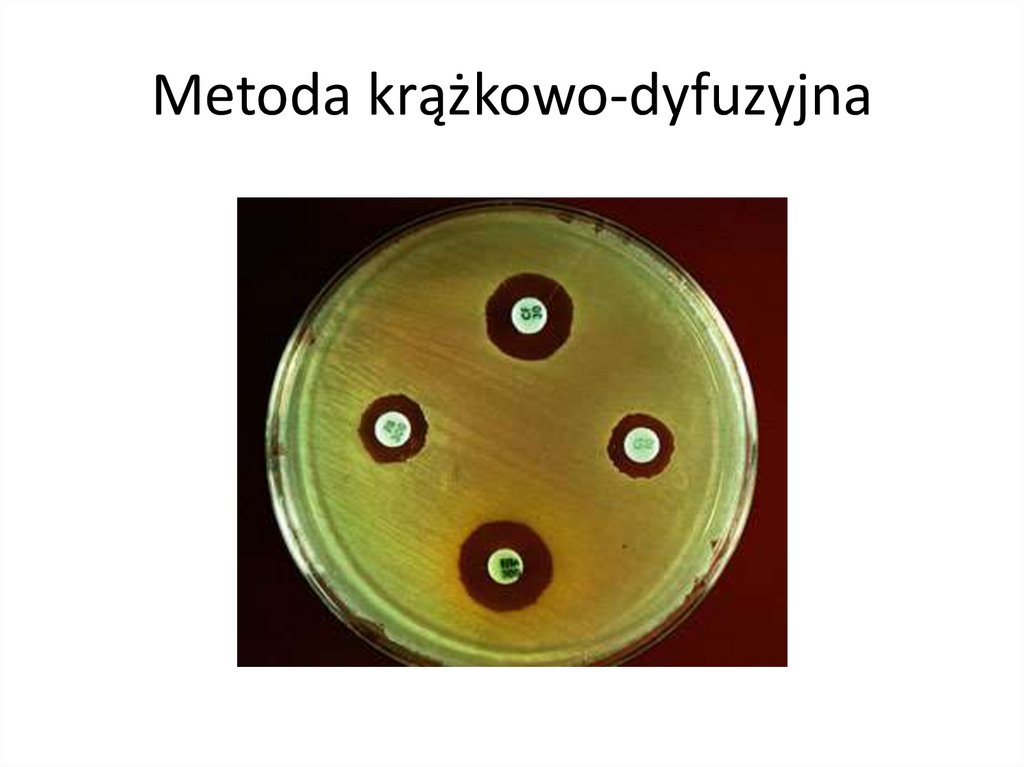
Metody badania wrażliwości bakteriina antybiotyki
• Testy krążkowo-dyfuzyjne
• E-testy
• Metody rozcieńczeniowe
14.
Metoda krążkowo-dyfuzyjna15.
16.
E-Testy17.
Otrzymano następujący wynik posiewu krwiz antybiogramem. Czy można powiedzieć, na
który antybiotyk bakteria jest „najbardziej
wrażliwa?”
Streptococcus pneumoniae
Penicylina benzylowa – I (MIC 1 µg/ml)
Ampicylina
– I (MIC 1 µg/ml)
Cefuroksym
– S (MIC 0.125 µg/ml)
Aksetyl cefuroksymu – S (MIC 0.125 µg/ml)
Lewofloksacyna
– S (MIC 0.25 µg/ml)
Wankomycyna
– S (MIC 0.125 µg/ml)
18.
NIE19.
Dlaczego?20.
• Nie wolno porównywać wrażliwości bakteriina różne antybiotyki na podstawie
bezwzględnej wartości MIC dla różnych
antybiotyków.
• Należy obliczyć, ile razy MIC oznaczone dla
konkretnego antybiotyku w przypadku
konkretnego szczepu jest mniejsze od
maksymalnej wartości stężenia antybiotyku,
przy którym bakteria zostaje uznana za
wrażliwą na konkretny lek.
21.
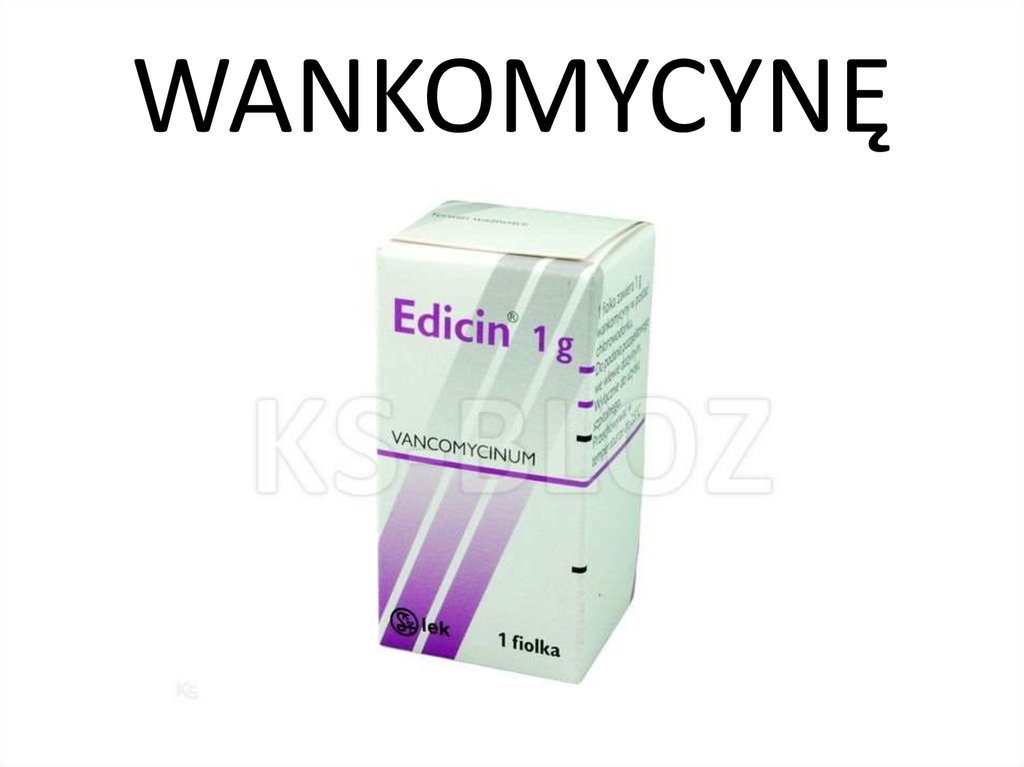
Streptococcus pneumoniaePenicylina benzylowa – I (2 > 1 > 0.06)
Ampicylina
– I (2 > 1 > 0.5)
Cefuroksym
– S (0.125 = 1/4 x 0.5)
Aksetyl cefuroksymu – S (0.125 = 1/2 x 0.25)
Lewofloksacyna
– S (0.25 = 1/8 x 2)
Wankomycyna
– S (0.125 = 1/16 x 2)
Zatem mimo identycznych wartości MIC dla
wankomycyny, cefuroksymu i aksetylu cefuroksymu,
wyizolowany szczep jest najbardziej wrażliwy na….
22.
WANKOMYCYNĘ23.
Lek przeciwbakteryjny jest skuteczny wtedy, kiedyw tkance objętej zakażeniem osiąga odpowiednie
stężenie, ponadto jest w stanie osiągnąć
w postaci aktywnej swój molekularny punkt
uchwytu w obrębie komórki bakteryjnej oraz
w sposób właściwy dla swojego mechanizmu
działania zadziałać na ten punkt uchwytu.
24.
Ogólne mechanizmy oporności bakterii• Zmiana w obrębie punktu uchwytu
• Zablokowanie transportu leku do komórki
bakteryjnej
• Aktywne wypompowywanie leku z komórki
bakteryjnej
• Produkcja enzymów, które modyfikują
cząsteczkę leku
• Biofilm
25.
Zmiana w obrębie punktu uchwytu• MRSA – metycylinooporny Staphylococcus
aureus
• Mechanizm oporności jest związany z mutacją
w obrębie białka PBP – w komórkach MRSA
jest obecne białko PBP-2a, które spełnia
funkcje właściwe dla PBP w kontekście
fizjologii bakterii, ale nie może związać się
z antybiotykami β-laktamowymi, poza
ceftaroliną.
26.
Enzymy modyfikujące aminoglikozydy• Acetylotransferazy, fosforylazy, nukleotydazy
• Enzymy znajdują się na powierzchni błony
komórkowej
• Stężenie aktywnej postaci leku w przestrzeni
pozakomórkowej spada tylko nieznacznie;
modyfikacji podlegają tylko cząsteczki leku
transportowane przez błonę cytoplazmatyczną
• HLAR – oporność na wysokie stężenia
aminoglikozydów (np. Enterococcus sp.)
27.
Zaburzenie transportu antybiotyku downętrza komórki bakteryjnej
• Zmniejszenie ekspresji poryn w obrębie błony
zewnętrznej bakterii Gram-ujemnych lub
zmiana
ich
struktury
są
związane
z
upośledzoną
penetracją
różnych
antybiotyków, m. in. antybiotyków βlaktamowych do ich miejsc docelowych.
28.
Aktywne usuwanie leku z komórkibakteryjnej
• Bakterie Gram-ujemne, w których ulega
ekspresji pompa transportowa Tet(AE) są
oporne na tetracykliny, doksycyklinę oraz
minocyklinę. Są jednak wrażliwe na
tygecyklinę, która nie jest substratem dla tej
pompy.
• Gen mefA odpowiada za ekspresję pompy,
która transportuje z komórki bakteryjnej
makrolidy
14i
15-członowe
oraz
streptograminę B
29.
β-laktamazy• Istnieją
różnice
pomiędzy
zasadami
funkcjonowania tego mechanizmu oporności
pomiędzy bakteriami Gram-dodatnimi i Gramujemnymi.
• W przypadku bakterii Gram-ujemnych enzymy
znajdują się w przestrzeni periplazmatycznej,
natomiast w przypadku bakterii Gramdodatnich są wydzielane do przestrzeni na
zewnątrz komórki.
30.
β-laktamazy• Istnieją dwie klasyfikacje β-laktamaz.
• Bush i Jacoby wyróżniają cztery klasy tych
enzymów: 1, 2, 3 i 4.
• Ambler wyróżnia klasy A, B, C i D.
• Podziały te częściowo nakładają się, np. grupa 1
według Busha i Jaccoby’ego odpowiada klasie C
według Amblera.
31.
Podział według Bush i Jacoby• Klasa 1 – cefalosporynazy słabo hamowane
przez kwas klawulanowy
• Klasa 2 – β-laktamazy o szerokim profilu
substratowym hamowane przez inhibitory
• Klasa 3 – Zn-zależne (hamowane przez EDTA)
zdolne do hydrolizy penicylin, cefalosporyn
i karbapenemów, słabo hamowane przez
inhibitory
• Klasa 4 – penicylinazy oporne na kwas
klawulanowy
32.
Podział według Amblera• Oparty na strukturze aminokwasowej
• Enzymy klasy B mają w centrum aktywnym
atom cynku
• Enzymy klasy A, C i D mają w centrum
aktywnym resztę seryny
33.
β-laktamazy• Pałeczki
Gram-ujemne
z
rodziny
Enterobacteriaceae są szczególnie podatne do
przekazywania genów odpowiedzialnych za
syntezę
β-laktamaz
za
pośrednictwem
plazmidów.
• Pałeczki
Gram-ujemne
syntetyzujące
karbapenemazy
są
obecnie
jednym
z największych zagrożeń dla zdrowia
publicznego.
34.
ESBL• β-laktamazy o rozszerzonym spektrum działania.
• Należą do klas A i D.
• Większość z nich jest hamowana przez kwas
klawulanowy, sulbaktam i tazobaktam.
• Zdolne do rozkładu penicylin, większości
cefalosporyn i monobaktamów.
• W Polsce 80% enzymów ESBL, izolowanych od
pałeczek jelitowych, należy do rodziny CTX-M,
charakteryzującej
się
silnym
rozkładaniem
cefotaksymu, ale jedynie niewielką aktywnością w
stosunku do ceftazydymu.
35.
AmpC• Gatunkowo-specyficzne
cefalosporynazy
należące do klasy C
• Rozkładają głównie cefalosporyny, ale również
penicyliny i monobaktamy
• Ulegają ekspresji najczęściej w sposób
indukowalny
36.
MBL• Metalo-β-laktamazy
• Rozkładają
penicyliny,
cefalosporyny
i karbapenemy
• Są enzymami o bardzo szerokim spektrum
• Przykładami MBL, charakterystycznymi dla
pałeczek ropy błękitnej są enzymy VIM, IMP,
SPM, GIM
37.
Biofilm jako przejaw „zbiorowejinteligencji” bakterii
• Biofilm stanowi ustrukturyzowaną społeczność
drobnoustrojów, zdolną do reakcji na bodźce
oraz cechującą się mechanizmami oporności
na
stosowane
antybiotyki
i
środki
antyseptyczne oraz zmniejszoną wrażliwością
na mechanizmy odpowiedzi immunologicznej
ze strony gospodarza.
38.
Biofilm• Zróżnicowana
dynamika
procesów
metabolicznych bakterii w różnych częściach
biofilmu.
• Dwojaki charakter mechanizmów obronnych
przed
działaniem
środków
przeciwbakteryjnych: oporność i tolerancja.
• Quorum sensing system.
39.
Biofilm• MIC bakterii wchodzących w skład biofilmu
może ok. 1000-krotnie przekraczać MIC
bakterii w formie planktonicznej!
• Takie stężenia leków przeciwbakteryjnych nie
są możliwe do uzyskania w warunkach in vivo.
40.
Poszukiwanie środków zopobiegającychpowstawaniu biofilmu
• Hamamelitanina
–
związek
hamujący
przekazywanie sygnału w ramach QSS
• Dyspersyna B, mutanaza, dekstranaza –
związki rozkładające cukrowe podjednostki
tworzące śluz
• Ksylitol – „fałszywy metabolit”; jego włączenie
do struktur macierzy biofilmu wiąże się z jej
osłabioną strukturą
• Laktoferyna – wiąże jony żelaza, które są
istotne w procesie powstawanie biofilmu
41.
42.
43.
Przykłady najważniejszych patogenówopornych na antybiotyki
• MRSA – gronkowiec złocisty oporny na
metycylinę, co w praktyce oznacza oporność
na wszystkie antybiotyki β-laktamowe,
z wyjątkiem ceftaroliny
• VISA – gronkowiec złocisty o zmniejszonej
wrażliwości na wankomycynę
• VRSA – gronkowiec złocisty oporny na
wankomycynę
44.
Przykłady najważniejszych patogenówopornych na antybiotyki
• VRE – enterokoki oporne na wankomycynę;
najczęściej przejawiają oporność na liczne inne
grupy antybiotyków
• PRP – pneumokoki oporne na penicylinę
45.
Przykłady najważniejszych patogenówopornych na antybiotyki
• CPE – Enterobacteriaceae wytwarzające βlaktamazy o aktywności karbapenemaz typu
KPC, MBL lub OXA-48; patogenem, którego
szczególnie często dotyczy ten mechanizm
oporności jest Klebsiella pneumoniae; zdarza
się, że patogeny z grupy CPE są oporne na
wszystkie dostępne antybiotyki; obecnie jest
to najgroźniejsza znana grupa patogenów
bakteryjnych
46.
Przykłady najważniejszych patogenówopornych na antybiotyki
• Wielolekooporne szczepy Pseudomonas
aeruginosa oraz Acinetobacter baumanni –
szczególnie niebezpieczne są zwłaszcza te
szczepy, wśród których obserwuje się
oporność na karbapenemy
47.
Ogólne nazewnictwo szczepówopornych
• MDR – szczepy oporne na co najmniej 3 grupy
leków lub szczep wykazuje oporność na
kluczową grupę leków
• XDR – szczep wrażliwy na co najwyżej dwie
grupy leków
• PDR – szczep oporny na wszystkie leki
48.
Działania, które przyspieszają selekcjęszczepów opornych
• Stosowanie subterapeutycznych dawek
• Zbyt krótki czas leczenia
• Stosowanie antybiotyków miejscowo (są
wyjątki, kiedy jest to uzasadnione)
• Stosowanie antybiotyków o zbyt szerokim lub
zbyt wąskim zakresie działania
• Zbyt rzadkie zlecanie badań mikrobiologicznych
49.
Konieczność edukowania pacjentów• W 2010 roku Instytut Badawczy MillwardBrown
przeprowadził na zlecenie NPOA badanie opinii
publicznej na temat antybiotyków.
• 41% badanych uważało, że powinni otrzymać
antybiotyk z powodu grypy, a 20% z powodu
przeziębienia.
• 63% badanych uważa, że antybiotyki zabijają wirusy.
• 61%
badanych,
którzy
przerwali
kurację
antybiotykiem zrobiło to z powodu poprawy
samopoczucia.
50.
Rodzaje antybiotykoterapii• Antybiotykoterapia empiryczna
• Antybiotykoterapia celowana
• Antybiotykoterapia deeskalacyjna
• Antybiotykoterapia sekwencyjna
51.
Antybiotykoterapia empiryczna• Polega na rozpoczęciu leczenia przed
zidentyfikowaniem czynnika etiologicznego
i poznaniem jego indywidualnego profilu
wrażliwości na antybiotyki.
• Nie każda antybiotykoterapia empiryczna jest
racjonalna.
52.
Warunki racjonalnej antybiotykoterapiiempirycznej
• Znajomość
najczęstszych
czynników
etiologicznych danej choroby na danym
obszarze
• Wiedza
na
temat
ich
właściwości
mikrobiologicznych
• Wiedza na temat najczęstszego profilu
wrażliwości tych bakterii na antybiotyki
• Wiedza
na
temat
właściwości
farmakologicznych antybiotyków
53.
Antybiotykoterapia celowana• Jest poprzedzona identyfikacją czynnika
etiologicznego, który wywołał chorobę
zakaźną u konkretnego pacjenta, jego profilu
wrażliwości na antybiotyki.
• Polega
na
zastosowaniu
antybiotyku
najbardziej optymalnego dla danego rodzaju
zakażenia oraz dla danego drobnoustroju.
54.
Antybiotykoterapia celowana• Antybiotykoterapia celowana jest zawsze
zgodna z wynikiem posiewu z antybiogramem,
ale nie każda antybiotykoterapia zgodna
z wynikiem posiewu z antybiogramem jest
racjonalna!
55.
Antybiotykoterapia deeskalacyjna• Zamiana antybiotykoterapii empirycznej na
celowaną.
56.
Antybiotykoterapia sekwencyjna• Zamiana dożylnej antybiotykoterapii, na
doustny preparat tego samego antybiotyku,
w adekwatnej dawce.
57.
Posiew z antybiogramem• Materiał do badania mikrobiologicznego
powinien zostać pobrany przed podaniem
antybiotyku.
• Jeżeli podczas dożylnej antybiotykoterapii
zlecamy kolejne wykonanie posiewu krwi, to
krew powinna zostać pobrana tuż przed
podaniem kolejnej dawki antybiotyku!
• Powinno się pobierać jednoczasowo krew na
posiew z dwóch różnych wkłuć.
58.
Posiew z antybiogramem• W warunkach szpitalnych, jeżeli zlecasz
podanie antybiotyku, pobierz materiał na
posiew!
• Jeżeli nie zlecasz badania mikrobiologicznego,
a więc z góry wykluczasz możliwość
wyizolowania drobnoustroju, to w jakim celu
zlecasz antybiotyk?
59.
Posiew z antybiogramemJeżeli
otrzymujemy
wynik
posiewu
z antybiogramem, z którego wynika, że bakteria
jest wrażliwa na kilka antybiotyków to nie
znaczy, że każdy z tych antybiotyków będzie
równie dobrym wyborem.
60.
Przykład86-letni pacjent, leczony przewlekłe z powodu
nadciśnienia tętniczego i cukrzycy typu 2, został
przywieziony przez ZRM do Izby Przyjęć
z powodu duszności i zaburzeń świadomości,
które według relacji rodziny nasilają się od kilku
dni.
61.
Lekarz badający pacjenta w Izbie Przyjęćstwierdził gorączkę 39.6 stopni Celsjusza
tachykardia,
tachypnoe,
cechy
nacieku
zapalnego w badaniu przedmiotowym klatki
piersiowej. Pacjent przytomny, ale bez
prawidłowej orientacji auto- i allopsychicznej.
Postawił podejrzenie zapalenia płuc, zlecił
badania laboratoryjne oraz zdjęcie RTG klatki
piersiowej.
62.
W otrzymanych wynikach badań laboratoryjnych:CRP – 189 mg/l
Prokalcytonina – 8,6 ng/ml
Morfologia krwi obwodowej – leukocytoza
21 tys./mm3, w obrazie odsetkowym 87%
granulocytów obojętnochłonnych; w zakresie
układu czerwonokrwinkowego oraz płytek krwi bez
istotnych nieprawidłowości.
Bez cech niewydolności nerek i wątroby w
badaniach laboratoryjnych.
Radiolog opisał cechy zapalenia płuc w zdjęciu RTG
klatki piersiowej.
63.
Lekarz postawił rozpoznanie pozaszpitalnegozapalenia płuc, zlecił pobranie krwi i plwociny na
posiew, zdecydował o przyjęciu pacjenta do Oddziału
Chorób Wewnętrznych.
W ramach empirycznej antybiotykoterapii lekarz
zlecił ceftriakson w dawce 2 g dożylnie co 24 godziny.
64.
Czy decyzja o włączeniu antybiotykoterapii byłasłuszna?
65.
TAK66.
Po kilku dniach otrzymano wyniki posiewówz antybiogramem. Zarówno z próbek plwociny jak
i krwi wyhodowano Staphylococcus aureus
o następującym profilu wrażliwości:
Penicylina benzylowa
–R
Cefoksytyna
–S
Ceftriakson
–S
Amoksycylina z klawulanianem
–I
Kloksacylina
–S
Gentamycyna
–S
Kotrimoksazol
–S
Wankomycyna
–S
67.
Lekarz stwierdził, że skoro według wynikuposiewu bakteria jest wrażliwa na antybiotyk
stosowany dotychczas, to nie ma potrzeby
dokonywać zmiany w leczeniu.
Stan kliniczny pacjenta porównywalny ze stanem
przy
przyjęciu
do
szpitala,
natomiast
w badaniach laboratoryjnych umiarkowana
tendencja do normalizacji parametrów stanu
zapalnego (CRP – 145 mg/l; leukocytoza 16,8
tys./mm3).
68.
Czy decyzja o utrzymaniu dotychczasowegoantybiotyku była słuszna?
69.
NIE70.
Zgodnie z wynikiem posiewuetiologicznym był MSSA.
czynnikiem
Lekiem z wyboru w leczeniu zakażeń
wywołanych przez MSSA jest kloksacylina!
Decyzja o utrzymaniu leczenia za pomocą
ceftriaksonu mimo, że według antybiogramu
bakteria była na niego wrażliwa, była błędem
medycznym.
71.
Należy zauważyć, że MSSA jako czynniketiologiczny chorób jest tak samo groźny, może
wytwarzać takie same toksyny jak szczepy MRSA.
Jedyna różnica sprowadza się do wyboru
optymalnego antybiotyku.
72.
Skuteczność antybiotykuin vitro vs. in vivo
Od początku 2011 r. jako kryterium oporności
szczepów
Staphylococcus
aureus
na
wankomycynę przyjmuję się MIC > 4 µg/ml
(według EUCAST). Wcześniej stosowano
kryterium MIC > 16 µg/ml.
73.
Skuteczność antybiotykuin vitro vs. in vivo
W 2006 r. opublikowano wynik badania
przeprowadzonego na grupie 95 pacjentów,
cierpiących z powodu zapalenia płuc i/lub bakteriemii
o etiologii MRSA, leczonych wankomycyną.
Pacjentów podzielono na dwie grupy, ze względu na
wartość MIC wyhodowanych od nich szczepów S.
aureus (MIC < 1 vs. MIC = 2).
Hidayat LK et al. High-dose vankomycin therapy for
methicillin-resistant Staphylococcus aureus infections.
Efficacy and toxicity. Arch Intern Med 2006; 166:
2138-2144.
74.
Skuteczność antybiotykuin vitro vs. in vivo
W przypadku pacjentów od których wyizolowano
szczepy o większej wrażliwości na wankomycynę (MIC
< 1 µg/ml) leczenia za pomocą tego antybiotyku
okazało się klinicznie skuteczne u 85% pacjentów; w
tej grupie pacjentów śmiertelność wynosiła 10%.
W przypadku pacjentów od których wyizolowano
szczepy o mniejszej wrażliwości na wankomycynę
(MIC = 2 µg/ml) leczenia za pomocą tego antybiotyku
okazało się klinicznie skuteczne u 62% pacjentów; w
tej grupie pacjentów śmiertelność wynosiła 24%.
75.
Człowiek i bakterie• Kontaminacja – zanieczyszczenie
materiału biologicznego
próbki
• Kolonizacja – obecność drobnoustroju
w obrębie określonej niszy ekologicznej
organizmu człowieka, bez objawów infekcji
• Infekcja – choroba, a więc występują objawy
kliniczne oraz cechy infekcji w badaniach
dodatkowych
76.
Wskazaniem doantybiotykoterapii jest
infekcja!
77.
Kolonizacja bywa wskazaniemwyłącznie w ściśle określonych
sytuacjach.
78.
Profilaktyczne podawanie antybiotykujest wskazane wyłącznie w ściśle
określonych sytuacjach, głównie w
okresie okołooperacyjnym, w
szczególnych przypadkach.
79.
Jeżeli stosujesz antybiotyk wprofilaktyce, to w razie wystąpienia
objawów infekcji, nigdy nie stosuj tego
samego antybiotyku ze wskazań
leczniczych!
80.
Antybiotyki:• Nie są lekami przeciwgorączkowymi
• Nie są lekami uspokajającymi dla lekarza
dyżurnego
• Nie są lekami uspokajającymi dla rodziny
pacjenta
• Są lekami przeciwbakteryjnymi
81.
Przykład• 68-letnia pacjentka zgłosiła się do Izby Przyjęć
na podstawie skierowania wystawionego przez
lekarza rodzinnego. Pacjentka prywatnie
wykonała
posiew
moczu,
ponieważ
w
popularnonaukowym
programie
telewizyjnym usłyszała, że zakażenia układu
moczowego są poważnym problemem
medycznym.
• Z
moczu
wyhodowano
Pseudomonas
aeruginosa, oporny na wszystkie antybiotyki
ujęte w badaniu, z wyjątkiem karbapenemów.
82.
• W wywiadzie: stan po OZW STEMI 3 lata temu,leczonym za pomocą PCI, NT, DM t. 2.
• Leki
na
stałe:
bisoprolol,
ramipryl,
metformina,
kwas
acetylosalicylowy,
atorwastatyna.
• Pacjentka nie zgłasza żadnych dolegliwości.
Zgłosiła się jedynie z powodu zaniepokojenia
otrzymanym wynikiem.
• Neguje ból i pieczenie przy oddawaniu moczu,
gorączkę
i
stany
podgorączkowe
w poprzednich dniach, naglące parcie na
mocz, etc.
83.
• W badaniu przedmiotowym nad polami płucnymiszmer pęcherzykowy symetryczny, wypuk jawny,
drżenie głosowe symetryczne prawidłowe.
• ASM ok. 62 na minutę zgodna z tętnem
obwodowym.
• Brzuch miękki niebolesny bez patologicznych
oporów i objawów otrzewnowych. Perystaltyka
osłuchowo prawidłowa. Wypuk bębenkowy.
• Objawy Goldflama i Chełmońskiego obustronnie
ujemne.
• Skóra różowa, prawidłowo ucieplona. Bez wysypek,
wybroczyn i innych niepokojących zmian.
• Temperatura ciała 36.6 stopni Celsjusza
84.
• Lekarzzlecił
badania
laboratoryjne:
morfologię
krwi
obwodowej,
CRP,
prokalcytoninę,
elektrolity,
glukozę,
kreatyninę, ALT i AST, badanie ogólne moczu.
85.
Otrzymał następujące wyniki:• CRP – 2 mg/l
• Prokalcytonina – 0,01 ng/ml
• W morfologii krwi obwodowej: leukocytoza 8
tys./mm3 z prawidłowym wzorem odsetkowym,
pozostałe parametry w normie
• Kreatynina – 0,8 mg/dl, eGFR > 60 ml/min
• Na – 138 mmol/l; K – 4,5 mmol/l
• ALT – 21; AST – 32
• Glukoza – 139 mg%
• W badaniu ogólnym moczu „dość liczne
bakterie” w osadzie moczu
86.
Czy są wskazania dohospitalizacji?
87.
NIE88.
Czy są wskazania doantybiotykoterapii w
warunkach
ambulatoryjnych?
89.
NIE90.
Kolonizacja jako wskazanie doantybiotykoterapii - przykłady
1. Eradykacja Helicobacter pylori
2. Nosicielstwo Staphylococcus aureus w przedsionku
nosa u pacjentów przed planowymi zabiegami
w zakresie kardiochirurgii i torakochirurgii
3. Bezobjawowy bakteriomocz u ciężarnej
4. Bezobjawowy bakteriomocz u pacjentów przed
zabiegami w zakresie urologii
91.
Ostre zapalenie gardła i migdałków etiologia• U dorosłych w 90-95% przypadków wirusy,
w 5-10% przypadków bakterie.
• Spośród bakterii najczęstszymi czynnikami
etiologicznymi są Streptococcus pyogenes
(PBHA), Fusobacterium necrophorum, rzadziej
paciorkowce grupy C i G, Arcanobacterium
haemolyticum.
• Staphylococcus aureus izolowany z posiewów
gardła nie jest przyczyną zapalenia migdałków.
92.
Streptococcus pyogenes• Ziarniaki Gram-dodatnie, o średnicy 1-2 µm,
tworzące łańcuszki
• Czynniki determinujące chorobotwórczość: białko
M, białko F, białko G, otoczka hialuronowa,
wielocukier C i antygeny błony cytoplazmatycznej,
toksyny erytrogenne, egzotoksyna A, egzotoksyna B,
toksyna sercowo-wątrobowa, streptolizyny, czynniki
rozprzestrzeniania
(hialuronidaza,
proteinazy,
streptokinaza, nukleazy)
93.
Streptococcus pyogenes• Powikłania zakażenia Streptococcus pyogenes:
gorączka reumatyczna, ostre paciorkowcowe
kłębuszkowe zapalenie nerek, rumień guzowaty.
• Postaci kliniczne zakażenia Streptococcus pyogenes:
ostre zapalenie gardła i angina, ropne zapalenie
skóry i liszajec, róża, cellulitis, gorączka połogowa,
martwicze zapalenie powięzi, zapalenie ucha
środkowego, zapalenie zatok, zapalenie wyrostka
robaczkowego, bakteriemia, zapalenie płuc, płonica,
paciorkowcowy zespół wstrząsu toksycznego.
94.
Ostre zapalenie gardła i migdałków diagnostyka• Najważniejszy
jest
badanie
przedmiotowe
i dokładny wywiad!
• W ocenie prawdopodobieństwa etiologii PBHA
pomgada skala Centora w modyfikacji McIsaaca.
• Można wykonać szybki test na obecność antygenu
PBHA oraz posiew wymazu z gardła.
• Posiewu wymazu z gardła nie wykonuje się w razie
ewidentnych objawów zakażenia wirusowego
(współistniejący nieżyt nosa, kaszel, zapalenie
spojówek).
95.
Ostre zapalenie gardła i migdałków – obrazkliniczny w przypadku etiologii PBHA
• Nie występuje zazwyczaj nieżyt nosa i kaszel
• Nagły początek
• Silny ból gardła i ból podczas połykania
• Gorączka > 38 stopni Celsjusza
• Skupiska wysięku na migdałkach
• Obrzęknięty języczek podniebienny i migdałki
• Tkliwe, powiększone węzły chłonne szyjne przednie
• Najczęściej występuje w wieku 5-15 lat, zimą
i wczesną wiosną
96.
Ostre zapalenie gardła i migdałków – obrazkliniczny w przypadku etiologii wirusowej
• Stan podgorączkowy lub prawidłowa temperatura
ciała
• Dodatkowo bóle mięśni, stawów
• Kaszel, chrypka, nieżyt nosa
• Ból gardła mniej nasilony
• Zapalenie spojówek
• Jeżeli występuje powiększenie węzłów chłonnych, to
głównie szyjnych tylnych
97.
Ostre zapalenie gardła i migdałków –przebieg naturalny
• Ostre zapalenie gardła w większości
przypadków ustępuje samoistnie, nawet jeśli
jest o etiologii bakteryjnej.
• Zapalenie wirusowe trwa zwykle 3-7 dni.
• Zapalenie o etiologii PBHA trwa zwykle 3-4
dni, nawet bez antybiotyku.
• Rokowanie jest dobre. Powikłania u dorosłych
zdarzają się bardzo rzadko, nawet w przypadku
etiologii bakteryjnej bez leczenia za pomocą
antybiotyku.
98.
Ostre zapalenie gardła i migdałków –antybiotykoterapia
• Tylko w razie istnienia wskazań!
• Lek pierwszego wyboru:
Penicylina fenoksymetylowa (p.o.)
500 mg co 12 godzin przez 10 dni =
1 mln IU co 12 godzin przez 10 dni
• Leki drugiego wyboru:
Cefadroksyl (p.o.)
1 g co 24 godziny przez 7-10 dni
Cefaleksyna (p.o.)
750 mg co 12 godzin przez 7-10 dni
99.
Ostre zapalenie gardła i migdałków –leczenie
• Jeżeli podejrzewamy, że chory może nie
stosować się do zaleceń, można zastosować:
Penicylina benzatynowa (i.m.)
1,2 mln IU jednorazowo
100.
Ostre zapalenie gardła i migdałków –leczenie
• U chorych z nadwrażliwością typu I na penicyliny –
antybiotyk makrolidowy:
Cykliczny węglan erytromycyny (p.o.)
500 mg co 12 godzin przez 10 dni
Klarytromycyna (p.o.)
250 mg co 12 godzin przez 10 dni lub
500 mg w postaci o zmodyfikowanym uwalnianiu co
24 godziny przez 5 dni
Azytromycyna (p.o.)
500 mg 1. dnia, 250 mg co 24 godziny przez 4 kolejne
dni
101.
Ostre zapalenie gardła i migdałków –leczenie
• Do tej pory nie stwierdzono szczepów
Streptococcus pyogenes opornych na penicylinę
fenoksymetylową.
• Oporność PBHA na makrolidy szybko narasta,
więc nigdy nie stosujemy ich jako lek pierwszego
rzutu bez przeciwwskazań do podania penicyliny.
• Nigdy w ostrym zapaleniu gardła nie stosuje się:
kotrimoksazolu,
tetracyklin
ani
aminoglikozydów!
102.
Ostre zapalenie gardła i migdałków –leczenie
• W razie braku skuteczności klinicznej
przedstawionego schematu antybiotykoterapii
możemy podejrzewać zakażenie szczepem
opornym lub mniej typową etiologię zakażenia
(np. Arcanobacterium hemolyticum). Wówczas
można rozważyć zastosowanie:
Klindamycyna (p.o.)
150 mg co 6 godzin przez 10 dni
lub
300 mg co 12 godzin przez 10 dni
103.
Ostre zapalenie gardła i migdałków –leczenie
• W razie podejrzenia zakażenia, wywołanego
przez wirus opryszczki zwykłej HSV-1:
Acyklowir (p.o.)
200 mg 5xdz.
104.
Antybiotyki β-laktamowe1. Penicyliny
2. Cefalosporyny
3. Karbapenemy
4. Monobaktamy
105.
Antybiotyki β-laktamowe –mechanizm działania
• Wiążą się z białkami wiążącymi penicylinę PBP
• Hamują transpeptydację, która jest ostatnim etapem
biosyntezy peptydoglikanu
• Transpeptydacja polega na tworzeniu wiązań
krzyżowych pomiędzy cząsteczkami peptydoglikanu
• Część polisacharydowa peptydoglikanu składa się na
przemian z cząsteczek N-acetyloglukozaminy i kwasu Nacetylomuraminowego
• Część peptydowa zbudowana jest z 5 aminokwasów,
połączonych
z
cząsteczką
kwasu
Nacetylomuraminowego; końcowy fragment to Dalanylo-D-alanina
106.
Antybiotyki β-laktamowe –mechanizmy oporności
• Inaktywacja antybiotyku przez bakteryjne betalaktamazy
• Modyfikacja struktury docelowych PBP
• Upośledzenie penetracji antybiotyku do docelowych
PBP
• Aktywne usuwanie antybiotyku z wnętrza komórek
bakteryjnych
107.
Penicyliny1. Penicyliny naturalne (postaci o standardowym
uwalnianiu, postaci o przedłużonym działaniu)
2. Penicyliny
penicylinazooporne
„przeciwgronkowcowe”)
(czyli
3. Penicyliny o poszerzonym spektrum działania
tzw.
108.
Penicyliny naturalne wraz z postaciamio przedłużonym działaniu
1) Penicylina
benzylowa
(penicylina
benzylopenicylina)
2) Penicylina fenoksymetylowa (penicylina
fenoksymetylopenicylina)
3) Penicylina prokainowa
4) Penicylina benzatynowa
G,
V,
109.
Spektrum penicylin naturalnych• Największa aktywność wobec bakterii Gramdodatnich, Gram-ujemnych ziarniaków oraz
beztlenowców, nieprodukujących beta-laktamaz.
Niewielka aktywność wobec pałeczek Gramujemnych. Są łatwo rozkładane przez betalaktamazy.
• Penicyliny o przedłużonym działaniu (prokainowa,
benzatynowa) mają identyczne spektrum jak
penicylina G – różnica polega jedynie na zupełnie
innej farmakokinetyce.
110.
Penicylina benzylowa• Jest rozkładana w kwaśnym środowisku soku
żołądkowego
• Może być podawana wyłącznie dożylnie
• Krótki okres półtrwania, ok. 30 minut
• Stosowana w 4-6 dawkach podzielonych
• Sole penicyliny G w postaci suchego proszku są
stabilne przez wiele lat w temp. 4 st. C; po
rozpuszczeniu szybką tracą aktywność
111.
Penicylina fenoksymetylowa• Jest stabilna w kwaśnym środowisku soku
żołądkowego
• Stosowana doustnie
• W Polsce jest dostępna w tabletkach oraz w
zawiesinie doustnej pod nazwą handlową Ospen
• Tabletki: Ospen 1000 (1 mln j.m.); Ospen 1500 (1.5
mln j.m.) (12 tabl. lub 30 tabl. w opakowaniu)
• Zawiesina doustna: Ospen 750 (0.75 mln j.m./5 ml)
(60 ml lub 150 ml w opakowaniu)
112.
Penicyliny przeciwgronkowcowe• Metycylina
• Nafcylina
• Penicyliny
izoksazoilowe
(oksacylina,
kloksacylina, flukloksacylina, dikloksacylina)
113.
Penicyliny przeciwgronkowcowe• W
Polsce
spośród
penicylin
penicylinazoopornych,
czyli
przeciwgronkowcowych, jedyną dostępną
substancją jest kloksacylina, pod nazwą
handlową Syntarpen.
• Syntarpen – tabletki 500 mg
• Syntarpen – proszek do sporządzenia roztworu
do wstrzykiwań; fiolka 1 g
114.
W zakażeniach wywołanychprzez MSSA lekiem z wyboru
jest kloksacylina!
115.
Penicyliny o poszerzonym spektrumdziałania
1) Aminopenicyliny – ampicylina, amoksycylina
2) Ureidopenicyliny – piperacylina
3) Karboksypenicyliny – karbenicylina,
tykarcylina
116.
Cefalosporyny• I generacja – cefazolina, cefaleksyna, cefadroksyl
• II generacja – cefuroksym, aksetyl cefuroksymu,
cefaklor
• III generacja – ceftriakson, cefotaksym,
ceftazydym
• IV generacja – cefepim
• V generacja – fosamil ceftaroliny
117.
Monobaktamy• Jedynym przedstawicielem jest aztreonam
• Monocykliczny pierścień β-laktamowy
• Aktywne jedynie wobec tlenowych bakterii
Gram-ujemnych
• Odporne na działanie większości β-laktamaz, z
wyjątkiem AmpC β-laktamaz oraz ESBL
118.
Karbapenemy• Imipenem zawsze w połączeniu z cilastatyną
w stosunku 1:1
• Meropenem
• Ertapenem
• Dorypenem
• Szerokie spektrum: aktywne wobec wielu
pałeczek Gram-ujemnych, bakterii Gramdodatnich oraz beztlenowców
119.
Nieżyt nosa i zatok przynosowych klasyfikacja• Ostry – trwa poniżej 12 tygodni; jeżeli jest
wywołany zakażeniem wirusowym, to najczęściej
trwa mniej niż 7 dni
• Przewlekły – trwa powyżej 12 tygodni, może być
z polipami nosa lub bez polipów; przebiega
z okresami zaostrzeń i remisji
120.
Ostry nieżyt nosa i zatok przynosowych etiologia• Rynowirusy – około 50% przypadków
• Inne wirusy
• Streptococcus pneumoniae
• Hemophilus influenzae
• Moraxella catharrhalis
• Rzadziej inne bakterie lub grzyby
121.
Ostry nieżyt nosa i zatok przynosowych –obraz kliniczny
• Wyciek wodnistej, śluzowej lub ropnej wydzieliny
z nosa
• Spływanie wydzieliny po tylnej ścianie gardła,
powodujące kaszel
• Ból głowy, uczucie rozpierania w okolicy zajętej
zatoki
• Gorączka lub stan podgorączkowy
• Tkliwość uciskowa okolicy chorej zatoki
• Zaostrzenie objawów po 5 dniach lub czas trwania
powyżej 10 dni sugerują nadkażenie bakteryjne
122.
Ostry nieżyt nosa i zatok przynosowych –wskazania do antybiotykoterapii
Wskazaniem do rozpoczęcia antybiotykoterapii jest
ciężki przebieg choroby, przez co należy rozumieć
występowanie co najmniej 3 z następujących:
1) ropna wydzielina po jednej stronie
2) ostry miejscowy ból bardziej nasilony po
jednej stronie
3) gorączka powyżej 38 stopni C
4) przyspieszony OB lub zwiększone stężenie CRP
5) pogorszenie po łagodnej fazie choroby
123.
Ostry nieżyt nosa i zatok przynosowych –antybiotykoterapia
• Lek pierwszego wyboru:
Amoksycylina (p.o.)
1.5 – 2 g co 12 godzin przez 7-10 dni
• Leki drugiego wyboru:
Klarytromycyna (p.o.)
500 mg co 12 godzin
Azytromycyna (p.o.)
250 – 500 mg co 24 godziny przez 3 dni
lub
2 g w dawce jednorazowej
124.
Ostry nieżyt nosa i zatok przynosowych –antybiotykoterapia
• Leki drugiego wyboru:
Lewofloksacyna (p.o.)
500 mg co 24 godziny
Moksyfloksacyna (p.o.)
400 mg co 24 godziny
• W razie nieskuteczności leczenia – amoksycylina z
kwasem klawulanowym w takiej dawce, aby dawka
amoksycyliny wynosiła j.w.
125.
Błonica – podstawowe informacje• Corynebacterium diphteriae – Gram-dodatnia,
bezotoczkowa
pałeczka
tlenowa
nieprzetrwalnikująca
• Bakterie namnażają się we wrotach zakażenia,
wytwarzają
egzotoksynę,
która
powoduje
zahamowanie syntezy białka, śmierć komórek
i powstanie błon rzekomych
• Może dojść do uszkodzenia serca, nerek i OUN
• Szczepy niewytwarzające egzotoksyny wywołują
chorobę inwazyjną
126.
Błonica – leczenie• Uwaga! Każdy pacjent z podejrzeniem błonicy
wymaga
hospitalizacji
w
warunkach
intensywnego nadzoru.
• Antytoksyna końska:
1) błonica gardła lub krtani: 20 tys. – 40 tys. j. i.v.
2) błonica nosogardła: 40 tys. – 60 tys. j. i.v.
3) ciężki przebieg lub późne włączenie leczenia:
80 tys. – 120 tys. j. i.v.
127.
Błonica – antybiotykoterapiaPenicylina prokainowa (i.m.)
12 500 – 25 000 IU/kg m.c. co 12 godzin,
maks. 1.2 mln IU/dobę
lub
Erytromycyna (i.v. lub p.o.)
10 – 12.5 mg/kg m.c. co 6 godzin
Antybiotykoterapia trwa 14 dni
Alternatywnie dla ww. antybiotyków można
zastosować ryfampicynę lub klindamycynę
128.
Błonica – profilaktyka poekspozycyjnaosób z kontaktu
• Przypominająca dawka szczepienia, jeśli od
zaszczepienia minęło co najmniej 5 lat
• Po
pobraniu
materiału
do
badania
mikrobiologicznego, erytromycyna p.o. przez
7-10 dni lub pojedyncza dawka penicyliny
benzatynowej 1.2 mln IU i.m. u osób powyżej
6 r.ż. oraz 0.6 mln IU i.m. u osób poniżej 6 r.ż.
129.
Ostre zapalenie oskrzeli – definicja• Ostre zakażenie układu oddechowego z kaszlem
trwającym mniej niż 3 tygodnie rozpoznawane
po wykluczeniu zapalenia płuc.
• Przeciwko zapaleniu płuc przemawiają: liczba
oddechów poniżej 24 na minutę, akcja serca
poniżej 100 na minutę, temperatura poniżej 38
stopni Celsjusza, brak cech nacieku zapalnego
w badaniu przedmiotowym klatki piersiowej.
130.
Ostre zapalenie oskrzeli – etiologia• W ponad 90% przypadków za ostre zapalenie
oskrzeli odpowiada infekcja wirusowa – wirusy
grypy A i B, paragrypy, RSV, koronawirusy,
adenowirusy i rynowirusy.
• Najczęstszymi
bakteryjnymi
czynnikami
etiologicznymi są Bordetella pertussis,
Mycoplasma pneumoniae i Chlamydophila
pneumoniae.
131.
Ostre zapalenie oskrzeli – obrazkliniczny
• Objawy podmiotowe: gorączka, ból mięśni, kaszel
odkrztuszanie śluzowej lub ropnej wydzieliny,
czasami świszczący oddech.
• Objawy przedmiotowe: możliwe świsty i furczenia
nad polami płucnymi, w badaniu przedmiotowym
klatki piersiowej może nie być odchyleń;
przejściowo może wystąpić nadreaktywność
oskrzeli.
• Choroba zwykle ustępuje samoistnie.
132.
Ostre zapalenie oskrzeli – leczenie• Wskazaniem do stosowania antybiotyku jest
jedynie ostre zapalenie oskrzeli w przebiegu
krztuśca.
• Poza tym stosuje się leczenie objawowe – leki
przeciwkaszlowe, przeciwgorączkowe, ew. betamimetyki w razie cech nadreaktywności oskrzeli.


































































































































 medicine
medicine








