Similar presentations:
Подтверждение антимикробной эффективности дезинфицирующих средств
1.
Евразийская Академия надлежащих практикgxp-academy.org
Практическое занятие по теме:
Подтверждение антимикробной эффективности
дезинфицирующих средств
Чернявская Ася Анатольевна
Заместитель генерального директора испытательной лаборатории «Микробиолог»
Москва
2022
2.
Юридическая информацияgxp-academy.org
Настоящая презентация не является и не может считаться консультацией по правовым, налоговым или
иным вопросам и не заменяет собой независимое заключение.
Настоящим не предоставляется никаких гарантий, заверений или обязательств, явно выраженных или
подразумеваемых, в отношении справедливости, точности, полноты и правильности сведений или
заключений, содержащихся в настоящей презентации, поскольку настоящая презентация подготовлена
в качестве вспомогательного материала для целей деятельности АНО «ЕАНП».
Лицо, вниманию которого представлена изложенная в настоящей презентации информация, несет
ответственность за самостоятельное изучение, анализ такой информации и принятие решений, и не
должно использовать ее в качестве безоговорочного основания для принятия решений, заключения
договоров, принятия на себя обязательств или совершения юридических действий.
Информация, содержащаяся в настоящей презентации, предназначена для слушателей (студентов)
Академии. Не допускается копирование, воспроизведение или распространение такой информации в
каком бы то ни было формате без явно выраженного письменного согласия правообладателя
настоящей презентации - АНО «ЕАНП» (ОГРН 1217700086504).
3.
Заданиеgxp-academy.org
В целях совершенствования дезинфекционной деятельности, в рамках процедуры очистки
производственных помещений и технологического оборудования компанией инициирован
подбор
нового
дезинфицирующего
средства,
обладающего
антимикробной
эффективностью в невысоких концентрациях.
Среди представленных на рынке дезинфицирующих средств подобрано средство,
работающее в невысокой концентрации 0,01 %, что соответствует поставленной задаче.
Но в инструкции по применению данного средства указано, что для 0,01 % концентрации
раствора необходимо выдерживать время экспозиции 30 минут.
Для оптимизации временных затрат, руководством компании дано задание лаборатории
провести испытания по определению антимикробной эффективности нового
дезинфектанта при более коротком времени экспозиции
(15 минут) без увеличения концентрации (0,01 %).
По итогам проведенных испытаний лаборатория должна сделать
заключение об эффективности и применимости нового
дезинфектанта.
4.
Выбор методаgxp-academy.org
Для
первичного
(принципиального)
определения
антимикробной
эффективности дезинфицирующих средств применим суспензионный метод,
приведенный в P 4.2.3676-20
«Методы контроля. Биологические и
микробиологические факторы. Методы лабораторных исследований и
испытаний дезинфекционных средств для оценки эффективности и
безопасности»
Лабораторией принято решение проведения испытания суспензионным
методом согласно P 4.2.3676-20
5.
Алгоритм испытанияgxp-academy.org
1. Приготовить 0,01% раствор дезинфицирующего средства
6.
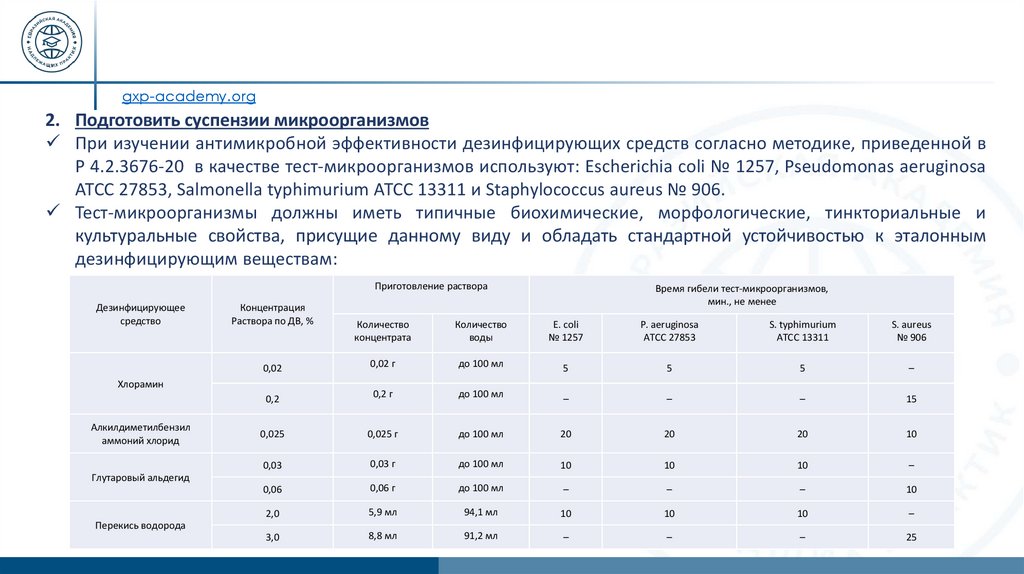
gxp-academy.org2. Подготовить суспензии микроорганизмов
При изучении антимикробной эффективности дезинфицирующих средств согласно методике, приведенной в
P 4.2.3676-20 в качестве тест-микроорганизмов используют: Escherichia coli № 1257, Pseudomonas aeruginosa
АТСС 27853, Salmonella typhimurium АТСС 13311 и Staphylococcus aureus № 906.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные и
культуральные свойства, присущие данному виду и обладать стандартной устойчивостью к эталонным
дезинфицирующим веществам:
Приготовление раствора
Дезинфицирующее
средство
Концентрация
Раствора по ДВ, %
Количество
концентрата
Количество
воды
Е. coli
№ 1257
P. aeruginosa
ATCC 27853
S. typhimurium
АТСС 13311
S. aureus
№ 906
0,02
0,02 г
до 100 мл
5
5
5
–
0,2
0,2 г
до 100 мл
–
–
–
15
0,025
0,025 г
до 100 мл
20
20
20
10
0,03
0,03 г
до 100 мл
10
10
10
–
0,06
0,06 г
до 100 мл
–
–
–
10
2,0
5,9 мл
94,1 мл
10
10
10
–
3,0
8,8 мл
91,2 мл
–
–
–
25
Хлорамин
Алкилдиметилбензил
аммоний хлорид
Время гибели тест-микроорганизмов,
мин., не менее
Глутаровый альдегид
Перекись водорода
7.
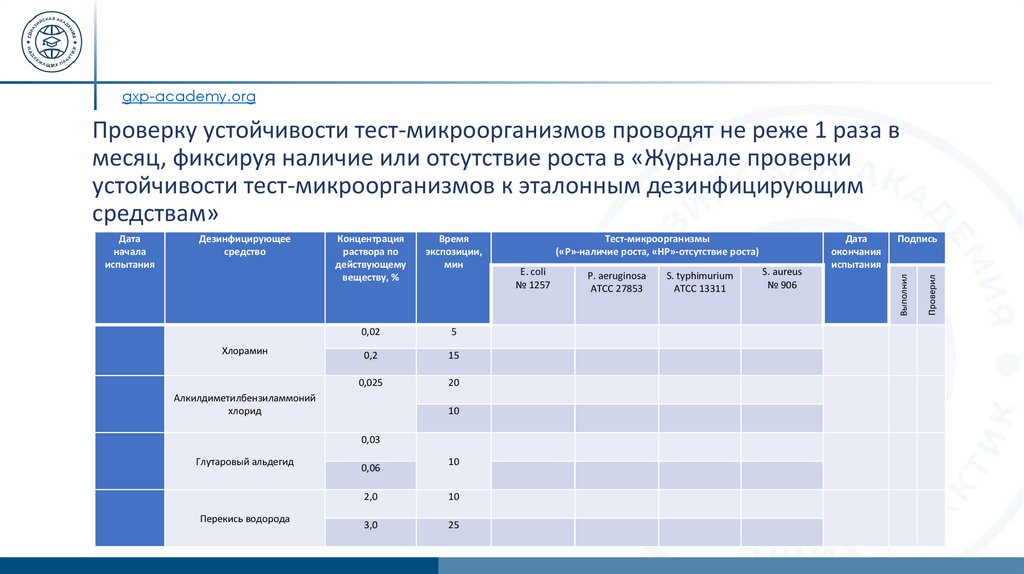
gxp-academy.orgПроверку устойчивости тест-микроорганизмов проводят не реже 1 раза в
месяц, фиксируя наличие или отсутствие роста в «Журнале проверки
устойчивости тест-микроорганизмов к эталонным дезинфицирующим
средствам»
Хлорамин
Концентрация
раствора по
действующему
веществу, %
Время
экспозиции,
мин
0,02
5
0,2
15
0,025
20
Алкилдиметилбензиламмоний
хлорид
10
0,03
Глутаровый альдегид
Перекись водорода
0,06
10
2,0
10
3,0
25
Тест-микроорганизмы
(«Р»-наличие роста, «НР»-отсутствие роста)
E. coli
№ 1257
P. aeruginosa
ATCC 27853
S. typhimurium
АТСС 13311
S. aureus
№ 906
Дата
окончания
испытания
Подпись
Проверил
Дезинфицирующее
средство
Выполнил
Дата
начала
испытания
8.
gxp-academy.orgУстойчивость тест-микроорганизмов к эталонным дезинфицирующим средствам определяют
методом батистовых тест-объектов:
Подготовка батистовых тест-объектов:
кусок батиста погрузить на 24 ч в холодную воду для удаления аплитуры, крахмала, после чего его тщательно
постирать с мылом, прокипятить и просушить утюгом. С помощью иглы в приготовленной куске ткани выдернуть
нитки в продольном направлении на расстоянии 11 мм друг от друга, а в поперечном-на расстоянии 6 мм и по этим
линиям разрезать батист на тест-объекты. Тест-объекты простерилизовать при (120±1) 0 С в течение 20 мин.
Контаминация батистовых тест-объектов:
Суточные культуры E. coli, S.aureus, P aeruginosa, S.typhimurium, выросшие на скошенном питательном агаре, смыть
стерильной водой и довести до концентрации 2×109 КОЕ/мл по стандарту мутности.
Стерильные батистовые тест-объекты в чашке Петри залить суспензией тест-микроорганизма из расчета 0,5 мл на 1
тест-объект, равномерно смачивая все тест-объекты. Чашку Петри закрыть крышкой и оставить на 20 мин.
В асептических условиях батистовые тест-объекты, пропитанные суспензией тест-микроорганизмов, перенести на
поверхность стерильной фильтровальной бумаги (2-4 слоя на дне чашки Петри), прикрыть их сверху стерильной
фильтровальной бумагой и закрыть чашку Петри крышкой.
Через 10 мин после удаления избытка жидкости тест-объекты перенести на поверхность сухой стерильной
фильтровальной бумаги в чашке Петри, сверху прикрыть стерильным листом фильтровальной бумаги и подсушить в
термостате при 37 0 С в течение 20 мин с приоткрытой крышкой.
Хранить контаминированные батистовые тест-объекты в чашках Петри в холодильнике при температуре 4 0 С. Срок
хранения тест объектов, контаминированных E. coli, P. aeruginosa, S.typhimurium – 1 сутки, S.aureus-4 суток.
9.
gxp-academy.orgПостановка опыта:
В стерильную колбу пипеткой внести 1 мл приготовленного эталонного дез. средства (из расчета по 0,5
мл на каждый тест-объект);
Не касаясь краев колбы опустить в дез. средство с помощью стерильного пинцета 2 тест-объекта;
Покачивая колбу, смочить тест-объекты;
Отсчет времени воздействия эталонного дез. средства начать с момента смачивания всех тест-объектов;
Через установленные интервалы времени стерильным пинцетом извлечь 2 тест-объекта из колбы и
погрузить в пробирки с 5 мл стерильного раствора соответствующего нейтрализатора;
Через 5 минут тест-объекты перенести в пробирку с 5 мл стерильной воды;
Через 5 минут каждый из двух тест-объектов по отдельности перенести в пробирки с 5 мл питательного
бульона;
Контролем являются 2 тест-объекта, погруженные на весь период испытания в раствор нейтрализатора,
и 2 тест-объекта, погруженные на этот же срок в стерильную воду, которые по окончанию испытания
необходимо перенести в питательный бульон;
Посевы инкубировать в термостате при 37 0 С;
Результаты оценить качественно по отсутствию/наличию роста тест-микроорганизмов в жидкой
питательной среде.
10.
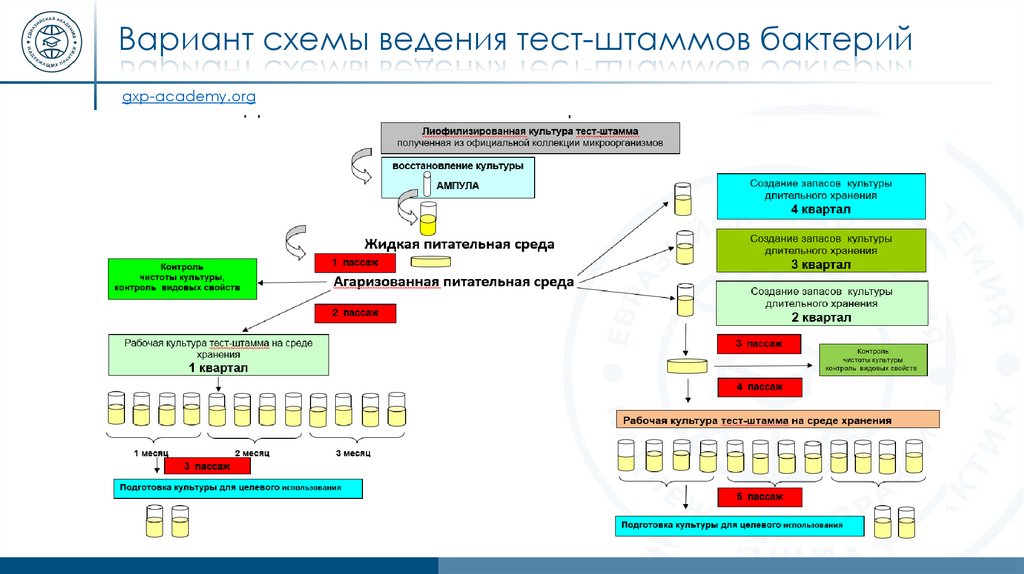
Вариант схемы ведения тест-штаммов бактерийgxp-academy.org
11.
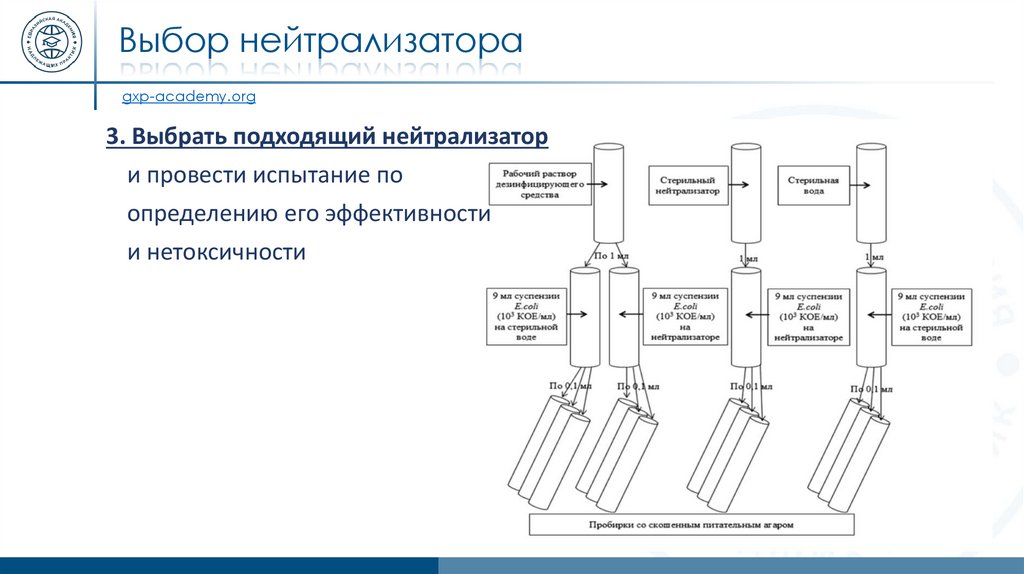
Выбор нейтрализатораgxp-academy.org
3. Выбрать подходящий нейтрализатор
и провести испытание по
определению его эффективности
и нетоксичности
12.
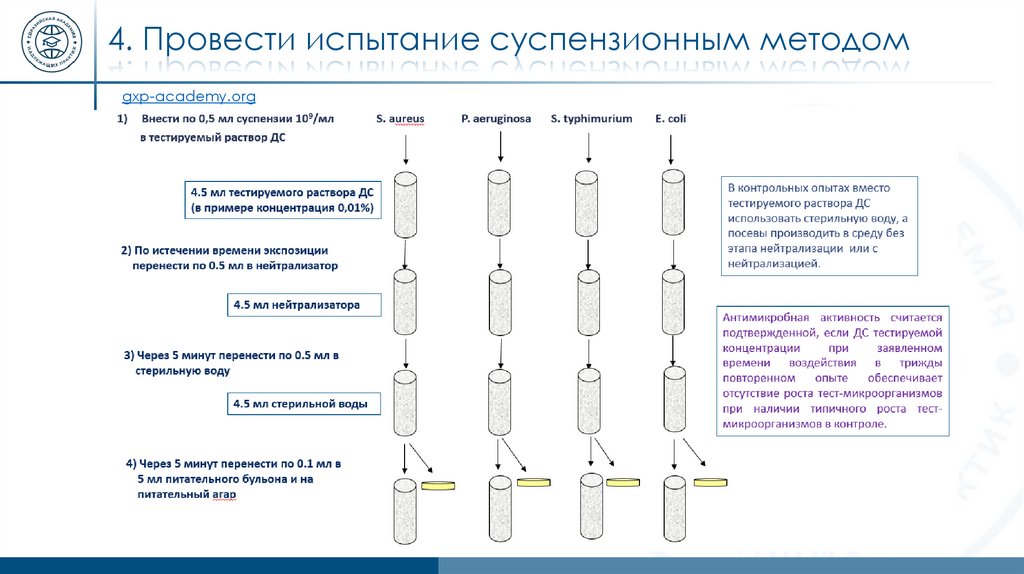
4. Провести испытание суспензионным методомgxp-academy.org
13.
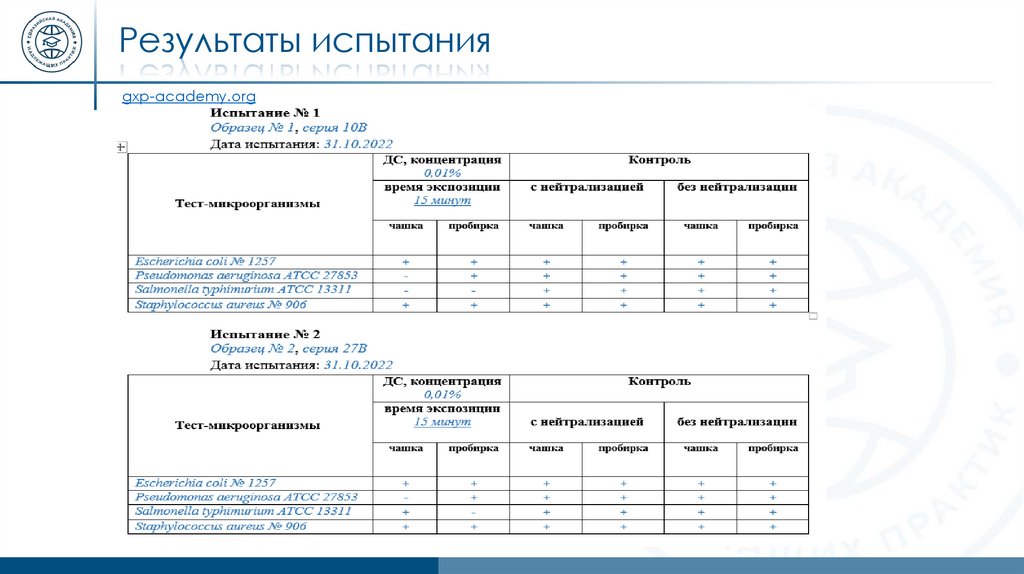
Результаты испытанияgxp-academy.org
14.
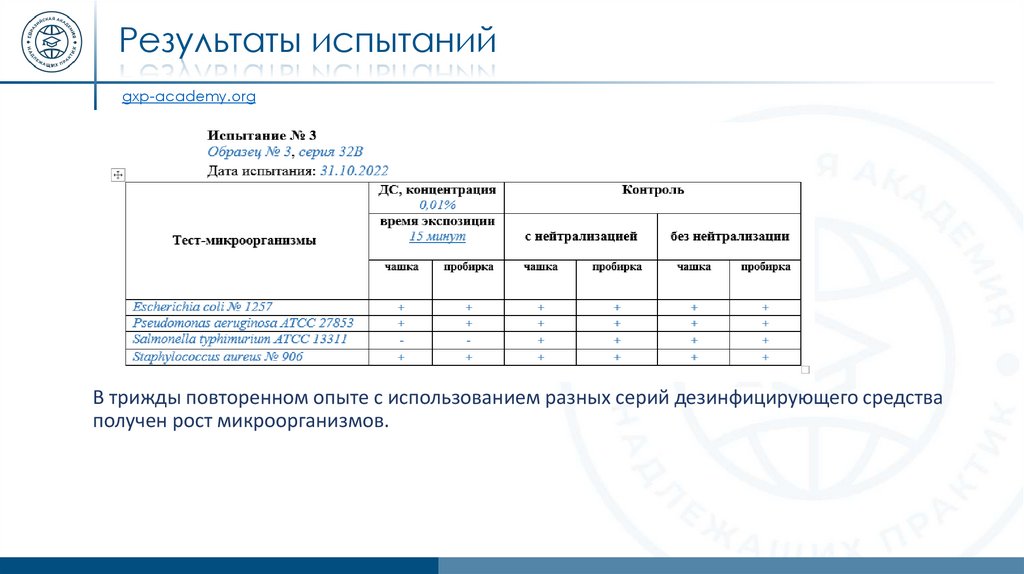
Результаты испытанийgxp-academy.org
В трижды повторенном опыте с использованием разных серий дезинфицирующего средства
получен рост микроорганизмов.
15.
Заключение лабораторииgxp-academy.org
Антимикробная эффективность не
подтверждена.
Дезинфицирующее средство
неэффективно и неприменимо к
использованию.
16.
Насколько правильное заключение сделала лаборатория?gxp-academy.org
17.
Заключениеgxp-academy.org
Если при более коротком, чем заявлено в инструкции по применению,
времени экспозиции в опыте получен отрицательный результат, это не
означает, что дезинфицирующее средство не эффективно. Это лишь
указывает на то, что дезинфектант неэффективен в данных условиях
эксперимента и не сможет обеспечить поставленные в примере цели по
оптимизации временных затрат на процесс очистки.
Однозначный вывод о неэффективности дезинфицирующего средства можно
сделать только если не подтверждена его антимикробная эффективность в
режимах дезинфекции (концентрация и время экспозиции), заявленных в
инструкции по применению.
18.
Евразийская Академия надлежащих практикgxp-academy.org
Спасибо за внимание!
Будем рады получить от Вас обратную связь по
пройденному материалу: info@gxp-academy.org











 law
law industry
industry








