Similar presentations:
Основы ферментативной кинетики
1.
Основы ферментативной кинетики2. Ферментативная кинетика
• Изучает скорость ферментативныхреакций в зависимости от:
• -вида субстрата (специфичность
фермента),
• -концентрации субстрата,
• -концентрации фермента,
• -температуры,
• -pH,
• -наличия или отсутствия активаторов и
ингибиторов
3. Зависимость скорости ферментативной реакции от типа субстрата (специфичность ферментов)
ВИДЫ СПЕЦИФИЧНОСТИ:• Абсолютная
(Пример: аргиназа действует только на
аргинин)
• Относительная
(Пример: пепсин действует на многие
пищевые белки)
• Стереоспецифичность
(Пример: оксидаза L-аминокислот действует
только на L, но не на D-аминокислоты)
4. Enzyme kinetics. “lock-and-Key” theory.
Enzyme kinetics. “lock-and-Key”Механизм действия ферментов. Теория ключа и замка
theory.
Эмиль Фишер
5. Механизм действия ферментов. Теория индуцированного соответствия
Даниэл Кошланд6. Зависимость скорости ферментативной реакции от концентрации субстрата
Леонор МихаэлисМауд Леонора Ментен
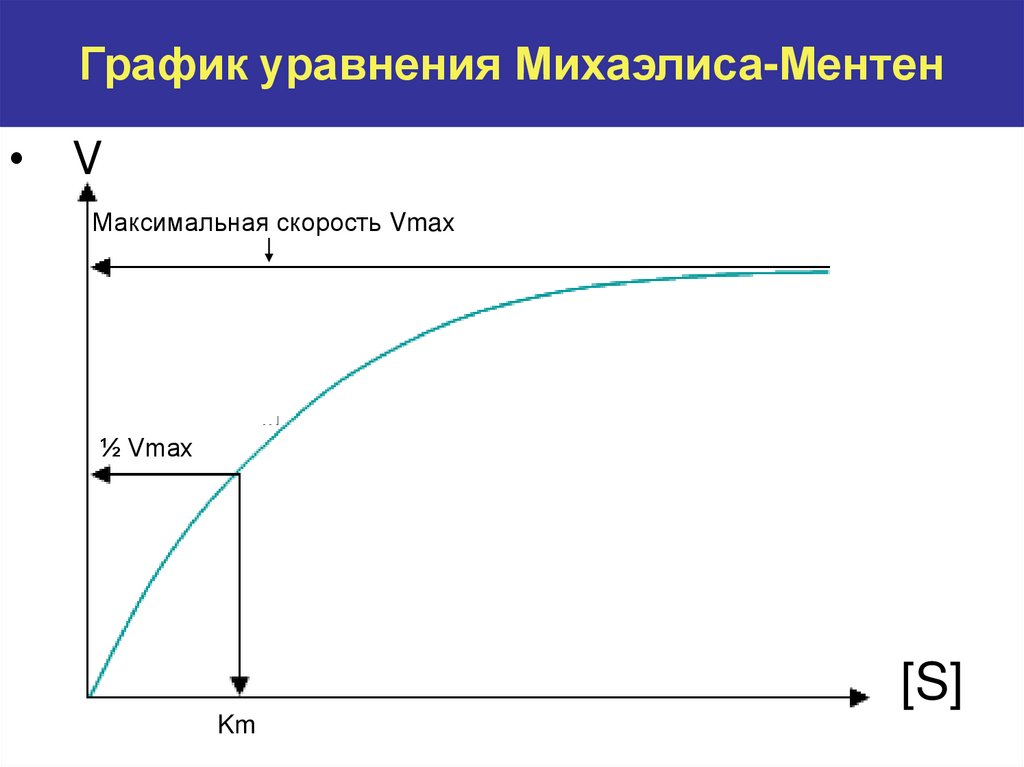
7. График уравнения Михаэлиса-Ментен
V
Максимальная скорость Vmax
½ Vmax
[S]
Km
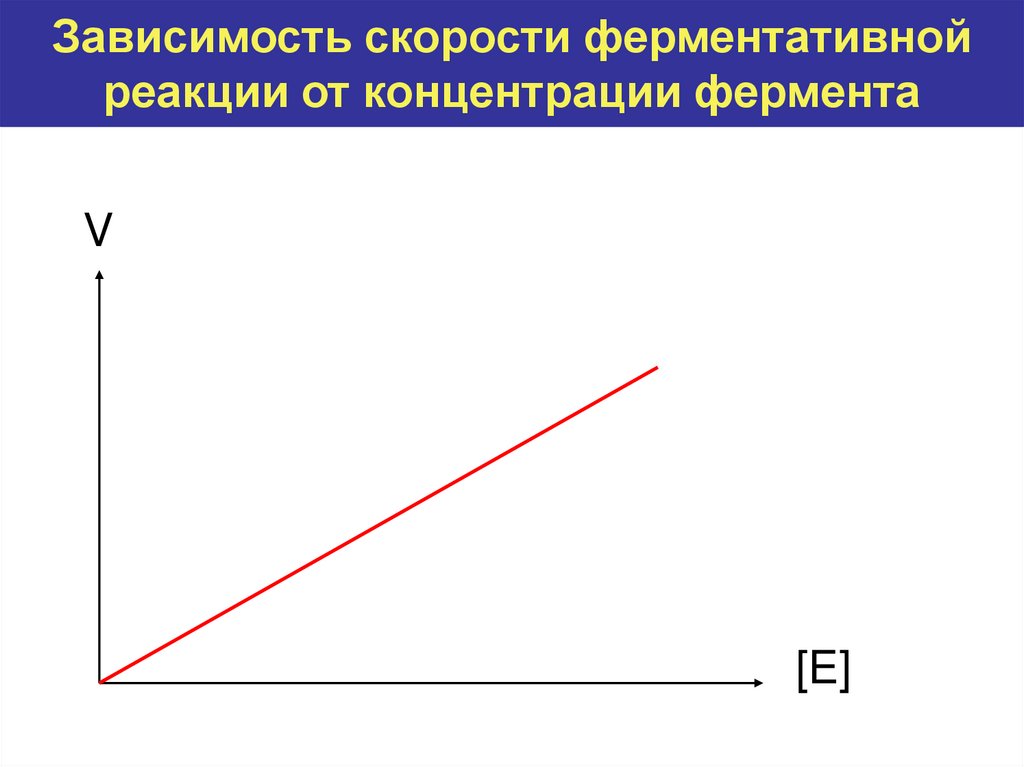
8. Зависимость скорости ферментативной реакции от концентрации фермента
V[E]
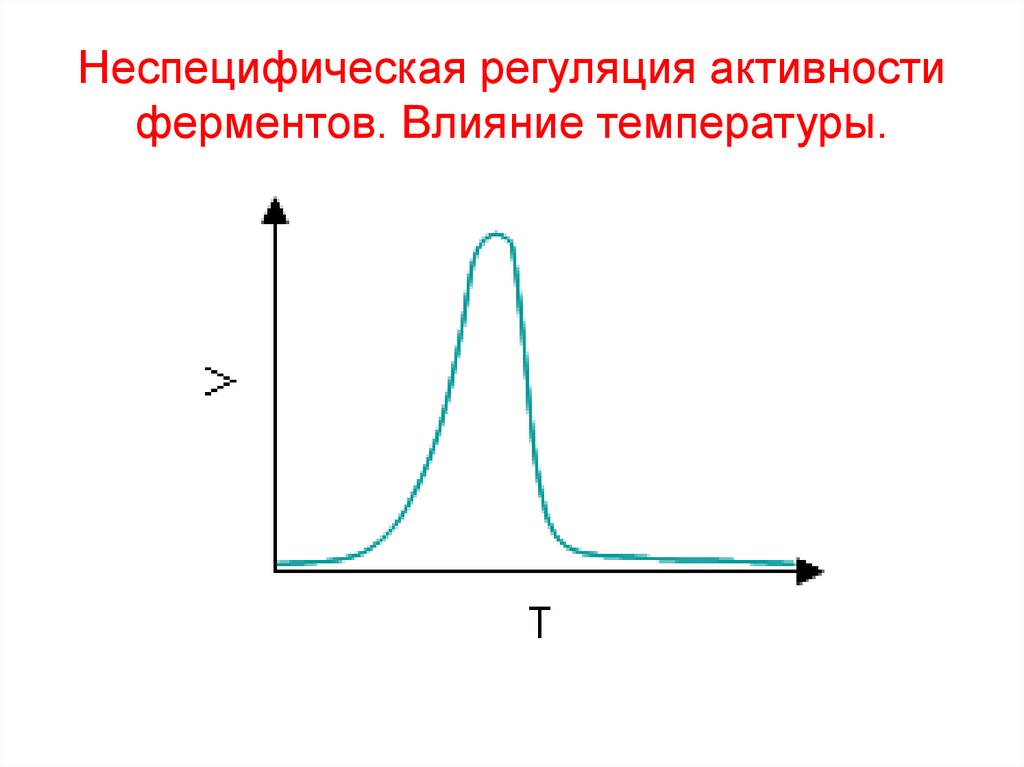
9. Зависимость скорости ферментативной реакции от температуры
Vtoопт
to
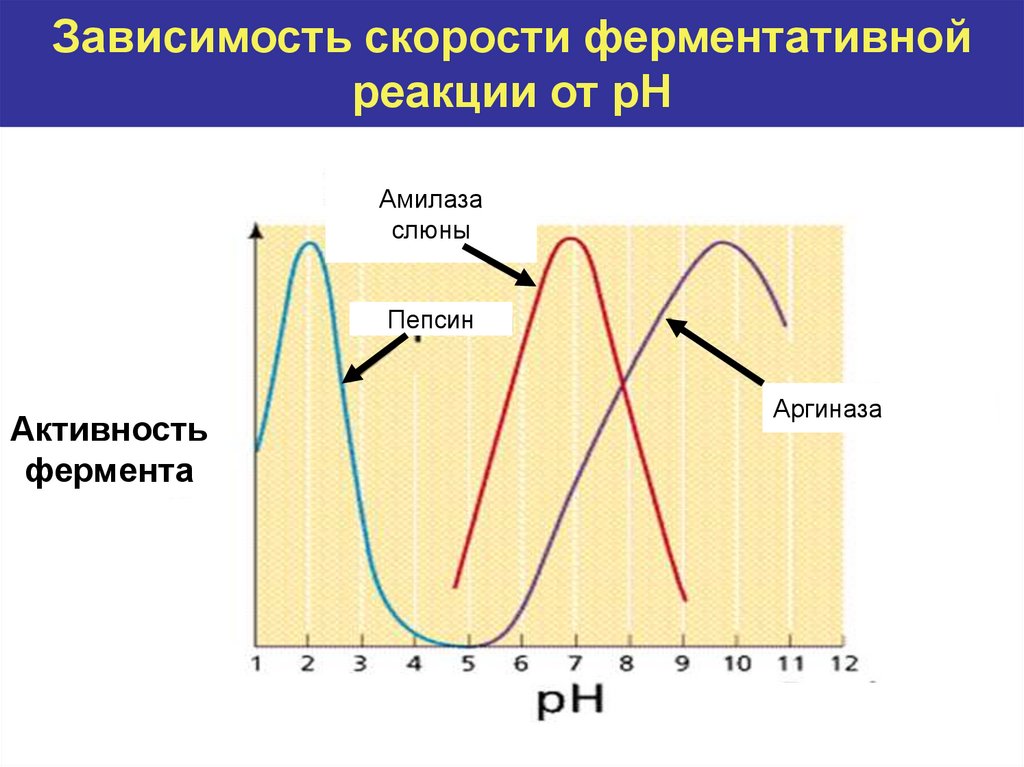
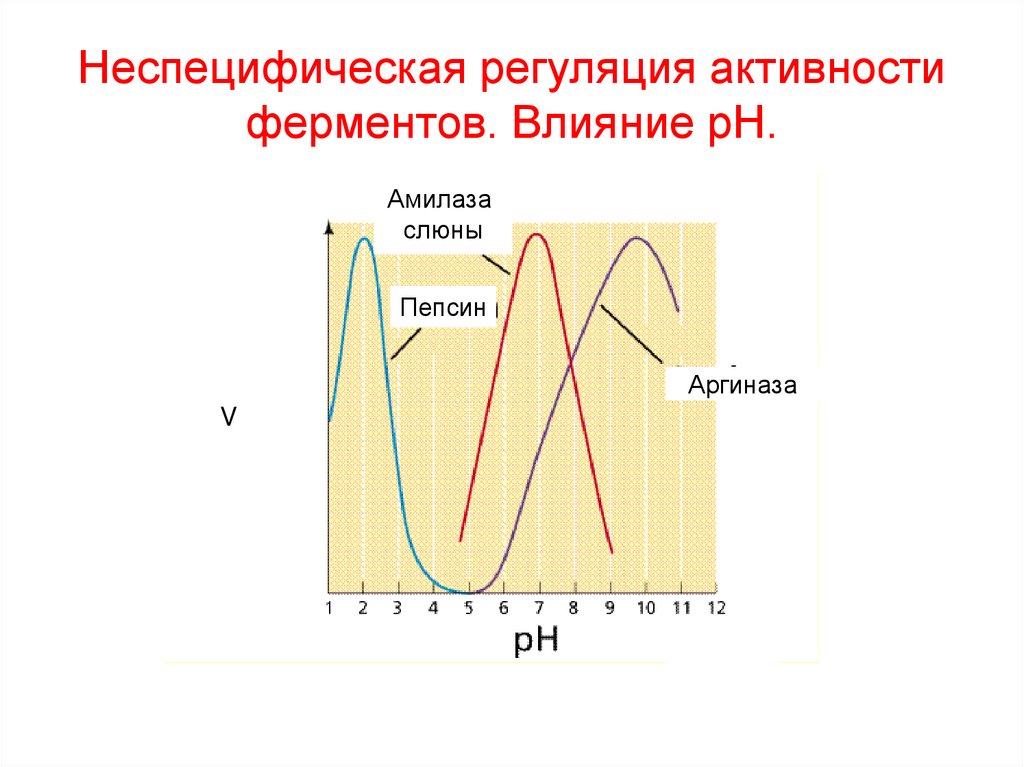
10. Зависимость скорости ферментативной реакции от рН
Амилазаслюны
Пепсин
Активность
фермента
Аргиназа
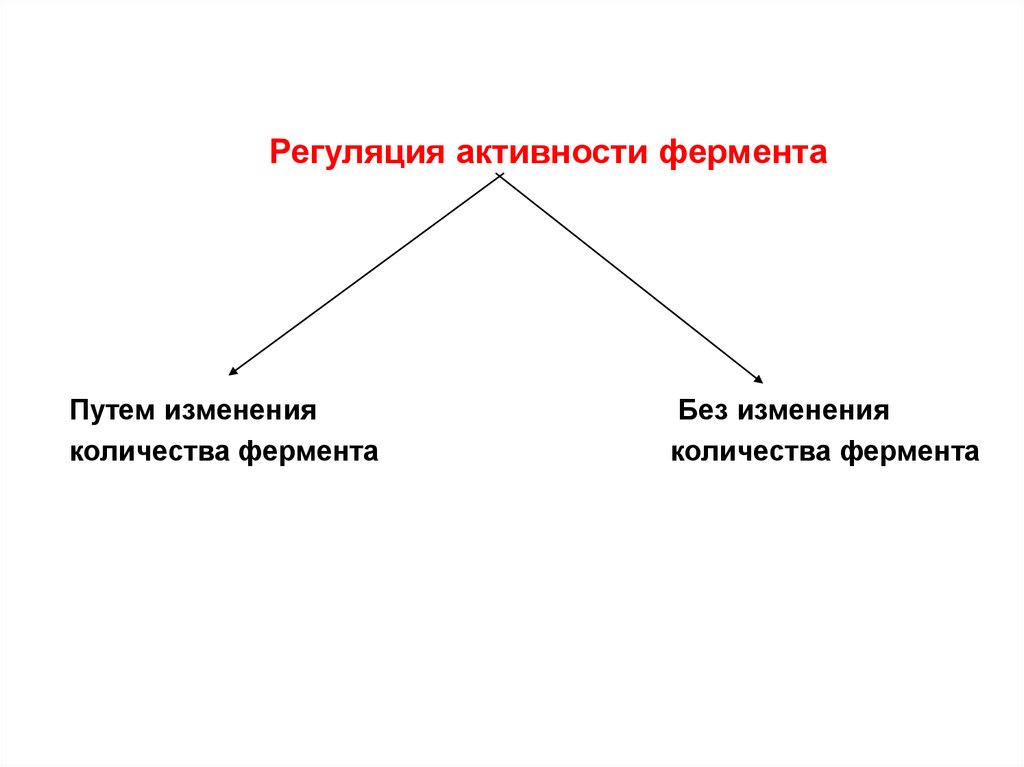
11. Регуляция активности ферментов
12.
Регуляция активности ферментаПутем изменения
количества фермента
Без изменения
количества фермента
13. Неспецифическая регуляция активности ферментов. Влияние температуры.
14. Неспецифическая регуляция активности ферментов. Влияние рН.
Амилазаслюны
Пепсин
Аргиназа
V
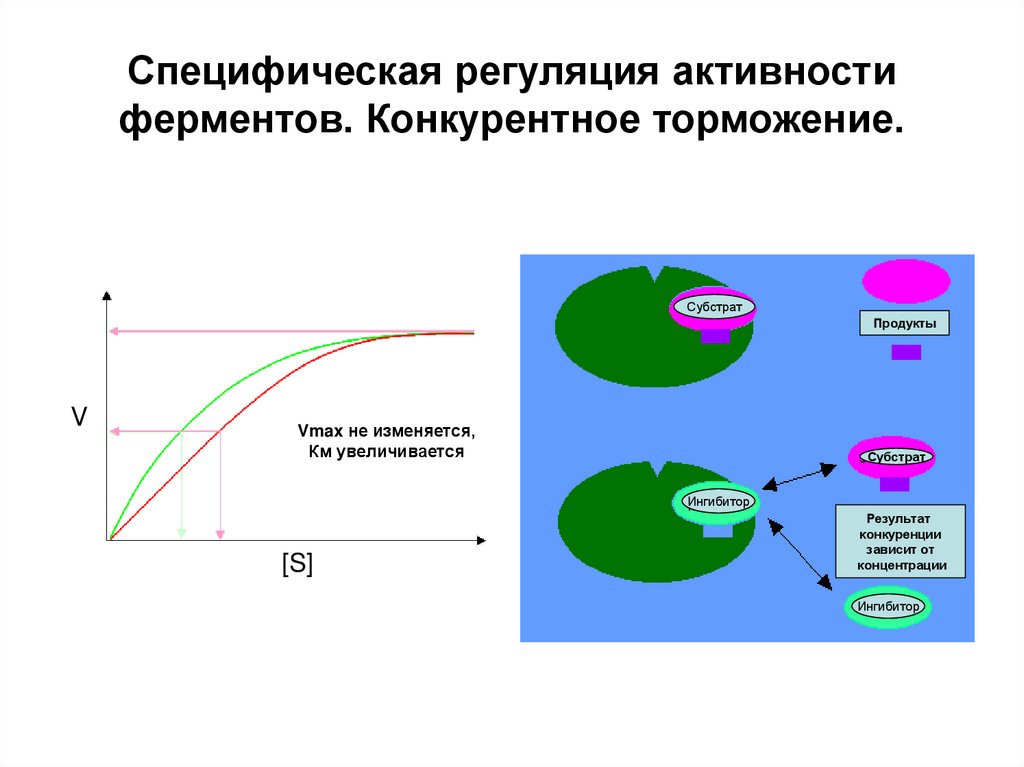
15. Специфическая регуляция активности ферментов. Конкурентное торможение.
СубстратПродукты
V
Vmax не изменяется,
Км увеличивается
Субстрат
Ингибитор
[S]
Результат
конкуренции
зависит от
концентрации
Ингибитор
16. Неконкурентное торможение
V[S]
17. Specific regulation of enzyme activity. Allosteric activation & inhibition
Specific regulation of enzyme activity.Аллостерическая регуляция активности ферментов
Allosteric activation & inhibition
Активный центр
Аллостерический
центр
V
Конформационные изменения
[S]
Аллостерич.
ингибитор
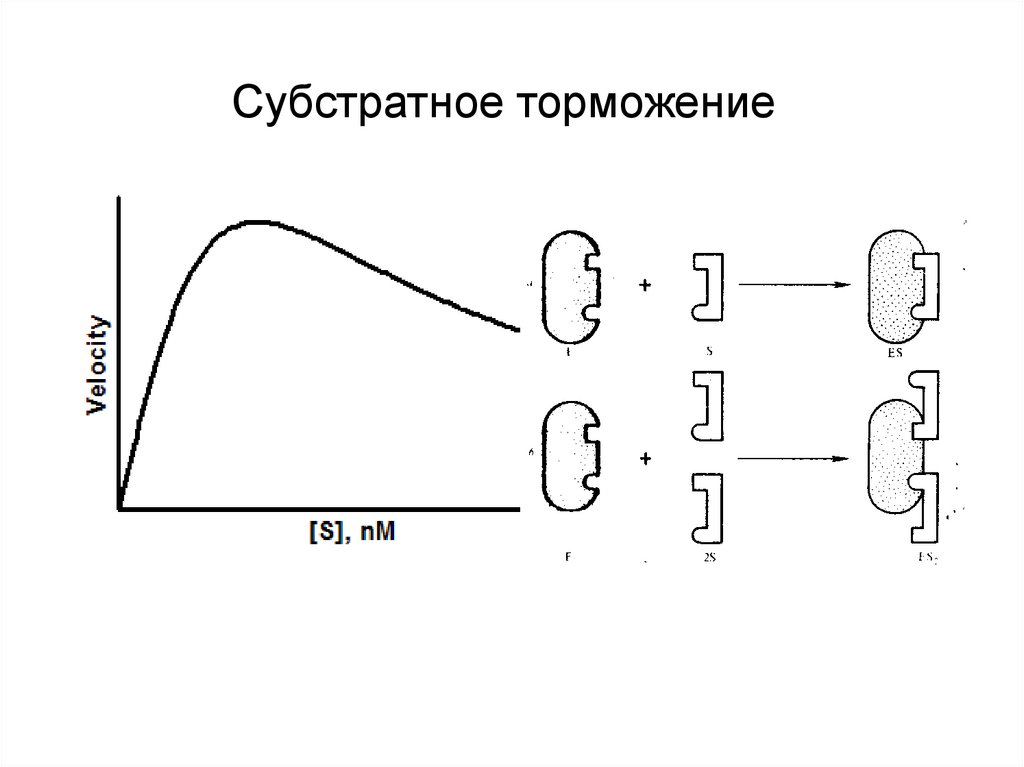
18. Specific regulation of enzyme activity. Substrate inhibition.
Specific regulation of enzyme activity.Субстратное
торможение
Substrate inhibition.
19. Specific regulation of enzyme activity. Partial hydrolysis (proteolysis)
Specific regulation of enzyme activity. PartialОграниченный протеолиз
hydrolysis (proteolysis)
Трипсиноген
Трипсин
Энтеропептидаза
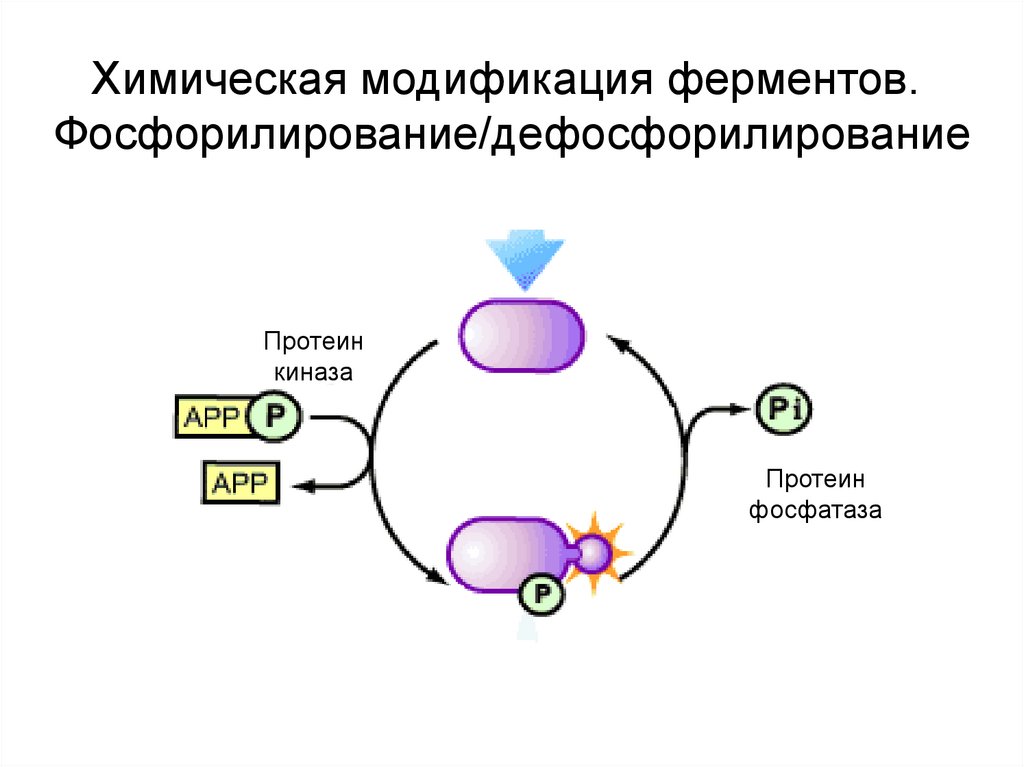
20. Specific regulation of enzyme activity. Chemical modification of enzymes.
Specific regulationof enzyme
activity.
Химическая
модификация
ферментов.
Chemical modification of enzymes.
Фосфорилирование/дефосфорилирование
Протеин
киназа
Протеин
фосфатаза
21.
Вопросы, на которые студент должен ответить, прослушав лекцию1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Что такое ферментативная кинетика? Какие задачи она решает?
Какое свойство ферментов обозначается как специфичность действия?
Какие виды специфичности действия ферментов следует различать?
С помошью каких теорий можно описать разные виды специфичности?
Какова зависимость скорости ферментативной реакции от концентрации
субстрата? В чем суть уравнения Михаэлиса-Ментен?
Каков информационный смысл основных кинетических констант: Km и Vmax?
Как зависит скорость реакции от концентрации фермента?
Как влияет изменение рН среды на активность ферментов?
Как влияет изменение температуры на активность ферментов?
Что такое конкурениное и неконкурентное торможение?
В чем суть аллостерической регуляции активности ферментов?
Какие пути регуляции активности ферментов связаны с их химической
модификацией?
Какие лекарственные вещества используются в стоматологии в качестве
регуляторов активности ферментов?












 biology
biology








