Similar presentations:
Основы организации изготовления лекарственных средств (лекция 1)
1.
Лекция 1ОСНОВЫ
ОРГАНИЗАЦИИ
ИЗГОТОВЛЕНИЯ
ЛЕКАРСТВЕННЫХ
СРЕДСТВ
2.
1. ФАРМАЦЕВТИЧЕСКАЯТЕХНОЛОГИЯ КАК НАУКА
• Термин «технология» происходит от
греческих слов «techne» – умение, искусство
и «logos» – наука.
• Дословно «фармацевтическая
технология» - это наука об искусстве
приготовления лекарственных средств.
2
3.
• Фармацевтическая технология – этонаука, изучающая теоретические основы
технологических процессов получения и
переработки лекарственных средств
(субстанций) в лечебные,
профилактические, реабилитационные и
диагностические препараты в различных
лекарственных формах и терапевтических
систем с оптимальной биологической
доступностью.
3
4.
Связь фармацевтической технологиис другими дисциплинами
4
5.
ЗАДАЧИ ФАРМАЦЕВТИЧЕСКОЙТЕХНОЛОГИИ
1. Совершенствование
существующих (традиционных)
методов изготовления
лекарственных форм
2. Совершенствование составов и
способов изготовления
(модификация) традиционных
лекарственных форм
3. Создание принципиально новых
лекарственных форм, в которых
максимально проявлялся бы
лечебный эффект при минимуме
побочного действия
4. Создание ЛФ и систем доставки
лекарственных средств к органам и
тканям, которые способны
обеспечить оптимальный
фармакологический эффект,
направленный транспорт,
регулируемое высвобождение,
минимальное побочное действие
5
6.
МЕТОДЫ РЕШЕНИЯПОСТАВЛЕННЫХ ЗАДАЧ:
1. Проведение научных исследований с
использованием современных приборов, аппаратов,
методов анализа, обобщение экспериментальных и
теоретических исследований
2. Расширение ассортимента вспомогательных
веществ: новых носителей лекарственных средств,
дисперсионных сред; веществ, обеспечивающих
стабильность; корригирующих веществ; регуляторов
скорости и степени высвобождения ЛВ, всасывания
3. Совершенствование технологического процесса,
создание и использование средств механизации
6
7.
4. Совершенствование упаковки с использованиемсовременных упаковочных материалов
5. Унифицикация прописей врачей, изготовление
препаратов по унифицированным прописям в
специализированных аптеках в качестве
внутриаптечной заготовки, на фармацевтических
фабриках, малых предприятиях и фирмах
6. Биофармацевтическое изучение лекарственных
форм и препаратов на всех этапах их создания (в
опытах in vitro и in vivo), используя различные модели
7
8.
2. Основные понятия итермины
• Согласно Федеральному закону Российской Федерации
от 12.04.2010 №61-ФЗ «Об обращении лекарственных
средств»:
• Лекарственные средства (ЛС) - вещества или их
комбинации, вступающие в контакт с организмом человека
или животного, проникающие в органы, ткани организма
человека или животного, применяемые для профилактики,
диагностики, лечения заболевания, реабилитации, для
сохранения, предотвращения или прерывания
беременности и полученные из крови, плазмы крови, из
органов, тканей организма человека или животного,
растений, минералов методами синтеза или с применением
биологических технологий.
8
9.
• Для характеристики лекарственных средств применяютследующие понятия:
• Стабильность – это свойство лекарственного средства
сохранять свои физико-химические и микробиологические
свойства в течение определенного времени с момента его
выпуска.
• Срок годности – это утвержденное законодательным
органом на основании результатов специального
исследования время хранения лекарственного средства, в
течение которого препарат сохраняет свои физикохимические, микробиологические и терапевтические
свойства без изменений или изменяет их в установленных
для него пределах при соблюдении условий хранения.
9
10.
• Рецепт на лекарственный препарат - медицинскийдокумент установленной формы, содержащий назначение
лекарственного препарата для медицинского применения,
выданный медицинским работником в целях отпуска
лекарственного препарата или его изготовления и отпуска
на бумажном носителе или с согласия пациента или его
законного представителя в форме электронного
документа, подписанного с использованием усиленной
квалифицированной электронной подписи медицинского
работника, либо документ установленной формы,
содержащий назначение лекарственного препарата для
ветеринарного применения, выданный специалистом в
области ветеринарии в целях отпуска лекарственного
препарата или его изготовления и отпуска на бумажном
10
носителе
11.
• Аптечная организация - организация, структурноеподразделение медицинской организации,
осуществляющие розничную торговлю лекарственными
препаратами, хранение, изготовление и отпуск
лекарственных препаратов для медицинского применения
• Безопасность лекарственного средства характеристика лекарственного средства, основанная на
сравнительном анализе его эффективности и риска
причинения вреда здоровью.
11
12.
• Для характеристики безопасности применениялекарственного средства (вещества) используются
следующие понятия:
• Терапевтическая широта – это интервал доз от
минимальной терапевтической до минимальной
смертельной.
• Терапевтический индекс – это отношение минимальной
смертельной дозы к минимальной терапевтической.
• В экспериментальной фармакологии терапевтический
индекс определяют как отношение дозы, вызывающей
гибель 50% экспериментальных животных (LD50), к
средней дозе, вызывающей специфический
фармакологический эффект.
12
13.
3. Изготовление ипроизводство ЛС
• Лекарственные препараты в нашей стране производят
учреждения и предприятия в системе Министерства
здравоохранения Российской Федерации (МЗ РФ) - аптеки и
фармацевтические производства, фармацевтические
фабрики различных форм собственности.
• Аптеки изготавливают препараты по индивидуальным
прописям (рецептам), а для ускорения отпуска проводят
внутриаптечную заготовку (ВАЗ) на основании анализа
часто повторяющихся рецептов.
• Промышленное производство является крупносерийным и
механизированным.
13
14.
• Препараты промышленного производства рассчитаны надлительное хранение (не менее 2 лет).
• В условиях аптек изготавливают лекарственные
препараты, не стойкие при хранении, что не позволяет
воспроизводить их на промышленных предприятиях.
• Лекарственные препараты, изготовленные в аптеках, в
большей степени решают проблему индивидуального
подхода при лечении конкретного больного с учетом
анатомо-физиологических и возрастных особенностей его
организма.
14
15.
Направления в фармации• Аллопатическое
направление
«Contraria contraibus curentur»
(Противоположное лечится
противоположным).
Лекарственные формы:
таблетки, мази, свечи
(суппозитории), капли,
аэрозоли и др.
• Гомеопатическое
направление
«Similia similibus curentur»
(Подобное лечится подобным)
Лекарственные формы:
тритурации
гомеопатические, настойки
ферментированные, мази
гомеопатические, гранулы
гомеопатические,
суппозитории
гомеопатические
15
16.
4. Государственноенормирование производства ЛС
• Система государственной
регламентации изготовления и
контроля качества ЛП –
комплекс требований (узаконенных
соответствующими документами) к
фармацевтическому персоналу, качеству ЛС,
вспомогательных веществ и материалов,
условиям изготовления, технологическому
процессу и изготовленным ЛП.
16
17.
• Согласно Федерального закона РоссийскойФедерации от 12.04.2010 №61-ФЗ «Об
обращении лекарственных средств»:
• Нормативная документация (НД) - документ,
содержащий перечень определяемых по
результатам соответствующих экспертиз
показателей качества лекарственного средства
для медицинского применения, методов контроля
его качества и установленный его
производителем.
17
18.
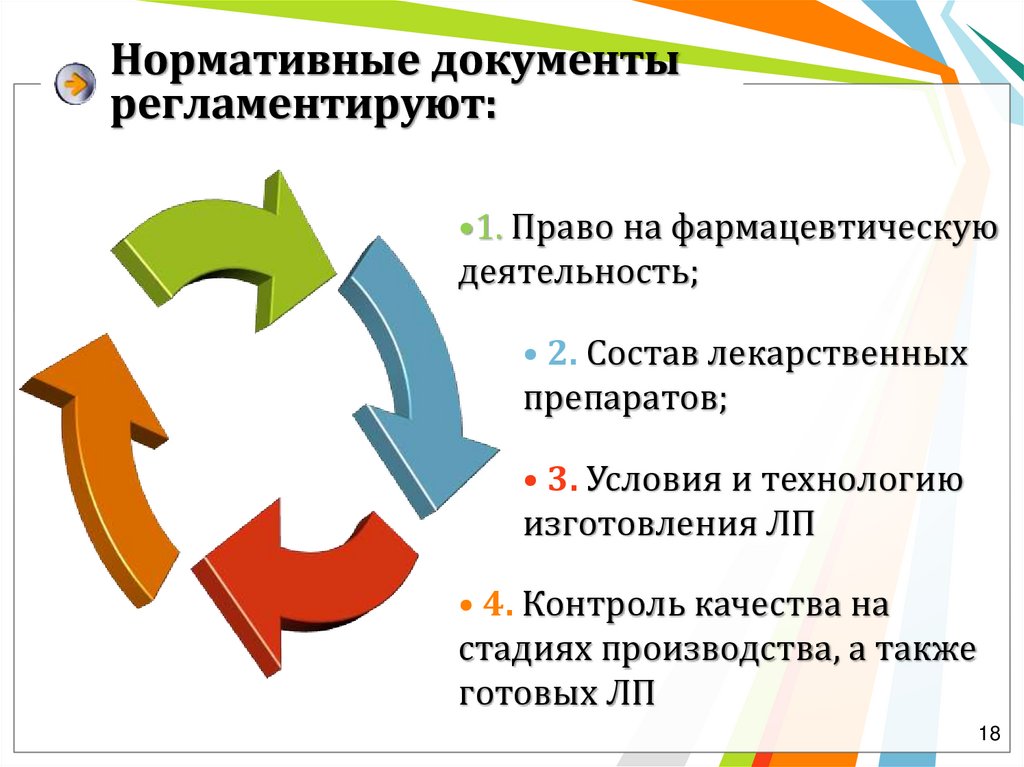
Нормативные документырегламентируют:
•1. Право на фармацевтическую
деятельность;
• 2. Состав лекарственных
препаратов;
• 3. Условия и технологию
изготовления ЛП
• 4. Контроль качества на
стадиях производства, а также
готовых ЛП
18
19.
Виды НД:Государственная фармакопея
Российской Федерации (ГФ)
ГОСТы, ОСТы,
Постановления Правительства РФ
Приказы, инструкции, методические
указания (рекомендации) МЗ РФ
Общие фармакопейные статьи (ОФС),
фармакопейные статьи (ФС),
фармакопейные статьи предприятий (ФСП)
Производственные технологические
регламенты (для условий промышленного
или малосерийного производства)
19
20.
• Государственнаяфармакопея (ГФ) –
это сборник
государственных
стандартов качества
лекарственных
средств, имеющий
законодательный
характер.
20
21.
• СП 2.1.3678-20 Санитарно-эпидемиологическиетребования к эксплуатации помещений, зданий,
сооружений, оборудования и транспорта, а также
условиям деятельности хозяйствующих
субъектов, осуществляющих продажу товаров,
выполнение работ или оказание услуг .
• Приказ МЗ РФ от 23.08.2010 №706н «Об
утверждении правил хранения лекарственных
средств».
21
22.
• Приказ от 26.10.2015 г. N 751н «Обутверждении Правил изготовления
и отпуска лекарственных
препаратов для медицинского
применения аптечными
организациями, индивидуальными
предпринимателями, имеющими
лицензию на фармацевтическую
деятельность»
22
23.
• Постановление Правительства РФ от31.12.2009 №1148 «О порядке хранения
наркотических средств, психотропных
веществ и их прекурсоров»
• Приказ МЗ РФ от 26.11.2021 N1103н «Об
утверждении специальных требований к
условиям хранения наркотических и
психотропных лекарственных средств,
предназначенных для медицинского
применения»
23
24.
• Приказ МЗ РФ от 31.08.2016 г. N 646н «Обутверждении Правил надлежащей практики
хранения и перевозки лекарственных препаратов
для медицинского применения»
• Приказ МЗ РФ от 31.08.2016 г. N 647н «Об
утверждении Правил надлежащей аптечной
практики лекарственных препаратов для
медицинского применения»
• Приказ МЗ РФ от 22.04.2014 №183н «Об
утверждении перечня лекарственных средств для
медицинского применения, подлежащих предметно24
количественному учету»
25.
• Приказ МЗ РФ от 24.11.2021 №1094н «Обутверждении порядка назначения лекарственных
препаратов, форм рецептурных бланков на
лекарственные препараты, порядка оформления
указанных бланков, их учета и хранения, форм
бланков рецептов, содержащих назначение
наркотических средств или психотропных
веществ, порядка их изготовления, распределения,
регистрации, учета и хранения, а также правил
оформления бланков рецептов, в том числе в
форме электронных документов »
25
26.
• Постановление Правительства РФ от 29.12.2007№964 «Об утверждении Списков
сильнодействующих и ядовитых веществ для
целей статьи 234 и других статей Уголовного
кодекса Российской Федерации, а также
крупного размера сильнодействующих веществ»
• Постановление Правительства РФ от 30.06.1998
№681 «Об утверждении Перечня наркотических
средств, психотропных веществ и их
прекурсоров, подлежащих контролю в
Российской Федерации»
26
27.
• Согласно Федерального закона Российской Федерацииот 12.04.2010 №61-ФЗ «Об обращении лекарственных
средств»:
• 1. Общая фармакопейная статья (ОФС) - документ,
утвержденный уполномоченным федеральным органом
исполнительной власти и содержащий перечень
показателей качества и (или) методов контроля качества
конкретной ЛП, ЛРС, описания биологических,
биохимических, микробиологических, физико-химических,
физических, химических и других методов анализа
лекарственного средства для медицинского применения, а
также требования к используемым в целях проведения
данного анализа реактивам, титрованным растворам,
индикаторам;
27
28.
• 2. Фармакопейная статья (ФС) - документ,утвержденный уполномоченным федеральным
органом исполнительной власти и содержащий
перечень показателей качества и методов контроля
качества лекарственного средства для медицинского
применения;
• 3. Фармакопейная статья предприятия (ФСП) –
государственный стандарт качества на ЛС под
торговым названием, содержащий обязательный
перечень показателей и методов контроля качества ЛС
конкретного предприятия, учитывающий конкретную
технологию и прошедший экспертизу и регистрацию в
установленном порядке.
28
29.
Право нафармацевтическую деятельность
• В нашей стране право изготавливать лекарственные
препараты имеют только лица с высшим и средним
фармацевтическим образованием.
• В порядке исключения при отсутствии фармацевтом
на медицинском пункте ЛП могут изготавливать
фельдшеры (но не медицинские сестры), используя
при этом только лекарственные вещества по
специальному списку.
• Самостоятельная работа в гомеопатическим аптеках
возможна после обучения на специализированных
курсах и получения соответствующего сертификата.
29
30.
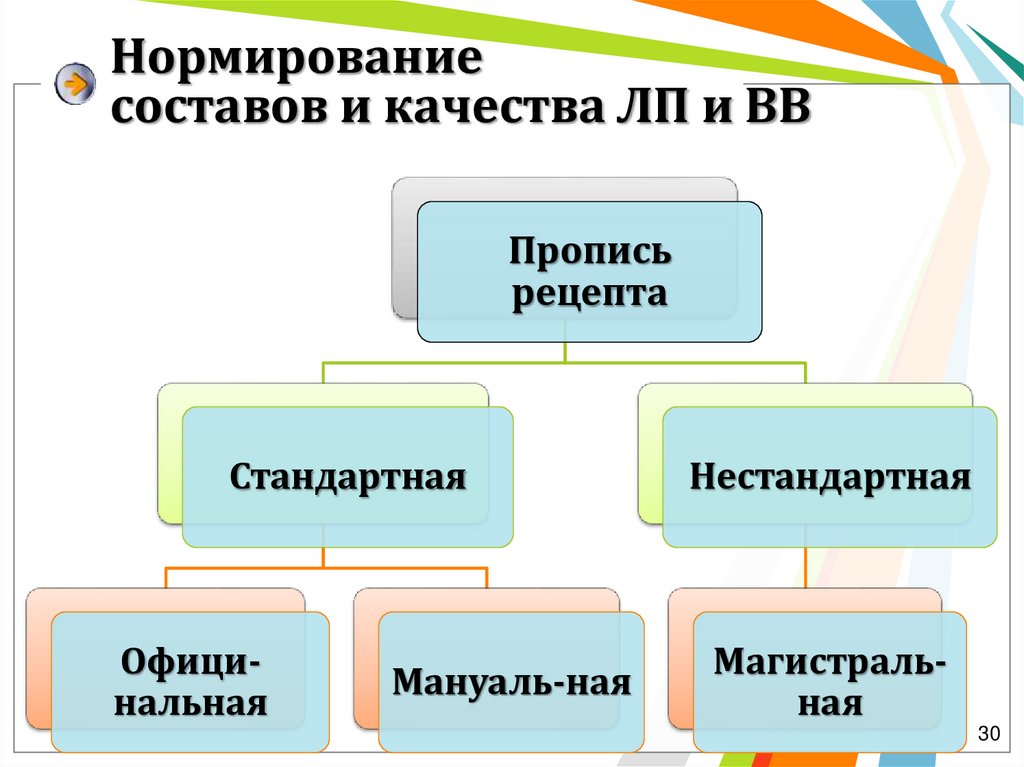
Нормированиесоставов и качества ЛП и ВВ
Пропись
рецепта
Стандартная
Официнальная
Мануаль-ная
Нестандартная
Магистральная
30
31.
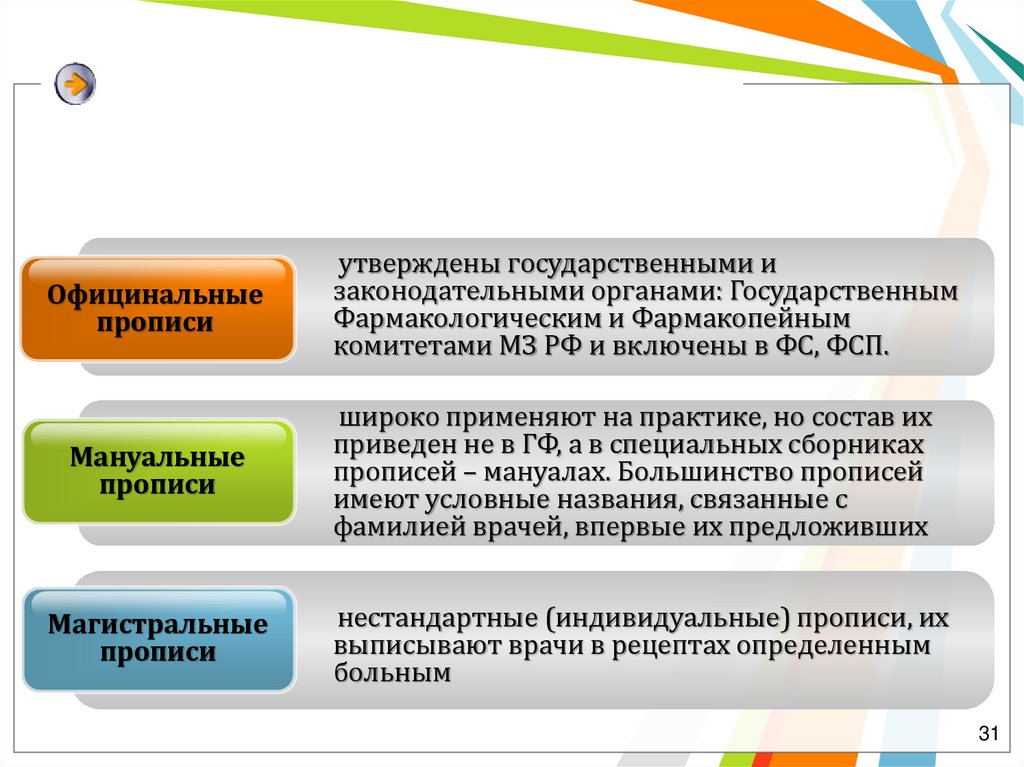
Официнальныепрописи
утверждены государственными и
законодательными органами: Государственным
Фармакологическим и Фармакопейным
комитетами МЗ РФ и включены в ФС, ФСП.
Мануальные
прописи
широко применяют на практике, но состав их
приведен не в ГФ, а в специальных сборниках
прописей – мануалах. Большинство прописей
имеют условные названия, связанные с
фамилией врачей, впервые их предложивших
Магистральные
прописи
нестандартные (индивидуальные) прописи, их
выписывают врачи в рецептах определенным
больным
31
32.
Формырецептурных бланков
• Специальный рецептурный
бланк на наркотическое
средство или психотропное
вещество
• Форма бланка №107/у-НП
• Срок действия–15 дней, срок
хранения в аптеке–5 лет
• Пациенту выдается
сигнатура с желтой полосой
в верхней части и надписью
«Сигнатура».
32
33.
• Специальный бланк предназначен длявыписывания препаратов, содержащих
наркотические вещества, такие как кодеин,
кодеина фосфат, морфин и его соли
(гидрохлорид, сульфат), промедол
(тримепередин), дионин (этилморфин) и
этилморфина гидрохлорид, фентанил и
другие, а также психотропные вещества
списка II: барбамил, натрия этаминал.
33
34.
• Форма бланка №148-1/у-88• Срок действия – 15 дней,
срок хранения в аптеке – 3
года
• Пациенту выдается
сигнатура с желтой полосой
в верхней части и надписью
«Сигнатура».
34
35.
• Бланк формы №148-1/у-88 предназначен длявыписывания препаратов, содержащих:
• 1) ПВ, внесенных в список III Перечня,
зарегистрированных в установленном порядке в качестве
ЛП
• 2) иных лекарственных препаратов, подлежащих ПКУ;
• 3) ЛП, обладающих анаболической активностью;
• 4) ЛП индивидуального изготовления, содержащих НС
или ПВ списка II Перечня, и другие фармакологические
активные вещества в дозе, не превышающей высшую
разовую дозу, и при условии, что этот комбинированный
ЛП не является наркотическим или психотропным
лекарственным препаратом списка II Перечня.
35
36.
• Форма бланка №107-1/у• Срок действия – 60 дней, в
аптеке не хранится,
возвращается пациенту.
• При выписывании
рецептов пациентам с
хроническими
заболеваниями
разрешается устанавливать
срок действия рецепта в
пределах до 1 года
36
37.
• Бланк формы №107-1/у предназначен длявыписывания препаратов, содержащих:
• 1) лекарственные вещества общего списка
• 2) лекарственные вещества, имеющие
ограничения доз, но не включенные в
списки II и III Перечня
37
38.
Структура рецепта• 1. Inscriptio – надпись, в которой указывают
наименование, адрес и телефон
медицинской организации, в которой был
выписан рецепт.
• 2. Datum – дата выдачи рецепта (число,
месяц, год)
• 3. Nomen aegroti – фамилия и инициалы
больного. В рецепте указывают также
возраст - для детей и лиц старше 60 лет
38
39.
• 4. Nomen medici – фамилия и инициалыврача. Врач обязан писать разборчиво. В
случае специального рецептурного бланка
на наркотическое ЛС здесь указывается
также номер истории болезни.
• 5. Invocatio – обращение. Эта часть
представлена одним словом – «recipe» –
«возьми», которое обычно пишется
сокращенно: Rp.: (Rec.: R.:).
39
40.
• 6. Designatio materiarum или Ordinatio –перечисление на латинском языке
лекарственных веществ, из которых следукт
изготовить лекарственный препарат.
• При выписывании рецепта разрешено
пользоваться только принятыми
сокращениями ГФ.
• Название каждого вещества пишут на
отдельной строке с прописной буквы в
40
родительном падеже.
41.
• 7. Praescriptio или subscriptio –предписание, подпись. После перечисление
лекарственных веществ указывается
лекарственная форма, которая должна быть
изготовлена.
• Например: М.f.Ung (Misce fiat unguentum –
Смешай, чтобы получилась мазь)
41
42.
• 8. Signatura – сигнатура, обозначение.Начинается словами «Signa» или «Signetur» –
«Обозначь, пусть будет обозначено»,
которые сокращенно обозначают одной
буквой – «S».
• Содержание сигнатуры предназначено для
больного. В ней указывают, как следует
принимать ЛП, поэтому запись делай на
русском или на русском и национальном
языках.
42
43.
• 9. Subcriptio medici – личная подпись врача.• Рецепт на наркотические вещества должен
быть также подписан главным врачом и
заверен круглой печатью МО.
• Эта последняя часть рецепта имеет
юридическое значение.
43
44.
Нормирование условийи процесса изготовления ЛП
• Категории ЛФ и ЛП по
микробиологической чистоте:
• 1 категория – инъекционные,
инфузионные, глазные ЛФ; препараты,
вводимые в стерильные полости тела, на
открытые раны, ожоги; препараты для
новорожденных должны быть
стерильными.
44
45.
• 2 категория – препараты, применяемыеместно, трандермально, интервагинально,
для ингаляций и вводимые в полости уха,
носа могут содержать не более 100
(суммарно) жизнеспособных бактерий и
грибов в 1 мл (1,0 г) при отсутствии
патогенных микроорганизмов. В 1,0 г мазей
допускается не более 100 клеток бактерий и
грибов, из них не более 10 нитчатых грибов.
45
46.
• 3 категория – лекарственные формы дляприема внутрь:
• - детские ЛФ (для детей от 1 мес до 1 года) – 1 мл
(1,0 г) препарата не должен содержать более 50
(суммарно) жизнеспособных бактерий и грибов
при отсутствии патогенных микроорганизмов.
• - другие детские ЛФ, а также жидкие ЛФ из
синтетического сырья – 1 мл (1,0 г) препарата не
должен содержать более 500 клеток бактерий и
50 клеток дрожжевых и плесневых грибов
(растворы, сиропы, капли и др).
46
47.
• - остальные ЛФ (например,таблетки, капсулы,гранулы из синтетического сырья) не должны
содержать в 1 мл (1,0 г) более 1000
жизнеспособных бактерий и 100 клеток грибов
(плесневых, дрожжевых) при отсутствии
патогенных микроорганизмов.
47
48.
• 4 категория – препараты для ректальноговведения, в 1 мл (1,0 г) не должно быть
более 1000 жизнеспособных бактерий, не
более 100 клеток грибов и недопустимы
другие кишечные бактерии.
• В воде очищенной (до стерилизации)
должно быть не более 100
микроорганизмов
48
49.
Регламентация процесса• Включает требования по соблюдению технологии
изготовления с контролем на всех стадиях.
• Первой стадией для всех ЛФ являются
подготовительные работы: подготовка
помещения, вспомогательных материалов,
оборудования, упаковочных средств,
лекарственных и вспомогательных веществ.
• Затем осуществляют стадии технологического
процесса в соответствии с особенностями ЛФ,
заканчивая упаковкой и оформлением ЛП и
контролем его качества.
49
50.
Упаковка лекарственных формТвердые ЛФ
Add your title in here
упаковывают в пакеты, коробки и банки;
Жидкие ЛФ
упаковывают во флаконы;
Мази
упаковывают в банки, иногда в тубы.
50
51.
Маркировка лекарственных формВсе ЛФ оформляют
этикетками в
зависимости от
способа применения
«Внутреннее»
«Наружное»
«Для инъекций»
«Глазные ЛФ»
51
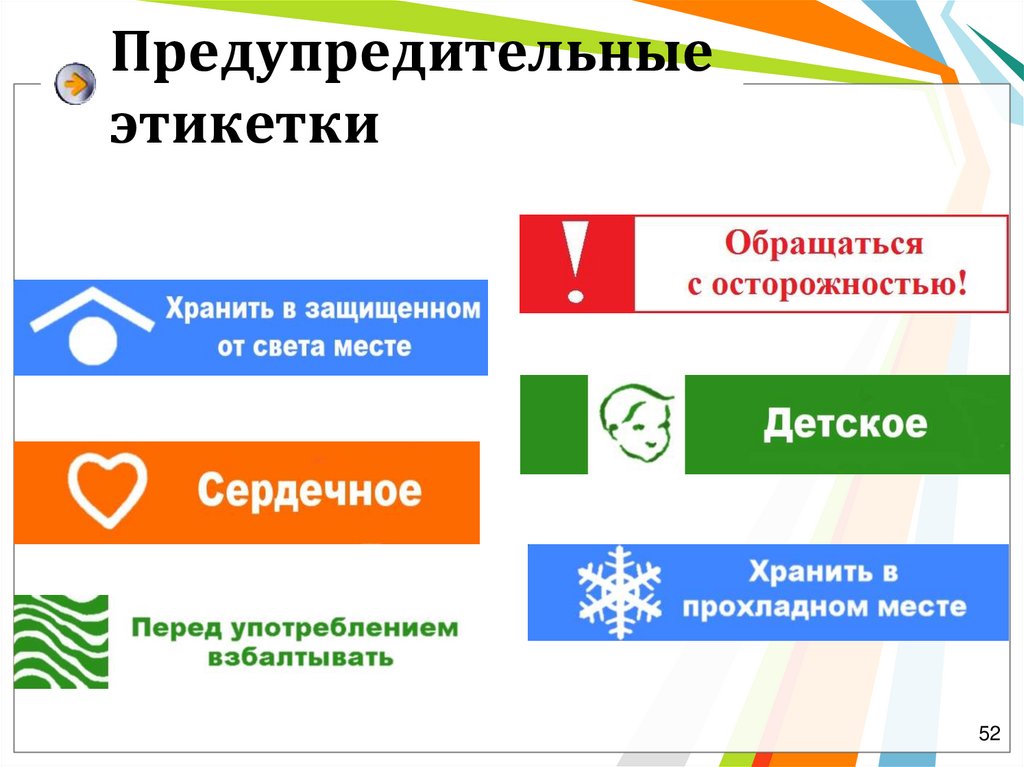
52.
Предупредительныеэтикетки
52
53.
Виды внутриаптечногоконтроля качества ЛП
Приемочный
Физический
Письменный
Опросный
Химический
Органолептический
Контроль
при отпуске
53
54.
• 1. Приемочный контроль заключается впроверке поступающих лекарственных
средств на соответствие требованиям по
показателям: "Описание", "Упаковка",
"Маркировка", а также в проверке
правильности оформления
сопроводительных документов, включая
документы, подтверждающие качество
лекарственных средств.
54
55.
• 2. Письменный контроль – подтверждаетсяпаспортом письменного контроля – ППК.
Паспорт выписывают после изготовления
недозированных ЛФ (микстур, мазей) или до
разделения ЛФ на дозы (порошки,
суппозитории, пилюли) или одновременно с
изготовлением (если изготавливает и
контролирует препарат один и тот же
специалист);
• Срок хранения ППК в аптеке – 2 месяца
55
56.
• 3. Опросный контроль – устный опросфармацевта или провизора-технолога по
качественному и количественному составу
прописи, но не позднее, чем после
изготовления 5 препаратов;
• 4. Физический контроль – проверка
следующих показателей: соответствие объема,
размера, формы, массы (отдельных доз или
всего препарата в целом); температура
плавления, время распадаемости,
растворимость, время деформации и др.
56
57.
• 5. Химический контроль – заключается впроведении качественного и
количественного анализов изготовленного
лекарственного препарата.
• 6. Органолептический контроль – проверка
запаха, внешнего вида, цветности,
прозрачности, однородности, отсутствия
механических включений и др.
57
58.
• 7. Контроль при отпуске :• а) соответствие упаковки лекарственного
препарата физико-химическим свойствам,
входящих в него лекарственных средств;
• б) соответствие указанных в рецепте или
требовании доз наркотических средств,
психотропных, сильнодействующих веществ
возрасту пациента;
58
59.
• в) соответствие реквизитов рецепта,требования сведениям, указанным на
упаковке изготовленного лекарственного
препарата;
• г) соответствие маркировки лекарственного
препарата требованиям НД.
• При выявлении одного из указанных
несоответствий изготовленный ЛП не
подлежит отпуску.
59
60.
• При оценке качества ВСЕХ лекарственныхпрепаратов проверяют:
• - цвет, запах, отсутствие механических
включение: волосков ваты, крошек от
пробки и д.д.;
• - отклонение в массе или объеме ЛП;
• - соответствие упаковки и укупорки массе
(объему) и виду ЛФ, а также свойствам
входящих ингредиентов;
60
61.
• - наличие соответствующих основныхэтикеток, а также предупредительных
надписей или дополнительных этикеток;
• - правильность оформления рецепта (при
необходимости сигнатуры), ППК.
61
62.
БЛАГОДАРЮЗА ВНИМАНИЕ!


























































 medicine
medicine