Similar presentations:
Материаловедение как наука
1. МАТЕРИАЛОВЕДЕНИЕ лек 1 (2 ч)
д.т.н., проф. Светлана Ивановна Губенко2. Материаловедение как наука
Материаловедение - это наука о структуре и свойствах материалов.В настоящее время известно 120 химических элементов. Из 92 элементов, встречающихся в
естественных
условиях, подавляющее большинство металлов (более 80); к металлоидам
(неметаллам) относят Si, P,S, H, B, N, C, O; к инертным газам – He, Ne, Ar, Kr, Xe, Rn; к галогенам –
F, Cl, Br, I.
4/5 элементов периодической системы являются металлами.
По степени
распространенности в
природе элементы
распределены
следующим образом:
О, Si, Al, Fe, Mg, Ti, Cu,
Ni, St, Zn, Pb, Ag, Au, Pt
и т.д.
Металлы отличаются от
неметаллов тем, что в
конденсированном
состоянии (жидком и
твердом) имеют
преимущественно
металлическую связь
между атомами.
В газообразном
состоянии металлы не
отличаются от
остальных элементов.
3. Материаловедение как наука
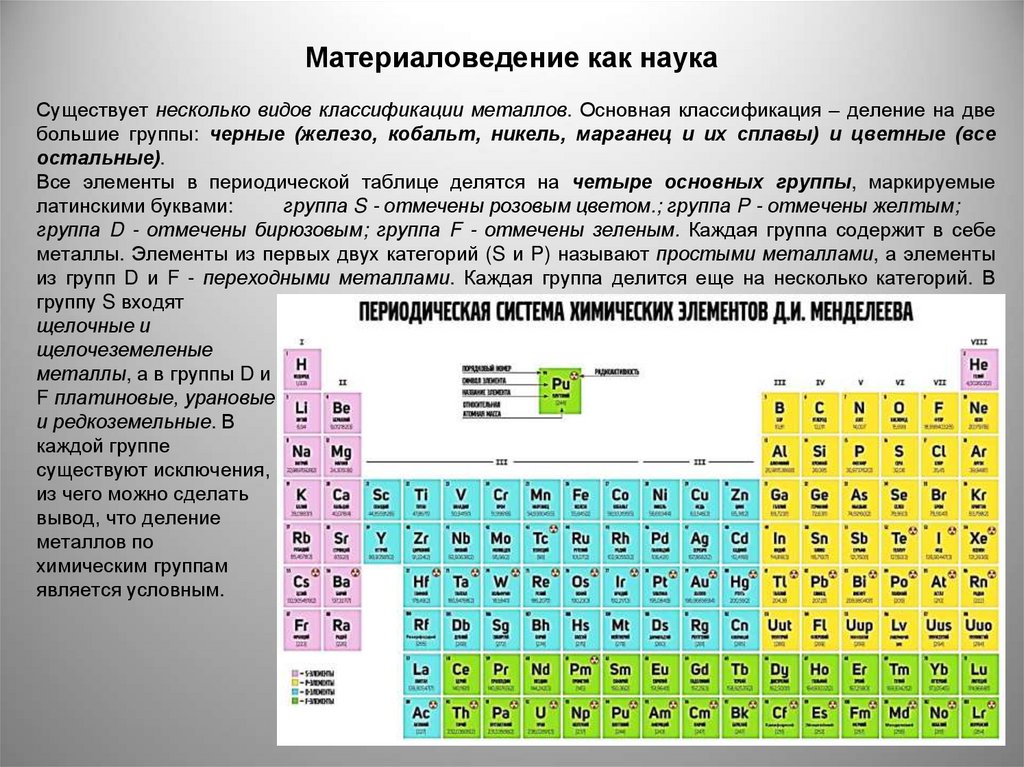
Существует несколько видов классификации металлов. Основная классификация – деление на двебольшие группы: черные (железо, кобальт, никель, марганец и их сплавы) и цветные (все
остальные).
Все элементы в периодической таблице делятся на четыре основных группы, маркируемые
латинскими буквами:
группа S - отмечены розовым цветом.; группа P - отмечены желтым;
группа D - отмечены бирюзовым; группа F - отмечены зеленым. Каждая группа содержит в себе
металлы. Элементы из первых двух категорий (S и P) называют простыми металлами, а элементы
из групп D и F - переходными металлами. Каждая группа делится еще на несколько категорий. В
группу S входят
щелочные и
щелочеземеленые
металлы, а в группы D и
F платиновые, урановые
и редкоземельные. В
каждой группе
существуют исключения,
из чего можно сделать
вывод, что деление
металлов по
химическим группам
является условным.
4. Материаловедение как наука
Из 120 химических элементов, открытых на 2021 год, к металлам часто относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
6 в группе щелочноземельных металлов: Ca, Sr, Ba, Ra; а также Mg и Be;
38 в группе переходных металлов: Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn; Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd,
Ag, Cd; Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg; Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе легких металлов лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po;
15 в группе лантаноидов: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
15 в группе актиноидов (физические свойства изучены не у всех элементов): Ac,Th, Pa, U, Np, Pu,
Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами обладает водород при определенных условиях, его не относят
к металлам.
Таким образом, к металлам могут относиться более 90 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические
элементы тяжелее гелия.
Кроме того, в физике элементы делят на металлы, полупроводники м диэлектрики.
Существуют классификации металлов по разным принципам:
чёрные (Fe, Co, Ni, Mn и их сплавы),
цветные (все остальные);
по плотности: легкие (плотность 0,53…5 г/см³ ; Li, Be,Al, Mg,К и др.) и тяжелые (5…22,5 г/см³ ,
Zn, Cu и др.);
по tпл: тугоплавкие (W, Mo, Zr и др.) и легкоплавкие (Pb, Bi, Hg, Sn, Zn, Cd и др.) (tпл чистых
металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (W);
по строению атомов: переходные металлы – в атомах электронные уровни заполнены не
последовательно (Fe, Co, Ni, и др.) и простые;
кроме того, бывают металлы РЗМ (редкоземельные - La, Ce и др.), ЩЗМ (щелочноземельные –
Li, Na,K и др.), благородные (Ag, Au, Pt, Rh, Os)
5. Материаловедение как наука
Техническая классификация металловЧерные металлы делят на 5 основных подгрупп:
Железные металлы. Сюда входят марганец, кобальт, никель, железо. Наиболее
распространенная в природе группа, используемая в сплавах как основной компонент.
Тугоплавкие. Элементы, имеющие высокую температуру плавления (платина, вольфрам,
хром, ванадий, молибден и др.). В качестве эталона принята мера в 1539 градусов по Цельсию.
Редкоземельные. Дорогостоящие в плане добычи и обработки элементы, к которым
относят неодим, европий, самарий и другие металлы, используемые в качестве присадок к
основному сплаву.
Щелочные. Особая группа, практически не применяемая в чистом виде. Чаще всего
используются в атомной энергетике. Сюда относят: литий, барий, радий и другие.
Урановые. Торий, уран, плутоний. Применяются исключительно в атомной энергетике.
Цветные металлы также делят на 3 подгруппы:
Легкие. Алюминий, магний, бериллий. Обладают низким удельным весом и часто
применяются в авиастроении и прочих сферах, где необходим твердый, но в то же время
легкий материал.
Легкоплавкие. Металлы с наиболее низкой температурой плавления: цинк, олово, свинец.
Используются как в чистом виде, в качестве припоя, и как легирующие добавки, изменяющие
характеристики сплава.
Благородные или драгоценные металлы. Наиболее редкие элементы, к которым относят:
золото, серебро, палладий, платину. Обладают максимальной устойчивостью к коррозии и
окислению, благодаря чему получают широкое распространение в различных промышленных
сферах.
6. Материаловедение как наука
«Металлом называется светлое тело, которое ковать можно. Таких тел находим только
шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые
металлы; которое разноство в том состоит, что высоких одним огнём без помощи других
материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел
обращаются.
За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть.» М. В. Ломоносов
Слово «металл» заимствовано из немецкого языка. Немецкое слово «metall» заимствовано из
латинского языка, где «metallum» — «рудник , металл». Латинское, в свою очередь,
заимствовано из греческого языка (μεταλλον — «рудник, копь»).
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют
оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых
металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку.
При необходимости добавляют другие элементы (легируют), проводят другую обработку
металлов. Изучением этого занимается наука металлургия.
Кроме того, в малых количествах металлы присутствуют в морской воде и в живых организмах
(играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме
кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и
цитоплазме. Магний накапливается в мышцах и нервной системе, медь – в печени, железо – в
крови.
7. Материаловедение как наука
ии
8. Материаловедение как наука
История развития представлений о металлах
Знакомство человека с металлами началось с Au, Ag, Cu, то есть с металлов, встречающихся в
свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы,
значительно распространенные в природе и легко выделяемые из их соединений: Sn, Pb, Fe, Hg. Эти
семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских
артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к
эпохе, удаленной на 3000—4000 лет от н. э.
Основные этапы в истории развития человечества (по названию основного материала, применяемого
для изготовления орудий труда): каменный век, бронзовый век, железный век.
К семи известным металлам уже только в средние века средние прибавились Zn, Bi, Sb, и в начале
XVIII столетия As. С середины XVIII века число открытых металлов быстро возрастает и к началу XX
столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как
процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие
моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото,
серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных
веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на
их натуру в более или менее определенной форме появляются только в средние века у алхимиков,
которые верили в возможность превращать одни металлы в другие, создавать их искусственно..
9. Материаловедение как наука
Известные древние изделия и сооружения из металлов: античные водопроводы (римский, греческийи в других странах ближнего востока); дамасские клинки (был еще булат японский, индийский,
русский); колосс родосский; колонны греческих акрополей (железные дюбеля); латунные монеты (др.
Рим, Египет, Ближний восток, Мессопотамия и др); Кутбская колонна (Индия); толедские клинки
(Испания); чугунные статуи (Китай), первый в мире чугунный мост (Англия) и еще множество!!!!!
колосс родосский
дамасский клинок
чугунная статуя Китай
Римский волопровод
Монеты древнего Египта и
Греции
толедский клинкок (Испания) Кутбская колонна
(Индия)
дюбеля колонн акрополя (Греция) чугунный мост (Англия)
10. Материаловедение как наука
Металловедение - это наука о структуре и свойствах металлов и сплавов.Металлография – это наука о структуре металлов и сплавов. Она является составной частью
металловедения. Металлография существует с момента открытия Д.К. Черновым в 1868 г.
полиморфизма железа. ). Как наука металлография начала складываться с 1832 года, когда русский
инженер П.П. Аносов применил микроскоп к изучению структуры стали. К концу XIX века после открытия
Д.К. Черновым в 1868 году полиморфизма железа, металлография сформировалась как точная наука.
Металлы отличаются от неметаллов тем, что в
конденсированном состоянии (жидком и твердом)
они имеют преимущественно металлическую
связь между атомами.
Классификация материалов (кристаллов) в
зависимости от природы сил, действующих между
частицами кристалла, или от типа межатомных
связей. Согласно этому признаку, существует
четыре типа кристаллов: металлические,
ковалентные (атомные), ионные и
молекулярные.
У кристаллов с различными типами
химической связи существуют определенные
типы кристаллических решеток.
11. Атомное строение металлов
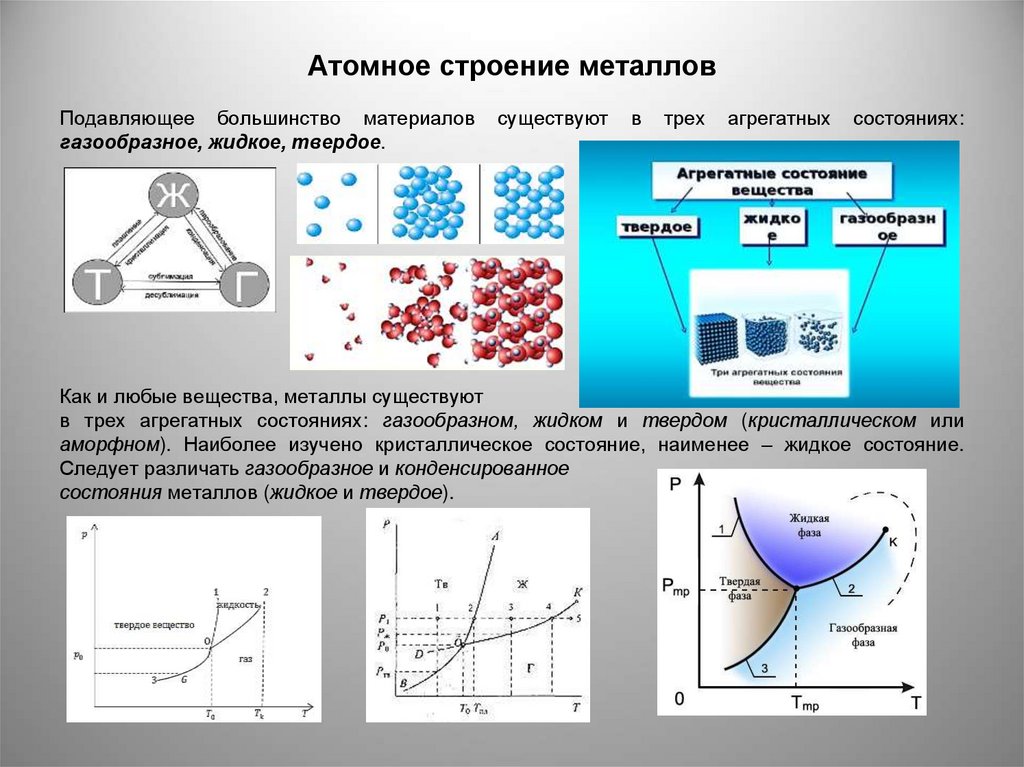
Подавляющее большинство материаловгазообразное, жидкое, твердое.
существуют
в
трех
агрегатных
состояниях:
Как и любые вещества, металлы существуют
в трех агрегатных состояниях: газообразном, жидком и твердом (кристаллическом или
аморфном). Наиболее изучено кристаллическое состояние, наименее – жидкое состояние.
Следует различать газообразное и конденсированное
состояния металлов (жидкое и твердое).
12. Атомное строение металлов
Газообразный металл состоит из электрически нейтральных атомов и ничем не отличается отостальных газов. Силы межатомных связей типа Ван-дер-Ваальса.
Жидкий металл (расплав) не имеет регулярности в расположении атомов, хотя в жидкости
возможно образование атомных группировок с плотной упаковкой, которые
называются кластерами или фазовыми флуктуациями.
Тип связи металлический. Существует ближний порядок в
расположении атомов (каждый атом имеет одинаковое число соседних
атомов).
Атомная модель твердого (кристаллического) металла
представляет собой воображаемую кристаллическую решетку, в узлах
которой находятся положительно заряженные ионы, а между ними
движутся коллективизированные электроны (электронный газ), которые
при сближении атомов покинули внешние электронные оболочки.
Межатомные связи в металле состоят из сил притяжения между
ионами и свободными электронами и сил отталкивания между одинаковыми
по заряду частицами ─ ионами и электронами. Взаимодействие между
положительными ионами и коллективизированными свободными
электронами является основным фактором, определяющим металлическую
связь.
13. Атомное строение металлов
На внешних оболочках атомов металлов находится небольшое число электронов, слабо связанных сядром. В изолированных атомах электроны движутся вокруг своих ядер на определенных
энергетических уровнях. Например, атом циркония
содержит следующие электроны: 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d2, 5s2.
Электроны на внешних оболочках слабо связаны с ядром.
Металлы с полностью заполненными или совершенно незаполненными
d- или f- уровнями называются простыми; металлы с незаполненными
d- или f- уровнями называются металлами переходных групп.
•Если два нейтральных атома металла сближать, то их электроны будут испытывать силы притяжения
от ядер соседних атомов, и распределение электронов по уровням и подуровням изменяется.
Энергетические уровни свободных атомов при сближении расщепляются на два уровня с различной
энергией. Когда объединяется много атомов, то расщепленные уровни образуют энергетические
полосы. Валентные электроны всех атомов коллективизируются и получается так называемый
электронный газ. Атомная модель металла схематически может быть изображена в виде упорядоченно
расположенных положительно заряженных ионов, окруженных коллективизированными свободными
электронами.
Межатомные связи в металле состоят из сил
притяжения между ионами и свободными электронами
и сил отталкивания между одинаковыми по заряду
частицами ─ ионами и электронами.
Взаимодействие между положительными ионами и
коллективизированными свободными электронами
является основным фактором, определяющим металлическую связь. Потенциальная энергия
взаимодействия между двумя соседними атомами U может быть представлена схемой. Равновесное
состояние между двумя атомами, соответствующее минимуму энергии системы Umin, возможно при
сближении на расстояние, равное r0. Значение Umin определяет энергию связи между атомами, которая
равна работе, необходимой для удаления соседних атомов на бесконечно большое расстояние.
14. Атомное строение металлов
Металлами и металлическими сплавами называют вещества, обладающие электро- итеплопроводностью, характерным блеском и высокой пластичностью. Такой комплекс
свойств обеспечивается особенностями их атомно-кристаллического строения. Высокая
электропроводность обусловлена ускорением свободных электронов под действием
приложенного поля. Высокая теплопроводность связана с тепловым движением электронов и
ионов. Пластичность обусловлена высокой компактностью расположения атомов в
кристаллической решетке и ненаправленностью межатомной связи. Блеск связан с
взаимодействием электронов со световыми волнами.
В металлах, кроме металлической, может быть доля ковалентной связи, а в металлических
сплавах - и определенная доля ионной межатомной связи.
Ковалентная связь осуществляется парами электронов, принадлежащих двум соседним
атомам, причем каждый атом стремится иметь максимальное число соседей. В этом случае
возникает состояние, при котором электроны принадлежат одновременно обоим ядрам. Такие
электроны называют обобществленными.
Ионная связь — сильная химическая связь, возникающая в результате электростатического
притяжения положительных и отрицательных ионов. Она возникает между атомами с большой
разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная
пара переходит преимущественно к атому с большей электроотрицательностью. Образуется
между типичными металлом и неметаллом. При этом электроны от металла полностью
переходят к неметаллу, образуются ионы.
15. Атомное строение металлов
В твердом (кристаллическом) состоянии атомы металла расположены определеннымобразом. Трехмерное периодическое расположение атомов в пространстве, получаемое путем
трансляции атомов вдоль координатных осей, называется кристаллической решеткой. В этом
состоянии существует и ближний, и дальний порядок в расположении атомов.
Из известных 14-ти кристаллических решеток Бравэ для металлов
Наиболее характерны следующие:
- ОЦК (объемноцентрированная кубическая);
КЧ = 8;(литий, натрий, калий, α-Fе, Мо, V и др.)
- ГЦК (гранецентрированная кубическая);
КЧ = 12; (Cu, Al, Ni, Au, γ-Fе и др.)
- ГП (гексагональная плотноупакованная);
КЧ = 12; (Zn, Mg, Cd и др.)
Кроме того, у металлов могут быть простая кубическая, ромбическая, тетрагональная,
тригональная, моноклинная и другие кристаллические решетки. Например, тетрагональную
решетку имеют уран, протактиний, нептуний, плутоний. В строении металлических кристаллов
проявляется периодический закон: щелочные металлы имеют ОЦК - решетку; три металла
подгруппы меди (Cu, Ag, Au) ─ ГЦК - решетку; металлы II группы с достроенными электронными
оболочками (Be, Mg, Zn, Cd) ─ ГП решетку; если у металла II группы электронная оболочка
недостроена (Ca), они имеют ГЦК решетку. Кроме того, у металлов могут быть и другие
решетки: простая кубическая (мышьяк) и др.
Лантан
Иттрий
Титан
Кобальт
Ниобий
16. Атомное строение металлов
Металлы с ГЦК и ГП решетками имеют до 100 % металлической связи; в металлах с ОЦКрешеткой есть доля ковалентной связи.
Характеристики кристаллической решетки:
Элементарная ячейка – простейший элемент кристаллической решетки,
при перемещении которого в пространстве можно построить всю решетку.
Параметр или период решетки – это длина ребра элементарной
ячейки (вдоль оси х - а, вдоль оси у - b, вдоль оси z - c).
Атомный радиус измеряется половиной расстояния
между соседними атомами из-за размытости электронного
облака.
Rат= а√3 / 4 для ОЦК
Rат= а √2 / 2 для ГЦК
Плотность упаковки атомов характеризуется координационным числом КЧ – это количество
соседних равноудаленных атомов, окружающих каждый атом. Его величина характеризует ближний
порядок.
Относительная плотность упаковки Vат/Vстр, где Vат – объем, занимаемый атомами, Vстр – атомы +
пустоты.
Для ОЦК Vат/Vстр = 0,62;
для ГЦК Vат/Vстр = 0,74.
Кристаллографические плоскости и направления в решетках характеризуются разными
расстояниями между атомами, поэтому они имеют различное количество атомов, приходящихся на
единицу площади, т.е. различную ретикулярную плотность.
Размещение атомов в различных плоскостях решетки ОЦК
металла: (100) (а), (110) (б), (111) (в)
а
б
в
17. Атомное строение металлов
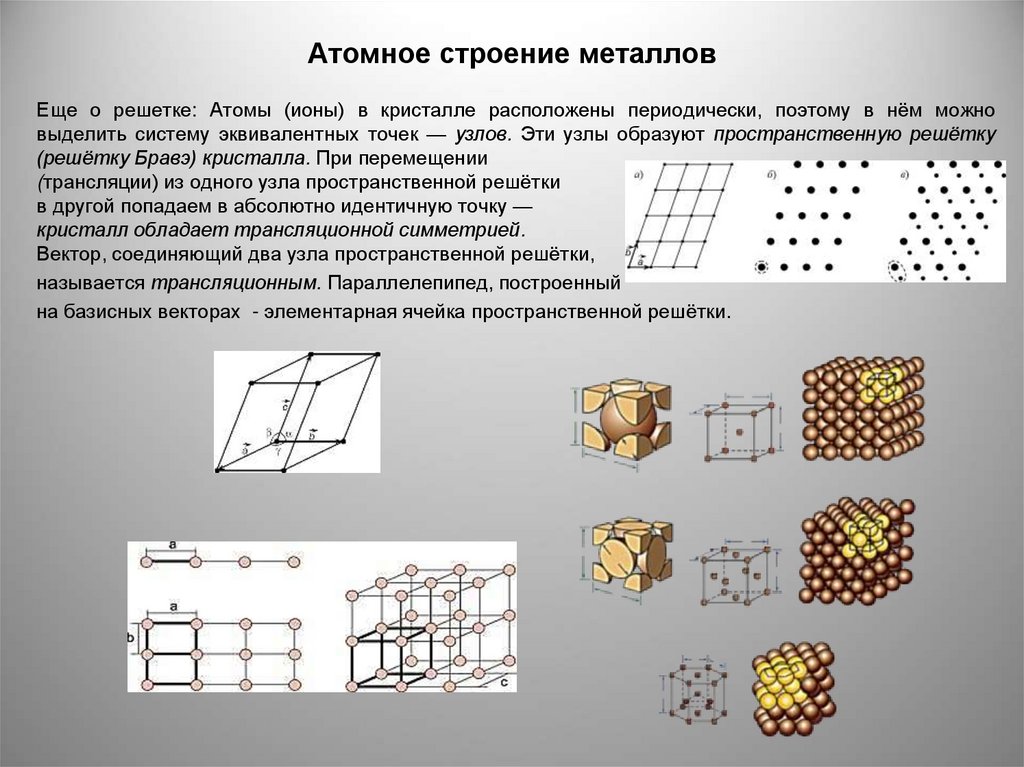
Еще о решетке: Атомы (ионы) в кристалле расположены периодически, поэтому в нём можновыделить систему эквивалентных точек — узлов. Эти узлы образуют пространственную решётку
(решётку Бравэ) кристалла. При перемещении
(трансляции) из одного узла пространственной решётки
в другой попадаем в абсолютно идентичную точку —
кристалл обладает трансляционной симметрией.
Вектор, соединяющий два узла пространственной решётки,
называется трансляционным. Параллелепипед, построенный
на базисных векторах - элементарная ячейка пространственной решётки.
18. АТОМИУМ В БРЮССЕЛЕ
Ато́миум — одна из главных достопримечательностей Брюсселя — был спроектирован коткрытию Всемирной выставки 1958 г как символ атомного века и мирного использования
атомной энергии. Сооружение, покрытое изначально алюминиевым слоем, а после
капитального ремонта — стальной оболочкой, состоит из девяти сфер («атомов», которые
объединены в конструкцию, изображающую кубический фрагмент кристаллической решётки Fe
(ОЦК), увеличенный в 165 млрд раз. Высота Атомиума -102 м, вес — около 2400 т,диаметр
каждой из девяти сфер — 18 м. Шесть из них являются доступными для посетителей. Сферы
соединены между собой трубами длиной 23 м, содержащими эскалаторами и соединительные
коридоры. Всего между шарами существует 20 соединительных труб. В средней из них
находится лифт, способный за 25 сек поднять посетителей к обзорной платформе,
находящимся в верхнем шаре Атомиума.
19. Атомное строение металлов
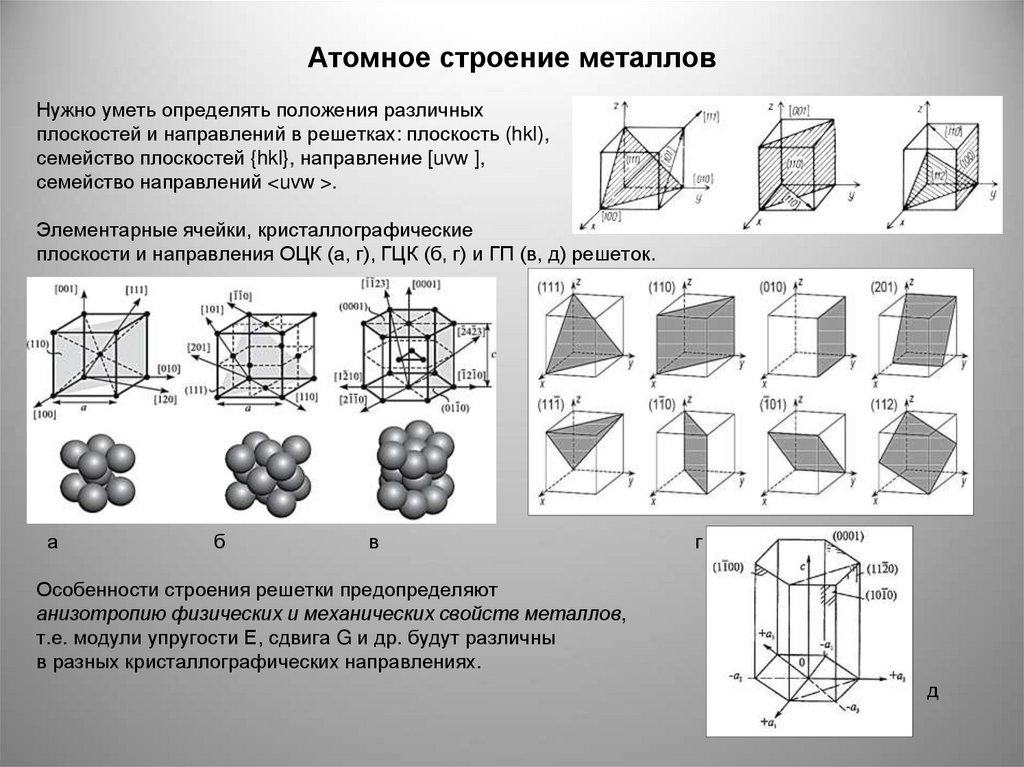
Нужно уметь определять положения различныхплоскостей и направлений в решетках: плоскость (hkl),
семейство плоскостей {hkl}, направление [uvw ],
семейство направлений <uvw >.
Элементарные ячейки, кристаллографические
плоскости и направления ОЦК (а, г), ГЦК (б, г) и ГП (в, д) решеток.
а
б
в
г
Особенности строения решетки предопределяют
анизотропию физических и механических свойств металлов,
т.е. модули упругости Е, сдвига G и др. будут различны
в разных кристаллографических направлениях.
д
20. Атомное строение металлов
Многие вещества металлы (как и неметаллы) при различных температурах и давленияхсуществуют в разных модификациях, отличающихся типом кристаллической решетки.
Полиморфи́зм - способность вещества существовать в различных кристаллических структурах,
называемых полиморфными модификациями (их принято обозначать греческими буквами α, β,
γ и т. д.). Он характерен для различных классов веществ. Полиморфизм для простых веществ
называют аллотропией. Частный случай полиморфизма, характерный для соединений со
слоистой структурой – это политипизм. Политипы отличаются между собой лишь порядком
чередования атомных слоёв. Примеры полиморфизма и политипизма элементов – железа (а),
титана (б) и углерода (в).
а
б
в
Металлы могут находиться в виде монокристаллов. Реальные металлы состоят из множества
кристаллов – это поликристаллические материалы.
Монокр. тугоплавких металлов монокр.
нитевидные монокристаллы поликристал. металл
21. Атомное строение металлов
В твердом состоянии металлы могут существовать, не имея кристаллической решетки. Их называютаморфными или металлическими стеклами. Их можно получить из газообразного, жидкого и твердого
состояния. Наиболее распространенными являются методы получения из жидкого состояния (из
расплава), общим приемом которых является быстрое соприкосновение малой порции жидкости с
хорошо отводящей тепло средой (холодильником). При этом скорости охлаждения составляют
105…106 К/с.
Из твердого кристаллического состояния аморфные сплавы получают при различного рода
высокоэнергетических воздействиях: облучение, большие пластические деформации.
Аморфное состояние является структурно метастабильным и термодинамически неравновесным. В
настоящее время общепринятой считается поликластерная модель аморфного состояния,
структурным элементом которой является икосаэдр, тетраэдр, октаэдр, трехгранная призма и т.д., из
которых нельзя собрать кристалл, так как они имеют симметрию 5, 7-го и т.д. порядка, несовместимую
с периодичностью.
Первым аморфным металлом был получен никель, затем
разработаны сплавы переходных металлов, а также сплавы на основе
меди, содержащие электроположительные элементы (теллур, бор, кремний,
углерод, германий, фосфор, олово).
В рамках настоящей дисциплины изучаем твердое кристаллическое состояние
металлов.
22. Структура металлов
Структура металлов и сплавов изучается на различных масштабных уровнях.
- Атомная структура: определяется типом металла и его агрегатным состоянием.
Газообразный металл имеет такую же структуру, как у газов других элементов, для которых
характерно отсутствие ближнего и дальнего порядка в расположении атомов, атомы
нейтральны, он состоит из электрически нейтральных атомов; межатомные связи типа
Ван-дер-Ваальса.
В жидком состоянии для металлов характерно отсутствие дальнего и наличие ближнего
порядка в расположении атомов, степень которого характеризует координационное число (КЧ)
- это число ближайших соседей у любого атома. При небольшом перегреве выше tпл (~10 – 50
С) структура жидкости состоит из кластеров (микрогруппировки атомов с плотной упаковкой,
напоминающей твердое состояние) и разупорядоченной зоны. Размеры кластеров порядка
20…50 А и объем разупорядоченной зоны около 3…6%.При большом перегреве выше tпл При
значительных перегревах жидкого металла выше tпл происходит "размытие" координаций в
микрогруппировках атомов, характерных для низкотемпературного состояния жидкости, КЧ
уменьшается. Структура расплава менее упорядочена, но есть группировки с более плотной
упаковкой атомов – фазовые флуктуации .
Тип связи металлический.
23. Структура металлов
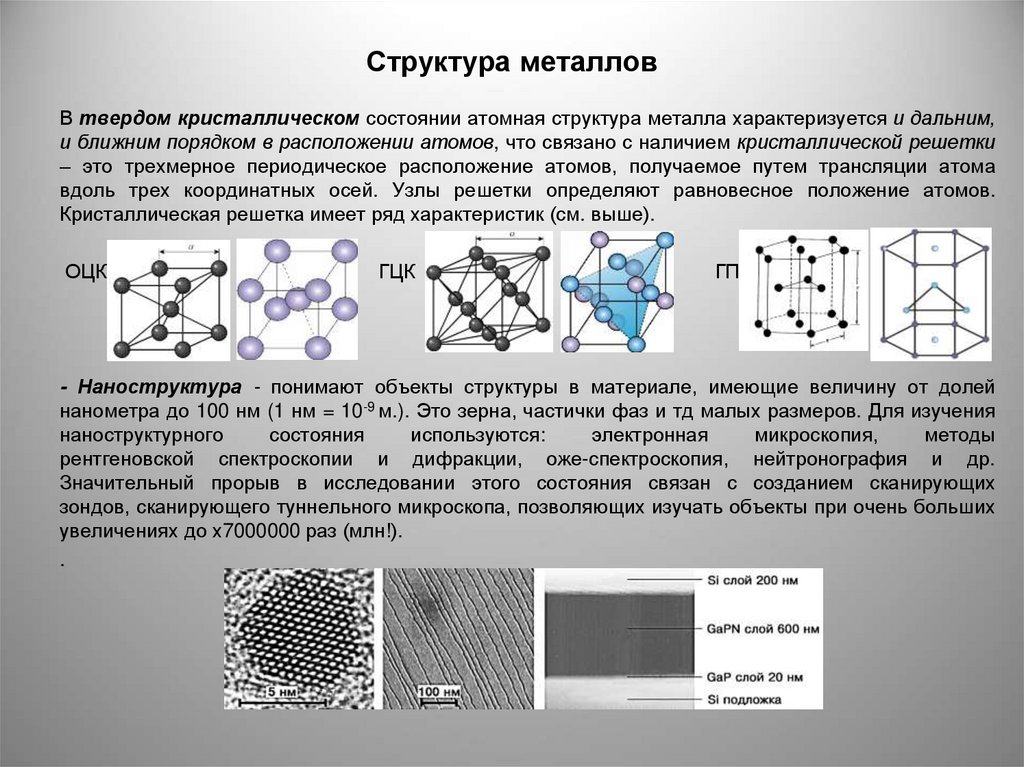
В твердом кристаллическом состоянии атомная структура металла характеризуется и дальним,и ближним порядком в расположении атомов, что связано с наличием кристаллической решетки
– это трехмерное периодическое расположение атомов, получаемое путем трансляции атома
вдоль трех координатных осей. Узлы решетки определяют равновесное положение атомов.
Кристаллическая решетка имеет ряд характеристик (см. выше).
ОЦК
ГЦК
ГП
- Наноструктура - понимают объекты структуры в материале, имеющие величину от долей
нанометра до 100 нм (1 нм = 10-9 м.). Это зерна, частички фаз и тд малых размеров. Для изучения
наноструктурного
состояния
используются:
электронная
микроскопия,
методы
рентгеновской спектроскопии и дифракции, оже-спектроскопия, нейтронография и др.
Значительный прорыв в исследовании этого состояния связан с созданием сканирующих
зондов, сканирующего туннельного микроскопа, позволяющих изучать объекты при очень больших
увеличениях до х7000000 раз (млн!).
.
24. Структура металлов
- Тонкая структура (субструктура) – выявляется в пределах группы атомов и локальныхобластей кристалла с помощью оптического микроскопа при увеличениях х500…2000, либо
электронного микроскопа при увеличениях х5000…60000. Для этого готовят тонкие фольги ( их
толщина порядка 0,01…0,1 мм ), которые изучают на просвет при прохождении через фольгу
потока электронов. Этот метод исследования называется трансмиссионная электронная
микроскопия. Тонкая структура позволяет выявить дефекты кристаллического строения,
различного рода границы, субграницы в кристалле.
Тонкая структура - размер объектов до 10-10 м, или 0,1 нм.
-
х50000
х100000
25. Структура металлов
- Микроструктура – выявляется с помощью оптического микроскопа при увеличенияхх10...1000. Исследования проводят на специальных микрошлифах; изображение формируется с
помощью световых лучей, отраженных от поверхности шлифа. Применяют также сканирующий
электронный микроскоп, этот метод исследования называется растровая электронная
микроскопия, позволяющая создает объемность изображения. Исследуется структура группы
зёрен, границы зёрен, фазы в сплавах.
Микроструктура - размер объектов до 10-7 м, или 0,1 мкм;
(~10-10…~10-7м)
- Мезоструктура
- структура внутри зерен, дислокации и их ансамбли, дисклинации, ячейки,
полигоны, их размеры и ориентация,(размеры объектов ~10-7…~10-3 м);
26. Структура металлов
- Макроструктура – это структура, которая выявляется при
небольших увеличениях в несколько раз, либо невооруженным глазом. Макроструктура размер объектов до 10-4 м, или 0,1 мм; ( ~10-3…~10-1 м)
Все масштабные уровни исследования структуры металлов органически взаимосвязаны





















 chemistry
chemistry








