Similar presentations:
Профилактические и лечебные иммунобиологические препараты
1. Профилактические и лечебные иммунобиологические препараты
УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТКАФЕДРА МИКРОБИОЛОГИИ, ВИРУСОЛОГИИ И ИММУНОЛОГИИ
Профилактические и лечебные
иммунобиологические препараты
2.
Иммунобиологические препараты(ИБП) представляют собой группу
препаратов биологического
происхождения, предназначенных для
иммунологической диагностики,
профилактики и лечения
инфекционных и неинфекционных
заболеваний.
3.
Препараты, используемыедля специфической
профилактики
инфекционных заболеваний
4.
Вакцина — медицинский препарат,предназначенный для создания
иммунитета к инфекционным болезням.
При использовании вакцин
формируется
искусственный активный
иммунитет
5.
Требования, предъявляемые к вакцинам:иммуногенность (иммунологическая эффективность) - в
80–95 % случаев вакцины должны создавать
напряженный и длительный специфический иммунитет,
который эффективно защитит от заболевания,
вызываемого «диким» штаммом патогена;
низкая реактогенность;
не должны обладать тератогенностью, онкогенностью;
штаммы, из которых приготовлена вакцина, должны
быть генетически стабильны;
длительный срок хранения;
простота и доступность в применении.
6.
С точки зрения иммунологии вакцина должнаудовлетворять следующим требованиям:
активировать вспомогательные клетки
(макрофаги, дендритные клетки), участвующие в
процессинге и представлении антигена,
содержать структуры, распознаваемые АПК;
содержать протективные эпитопы для Т- и Влимфоцитов;
эффективно презентироваться: легко
подвергаться процессированию, эпитопы должны
взаимодействовать с антигенами МНС;
индуцировать образование регуляторных,
эффекторных клеток и клеток иммунологической
памяти.
7. Классификации вакцин
По цели применения:1. В плановом порядке, согласно календарю прививок, всем лицам, указанным в календаре
и не имеющим противопоказаний.
Календарь прививок — инструктивно-нормативный документ, который издается в виде
приказа Министерства здравоохранения и регламентирует виды прививок,
эпидемиологически оправданные в настоящее время. Календарь прививок периодически
пересматривается, исходя из эпидемической ситуации и экономических возможностей
государства.
2. По эпидемическим показаниям прививки делают:
контактным лицам в очагах при возникновении вспышки вакциноуправляемой
инфекции;
группам риска накануне эпидемии гриппа (напр., медработникам, группам высокого
риска неблагоприятных последствий заболевания);
профессиональным группам риска (напр., вакцинация против ВГВ студентов
медуниверситетов);
выезжающим в неблагополучные регионы и страны с широким распространением
заболевания (напр., вакцинация против клещевого энцефалита).
3. «Туровая» вакцинация с целью допривить неохваченные вакцинацией группы
населения.
8. Классификации вакцин
По составу:моновакцины — содержат антигены одного
серовара (BCG, «Энджерикс В»);
поливакцины (поливалентные) — содержат
антигены нескольких сероваров (вакцины против
гриппа – состав тип A/Victoria/2019 (H1N1)pdm09;
тип A/Cambodia/2020 (H3N2); тип B/Washington/2019);
ассоциированные (комбинированные, комплексные,
многокомпонентные) — содержат антигены
нескольких видов (адсорбированная коклюшнодифтерийно-столбнячная вакцина (АКДС-вакцина).
9. Классификации вакцин
По способу получения:корпускулярные, то есть состоящие из цельных
микроорганизмов возбудителя (гриппозные
цельновирионные вакцины);
компонентные или бесклеточные состоят из частей
возбудителя, его антигены (Адсорбированные
ацеллюлярные коклюшно-дифтерийно-столбнячные
вакцины, которые содержат бесклеточный
коклюшный компонент).
10. Классификации вакцин
По способу введения в организм вакциныделят на: накожные, внутрикожные,
подкожные, внутримышечные,
интраназальные, пероральные.
Выбор метода иммунизации зависит от
иммуногенности вакцины и степени ее
реактогенности.
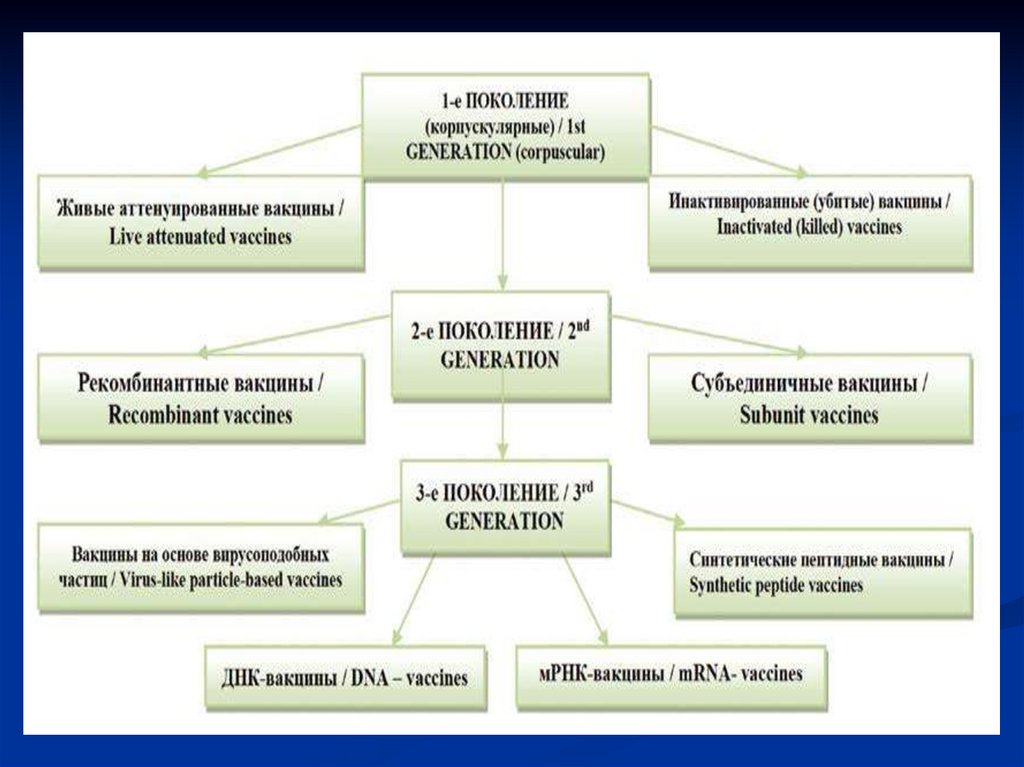
11. Классификации вакцин
В зависимости от природы иммуногенавакцины подразделяются на:
живые (аттенуированные);
убитые (инактивированные);
расщепленные (сплит-вакцины);
субъединичные вакцины;
анатоксины;
рекомбинантные;
конъюгированные;
вакцины с искусственным адъювантом.
12. Живые вакцины
Аттенуированные вакцины - препараты,действующим началом в которых являются
ослабленные тем или иным способом, потерявшие
свою вирулентность, но сохранившие
иммуногенность штаммы микроорганизмов.
Примером живых вакцин могут служить вакцины
для профилактики краснухи ( Рудивакс),
кори ( Рувакс), вакцина бруцеллёзная живая,
BCG (БЦЖ– живая туберкулёзная вакцина), на
основе Mycobacterium bovis.
13.
Аттенуация (латинский attenuatio уменьшение, ослабление) — стойкоенеобратимое ослабление вирулентности
патогенных микроорганизмов.
Впервые аттенуированные штаммы
микроорганизмов были получены Л.
Пастером (1881, 1885), применившим их в
качестве вакцинных для борьбы с
сибирской язвой и бешенством.
14.
Аттенуация достигается путем:использования питательных сред
неблагоприятного для микроорганизма
состава;
использования неблагоприятной
температуры выращивания;
культивирования микроорганизмов в
организме невосприимчивых
животных.
15. Живые вакцины
Дивергентные вакциныИх изготавливают на базе родственных
возбудителей инфекционных патологий штаммов.
Их антигены провоцируют возникновение
иммунного ответа, перекрестно направленного на
антигены возбудителя.
Примером подобных вакцин является вакцина
против натуральной оспы, которая была
изготовлена на базе вируса коровьей оспы.
16. Живые вакцины
Живые вакцины высоко иммуногенны.Размножение вакцинного штамма в организме
обеспечивает напряженный и довольно длительный
(иногда пожизненный) иммунитет, иногда требуется лишь
одна ревакцинация.
В тканях, где происходит размножение вакцинного
штамма, развивается местный иммунитет. Так, при
иммунизации живым аттенуированным вирусом
полиомиелита в носоглотке устанавливается высокий
уровень sIgA.
Иногда поствакцинальный иммунитет носит
нестерильный характер, т. е. при сохранении вакцинного
штамма возбудителя в организме (BCG).
17. Живые вакцины
Преимущества:высокая эффективность - под воздействием
живых вакцин активируются все типы
иммунитета т.е. они вызывают и
клеточный и гуморальный иммунитет;
необходима минимальная дозировка;
возможность разнообразных способов
вакцинации (внутрикожный, пероральный,
аэрозольный);
быстрое вырабатывание иммунного ответа.
18. Живые вакцины
Отрицательные стороны:в случае наличия у пациента ослабленного иммунитета
при введении живой вакцины возможно развитие
болезни из-за реверсии вирулентных форм возбудителя.
По этой причине пациенты с иммунодефицитами (при
СПИДе и опухолях) не должны получать такие
вакцины;
живые вакцины чувствительны к действию высоких
температур и требуют неукоснительного соблюдения
холодовой цепи;
невозможность комбинирования подобных вакцин с
другими вакцинными препаратами, ввиду развития
побочных реакций.
19. Классификация вакцин
Инактивированные (убитые) вакцины –препараты, в качестве действующего
начала включающие убитые химическим
или физическим способом культуры
патогенных вирусов или бактерий.
К ним относятся: Хаврикс - вакцина от
гепатита А; Ваксигрипп - вакцина от
гриппа; вакцины против коклюша;
клещевого энцефалита; холеры.
20. Инактивированные вакцины
«Убитые» вакцины по составу могут быть каккорпускулярными ( цельноклеточные, цельновиральными),
так и субъединичными (компонентными) и генноинженерными (рекомбинантными).
Инактивация возбудителя осуществляется несколькими
способами:
перегревом, то есть воздействием на культивируемый
микроорганизм повышенной температурой (56-60 0 С);
воздействие формалином в течение 28-30 суток с
поддержанием температурного режима на уровне 40 0 С,
спиртом, ацетоном, хлороформом.
21. Инактивированные вакцины
Корпускулярные (цельноклеточные,цельновирионные) вакцины – приготовлены
из убитых вирулентных микроорганизмов
(бактерий или вирусов) и содержат полный
набор антигенов.
Примерами корпускулярных вакцин являются:
коклюшная (компонент АКДС); антирабическая;
гриппозные цельновирионные; вакцины против
клещевого энцефалита; против гепатита А;
инактивированная полиовакцина.
22. Инактивированные вакцины
Субъединичные вакцины – состоят изотдельных антигенных компонентов,
способных обеспечить развитие иммунного
ответа. Для придания этим вакцинам более
высокой иммуногенности их сочетают с
адъювантами.
Пример:
вакцины против гриппа (Гриппол, Инфлювак,
Агриппол).
23.
Адъюва́нт— соединение, используемое для
усиления иммунного ответа на вводимый
антиген.
Основное свойство большинства
адъювантов - способность их адсорбировать
антиген на своей поверхности и длительное
время сохранять в организме, что
увеличивает продолжительность его
влияния на иммунную систему.
Адъювантами могут быть неорганические
(соединения алюминия и кальция) и
органические (агар) вещества.
24.
Минеральные адъюванты (алюминевыеквасцы) усиливают фагоцитоз;
Вирусоподобные адъюванты —
цитотоксический Th1-зависимый тип
ответа иммунной системы;
Маслянные эмульсии ( ланолин,
эмульгаторы) – Th2- и Th1-зависимый тип
ответа (где усиливается тимусозависимый
гумopaльный иммунитет);
Наночастицы, в которые включен антиген
— Th2- и Th1-зависимый тип ответа.
25. Инактивированные вакцины
Молекулярные вакцины – в них антигеннаходится в молекулярной форме или даже в виде
фрагментов его молекул, определяющих
специфичность т. е. в виде эпитопов.
Приготовление субклеточных и субвирионных
вакцин сложнее, чем цельноклеточных и
цельновирионных, однако такие вакцины содержат
меньше балластных компонентов микроорганизмов.
В настоящее время используют субклеточные
инактивированные вакцины против брюшного тифа
(на основе О-, Н- и Vi-антигенов).
26. Инактивированные вакцины
Конъюгированные вакцины — комбинации бактериальныхполисахаридов с иммуногенным белком-носителем (обычно
анатоксином другого типа микроорганизмов).
Некоторые бактерии (гемофильная палочка, пневмококки)
имеют антигены, которые плохо распознаются иммунной
системой человека. В современных вакцинах полисахариды
конъюгируют с иммуногенным белком-носителем, хорошо
распознаваемым иммунной системой.
В результате иммуногенность конъюгированных вакцин
повышается, а при их введении индукцируется Т-клеточная
иммунологическая память.
Примеры конъюгированных вакцин: Превенар — вакцина
для профилактики пневмококковой инфекции
(конъюгирована с дифтерийным анатоксином).
27. Классификация вакцин
Генно-инженерные (рекомбинантные)вакцины содержат антигены возбудителей,
полученные с использованием методов
генной инженерии, и включают только
высокоиммуногенные компоненты,
способствующие формированию
иммунного ответа.
28. Генно-инженерные вакцины
Пути создания генно-инженерных вакцин:Внесение генов вирулентности в авирулентные или
слабовирулентные микроорганизмы (векторные
вакцины).
Внесение генов вирулентности в неродственные
микроорганизмы с последующим выделением антигенов и
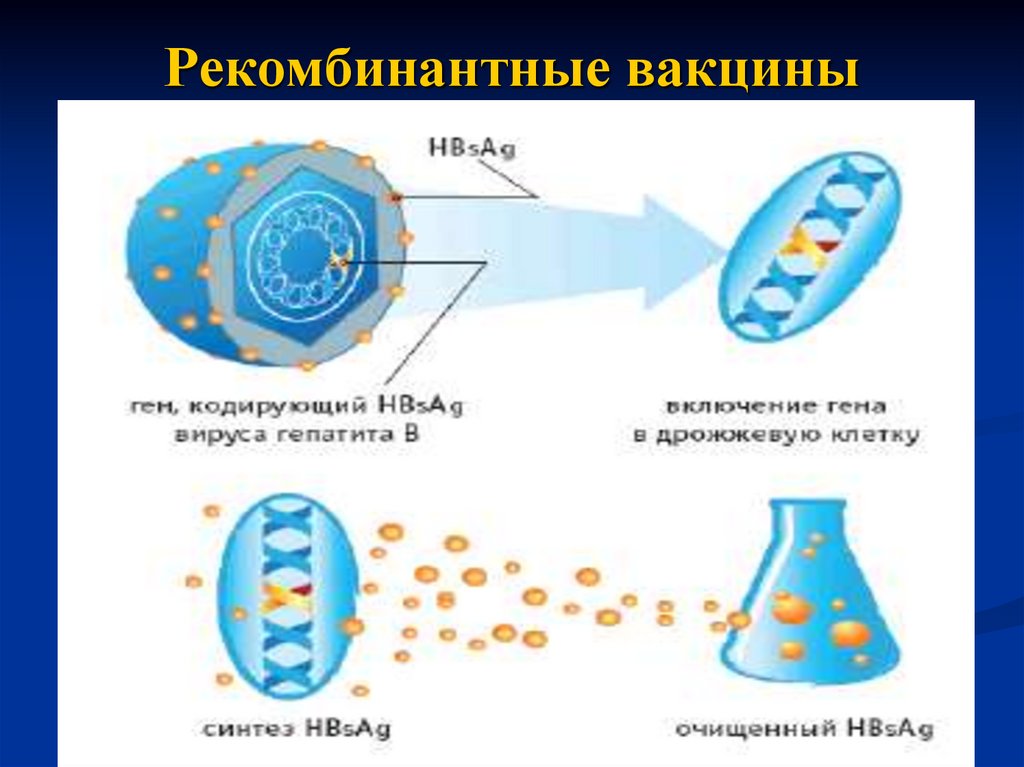
их использованием в качестве иммуногена. Например, для
иммунопрофилактики гепатита В предложена вакцина,
представляющая собой HBsAg вируса. Его получают из
дрожжевых клеток, в которые введен вирусный ген (в
форме плазмиды), кодирующий синтез HBsAg. Препарат
очищают от дрожжевых белков и используют для
иммунизации.
29. Рекомбинантные вакцины
30. Генно-инженерные вакцины
Искусственное удаление генов вирулентности ииспользование модифицированных организмов в
виде корпускулярных вакцин. Селективное
удаление генов вирулентности открывает
широкие перспективы для получения стойко
аттенуированных штаммов шигелл, токсигенных
кишечных палочек, возбудителей брюшного
тифа, холеры и др. бактерий. Возникает
возможность для создания поливалентных
вакцин для профилактики кишечных инфекций.
31. Инактивированные вакцины
Положительные стороны:инактивированные вакцины легче дозировать и
очищать;
они длительно хранятся;
менее чувствительны к температурным
колебаниям.
Отрицательные стороны:
вакцинация проводится в 2 или 3 приема;
требуются ревакцинации.
32. Классификация вакцин
АнатоксиныПринцип получения – токсин
соответствующей бактерии в молекулярном
виде превращают в нетоксичную, но
сохранившую иммуногенность форму путем
воздействия 0,4% формальдегида при
37- 50 оС в течение 3-4 недель.
Пример:
АДС –дифтерийно-столбнячный анатоксина
33. Анатоксины
При введении в организм человека илиживотных анатоксины вызывают образование
антитоксического иммунитета (антитоксинов),
это свойство и позволяет применять их для
профилактики тех инфекционных заболеваний,
в основе которых лежит действие экзотоксинов,
выделяемых возбудителями, а также для
гипериммунизации животных - продуцентов
антитоксических сывороток.
34. Анатоксины
Преимущества анатоксинов – более устойчивык колебаниям температуры, не требуют
специальных условий для хранения.
Недостатки анатоксинов — индуцируют только
антитоксический иммунитет, что не исключает
возможности возникновения локализованных
болезней у привитого, а также носительство им
возбудителей данного заболевания.
35. Рекомбинантные векторные вакцины
Вектор — микроорганизм, который не является причинойболезни у человека и используется в качестве носителя для
транспорта в организм человека генов, кодирующих
антигены патогенов. В качестве вектора могут
использоваться безопасные для человека вирусы
(аденовирусы, плазмиды).
Ген, отвечающий за антигенные свойства микроорганизма,
встраивают в геном вектора.
Векторные микроорганизмы размножаются в организме
привитого, индуцируя иммунитет против носителя и тех
возбудителей, чьи гены встроены в геном.
36. Рекомбинантные векторные вакцины
При применении векторных вакцин существуетопасность: возможная патогенность носителя для
лиц с иммунодефицитами.
В перспективе предполагается использовать
векторы, в которые встроены не только гены,
контролирующие синтез антигенов возбудителя,
но и гены, кодирующие различные медиаторы
иммунного ответа (интерфероны, интерлейкины).
37. Вакцины на основе вирусоподобных частиц (virus like particle vaccine — VLPV)
Вирусоподобные частицы — это пустые частицы вирусов,состоящие из основных структурных белков, имитирующие
организацию и конформацию нативных вирусов.
На сегодняшний день сконструирован ряд VLP-вакцин
(например, против коронавирусов), которые вызывают
образование вируснейтрализующих антител и стимулируют
Т-клеточный цитотоксический ответ.
Создание VLPS-вакцин является перспективным
направлением, так как сохраняется конформационная
структура эпитопов, что имеет значение для
иммуногенности вакцин, кроме того, отсутствует риск
получения вирулентных ревертантов, что имеет место при
применении живых аттенуированных вакцин.
38. Пептидные вакцины
Пептидные вакцины — искусственно синтезированные из аминокислотпептидные фрагменты, соответствующие антигенным детерминантам
микроорганизмов. Они индуцируют иммунный ответ узкой
специфичности.
Получение синтетических пептидных вакцин:
выявление главной детерминанты (эпитопа протективного антигена),
ответственной за иммуногенность и расшифровка ее структуры;
проведение химического синтеза пептидных последовательностей
эпитопа;
химическая сшивка эпитопа с полимерным носителем.
Экспериментальные пептидные вакцины получены против дифтерии,
холеры, стрептококковой инфекции, пневмококковой инфекции,
сальмонеллезной инфекции, ВГВ, гриппа, клещевого энцефалита.
39. Пептидные вакцины
Преимущества синтетических вакцин:не содержат микроорганизмов и продуктов их жизнедеятельности, имеют
высокую степень стандартности;
исключаются трудности культивирования микроорганизмов и хранения
вакцин;
безопасны, так как отсутствует возможность реверсии в вирулентную форму и
остаточная вирулентность ввиду неполной инактивации;
использование 1–2 иммуногенных белков вместо целого микроорганизма
обеспечивает формирование специфического иммунитета и устраняет
образование антител к другим антигенам, что обеспечивает самую низкую
реактогенность;
к носителю можно присоединить несколько разных пептидов, которые способны
индуцировать формирование иммунитета к разным инфекциям.
Проблемы синтетических вакцин:
отсутствие полной информации о гомологии синтетических пептидов нативным
антигенам;
синтетические пептиды низкоиммуногенны т.к. имеют малую молекулярную
массу. Для повышения иммуногенности необходимы носители (адъюванты).
40.
Вакцины на основе технологии "обратная вакцинология"(от генома - к его продуктам).
Технология разработки этих вакцин базируется на ДНКсеквенировании – автоматическом определении
нуклеотидной последовательности полного генома
микроорганизма и свойств кодируемых каждым геном
белков.
Это дает возможность получения вакцин на основе
отдельного гена, кодирующего протективные белки, или
штамма с "вырезанным" геном, который отвечает за
вирулентность, но не влияет на репродукцию
микроорганизмов и их иммуногенность.
Выбранный ген экспрессируют в различных
гетерологичных системах, производят очистку
препарата и используют для иммунизации.
41. ДНК-вакцины
ДНК-вакцины - вакцины, действующим веществом которых являютсярекомбинантные плазмиды, содержащие ген или гены, кодирующие один или
несколько протективных антигенов, и способные стимулировать иммунный ответ
против инфекционного заболевания.
Преимущества ДНК-вакцин:
стабильны и неинфекционны;
дают возможность в перспективе получать многокомпонентные вакцины,
содержащие две или несколько плазмид, кодирующих разные антигены,
цитокины или другие биологически активные молекулы.
Проблемы ДНК-вакцин:
неизвестны сроки, в течение которых клетки организма будут вырабатывать
чужеродный белок;
не исключена онкогенная опасность: вводимая ДНК, встраиваясь в геном
клетки человека, может индуцировать развитие злокачественных опухолей.
42. РНК-вакцины
РНК-вакцина, вакцина на основе рибонуклеиновойкислоты (мРНК) - кодирующая белок, характерный для
патогена. Помимо собственно РНК, в вакцине присутствует
липидная оболочка, защищающая РНК от разрушения и
обеспечивающая проникновение РНК в клетку.
Когда вакцинная РНК попадает в клетку, клеточные
механизмы синтеза белков продуцируют закодированный в
РНК белок.
Этот белок действует как антиген— в организме формируется
иммунитет.
В дальнейшем, при попадании в организм патогена,
иммунная система опознаёт его по уже известному белку и
уничтожает инфекцию, не давая развиться заболеванию.
43.
44. Контроль качества вакцин
1 этап — доклинические испытания на животных.Вакцина-кандидат и все компоненты, которые используются при ее создании, проверяются
на токсичность, максимальную дозу, мутагенность, переносимость при введении
максимальных доз.
2 этап — клинические испытания на людях. В ходе клинических испытаний I фазы вакцину
впервые проверяют на ограниченной группе людей, уточняется дозировка, схема применения
препарата. Во время клинических испытаний II фазы вакцину испытывают у пациентов из
групп риска по данной инфекции. Завершают стадию экспериментов клинические испытания
III фазы , когда вакцина проверяется на большом числе здоровых пациентов. На всех этапах
клинических исследований обязательными требованиями являются информированное
согласие пациентов на участие в эксперименте и утверждение протокола этическим
комитетом.
Для правильного учета поствакцинальных осложнений проводятся испытания с
обязательным включением групп плацебо, которые получают препарат, лишенный
специфического иммуногена, но во всем остальном идентичный испытуемой вакцине.
В целях объективности учета проводятся «слепые» испытания: вакцинные препараты и
плацебо поступают на испытания в закодированном виде, а персонал, привлекаемый к
регистрации поствакцинальных осложнений, не информируется о содержимом вводимого
препарата до конца испытаний.
45. Контроль качества вакцин
3 этап — регистрация вакцины в стране-разработчике после успешногозавершения трех фаз клинических испытаний.
4 этап — лицензирование вакцины в других странах возможно только после
регистрации в стране-производителе. В ходе лицензирования вакцины в стране
проводится полное лабораторное и клиническое исследование вакцины, в ходе
которого оценивают безопасность и иммуногенность вакцины. Для проведения
контрольных испытаний выбирается группа участников исследования около 100–
200 человек, для которой показана вакцинация данным препаратом.
5 этап — постмаркетинговое (пострегистрационное) наблюдение осуществляется
как государственными органами здравоохранения, так и производителями
вакцин. Основная его задача — мониторинг числа тяжелых побочных реакций и
осложнений, возникающих при практическом применении вакцины. Некоторые,
исключительно редкие осложнения на вакцины, удается выявить только при
массовом применении, поскольку частота осложнений может быть ниже, чем
предельное число добровольцев в контрольных исследованиях.
46. Факторы, влияющие на формирование поствакцинального иммунитета
Факторы, зависящие от вакцины:Соответствие вакцинного штамма циркулирующему возбудителю.
Наличие протективных антигенов.
Иммуногенность. При естественной иммунизации или введении живых и
инактивированных вакцин организм отвечает на все виды антигенов,
входящих в состав микроорганизмов. При иммунизации субъединичными,
рекомбинантными, синтетическими и ДНК- вакцинами иммунитет менее
полноценен, так как он формируется под влиянием только отдельных
антигенов. Однако с точки зрения выработки протективного иммунитета
последние вакцины имеют преимущество.
Степень очистки вакцины во многом определяет ее качество и снижение
частоты побочных явлений при вакцинации.
Доза вакцины должна быть оптимальной, обеспечивающей протективный
эффект.
Длительность антигенного раздражения.
Кратность введения. Первичная иммунизация (первое введение вакцины)
называется праймингом. Бустерная иммунизация — это вторичная, третичная
и т. д. иммунизация.
47. Факторы, влияющие на формирование поствакцинального иммунитета
Факторы, зависящие от макроорганизма:состояние индивидуальной иммунореактивности
определяется генотипом организма, в связи с чем в
популяции всегда есть высоко реагирующие индивидуумы
(20 %), умеренно реагирующие (50–70 %), ареактивные (не
отвечающие на антиген) (10 %);
возраст. Хуже поствакцинальный иммунитет формируется
в периоды физиологических иммунодефицитов - у
маленьких детей и пожилых людей;
состояние организма в целом;
наличие противопоказаний.
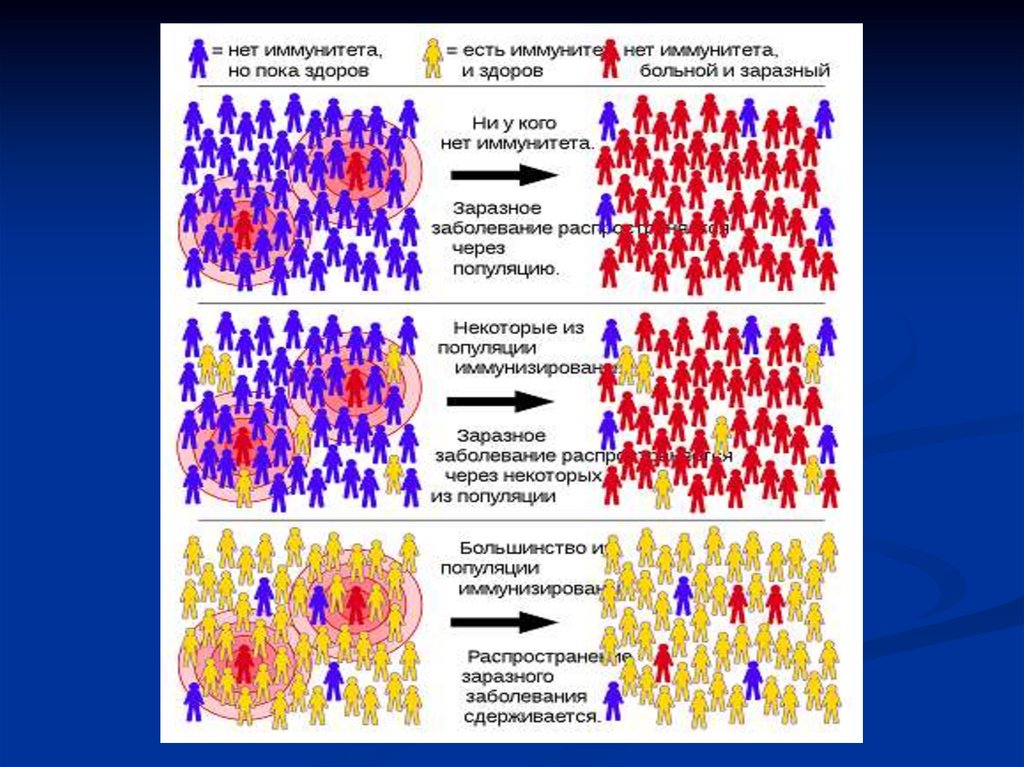
48. Коллективный иммунитет
Коллективный иммунитет (популяционный иммунитет, иммунитетнаселения]) —эффект сопротивления распространению инфекции в
некоторой популяции.
Зависит от особенностей передачи конкретной инфекции (высокая или
низкая заразность, способность вакцины не только облегчить болезнь, но
и предотвратить размножение вируса или бактерии), и от доли охваченных
вакцинацией в возрастной когорте или среди всего населения.
Так, для кори уровень охвата двумя дозами вакцины для полного
искоренения кори в одной стране оценивается в настоящее время, как
превышающий 95 %; для снижения смертности, охват двумя дозами
вакцины должен превышать 90 % на национальном уровне и 80 % в
каждом районе страны.
Для большинства инфекций вполне может хватить 80 % иммунных людей,
однако на практике не у всех будут вырабатываться достаточные титры
антител, и может потребоваться прививать не менее 95 %.
49.
50. Коллективный иммунитет
Появлению коллективного иммунитета могут препятствовать:антигенная изменчивость микроорганизма, в результате
которо штаммы микробов могут изменяться,
завоз инфекций из других стран,
большое количество непривитых людей,
большой процент людей, у которых нет антител или их титр
является низким,
активность антипрививочного движения.
Однако даже при достижении коллективного иммунитета
против какого-либо заболевания, оно не исчезает.
Единственным исчезнувшим благодаря коллективному
иммунитету заболеванием является натуральная оспа, что
было достигнуто благодаря массовой вакцинации.
51. Побочные явления при вакцинации
К побочным явлениям относятся поствакцинальные реакции и осложнения.Поствакцинальные реакции — изменения функционального состояния
организма, связанные с вакцинацией и не выходящие за пределы
физиологической нормы.
Степень выраженности и длительность поствакцинальных реакций зависят от
следующих факторов:
свойств препарата (природы вакцины, степени ее очистки, дозы).
индивидуальной чувствительности организма и возраста привитого.
Различают местные и общие поствакцинальные реакции.
Местные реакции классифицируются по диаметру инфильтрата (папулы).
Общие реакции проявляются в виде повышения температуры, общего
недомогания, головной боли, головокружения, кратковременного обморочного
состояния, тошноты, рвоты, катаральных явлений в носоглотке,
конъюнктивита, артрита, сыпи, гипотонии.
Слабые поствакцинальные реакции у лиц, не имеющих противопоказаний к
вакцинации и при правильном проведении прививок, не носят
патологического характера и не требуют терапевтического вмешательства.
В остальных случаях проводится симптоматическая терапия.
52. Побочные явления при вакцинации
Виды поствацинальных осложнений:аллергические реакции на компоненты вакцины: Наример,
анафилактический шок, который характеризуется проявлением
резкого возбуждения с последующим угнетением ЦНС, резким
падением артериального давления — коллапсом, иногда
сопровождается судорогами, бронхоспазмом, аллергической
сыпью, кишечными симптомами; может наступить смерть;
вовлечение в процесс различных систем и органов:
а) поражение ЦНС (неврит, энцефалит, менингоэнцефалит);
б) поражение костей (остеомиелит);
в) специфические осложнения со стороны органа, который является
объектом поражения при естественной инфекции: при гепатитах —
печеночные осложнения, при полиомиелите — симптомы
повреждения двигательных нейронов.
53.
Иммунобиологическиепрепараты на основе
антител
54.
К иммунобиологическимпрепаратам на основе антител
относятся:
иммунные сыворотки;
иммуноглобулины;
моноклональные антитела.
55.
При использовании иммунныхсывороток или
иммуноглобулинов
формируется
искусственный
пассивный иммунитет
56. иммунобиологические препараты на основе антител
Иммунные сыворотки получают путемгипериммунизации (многократной
интенсивной иммунизации) животных
(чаще всего лошадей,) специфическим
антигеном (анатоксином,
бактериальными или вирусными
антигенами).
57. иммунобиологические препараты на основе антител
В период максимальногоантителообразования производят забор
крови и выделение из нее иммунной
сыворотки.
Иммунные сыворотки, полученные от
животных, называют гетерологичными, так
как они содержат чужеродные для человека
сывороточные белки.
58.
С целью предупреждения развития анафилактического шока привведении иммунных сывороток используют метод Безредки для
определения реакции больного на введение сыворотки.
Для этого в шприц набирают 0,1 мл разведённой в 100 раз
иммунной сыворотки, вводят её под кожу и через 20 мин
оценивают реакцию.
Если у больного диаметр образовавшегося бугорка не превышает
0,9 см, не снижается АД, то вводят 0,1 мл неразведённой
сыворотки, а еще через 30-60 мин. при отсутствии реакции - всё
остальное количество препарата.
Безредка Александр Михайлович (1870-1940) - микробиолог и
иммунолог, разработал теорию местного иммунитета, методы
вакцинации против некоторых инфекционных заболеваний,
метод предупреждения анафилактического шока при введении
лечебно-профилактических сывороток. В 1916 году стал
заместителем директора в Институте Пастера в Париже.
59. иммунобиологические препараты на основе антител
Для получения гомологичных иммунныхсывороток используют сыворотки
переболевших людей (коревая, паротитная)
или иммунизированных людей-доноров
(противостолбнячная,
противоботулиническая сыворотки).
Гомологичные сыворотки предпочтительнее
гетерологичных.
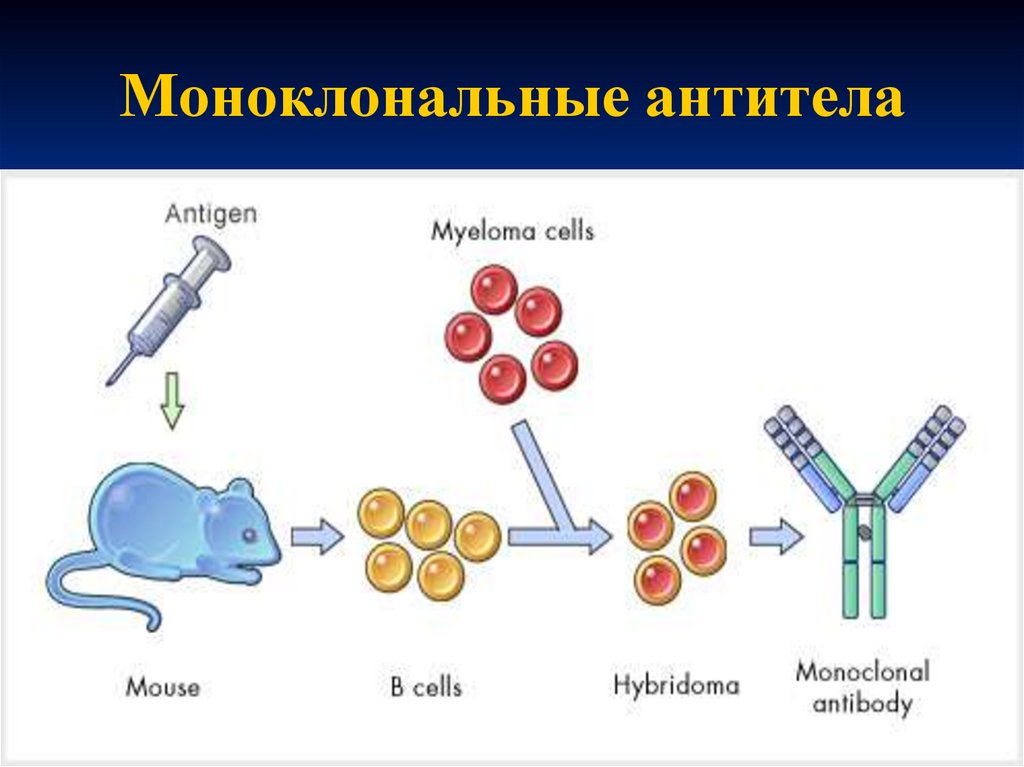
60. Моноклональные антитела
Антитела в организме в ответ на введениеантигена вырабатываются В-лимфоцитами.
Каждый В-лимфоцит синтезирует свой класс
и тип антител.
Для получения моноклональных
иммуноглобулинов, синтезируемых только
одним В-лимфоцитом, необходимо получить
клон этого В-лимфоцита.
С этой целью используют В-лимфоцит от
иммунизированного животного или
человека.
61. Моноклональные антитела
В условиях in vitro путем слияния Влимфоцита с миеломной клеткой получаютгибридные клетки (гибридомы).
Гибридомы способны быстро размножаться
в культуре клеток и продуцировать
иммуноглобулин, характерный только для
взятого В-лимфоцита.
Полученные моноклональные антитела
используют для создания диагностических
препаратов.
62. Моноклональные антитела
63. Области применения моноклональных антител
Диагностика:определение различных микроорганизмов;
определение типов опухолей;
типирование групп крови и тканей;
Терапия:
воздействие на отдельные клеточные популяции;
влияние на иммунные регуляторные механизмы с
помощью антител к лимфокинам;
направленный транспорт лекарственных веществ;
элиминация токсинов.
Научные разработки:
исследования этиологии и патогенеза различных
заболеваний;
создание новых лекарственных средств и биопрепаратов.



























































 medicine
medicine








