Similar presentations:
Оксид серы (IV).Сернистая кислота и её соли
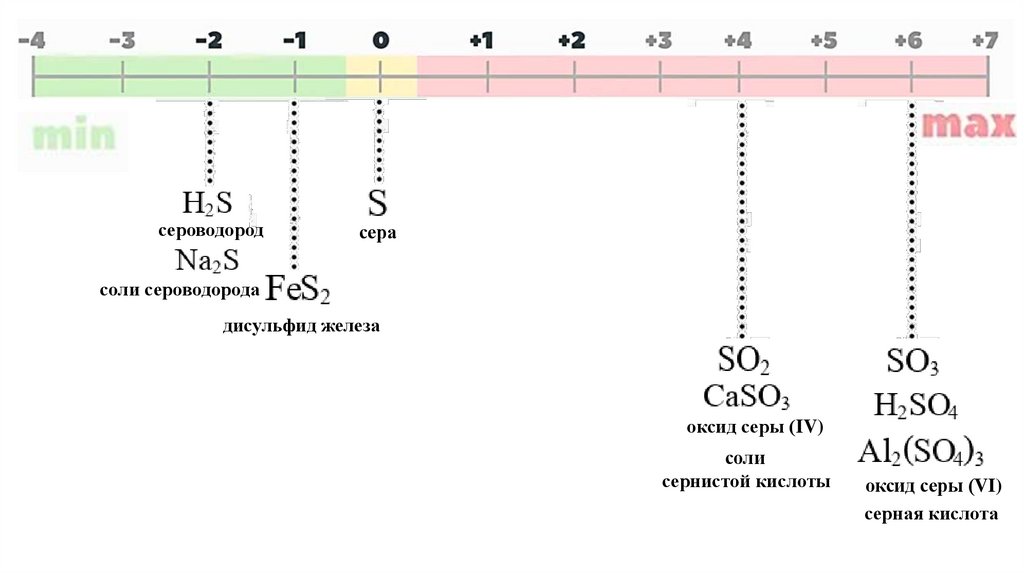
1.
сероводородсера
соли сероводорода
дисульфид железа
оксид серы (IV)
соли
сернистой кислоты
оксид серы (VI)
серная кислота
2.
- сернистый газ, диоксид серы, сернистый ангидридБесцветный газ с резким запахом, тяжелее воздуха.
Задача 1.
Вычислите относительную плотность диоксида серы по воздуху.
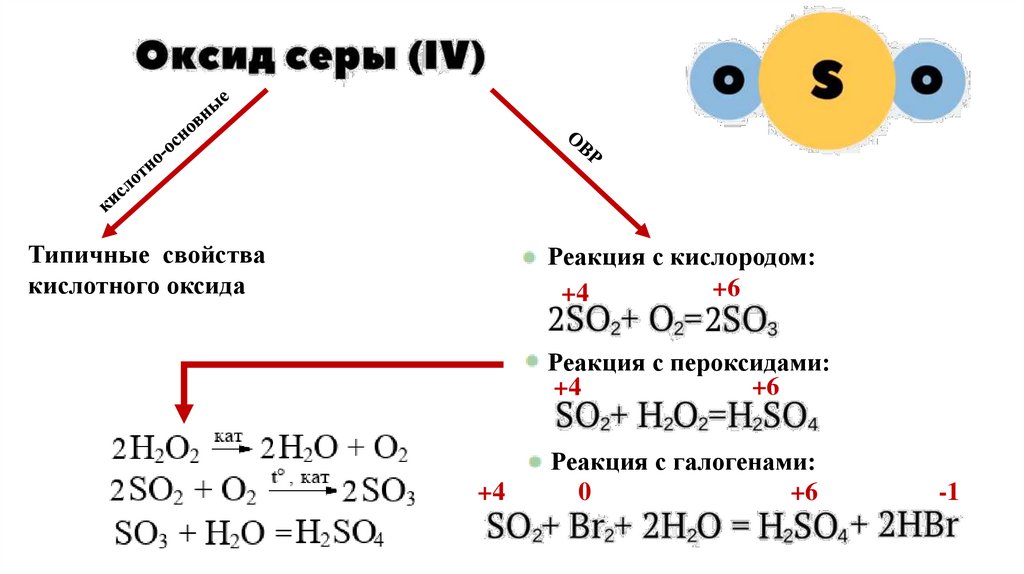
3.
Типичные свойствакислотного оксида
Реакция с кислородом:
+6
+4
Реакция с пероксидами:
+6
+4
+4
Реакция с галогенами:
0
+6
-1
4.
Горение серыГорение сероводорода
Из сульфитов и гидросульфитов:
5.
Неустойчивая кислота, которая при образованиираспадается:
2H+ +SO32- = SO2 + H2O
Сульфиты и гидросульфиты проявляют все свойства,
характерные для солей:
соль1 + кислота1 = соль2 + кислота2
соль1 + кислота1 = соль2 + кислота2
соль1 +
щелочь =
соль2 + основание2
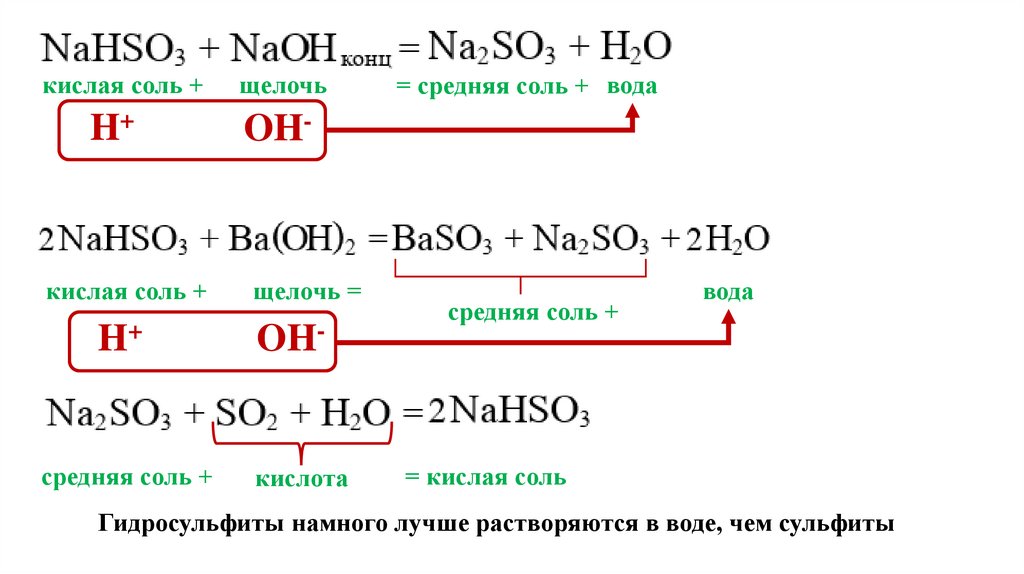
6.
кислая соль +H+
щелочь
OH-
кислая соль +
щелочь =
H+
OH-
средняя соль +
кислота
= средняя соль + вода
средняя соль +
вода
= кислая соль
Гидросульфиты намного лучше растворяются в воде, чем сульфиты
7.
Реакции разложения сульфитов игидросульфитов
Кислые соли
Средние соли
+4
-2
+6
*Средние соли металлов IIA – разложение на оксиды
8.
Пагубное влияние сернистого газаОсновной источник
– отходы тепловых
электростанций
Сернистый газ в атмосфере
окисляется,
далее
соединяется с молекулами
воды – сернистый газ
основной
источник
кислотных дождей
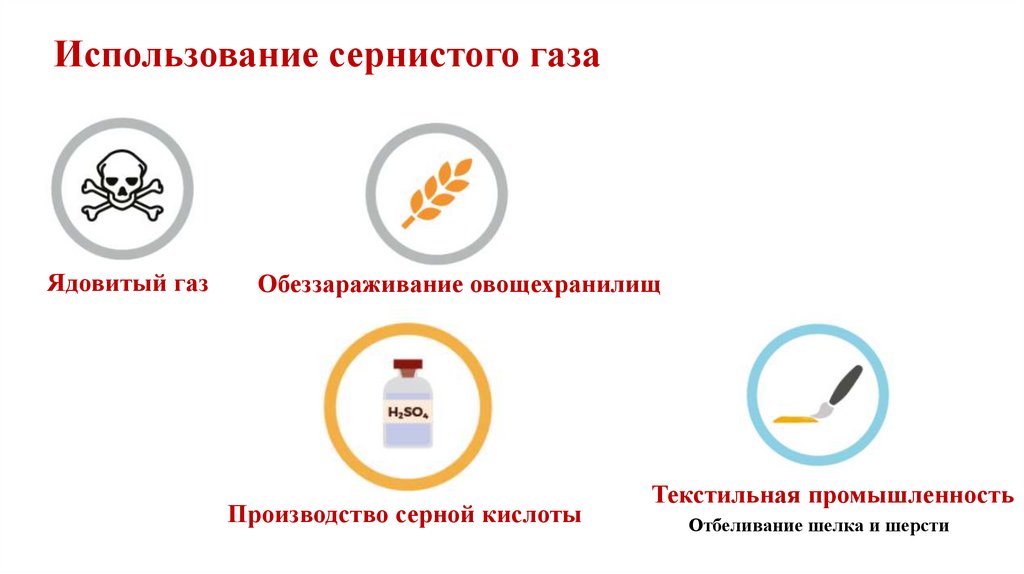
9.
Использование сернистого газаЯдовитый газ
Обеззараживание овощехранилищ
Производство серной кислоты
Текстильная промышленность
Отбеливание шелка и шерсти
10.
2. Осуществить превращения:3.






 chemistry
chemistry








