Similar presentations:
Металлы. Положение в ПСХЭ
1. Металлы
1. Положение в ПСХЭ2. Строение атома металла
3. Физические свойства металлов
4. Нахождение в природе
5. Способы получения металлов
6. Химические свойства металлов
7. Применение
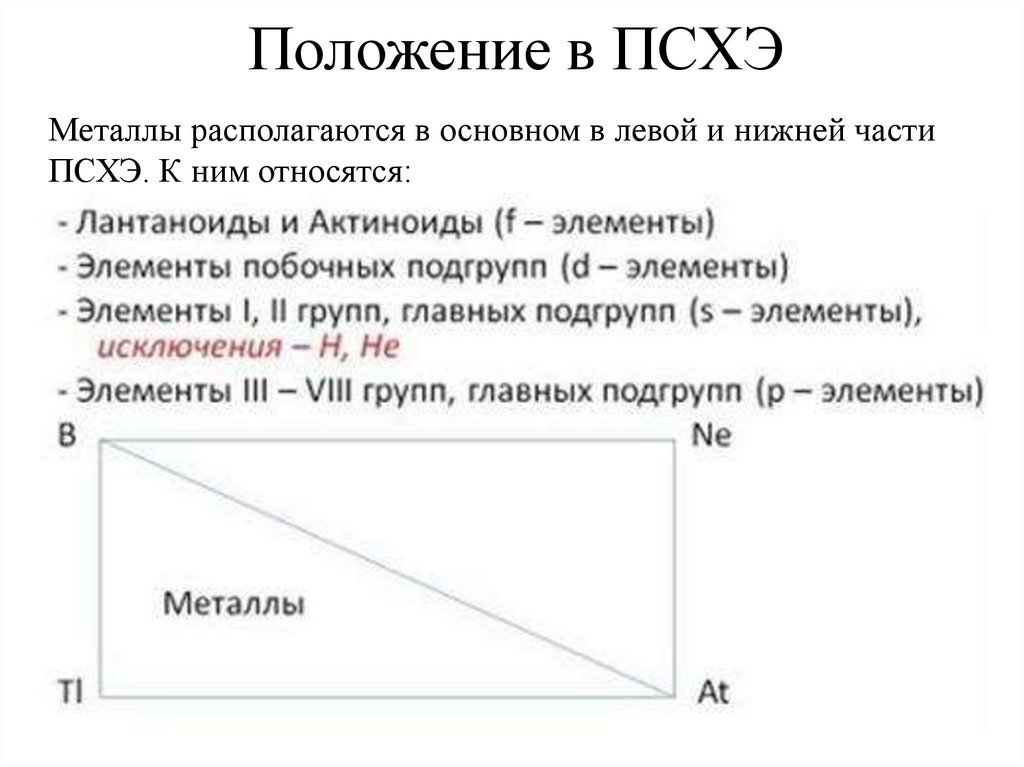
2. Положение в ПСХЭ
Металлы располагаются в основном в левой и нижней частиПСХЭ. К ним относятся:
3. Строение атома металла
У атомов металлов на наружном энергоуровне обычно 1-3электрона. Их атомы обладают большим радиусом и легко
отдают валентные электроны, т.е. проявляют
восстановительные свойства.
4. Физические свойства металлов
1. Металлическая кристаллическая решеткас металлической связью – это
совокупность положительно заряженных
ионов (катионов) нейтральных атомов
металла, свободно передвигающихся
электронов.
2. Ковкость и пластичность
3. Тепло- и электропроводность
4. Металлический блеск
5. Плавкие
5. Нахождение в природе
Самый распространённый в земной кореметалл – алюминий.
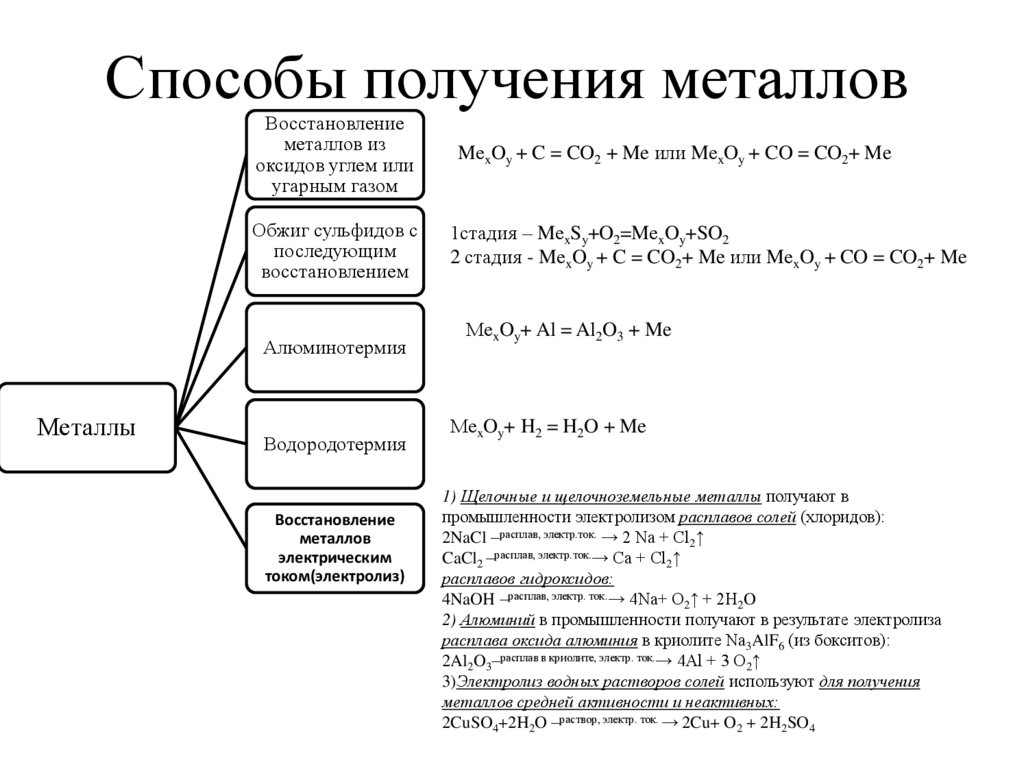
6. Способы получения металлов
Восстановлениеметаллов из
оксидов углем или
угарным газом
MеxOy + C = CO2 + Me или MеxOy + CO = CO2+ Me
Обжиг сульфидов с
последующим
восстановлением
1стадия – MеxSy+O2=MеxOy+SO2
2 стадия - MеxOy + C = CO2+ Me или MеxOy + CO = CO2+ Me
Алюминотермия
Металлы
Водородотермия
Восстановление
металлов
электрическим
током(электролиз)
MеxOy+ Al = Al2O3 + Me
MеxOy+ H2 = H2O + Me
1) Щелочные и щелочноземельные металлы получают в
промышленности электролизом расплавов солей (хлоридов):
2NaCl –расплав, электр.ток. → 2 Na + Cl2↑
CaCl2 –расплав, электр.ток.→ Ca + Cl2↑
расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na+ O2↑ + 2H2O
2) Алюминий в промышленности получают в результате электролиза
расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3–расплав в криолите, электр. ток.→ 4Al + 3 O2↑
3)Электролиз водных растворов солей используют для получения
металлов средней активности и неактивных:
2CuSO4+2H2O –раствор, электр. ток. → 2Cu+ O2 + 2H2SO4
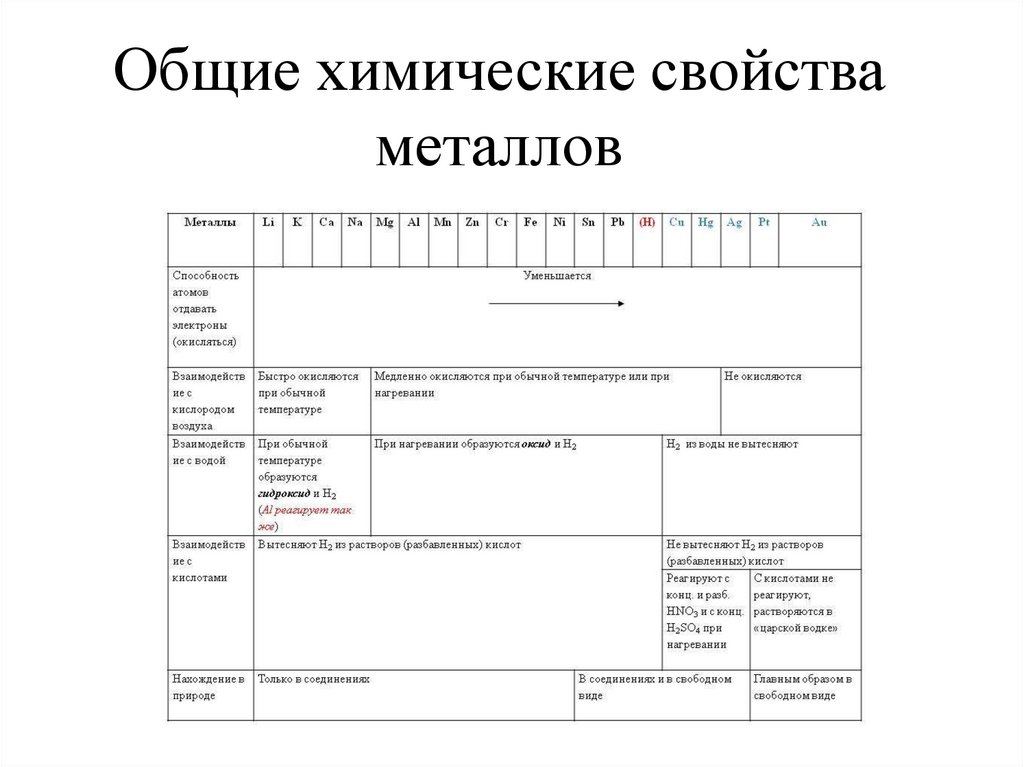
7. Общие химические свойства металлов
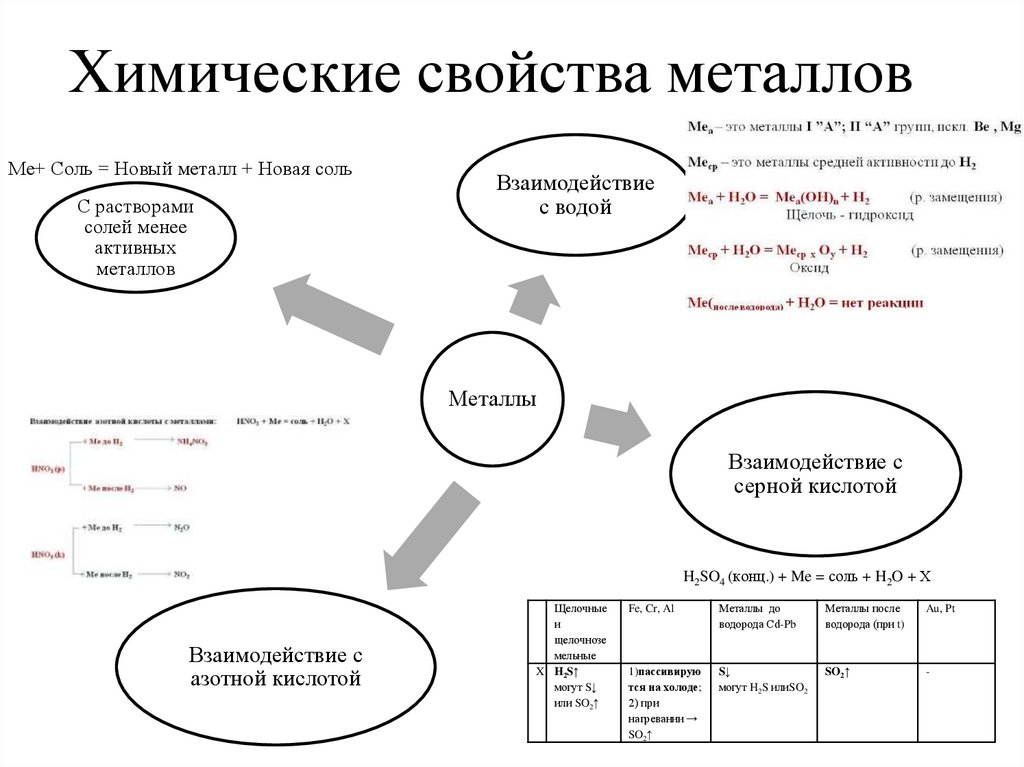
8. Химические свойства металлов
Ме+ Соль = Новый металл + Новая сольС растворами
солей менее
активных
металлов
Взаимодействие
с водой
Металлы
Взаимодействие с
серной кислотой
H2SO4 (конц.) + Me = соль + H2O + Х
Взаимодействие с
азотной кислотой
Щелочные
и
щелочнозе
мельные
X H2S↑
могут S↓
или SO2↑
Fe, Cr, Al
Металлы до
водорода Сd-Pb
Металлы после
водорода (при t)
Au, Pt
1)пассивирую
тся на холоде;
2) при
нагревании →
SO2↑
S↓
могут H2S илиSO2
SO2↑
-
9. Применение
СтанкостроениеМеталлургическая
промышленность
Для
получения
сплавов
Металлы
Домашнее
хозяйство
Сельское
хозяйство




 chemistry
chemistry








