Similar presentations:
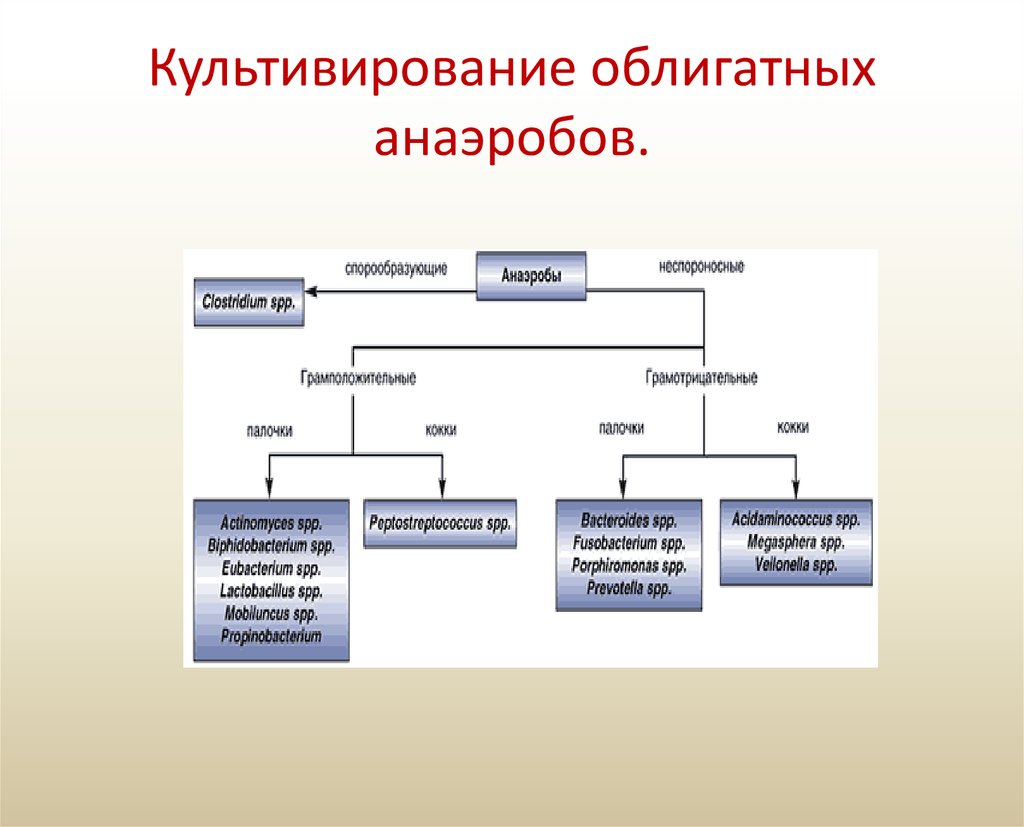
Культивирование облигатных анаэробов
1. Культивирование облигатных анаэробов.
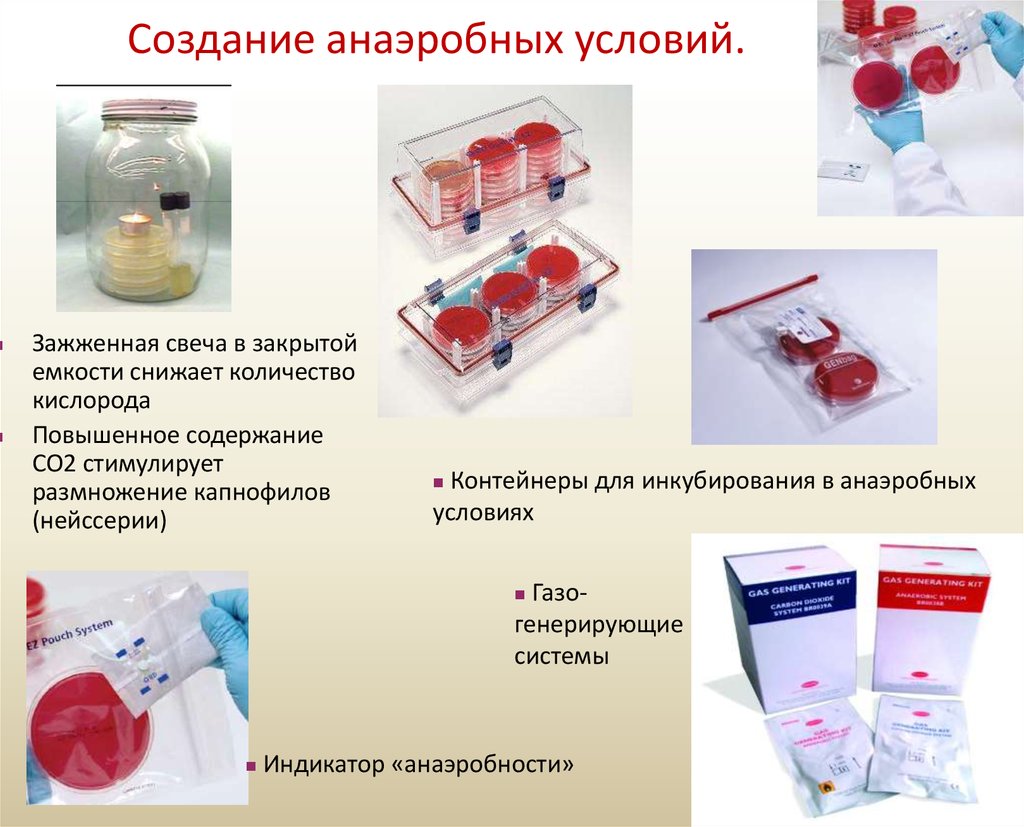
2. Создание анаэробных условий
Кислород удаляется прикипячении жидкой
питательной среды вследствие
снижения его растворимости в
воде.
После посева поверхность
среды заливается
вазелиновым маслом или
парафином для
предотвращения попадания
кислорода в ходе инкубации.
Посев в высокий столбик
полужидкой или плотной
питательной среды
Можно культивировать
сравнительно нетребовательные к
анаэробным условиям
микроорганизмы (например,
некоторых представителей родов
Clostridium и Bifidobacterium).
На фото рост клостридий на среде
Вильсон-Блер
3. Культивирование облигатных анаэробов. Питательные среды.
СРЕДА ВИЛЬСОНА-БЛЕРА(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР)
Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид
железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens)
образуют сероводород и колонии окрашиваются в черный цвет за счет
образования сульфида железа
4. Создание анаэробных условий. Микроанаэростат
Анаэростат представляетсобой цилиндрическую
ёмкость, герметично
закрываемую с помощью
ленточного замка.
В крышку вмонтирован
вакууметр и вентиль для
присоединения вакуумного
насоса и внешней системы
источника газа.
С использованием насоса удаляется воздух и накачивается бескислородная
газовая смесь, содержащая 80% N2, 10% CO2 и 10% H2.
Палладиевые или платиновые катализаторы обеспечивают удаление остатков
кислорода, катализируя связывание O2 с H2.
Создание анаэробных условий возможно с помощью химических
газогенерирующих пакетов
Использование микроанаэростатов позволяет производить посев облигатных
анаэробов на обычные чашки Петри, обеспечивая простоту выделения чистых
культур, а также расширяет спектр выделяемых микроорганизмов (например,
позволяя культивировать представителей рода Bacteroides).
5.
Создание анаэробных условий.Зажженная свеча в закрытой
емкости снижает количество
кислорода
Повышенное содержание
СО2 стимулирует
размножение капнофилов
(нейссерии)
Контейнеры для инкубирования в анаэробных
условиях
Газогенерирующие
системы
Индикатор «анаэробности»
6. Культивирование облигатных анаэробов
Для культивирования микроорганизмов,особо требовательных к анаэробным условиям
(например, Faecalibacterium prausnitzii),
применяют пробирки Хангейта, которые
закрываются завинчивающимися пластиковыми
крышками со вставкой из бутиловой резины.
Пробирки Хангейта (Hungate tubes) разработаны для
культивирования облигатных (строгих) анаэробов!
Специальная винтовая крышка плотно прижимает септу и исключает
проникновение кислорода из окружающей среды в пробирку
во время автоклавирования и культивирования.
Материал пробирки - боросиликатное стекло
Стандартная процедура работы с пробирками Хангейта:
удалить кислород из пробирки при постоянном потоке инертного газа;
добавить 4,5 мл агаризованной среды, освобожденной от примеси
кислорода;
закрыть плотно септой и винтовой крышкой и поместить в автоклав;
после автоклавирования произвести посев шприцем;
инкубировать пробирки при необходимой температуре.
7. Вращающиеся пробирки Хангейта
Для выделения отдельных колоний строгих анаэробов и для подсчета
жизнеспособных клеток используют вращающиеся пробирки, которые удобнее, чем
чашки Петри.
Готовят агаровую среду и разливают ее по пробиркам. Охлаждают расплавленный
агар до 45 °С в пробирках с пробками и зажимами.
Неразведенные пробы и пробы, разведенные предварительно восстановленной
средой (или раствором), переносят в пробирки, как описано выше, смешивают со
средой (при этом следят за тем, чтобы не образовалась пена) и затем вращают
пробирку под струей холодной воды, пока агар не застынет. Стараются, чтобы агар
равномерно покрыл стенки пробирки.
Вращающиеся пробирки можно засевать штрихом с помощью специальной петли
или шпателя, начиная со дна пробирки и затем постепенно продвигая петлю вверх,
одновременно вращая пробирку и продувая ее газом с помощью газовой канюли ,
Фирма Bellco Glass, Inc. производит устройство для вращения пробирок во время
посева культуры штрихом.
Роллер для вращения пробирок
Результаты культивирования
8. АНАЭРОБНЫЕ БОКСЫ
Наиболее сложным подходом является пересев и
культивирование в анаэробных боксах.
Это прозрачные камеры со шлюзами и отверстиями для
рук с рукавами, заканчивающимися резиновыми
перчатками.
В них создают стерильные условия, заполняют
бескислородной газовой смесью, поддерживают
температуру 37°С.
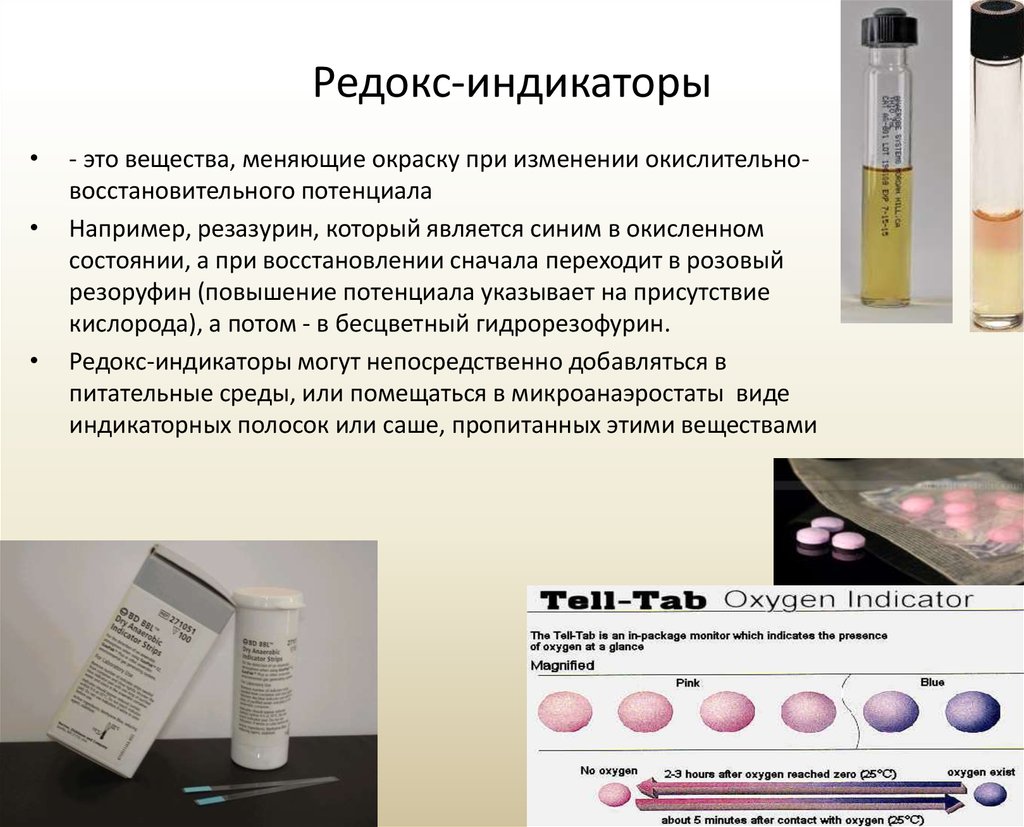
9. Редокс-индикаторы
- это вещества, меняющие окраску при изменении окислительновосстановительного потенциала
Например, резазурин, который является синим в окисленном
состоянии, а при восстановлении сначала переходит в розовый
резоруфин (повышение потенциала указывает на присутствие
кислорода), а потом - в бесцветный гидрорезофурин.
Редокс-индикаторы могут непосредственно добавляться в
питательные среды, или помещаться в микроанаэростаты виде
индикаторных полосок или саше, пропитанных этими веществами
10. Требования к питательным средам
Питательные среды для анаэробов должны:• удовлетворять пищевым требованиям анаэробов и
способствовать их стабильному и здоровому росту (пептоны,
декстроза)
• содержать в себе добавки для стимуляции развития (гемин)
• Наличие низкого окислительно-восстановительного
потенциала. В состав сред для культивирования облигатных
анаэробов для этого включаются редуцирующие вещества,
восстанавливающие кислород и снижающие окислительновосстановительный потенциал среды, такие как тиогликолят
натрия и цистеин.
• Наличие селективных добавок. В большинстве случаев
используется аминогликозидный ряд антибиотиков.
• Анаэробные микроорганизмы, имеющие клиническое
значение, характеризуются сравнительно медленным ростом и
бедными метаболическими возможностями, поэтому среды
для их культивирования часто обогащены питательными
веществами и витаминами.
11.
12. Транспортные среды
Пример – транспортная тиогликолевая среда, состав:
- Гидролизат казеина – 15 г.
- Дрожжевой экстракт – 5 г.
- NaCl – 2,5 г.
- Тиогликолят натрия – 0,5 г.
- Глюкоза – 5,5 г.
- L-цистин - 0,5 г.
- Резазурин– 0,001 г.
- Агар-агар – 0,75 г.
- Дистиллированная вода – до 1000 мл.
Пробирки с транспортными средами предварительно прогревают для
удаления диффундировавшего кислорода (редуцируют), пространство над
средой заполняют газом тяжелее воздуха (например, пропаном) пробирки
закрывают специальными резиновыми пробками. Взятие исследуемого
материала из пораженного участка осуществляется шприцем с притертым
поршнем, после чего материал вносят в пробирку с транспортной средой,
прокалывая пробку.
13. Среды для культивирования
Пример – агар ШедлераКазеиновый пептон – 8,2
Мясной пептон – 3,5
питательные вещества
Дрожжевой экстракт – 5
богат витаминами
Глюкоза – 5,8
источник энергии
NaCl – 1,7
изотоничность
K2HPO4 – 0,8
Трис-буфер – 0,75
для избежания снижения pH в ходе ферментации глюкозы
Гемин – 0,01
Овечья кровь, дефибринированная
стимулируют рост
L-цистин 0,4
редуцирующий агент
Витамин K 1
необходим для некоторых видов
Агар – 11,5
14. Схема выделения чистой культуры облигатных анаэробов.
• Взятие исследуемого материала осуществляется шприцем спритертым поршнем, после чего материал вносят в пробирку с
транспортной средой.
• Выделение чистой культуры проводится со строгим соблюдением
анаэробных условий на всех этапах исследования.
• 1-й этап – получение изолированных колоний.
• Готовят ряд разведений исследуемого материала и делают посев
на чашки Петри со средой КАБ или другой питательной средой
для культивирования анаэробов.
Посевы инкубируют в
микроанаэростатах. заполненных
газовой смесью, при температуре
37С в течение 48-72 часов.
15. Схема выделения чистой культуры облигатных анаэробов.
Схема выделения чистойкультуры облигатных анаэробов
• 2-й этап - получение чистой культуры анаэробов.
• На этом этапе:
• 1.Изучают морфологические и культуральные свойства
выросших колоний.
• 2. Проводят параллельный рассев каждой отобранной
колонии на две чашки Петри с питательной средой,
например КАБ. Одну чашку инкубируют в аэробных
условиях, другую - в анаэробных условиях.
• Дня дальнейшего исследования отбирают культуры,
выросшие только в анаэробных условиях (так исключают
факультативные анаэробы).
16. Схема выделения чистой культуры облигатных анаэробов.
• 3-й этап - идентификация выделенныхоблигатных анаэробов.
• Проводят биохимическую идентификацию в
микротест-системе, например АР1-20А. Суспензию
выделенной культуры засевают на пластину АР20А с набором биохимических гестов, инкубируют
в анаэробных условиях в течение 48 часов,
учитывают биохимические свойства культуры по
изменению окраски индикаторов системы и
определяют ее родовую и/или видовую
принадлежность.












 biology
biology








