Similar presentations:
Ароматические углеводороды
1.
Презентация по теме:”Ароматические углеводороды”Выполнил ученик
10 “А” класса
МОУ Куровской СОШ №6
Кутасин Дмитрий
2.
Что это такое?Это органические вещества, которые имеют в своем составе
одно или несколько бензольных ядер — устойчивых структур из
шести атомов углерода, соединенных в многоугольник.
Данные химические соединения обладают специфическим
запахом, что можно понять из их названия. Углеводороды этой
группы относятся к циклическим, в отличие от алканов, алкинов
и др.
Арены (ароматические углеводороды) – органические
соединения, имеющие общую формулу СnH2n – 6, а в составе
молекулы бензольное кольцо (ядро).
3.
Ароматические углеводороды. Бензол.Это самое простое химическое соединение из данной
группы веществ. В состав его молекул входят шесть атомов
углерода и столько же гидрогена. Все остальные
ароматические углеводороды являются производными
бензола и могут быть получены с его использованием. Это
вещество при нормальных условиях находится в жидком
состоянии, оно бесцветное, обладает специфическим
сладковатым запахом, в воде не растворяется. Закипать
оно начинает при температуре +80 градусов по Цельсию, а
замерзать — при +5.
Химическая формула бензола: C6H6
4.
Химические свойства бензола и других ароматических углеводородов.Для бензола наиболее характерны реакции замещения атомов водорода в бензольном кольце на
атомы галогенов и различные группы атомов. В результате реакций замещения ароматическая
система сохраняется. Реакции замещения протекают в присутствии катализаторов —
галогенидов алюминия или железа, которые называются кислотами Льюиса.
Реакции присоединения, разрушающие ароматическую систему, энергетически невыгодны и для
бензола не характерны.
В отличие от этиленовых и ацетиленовых углеводородов, бензол не реагирует с бромной водой и
не окисляется раствором перманганата калия.
5.
Реакции замещения.Первая из них — галогенирование. Чтобы
химическое взаимодействие могло
осуществиться, нужно использовать
катализатор, а именно трихлорид железа.
Таким образом, если добавить к бензолу (C6H6)
хлор (Cl2), то мы получим хлорбензол (C6Н5Cl) и
хлороводород (HCl), который выделится в виде
прозрачного газа с резким запахом. То есть
вследствие этой реакции один атом водорода
замещается атомом хлора. То же самое может
произойти и при добавлении к бензолу других
галогенов (йода, брома и т. д.).
Вторая реакция замещения — нитрование —
проходит по похожему принципу. Здесь в роли
катализатора выступает концентрированный
раствор серной кислоты. Для проведения
такого рода химической реакции к бензолу
необходимо добавить нитратную кислоту
(HNO3), тоже концентрированную, в результате
чего образуются нитробензол (C6H5NO2) и вода.
В этом случае атом гидрогена замещается
группой из атома нитрогена и двух оксигена.
Существуют и другие виды
реакций замещения, такие как
алкилирование, сульфирование.
6.
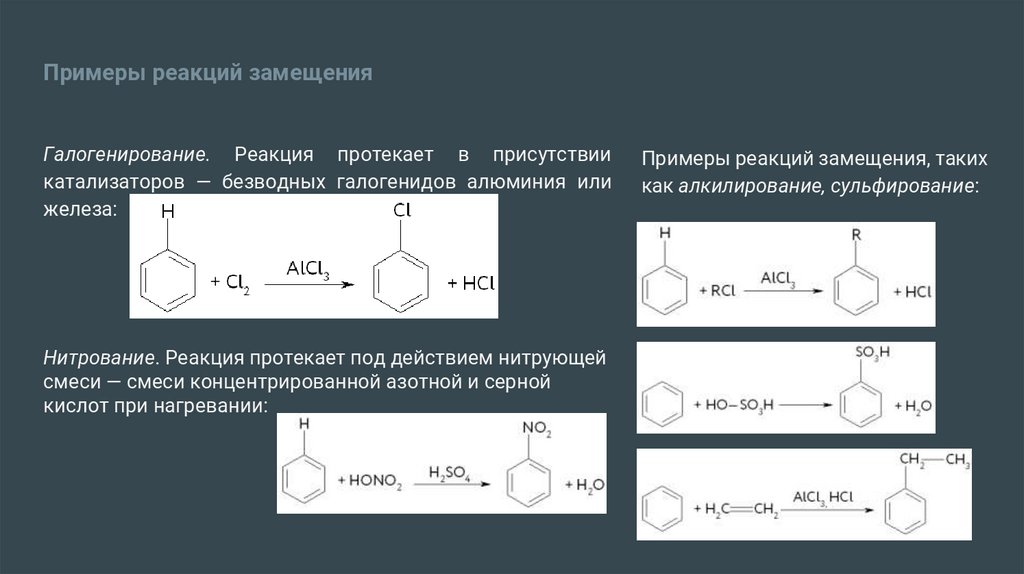
Примеры реакций замещенияГалогенирование. Реакция протекает в присутствии
катализаторов — безводных галогенидов алюминия или
железа:
Нитрование. Реакция протекает под действием нитрующей
смеси — смеси концентрированной азотной и серной
кислот при нагревании:
Примеры реакций замещения, таких
как алкилирование, сульфирование:
7.
Реакции присоединения.Это второй тип химических взаимодействий, в которые способны вступать ароматические
углеводороды. Существует также несколько видов: гидрирование, а также радикальное
хлорирование.
Нужно принять к сведению, что гидрирование происходит только в присутствии никеля. Для
этого необходимо смешать бензол и гидроген (H2). Пропорции те же, что и в предыдущей
реакции. Вследствие этого образуется циклогексан (С6H12). Все остальные ароматические
углеводороды также могут вступать в такого типа реакции. Они происходят по такому же
принципу, как и в случае с бензолом, только с образованием уже более сложных веществ.
8.
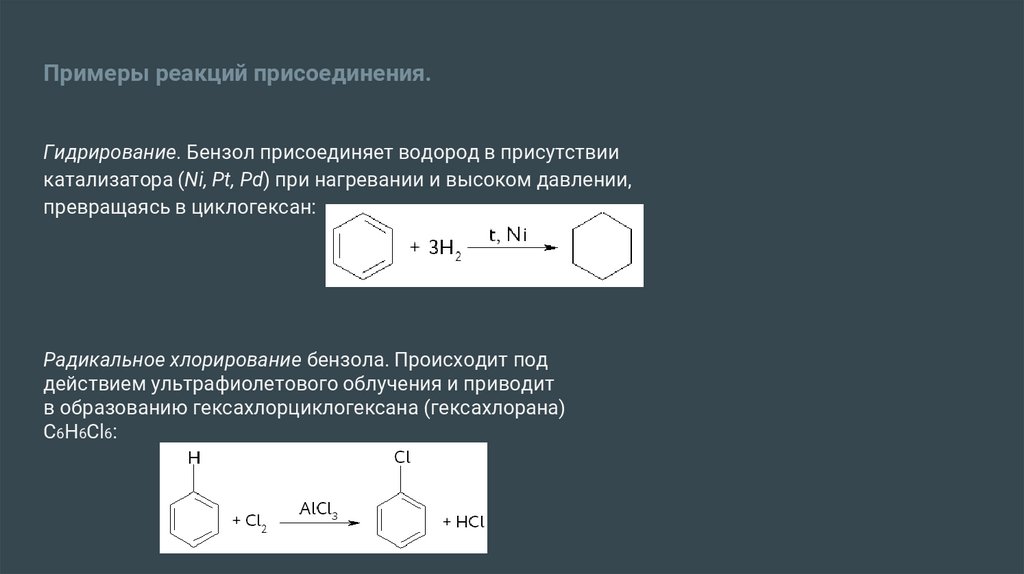
Примеры реакций присоединения.Гидрирование. Бензол присоединяет водород в присутствии
катализатора (Ni, Pt, Pd) при нагревании и высоком давлении,
превращаясь в циклогексан:
Радикальное хлорирование бензола. Происходит под
действием ультрафиолетового облучения и приводит
в образованию гексахлорциклогексана (гексахлорана)
C6H6Cl6:
9.
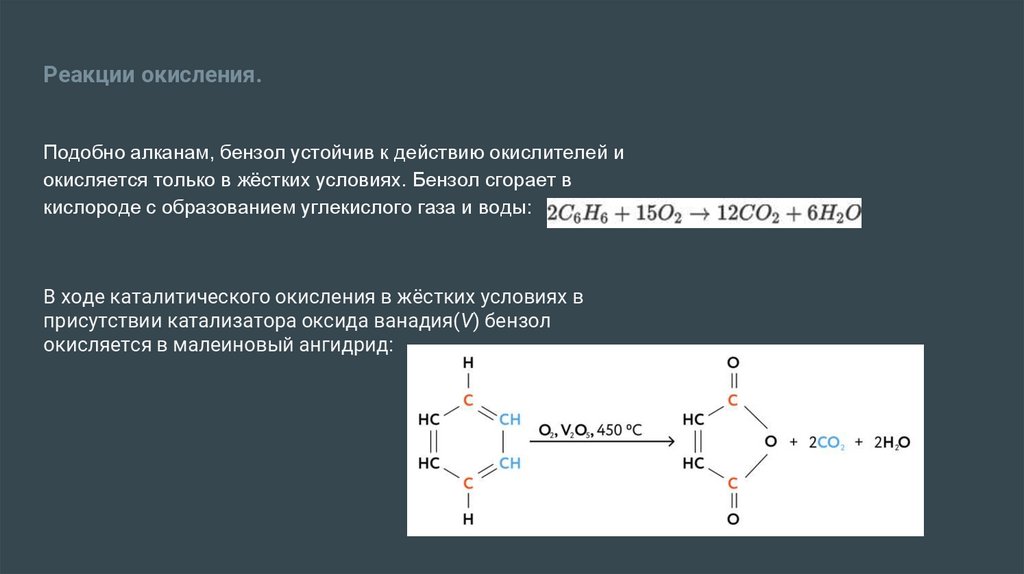
Реакции окисления.Подобно алканам, бензол устойчив к действию окислителей и
окисляется только в жёстких условиях. Бензол сгорает в
кислороде с образованием углекислого газа и воды:
В ходе каталитического окисления в жёстких условиях в
присутствии катализатора оксида ванадия(V) бензол
окисляется в малеиновый ангидрид:
10.
Вывод.Подводя итоги, можно сделать вывод, что что все ароматические углеводороды имеют
однотипную химическую структуру, что позволяет объединить их в один класс соединений.
Кроме того, их физические и химические свойства также весьма похожи. Внешний вид,
температуры кипения и плавления всех химических веществ данной группы не сильно
отличаются. Свое применение многие ароматические углеводороды находят в одних и тех же
отраслях промышленности. Например, бензол используется в качестве добавки к моторному
топливу, улучшает его качество. Толуол С6Р5-СР3 – растворитель, используется при производстве
красителей, лекарственных и взрывчатых веществ (тротил).








 chemistry
chemistry








