Similar presentations:
Розв’язування експериментальних задач (9 клас)
1.
ПРАКТИЧНА РОБОТА № 2ТЕМА
«РОЗВ’ЯЗУВАННЯ
ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ»
9 КЛАС
УРОК №19
2.
МЕТА УРОКУЗакріпити знання про умови перебігу
реакцій йонного обміну в розчинах
електролітів до кінця.
Удосконалювати уміння використовувати
якісні реакції на практиці.
Удосконалити навички, пов’язані із
складанням рівнянь реакцій у
молекулярній, повній та скороченій
йонній формі.
3.
ПОВТОРЮЄМО НАЙГОЛОВНІШЕ1. У яких випадках реакції йонного обміну відбуваються до
кінця?
2. Яких правил потрібно дотримуватися під час запису
йонно – молекулярних рівнянь реакцій?
Які речовини записуються в молекулярному вигляді,
Які речовини розкладаються на йони?
4.
3. Довести наявність йонів гідрогену (Н+) можна задопомогою:
1) Фенолфталеїну
2) Лакмусу
3) Аргентум нітрату (AgNO3)
4) Барій хлориду (BaCl2)
5.
4. Довести наявність гідроксид- йонів (ОН- ) можна задопомогою:
1) Фенолфталеїну
2) Кислоти
3) Активного металу
4) Барій хлоридуBaCl2
6.
5 .Довести наявність хлорид-іонів (СІ ) можна за допомогою:1) Натрій гідроксиду (NaOH)
2) Лакмусу
3) Аргентум нітрату (AgNO3)
4) Барій хлориду (BaCl2)
7.
-6 .Довести наявність сульфат-іонів (SO42 )
можна за допомогою:
1) Натрій гідроксиду (NaOH)
2) Метилоранжу
3) Аргентум нітрату (AgNO3)
4) Барій хлориду (BaCl2)
8.
-7. Довести наявність карбонат-іонів (СO32 )
можна за допомогою:
1) Натрій гідроксиду (NaOH)
2) Лакмусу
3) Будь - якою мінеральною кислотою
4) Барій хлориду (BaCl2)
9.
ВИКОНАННЯПРАКТИЧНОЇ РОБОТИ
Працюємо за інструкцією до практичної роботи № 2
Тема. «Розв’язування експериментальних задач»
10.
РЕАКТИВИ І ОБЛАДНАННЯРозчини солей:
барій хлорид(ВаCl2),
барій нітрат (Ba(NO3)2 ,
натрій сульфат(Na2SO4) ,
натрій хлорид (NaCl),
натрій карбонат (Na2СО3),
алюміній сульфат (Al2(SO4)3 ),
алюміній хлорид (AlCl3),
кальцій хлорид (CaCl2 ).
Сульфатна кислота ( H2SO4);
Розчин лугу- натрій гідроксид (NaOH);
Індикатори- лакмус, метилоранж, фенолфталеїн.
11.
ПОВТОРЕННЯ ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ В КАБІНЕТІ ХІМІЇ12.
Задача 1Використовуючи реактиви, які є на столі, виконайте
реакції, що відповідають таким скороченим йонним
рівнянням:
1. Ва2+ + SO42─ =BaSO4↓
2. CO32─ +2H+ = CO2 + H2O
3. H+ + OH─ = H2O.
Запишіть молекулярні, повні та скорочені йонні рівняння
реакцій.
13.
ЩО І ЯК РОБИТИ? ВИКОНУЄМО ПЕРШЕ ЗАВДАННЯ ІЗ ЗАДАЧІ №1:1. Ва2+ + SO42─ =BaSO4↓
1. Підбираємо реактиви.
Один має мати в своєму складі йони Ва2+ (ВаCl2 або Ba(NO3)2)
а інший – йони SO42─ (Na2SO4, Al2(SO4)3 , або H2SO4 )
Далі записуєте одне молекулярне рівняння.
Комбінацій може бути багато:
ВаCl2 + Na2SO4 =
?
ВаCl2 + Al2(SO4)3 =
ВаCl2 + H2SO4 =
Вa(NO3)2 + Na2SO4 =
BaSO4↓
?
Ва(NO3)2 + Al2(SO4)3 =
Ва(NO3)2 + H2SO4 =
Під молекулярним рівнянням записуємо повне і скорочене йонне
рівняння.
14.
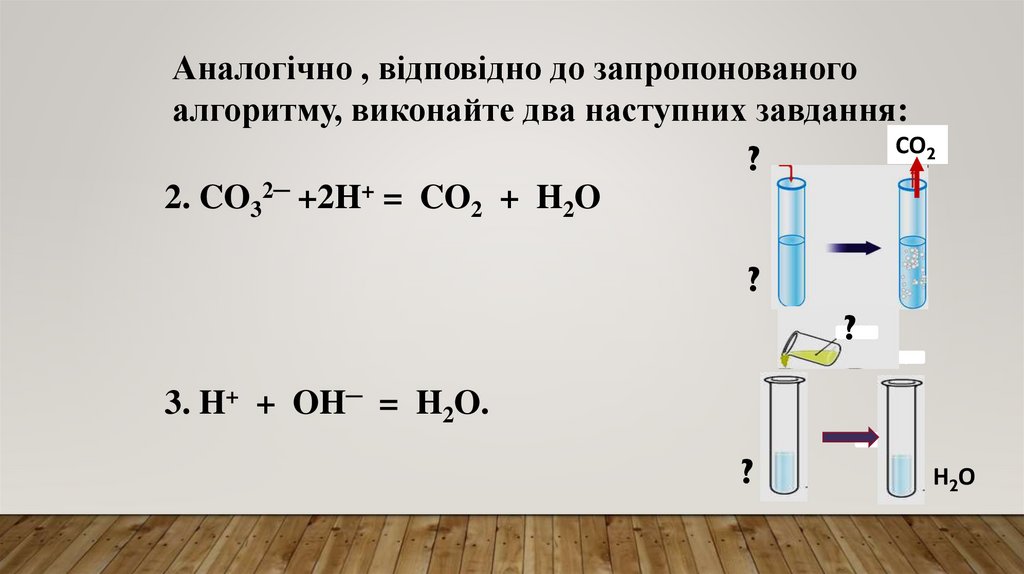
Аналогічно , відповідно до запропонованогоалгоритму, виконайте два наступних завдання:
СО2
?
2. CO32─ +2H+ = CO2 + H2O
?
?
?
3. H+ + OH─ = H2O.
?
Н2О
15.
Задача 2Використовуючи реактиви, які є на столі, добудьте
реакцією обміну наступні речовини:
1.Алюміній гідроксид (Al (OH)3);
2.Кальцій карбонат (СаСО3);
3.Карбон (ІV) оксид.
Складіть рівняння у молекулярній формі, повній та
скороченій йонних формах.
16.
ЩО І ЯК РОБИТИ? ВИКОНУЄМО ПЕРШЕ ЗАВДАННЯ ІЗ ЗАДАЧІ №2:1. Добути алюміній гідроксид (Al (OH)3);
Підбираємо реактиви.
Один має мати в своєму складі йони Al3+ (AlCl3 , Al2(SO4)3 ),
а інший – йони OH─ (NaOH).
Далі записуєте одне із можливих молекулярних рівнянь:
AlCl3 + NaOH =
Al2(SO4)3 + NaOH =
Під молекулярним рівнянням записуємо повне і скорочене
йонні рівняння.
17.
Аналогічно , відповідно до запропонованогоалгоритму, виконайте два наступних завдання:
Добудьте реакцією обміну наступні речовини:
2. Кальцій карбонат (СаСО3);
3. Карбон (ІV) оксид.
18.
Задача 3У трьох пронумерованих пробірках містяться
розчини таких речовин:
натрій хлорид,
натрій сульфат,
натрій карбонат.
Визначте вміст кожної пробірки.
Запишіть відповідні молекулярні та йонні рівняння
реакцій.
19.
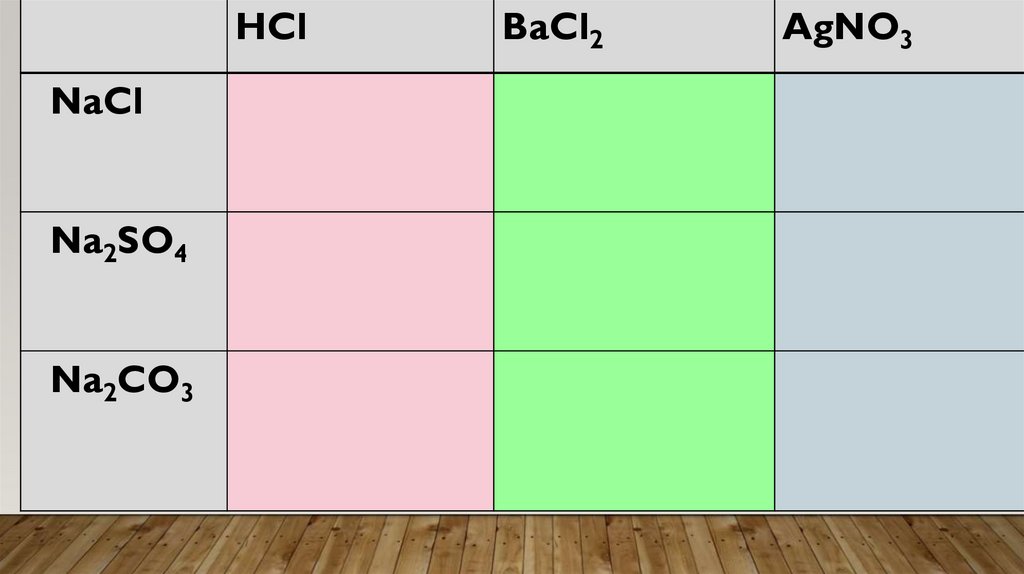
HClNaCl
Na2SO4
Na2CO3
BaCl2
AgNO3
20.
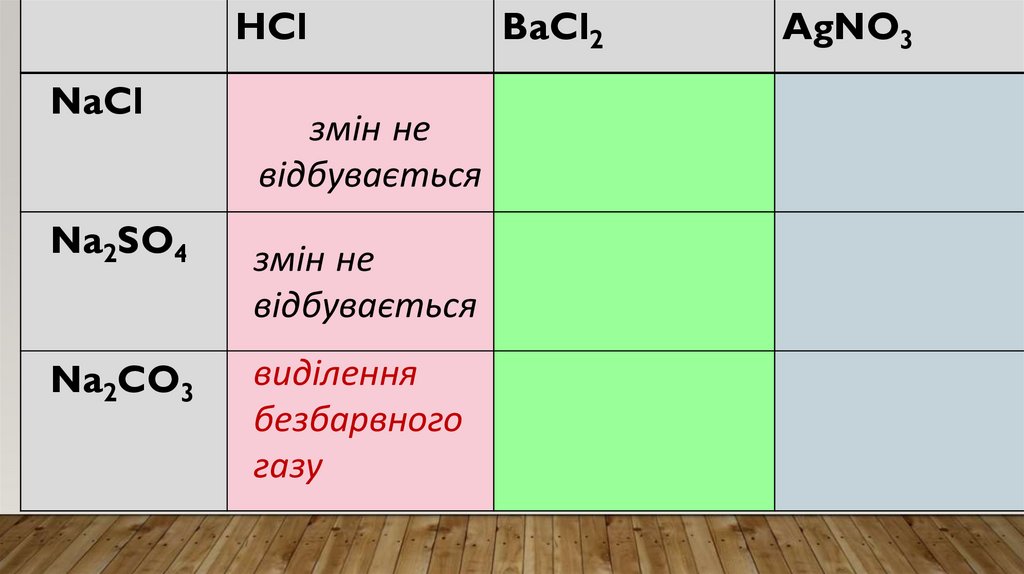
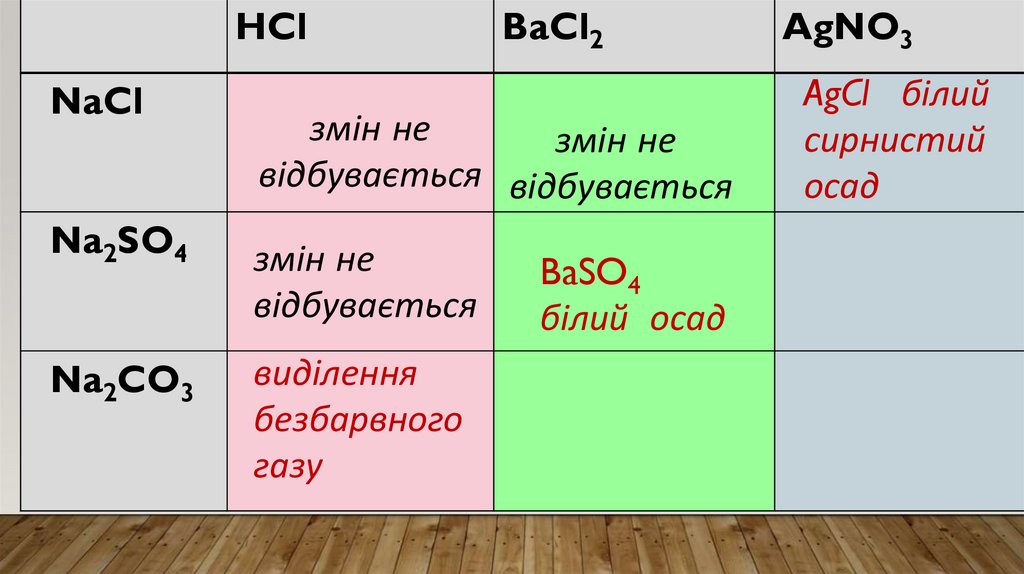
ХІД РОБОТИ• Відливаю у три пробірки по 2 мл кожної з речовин
• До кожної речовини додаю хлоридну кислоту.
• Спостерігаю: в двох пробірках видимих змін не
відбувається, а в одній відбувається виділення
великої кількості безбарвного газу, без запаху,
суміш скіпає.
• Висновок: саме тут знаходиться натрій карбонат.
Реактивом на карбонат-іони СО32- в розчинах є
катіони Гідрогену Н+.
Результатом таких реакцій є утворення
вуглекислого газу.
Отже, в пробірці №3 є розчин натрій карбонату.
HCl
NaCl Na2SО4 Na2СО3
21.
HClNaCl
Na2SO4
Na2CO3
змін не
відбувається
змін не
відбувається
виділення
безбарвного
газу
BaCl2
AgNO3
22.
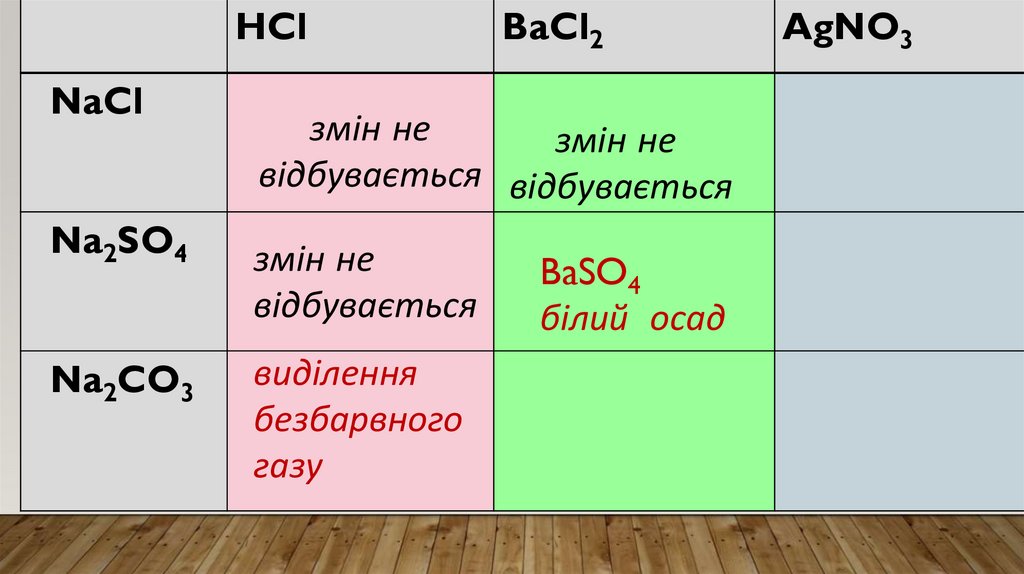
• До речовин під номерами 1 і 2 доливаю розчин барійхлориду.
• Спостерігаю: в першій пробірці видимих змін не
відбувається, а в другій відбувається виділення білого
осаду.
• Висновок: саме тут знаходиться натрій сульфат.
Реактивом на сульфат-іони SО42- є йони барію (Ва2+)
Результатом таких реакцій є утворення білого осаду
ВаSО4
Отже, в пробірці №2 є розчин натрій сульфату.
BaCl2
NaCl Na2SО4
23.
HClNaCl
Na2SO4
Na2CO3
BaCl2
змін не
змін не
відбувається відбувається
змін не
відбувається
виділення
безбарвного
газу
BaSO4
білий осад
AgNO3
24.
• Щоб довести, що в пробірці під номером 1 залишився натрійхлорид NaCl, доливаю розчин аргентум нітрату AgNO3.
• Спостерігаю виділення білого сирнистого осаду.
• Висновок: саме тут знаходиться натрій хлорид.
AgNO3
Реактивом на хлорид-іони Cl є йони аргентуму (Ag+).
Результатом таких реакцій є утворення білого сирнистого
осаду AgCl
Отже, в пробірці №1 є розчин натрій хлориду.
NaCl
25.
HClNaCl
Na2SO4
Na2CO3
BaCl2
змін не
змін не
відбувається відбувається
змін не
відбувається
виділення
безбарвного
газу
BaSO4
білий осад
AgNO3
AgCl білий
сирнистий
осад
26.
Повторити матеріал з теми«Електролітична
дисоціація»
§ 3-13
вправа №12 ст.73
27.
“НАШ ПСИХОЛОГІЧНИЙ СТАН”Виберіть 3 слова, які передають ваш стан на уроці:
1. Радість
7. Невпевненість
2. Задоволення
8. Злість
3. Спокій
9. Натхнення
4. Впевненість
10. Нудьга
5. Тривога
6. Роздратування
11. Насолода






















 chemistry
chemistry








