Similar presentations:
Знаки химических элементов. Относительная атомная масса
1.
2.
скисание молока,испарение воды,
образование ржавчины,
горение древесины,
гашение соды уксусом,
горение свечи,
таянье льда,
кипение воды,
подгорание пищи на
сковороде,
испарение жидкой ртути,
замерзание воды,
почернение серебряных
изделий,
образование тумана,
3.
физическиехимические
испарение воды
таянье льда
скисание молока
образование ржавчины
кипение воды
образование тумана
испарение жидкой ртути
замерзание воды
горение древесины
гашение соды уксусом
горение свечи
подгорание пищи на
сковороде
почернение серебряных
изделий
4.
«Читая Менделеева»Другого ничего в природе нет
Ни здесь, ни там, в космических
глубинах:
Все – от песчинок малых до планет –
Из элементов состоит единых.
С. Щипачев
5.
Древнегреческие мудрецы первыми сказали слово«элемент». Правда, «элементами» считались
вода, земля, воздух и огонь
6.
• В средние века ученые знали уже десятьхимических элементов – семь металлов (золото,
серебро, медь, железо, олово, свинец, и ртуть) и
три неметалла (серу, углерод, и сурьму).
Обозначение химических элементов алхимиками
СВИНЕЦ
МЕДЬ
РТУТЬ
ЗОЛОТО
СЕРЕБРО
ОЛОВО
7.
ЗолотоЖелезо
Ртуть
Серебро
Медь
Олово
Свинец
8.
Серасера
Углерод
Сурьма
9.
Золото называлось Солнцем, а обозначалось кружком сточкой:
Медь – Венерой, символом этого металла служило
«венерино зеркальце»:
А железо – Марсом; как и полагается богу войны,
обозначение этого металла включало щит и копье:
10.
Золото - СолнцеСеребро - Луна
Железо - Марс
Медь - Венера
11.
12.
Этот способ изображения символов элементовпридумал английский ученый, физик и химик,
Джон Дальтон.
13.
14.
Углерод – Carboneum – CЗолото – Aurum – Au
Водород – Hydrogenium – H
Ртуть - Hidrargirum - Hg
Символ
Русское
название
Произнош
ение
Ag
Серебро
Аргентум
C
Углерод
Це
P
Фосфор
Пэ
F
Фтор
Фтор
Cl
Хлор
Хлор
Zn
Цинк
Цинк
15.
Определенный видатомов называют
химическим
элементом.
16.
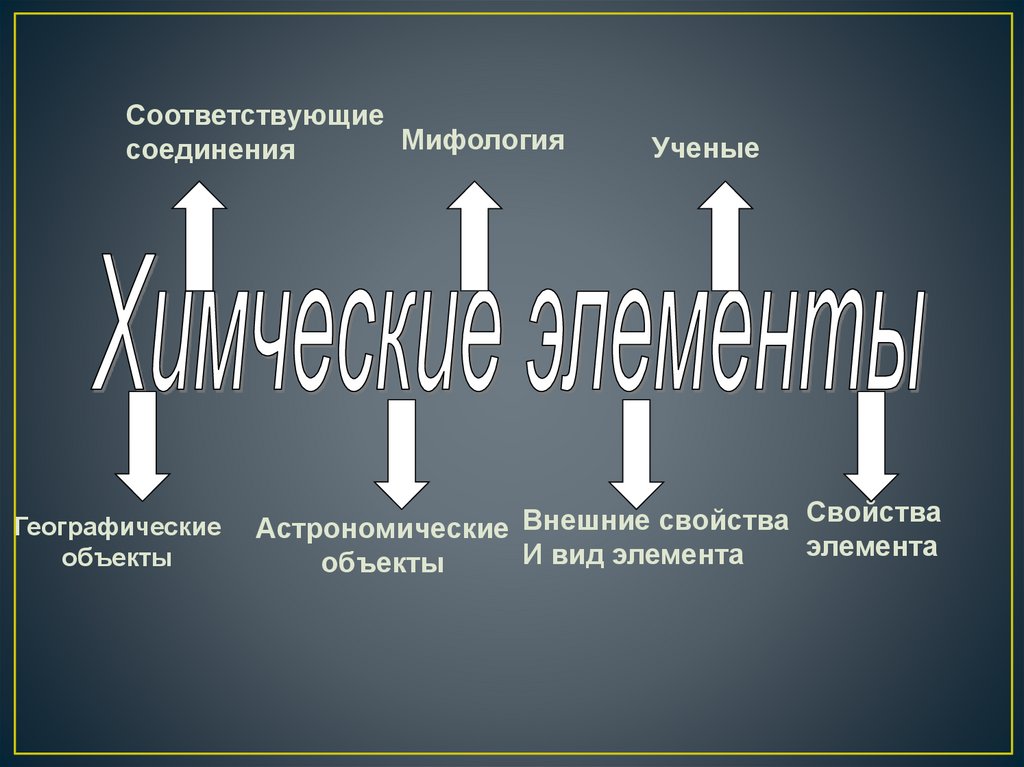
СоответствующиеМифология
соединения
Географические
объекты
Ученые
Свойства
Астрономические Внешние свойства
элемента
И вид элемента
объекты
17.
Германий( от лат.- Germnia)
Полоний
( в честь Польши )
Галлий ( от лат.Gallia-Франция ) Рутений (от. Ruthenia- Россия)
18.
Селен( от греч. Selene- луна )
Нептуний (в честь планеты Нептун )
Гелий ( от греч. Helios- Солнце)
Плутоний ( в честь планеты Плутон)
19.
Литий( от греч. Lithos – камень)
Барий
( от греч. Barys – тяжелый)
20.
Серебро( лат. название от
argentum – светлый,
белый)
Железо ( лат. название от греко-латинского
Fars-быть твердым)
Водород ( лат. название от греч. Hydry genesпорождающий воду)
21.
Азот ( лат. название от греч. Hitron genes- образующий селитру)Алюминий ( лат. alumen- квасцы)
22.
Ванадий ( в честь Vanadis- скандинавская богиня красоты )Кобальт ( от нем. Kobold- гром )
23.
Кюрий ( в честь французскиххимиков Пьера (1859-1906 )
и Марии (1867-1934)
Менделевий (Md) № 101 – в
честь
Д.И. Менделеева
24.
Гафний (Hf) № 72 – в честьКопенгагена
Берклий (Bk) № 97 – в
честь города в США
25.
Русский языкБуквы
↔
Слова
↔
Предложения
Химический язык
Знаки
химических
элементов
↔
Химические
формулы
↔
Уравнения
химических
реакций
26.
Авторы славянской письменности Отец химической письменностиЙ. Я. Берцелиус
Кирилл и Мефодий
27.
Знаки химических элементовнеметаллы
Кислород – О
Водород - H
Сера - S
Фосфор - P
Азот - N
Кремний - Si
металлы
Железо - Fe
Натрий - Na
Кальций - Ca
Медь - Cu
Магний - Mg
Калий - K
28.
Джон Дальтон (1766-1844) английский физик и химик ,изучая газы в составе воздуха ,
сделал вывод:
«Я считаю , что атомы одного
элемента одинаковы между собой ,
но отличаются от атомов других
элементов . Если об их размерах
нельзя сказать ничего
определённого , то об основном их
физическом свойстве говорить
можно : атомы имеют вес».
29.
Масса самого лёгкого атома водорода0,000 000 000 000 000 000 000 001 674 г
или 1,674 * 10-24 г
Масса самого тяжёлого атома урана
0,000 000 000 000 000 000 000 395 г
или 3,95 * 10-22 г
Пользоваться такими
величинами неудобно!
30.
Учёные пытались сопоставить во сколько раз массыатомов одних элементов тяжелее других.
• Джон Дальтон сравнивал атомные массы химических
элементов с массой самого лёгкого атома водорода и в 1803
году составил первую таблицу относительных атомных масс
элементов по водороду.
• Шведский химик Йёнс Якоб Берцелиус в 1818 году
предложил для сравнения массу атома кислорода.
• В 1961 году эталоном измерения или
атомной единицей массы принята
1/1
1/12 часть массы атома углерода.
2
оCн
31.
m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кгma(H)=1 а.е.м.
ma(He)=4 а.е.м.
32.
А r англ. « relative» - относительныйвеличина безразмерная
Аr показывает во сколько раз масса атома элемента
больше 1/12 части массы атома углерода или а.е.м.
33.
34.
16
8
1,00797
12,01115
15,9994
водород
Аr(Н) =1
углерод
Аr(С) =12
кислород
Аr(О) =16
35.
В расчётах используют17
35,454
хлор
значения относительных
атомных масс ,
округлённые до целых
чисел, но в случае с
хлором для более точных
вычислений пользуются
дробной величиной
Аr (Сl )=35,5
36.
•порядковыйЧто означают
записи: значение округлённое Условная запись
название
номер
значение Аr
ma(Al)=27 элемента
a.e.м.
maАr
(S)=32 a.e.м.
Аr(Al)=26,9815≈27
Ar(S)=32,064≈32
• Напишите
округлённые
значения
относительных
Литий
6,941
7
3
Аr(атомных
Li )=7
масс элементов № 3, 9, 17, 26 , 29
Фтор
19железаАr(
9
F )=19а)
• Определите
во сколько 18,9984
раз масса атома
больше
массы атома водорода
Хлор
17
35,454
35,5
Аr( Cl )=35,5
б) массы атома кислорода
в) 1/12
атома углерода
Железо
26 массы
55,847
56
Аr( Fe )=56
29
Медь
63,546
64
Аr( Cu )=64



































 chemistry
chemistry








