Similar presentations:
Органические соединения. Урок № 2. 10 класс
1.
В середине XIX века учёныеопределили состав и изучили
свойства большого
числа органических соединений,
обнаружив при этом много
удивительного.
2.
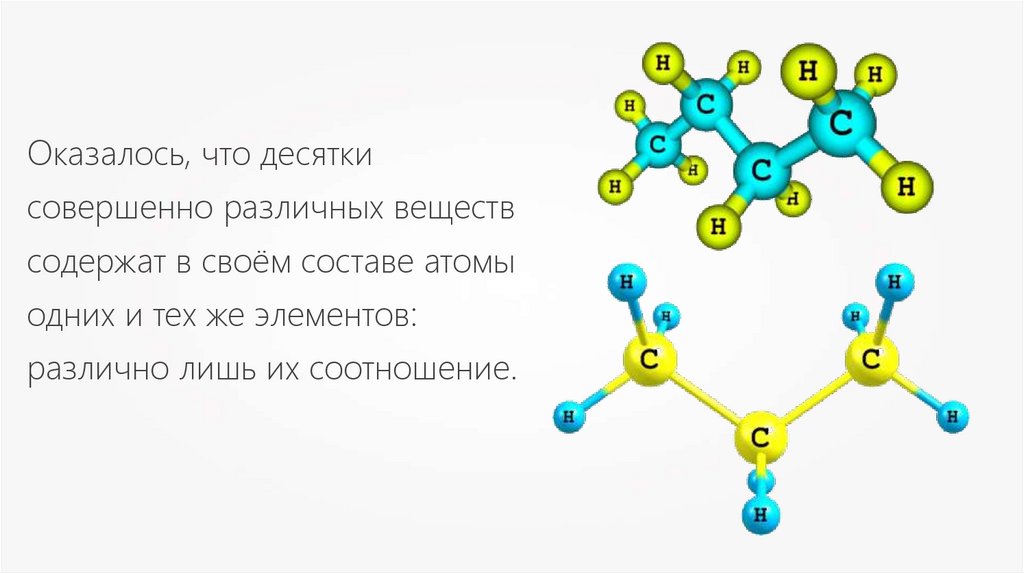
Оказалось, что десяткисовершенно различных веществ
содержат в своём составе атомы
одних и тех же элементов:
различно лишь их соотношение.
3.
Фридрих Вёлер в 1835 году писал:«... органическая химия
в настоящее время может
кого хочешь свести с ума.
Она представляется мне
дремучим лесом, полным чудесных
вещей, огромной чащей
без выхода, без конца, куда
не осмеливаешься проникнуть...»
Ф. Вёлер
1800–1882гг.
4.
Для того чтобы органическаяхимия могла развиваться дальше,
необходимо было
систематизировать всё это
множество соединений, навести
порядок в знаниях о них.
5.
Возможность описать строениеорганических молекул появилась
после того, как английский химик
Эдуард Франкланд в 1853 году ввёл
понятие «валентность».
Э. Франкланд
1825–1899гг.
6.
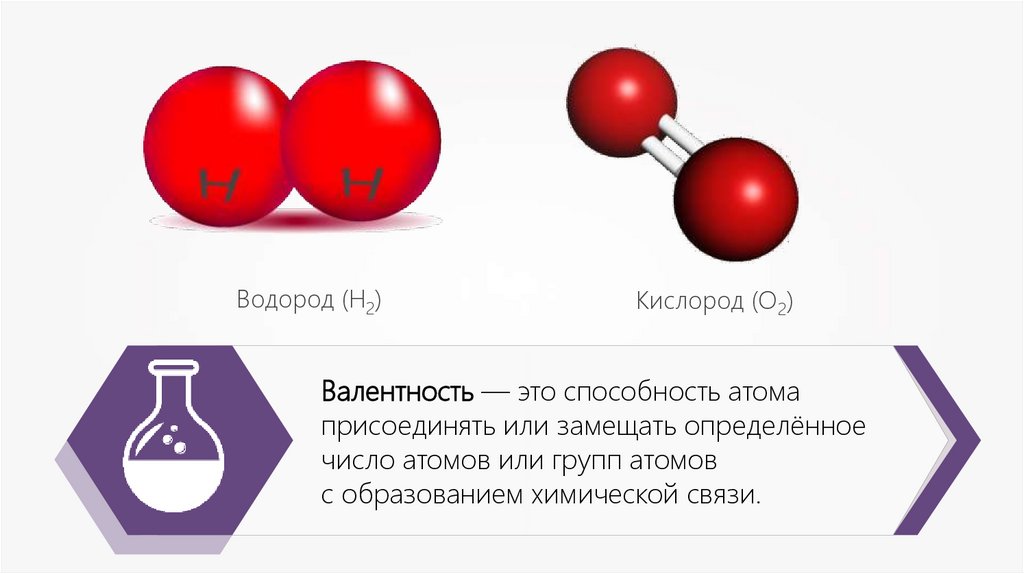
Водород (Н2)Кислород (О2)
Валентность — это способность атома
присоединять или замещать определённое
число атомов или групп атомов
с образованием химической связи.
7.
Фридрих Кекуле предположил,что атомы углерода в органических
соединениях всегда образуют
четыре связи, т.е. четырёхвалентны.
Ф. Кекуле
1829–1896гг.
8.
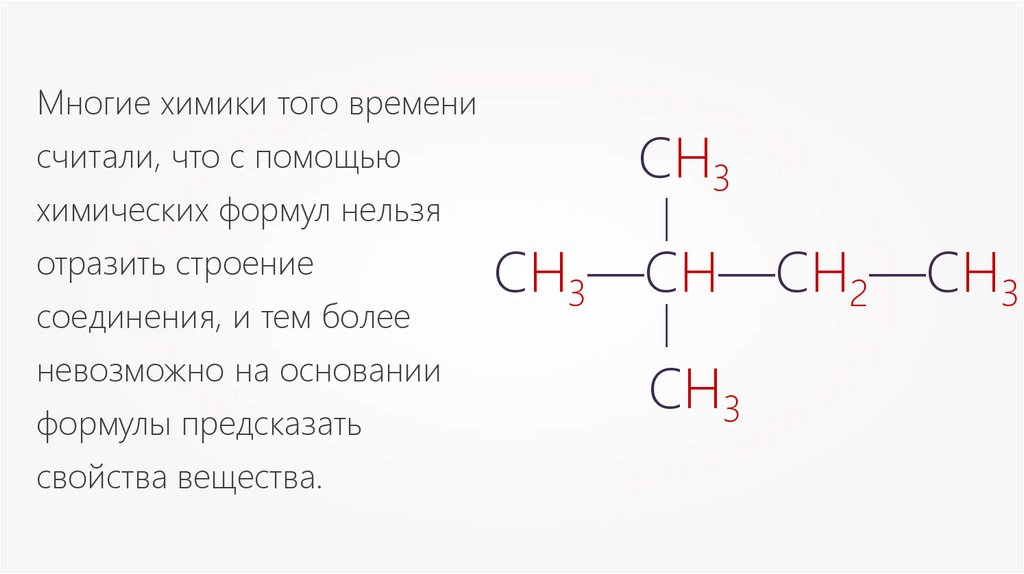
Многие химики того временисчитали, что с помощью
отразить строение
невозможно на основании
формулы предсказать
свойства вещества.
СН3—СН—СН2—СН3
—
соединения, и тем более
—
химических формул нельзя
СН3
СН3
9.
Молодой российский учёныйАлександр Михайлович Бутлеров
выступил на конгрессе с основными
положениями теории строения
органических соединений.
А.М. Бутлеров
1828–1886гг.
10.
Сущность теории Бутлерова состоитв следующем: свойства молекулы
определяются свойствами атомов,
составляющих её, их числом и
расположением в молекуле.
А.М. Бутлеров
1828–1886гг.
11.
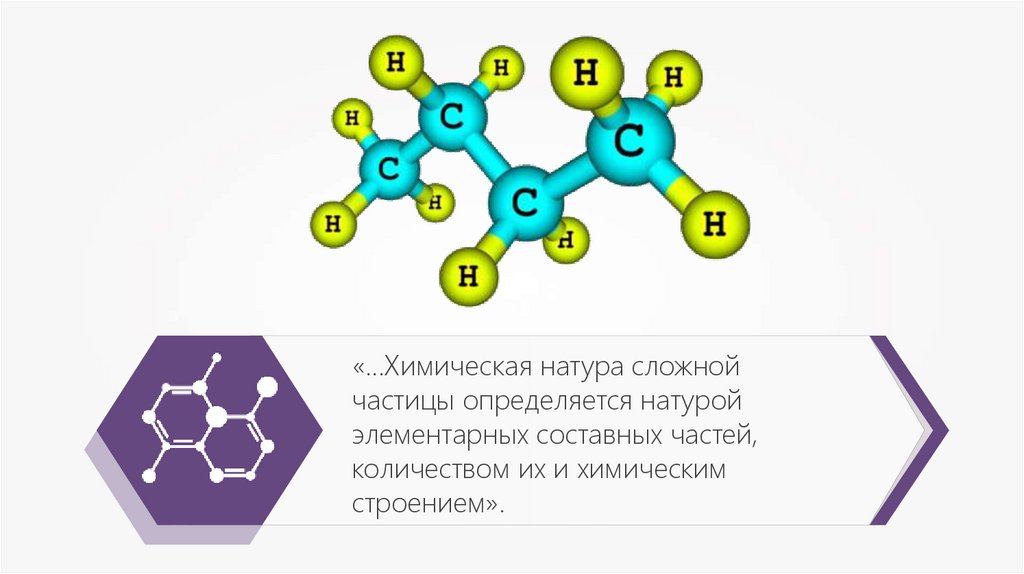
«…Химическая натура сложнойчастицы определяется натурой
элементарных составных частей,
количеством их и химическим
строением».
12.
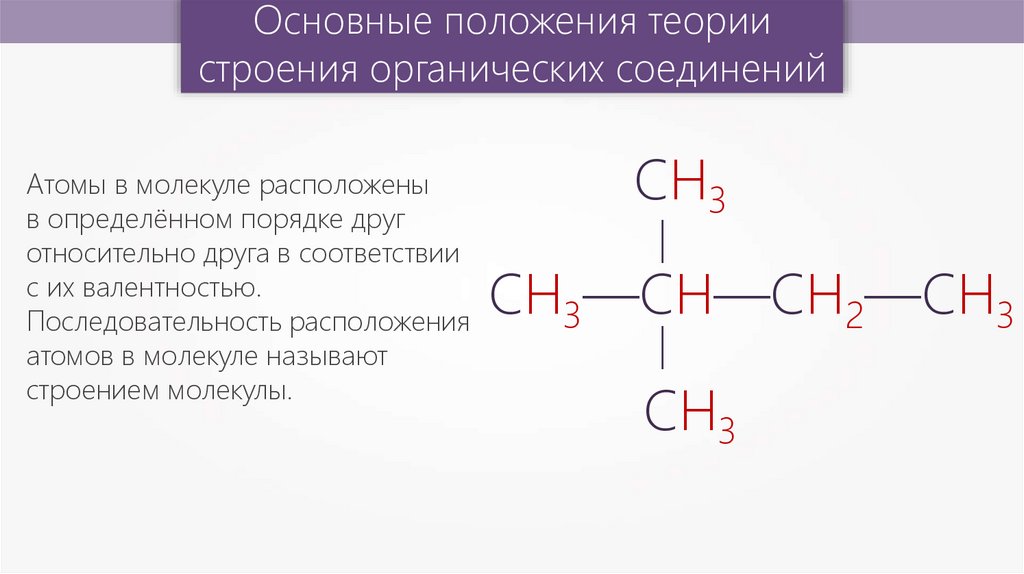
Основные положения теориистроения органических соединений
СН3
—
СН3—СН—СН2—СН3
—
Атомы в молекуле расположены
в определённом порядке друг
относительно друга в соответствии
с их валентностью.
Последовательность расположения
атомов в молекуле называют
строением молекулы.
СН3
13.
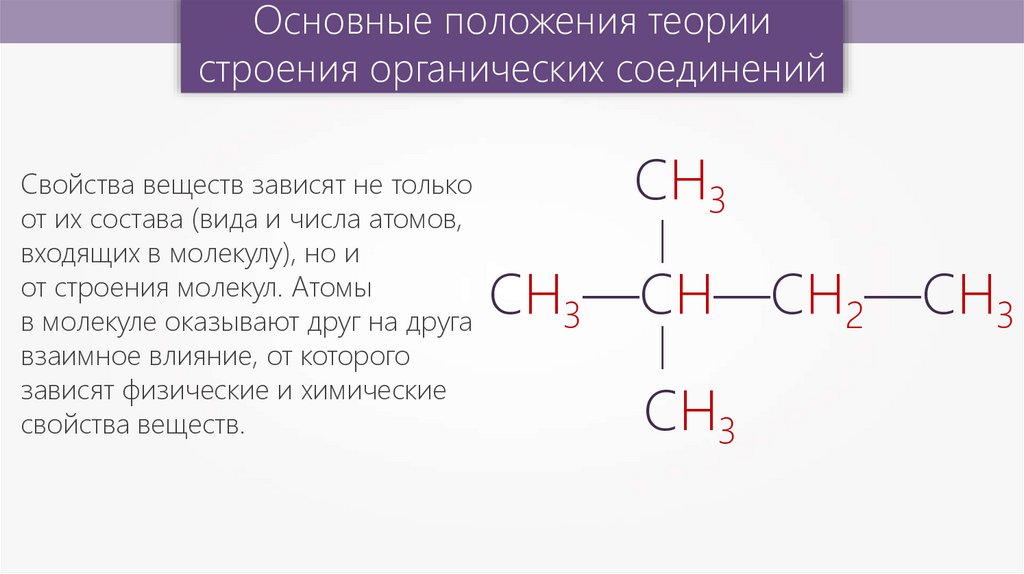
Основные положения теориистроения органических соединений
СН3
—
СН3—СН—СН2—СН3
—
Свойства веществ зависят не только
от их состава (вида и числа атомов,
входящих в молекулу), но и
от строения молекул. Атомы
в молекуле оказывают друг на друга
взаимное влияние, от которого
зависят физические и химические
свойства веществ.
СН3
14.
Основные положения теориистроения органических соединений
Строение вещества можно
установить экспериментально,
изучая его химические
и физические свойства,
и выразить химической
формулой.
СН3—СН2—СН2—ОН
15.
—СН3
—
СН3—СН—СН2—СН3
СН3
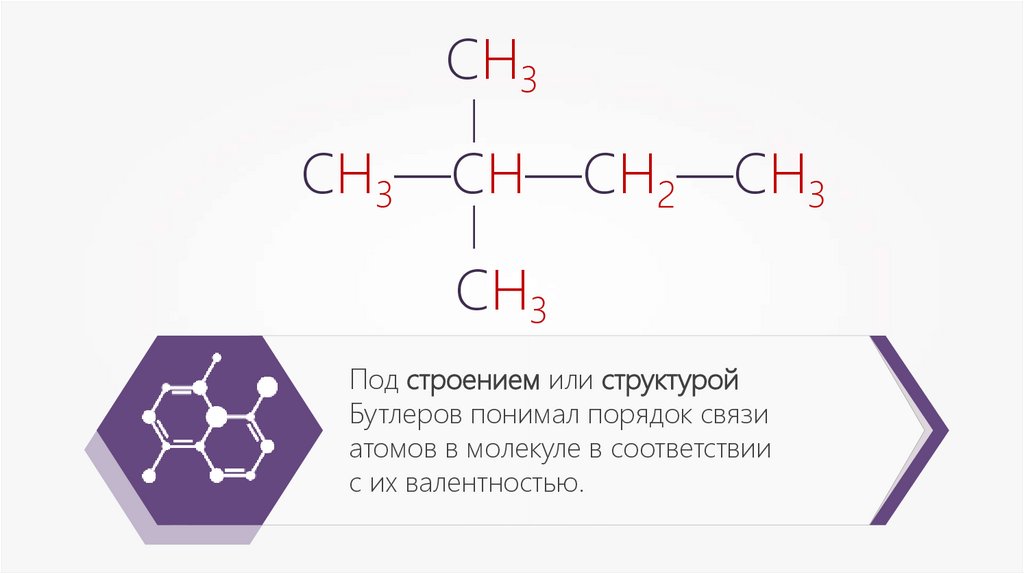
Под строением или структурой
Бутлеров понимал порядок связи
атомов в молекуле в соответствии
с их валентностью.
16.
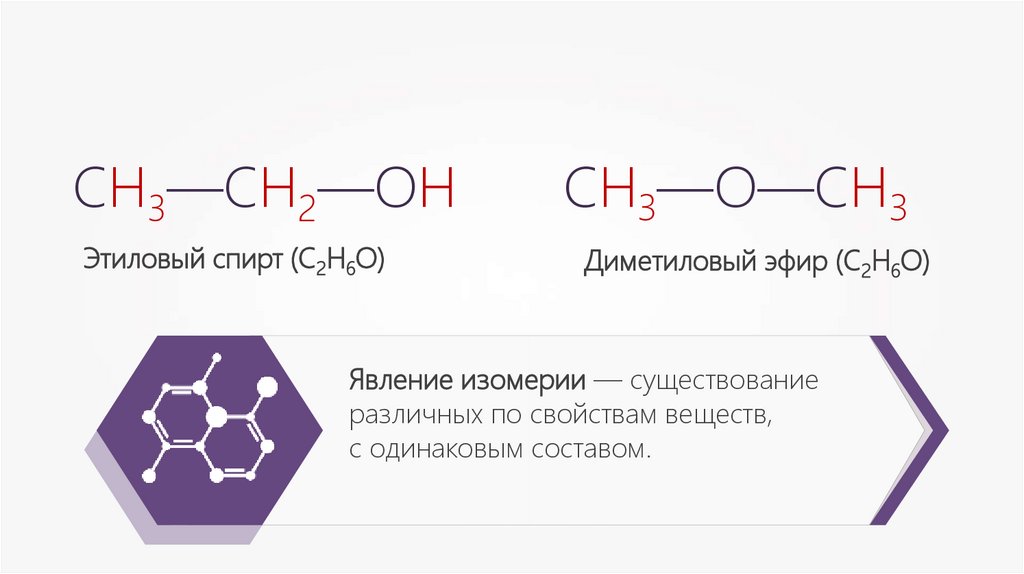
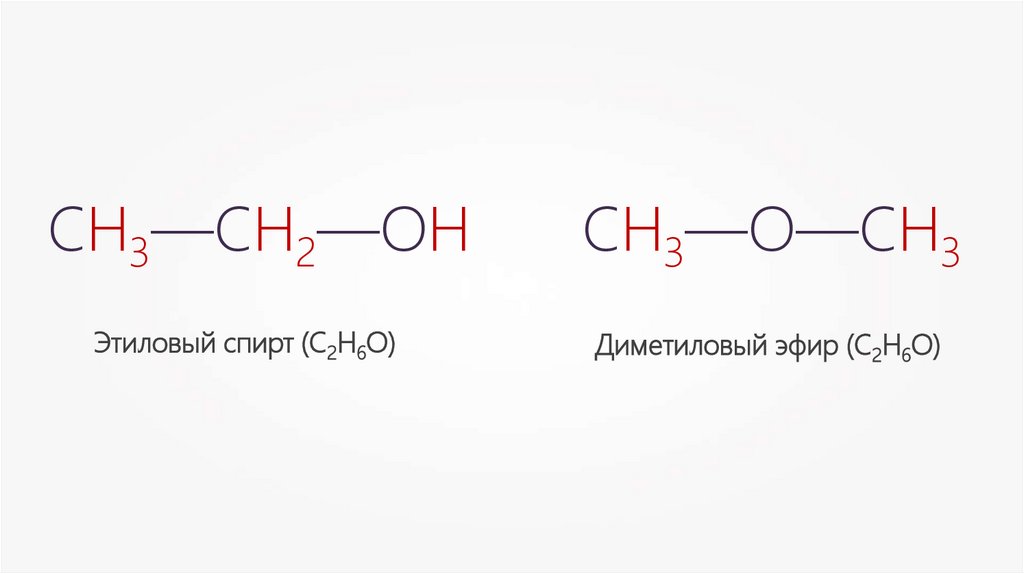
СН3—СН2—ОНЭтиловый спирт (С2Н6О)
СН3—О—СН3
Диметиловый эфир (С2Н6О)
Явление изомерии — существование
различных по свойствам веществ,
с одинаковым составом.
17.
СН3—СН2—ОНЭтиловый спирт (С2Н6О)
СН3—О—СН3
Диметиловый эфир (С2Н6О)
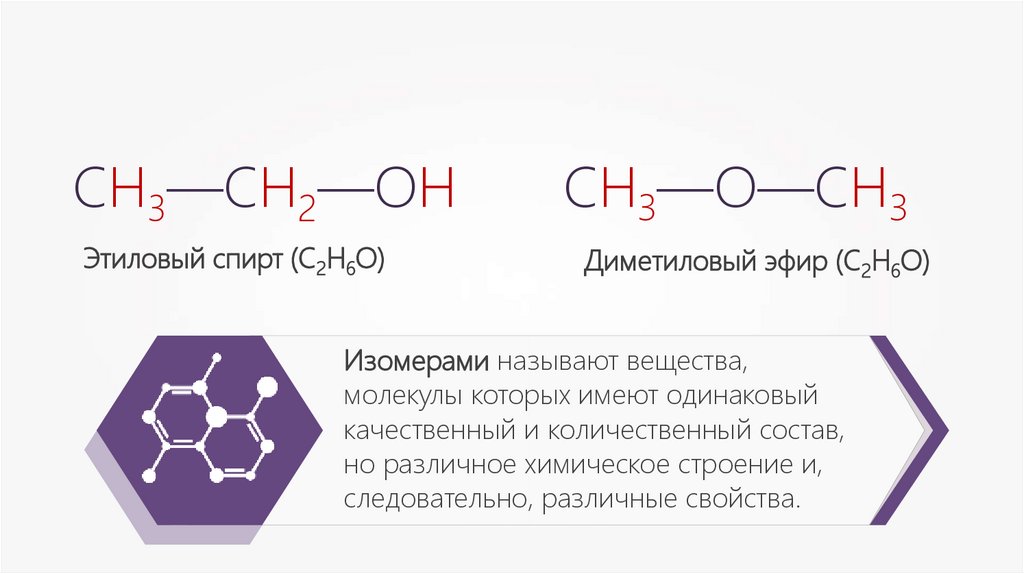
Изомерами называют вещества,
молекулы которых имеют одинаковый
качественный и количественный состав,
но различное химическое строение и,
следовательно, различные свойства.
18.
Состав двух веществ может бытьабсолютно одинаковым, но их
физические константы и
химические свойства могут
значительно различаться.
19.
СН3—СН2—ОНСН3—О—СН3
Этиловый спирт (С2Н6О)
Диметиловый эфир (С2Н6О)
20.
Научная теория получаетпризнание лишь тогда, когда
с её помощью можно не только
объяснить известные факты,
но и предсказать ранее
не известные явления.
21.
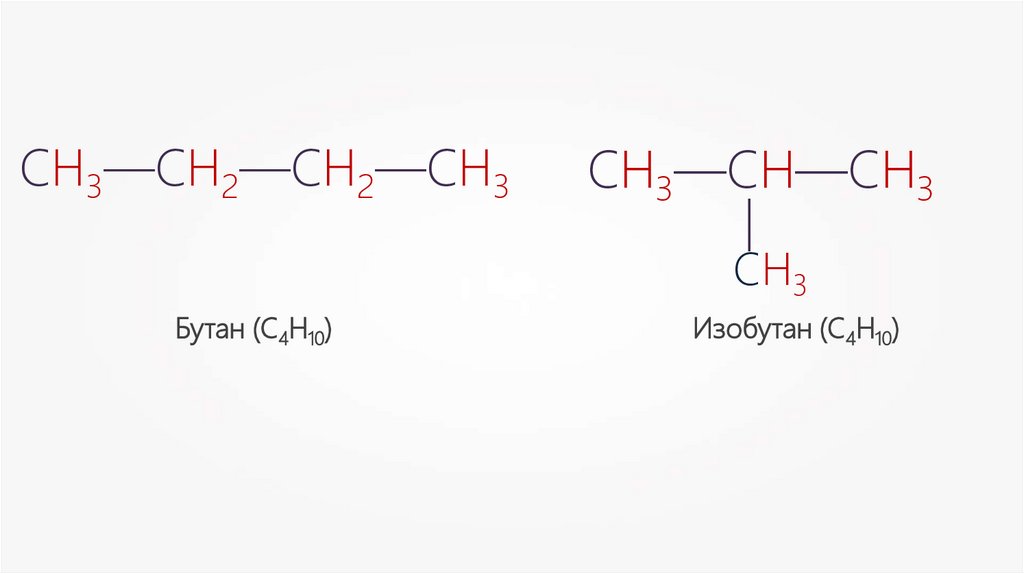
СН3—СН—СН3—
СН3—СН2—СН2—СН3
СН3
Бутан (С4Н10)
Изобутан (С4Н10)
22.
СН3—СН—СН3—
СН3—СН2—СН2—СН3
СН3
Бутан (С4Н10)
Изобутан (С4Н10)
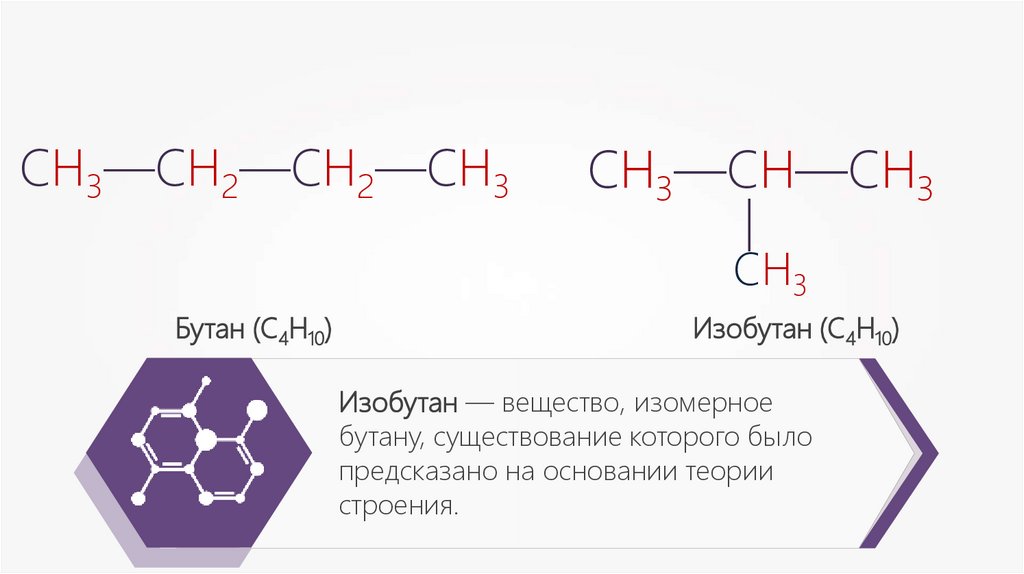
Изобутан — вещество, изомерное
бутану, существование которого было
предсказано на основании теории
строения.
23.
СН3—СН—СН3—
СН3—СН2—СН2—СН3
СН3
Бутан (С4Н10)
Изобутан (С4Н10)
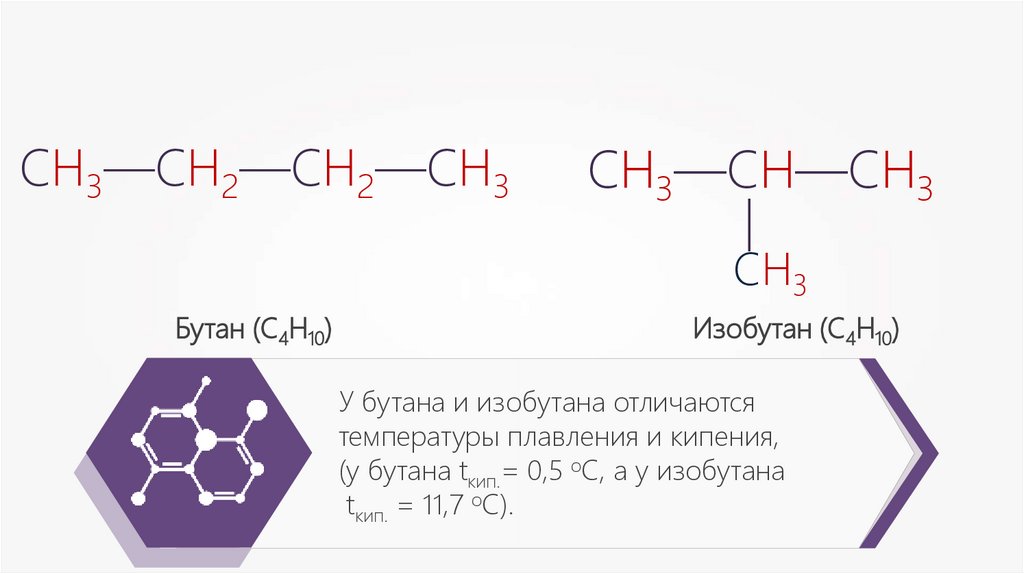
У бутана и изобутана отличаются
температуры плавления и кипения,
(у бутана tкип.= 0,5 oС, а у изобутана
tкип. = 11,7 oC).
24.
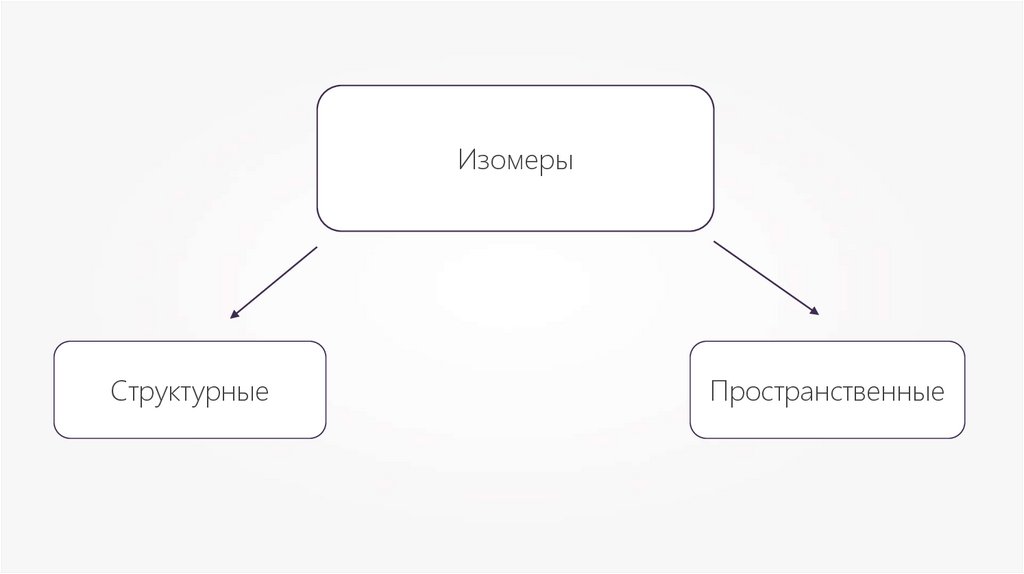
ИзомерыСтруктурные
Пространственные
25.
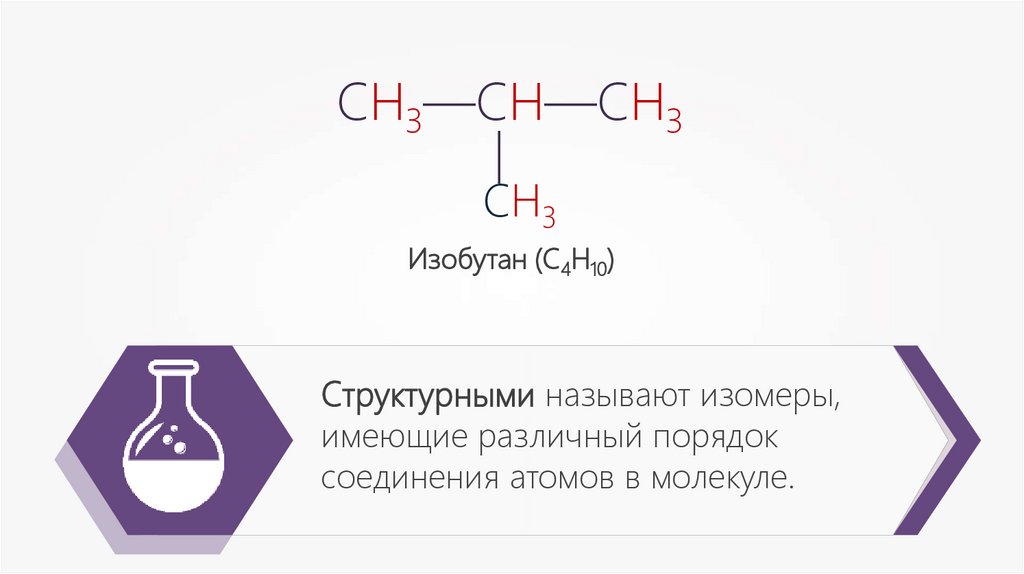
—СН3—СН—СН3
СН3
Изобутан (С4Н10)
Структурными называют изомеры,
имеющие различный порядок
соединения атомов в молекуле.
26.
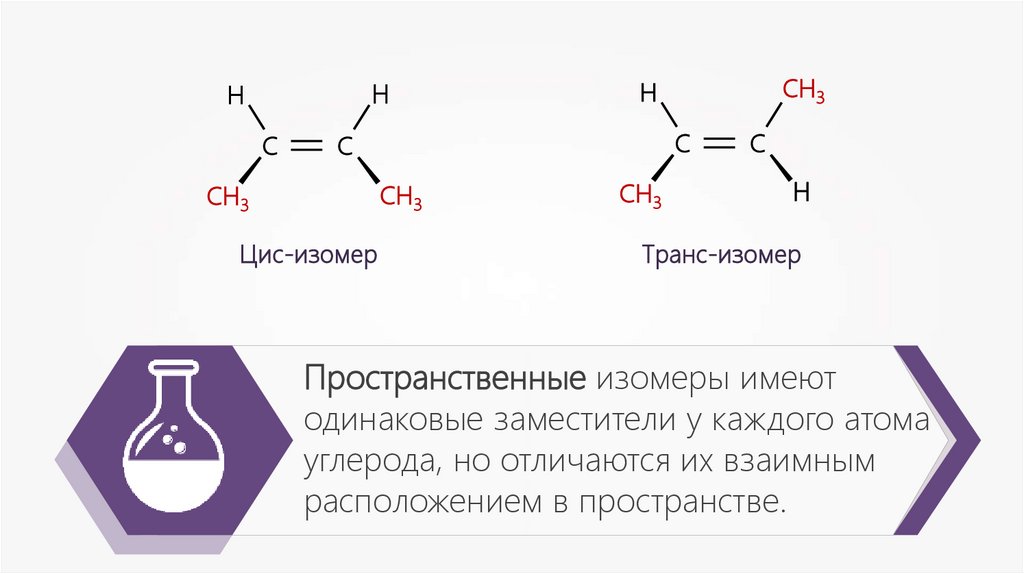
HH
С
С
С
CH3
CH3
Цис-изомер
CH3
H
CH3
С
H
Транс-изомер
Пространственные изомеры имеют
одинаковые заместители у каждого атома
углерода, но отличаются их взаимным
расположением в пространстве.
27.
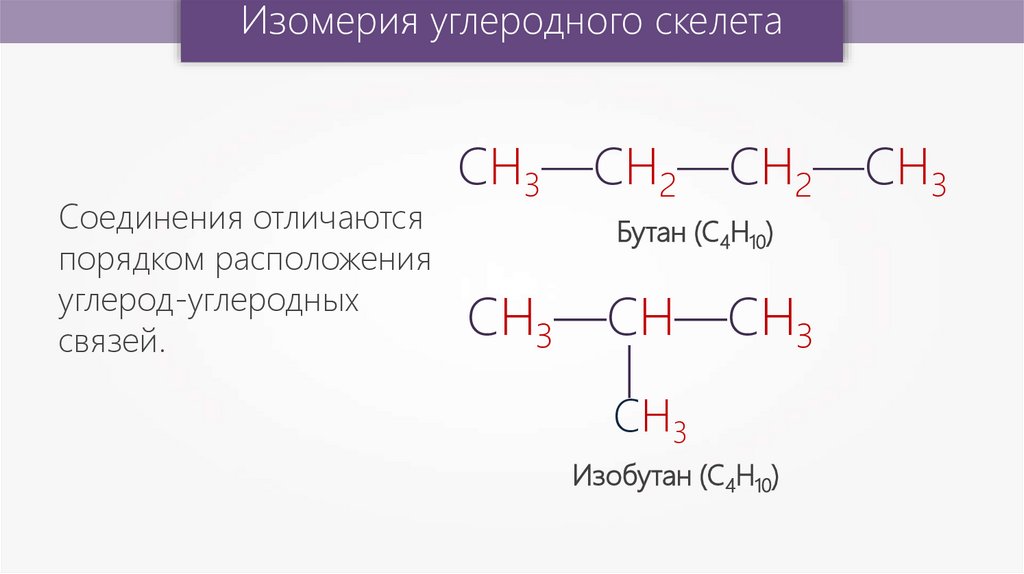
Изомерия углеродного скелетаБутан (С4Н10)
СН3—СН—СН3
—
Соединения отличаются
порядком расположения
углерод-углеродных
связей.
СН3—СН2—СН2—СН3
СН3
Изобутан (С4Н10)
28.
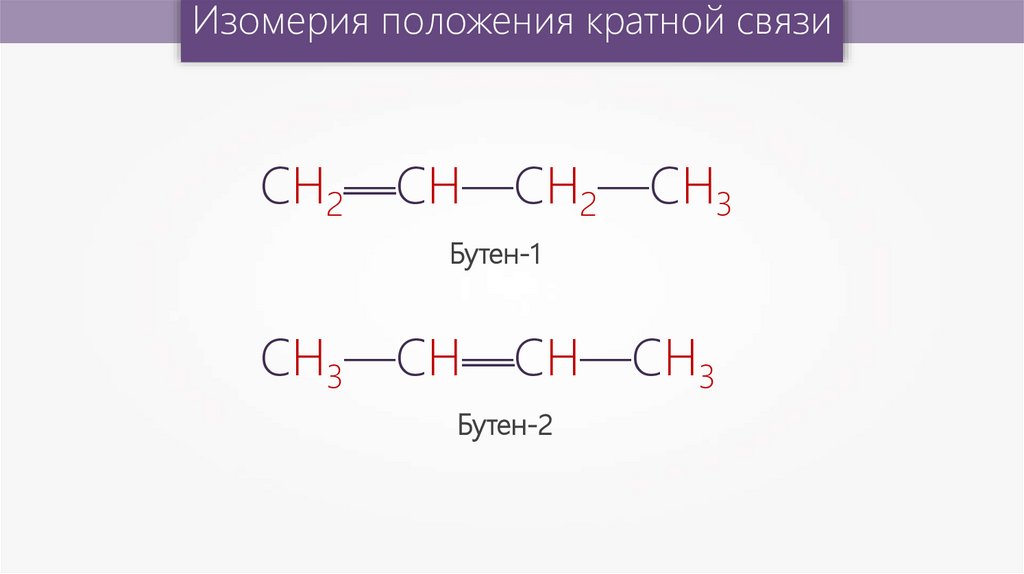
Изомерия положения кратной связиСН2—СН—СН2—СН3
Бутен-1
—
СН3—СН—СН—СН3
—
Бутен-2
29.
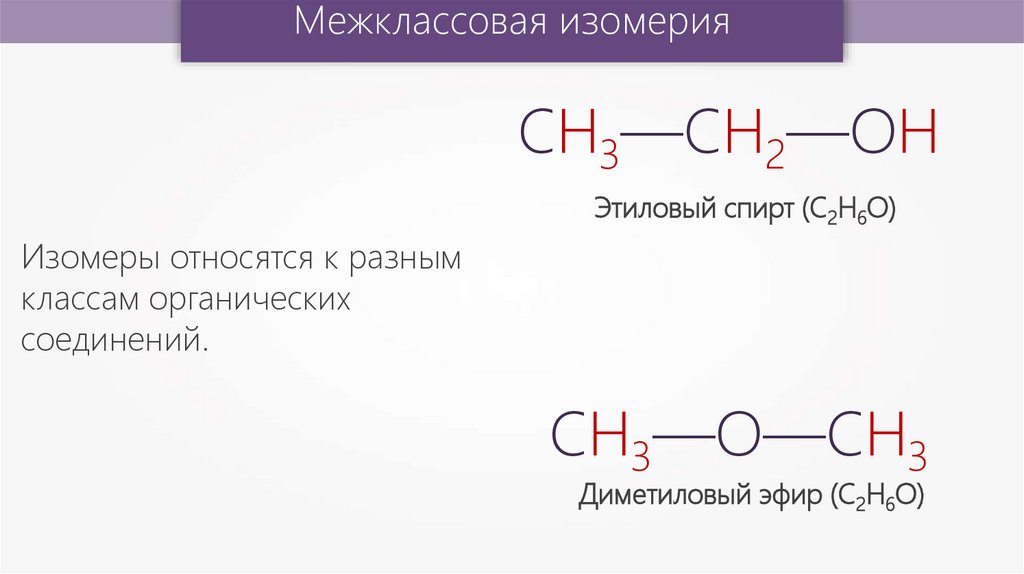
Межклассовая изомерияСН3—СН2—ОН
Этиловый спирт (С2Н6О)
Изомеры относятся к разным
классам органических
соединений.
СН3—О—СН3
Диметиловый эфир (С2Н6О)
30.
Пространственнаяизомерия
Геометрическая
Оптическая
31.
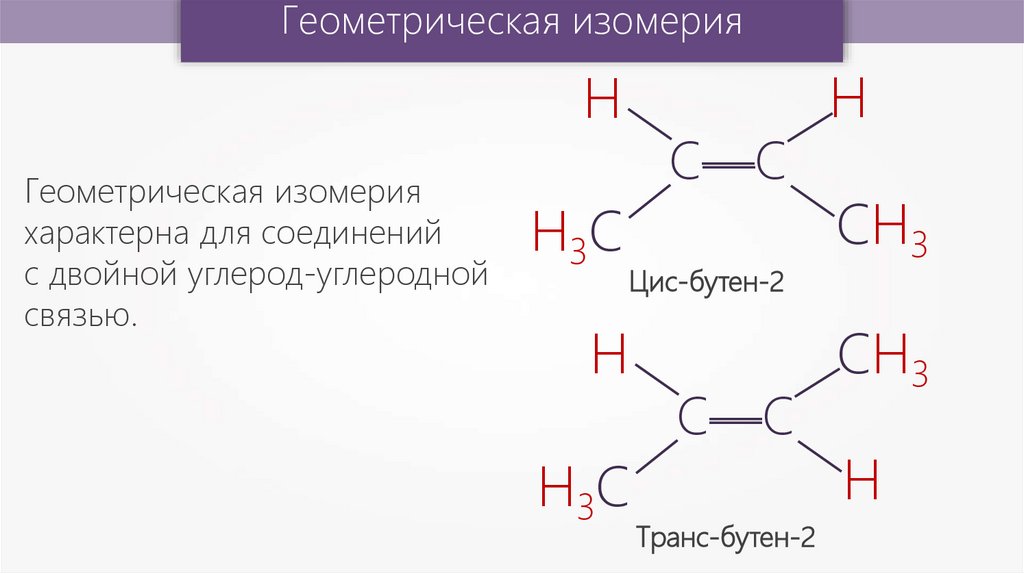
Геометрическая изомерияН
Цис-бутен-2
Н
Н3С
С—С
—
Н3С
—
Геометрическая изомерия
характерна для соединений
с двойной углерод-углеродной
связью.
С—С
Транс-бутен-2
Н
СН3
СН3
Н
32.
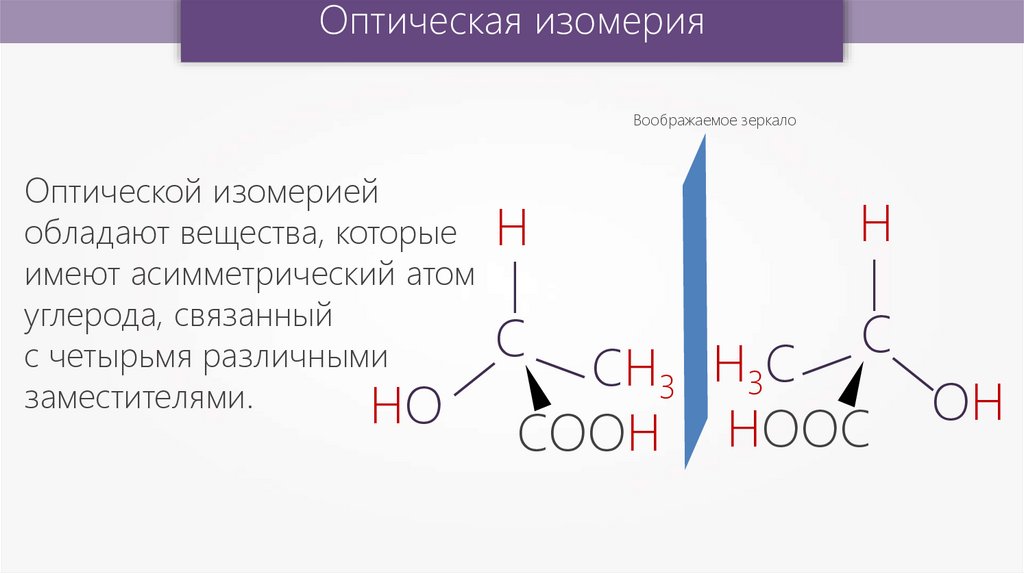
Оптическая изомерияВоображаемое зеркало
Н
—
—
Оптической изомерией
обладают вещества, которые Н
имеют асимметрический атом
углерода, связанный
С
с четырьмя различными
заместителями.
НО
С
СН3 Н3С
СООН НООС
ОН
33.
Нетоксичные изомерыгексахлорциклогексана
являются ценными
сельскохозяйственными
химикатами.
34.
Некоторые изомеры широкоиспользуются в
фармацевтической
практике.
35.
Оптическая изомерия — новоеслово в кардиологии.







 chemistry
chemistry








