Similar presentations:
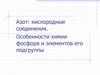
Фосфор [Ne] 3s23p3
1.
Фосфор[Ne] 3s23p3
Электронный аналог азота, однако в отличие от азота:
- Для фосфора возможно проявление валентности,
равной пяти;
- Для фосфора менее характерно образование
кратных связей Э-Э, молекула P2
2.
Фосфор: нахождение в природе• Одиннадцатый по распространенности элемент в земной коре
( 0,112%)
• В земной коре представлен фосфатами:
Апатиты – 3Ca3(PO4)2 CaX2; наиболее распространены фторапатит
Ca5(PO4)3F, хлорапатит Ca5(PO4)3Cl, гидроксилапатит Ca5(PO4)3(OH).
Фосфорит – Ca3(PO4)2.
В железных метеоритах присутствует нефосфатный минерал
фосфора – шриберзит (Fe,Ni)3P.
Фосфор присутствует во всех без исключения живых организмах.
Геохимический цикл фосфора – медленный, миллионы лет.
Биологический цикл фосфора – быстрый, недели и годы.
3.
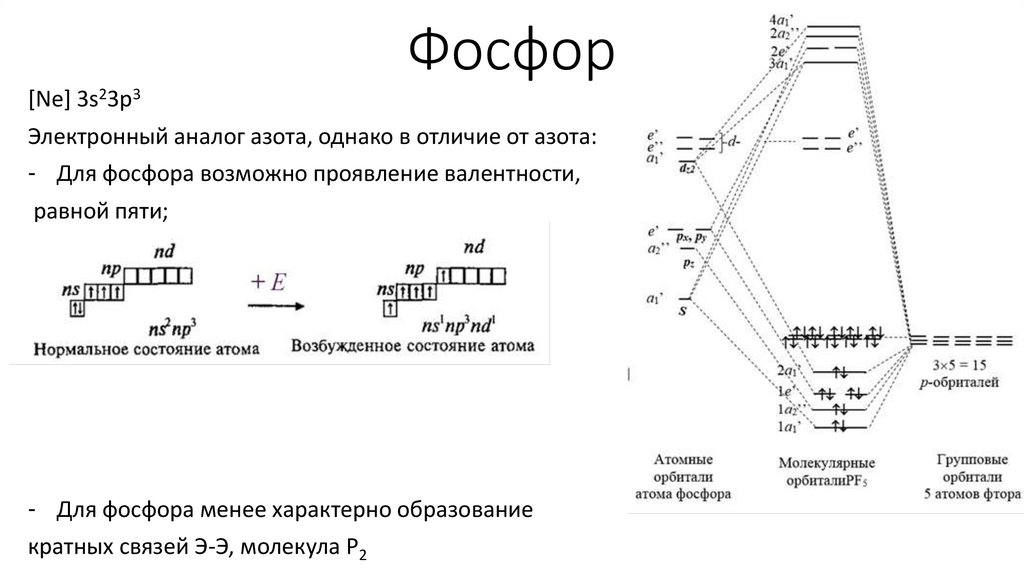
Получение фосфораСША – Э. Аубертин, Л. Боблик (1867); усовершенствован Дж.
Ридменом.
Процесс энергоемкий и
требует 15 МВт Ч
электроэнергии на 1 т.
фосфора
4.
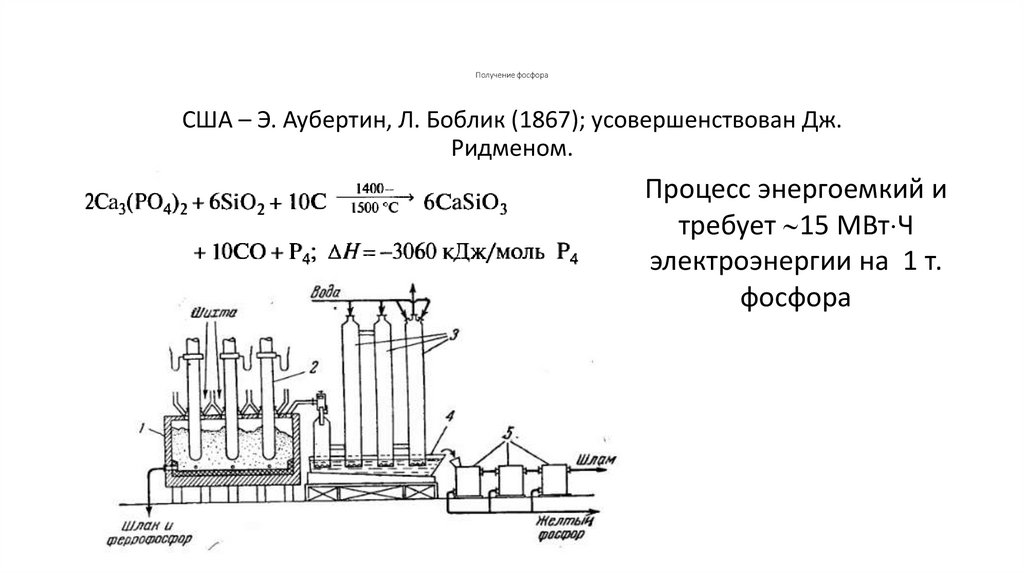
Аллотропия фосфора5.
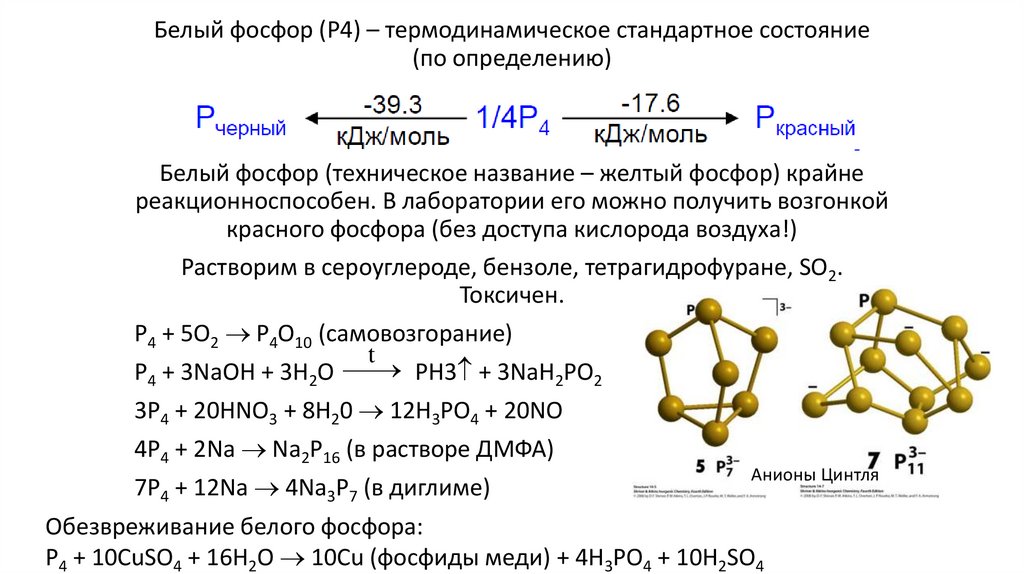
Белый фосфор (P4) – термодинамическое стандартное состояние(по определению)
Белый фосфор (техническое название – желтый фосфор) крайне
реакционноспособен. В лаборатории его можно получить возгонкой
красного фосфора (без доступа кислорода воздуха!)
Растворим в сероуглероде, бензоле, тетрагидрофуране, SO2.
Токсичен.
P4 + 5O2 P4O10 (самовозгорание)
t
P4 + 3NaOH + 3H2O
PH3 + 3NaH2PO2
3P4 + 20HNO3 + 8H20 12H3PO4 + 20NO
4P4 + 2Na Na2P16 (в растворе ДМФА)
7P4 + 12Na 4Na3P7 (в диглиме)
Анионы Цинтля
Обезвреживание белого фосфора:
P4 + 10CuSO4 + 16H2O 10Cu (фосфиды меди) + 4H3PO4 + 10H2SO4
6.
• Красный фосфор менее химически активен• Красный фосфор может быть получен полимеризацией белого фосфора
при его нагревании до 320 С без доступа воздуха, рентгеноаморфен.
Нерастворим в сероуглероде, но растворяется во ртуте, в расплавленных
свинце и висмуте.
• P + Cl2 PCl5 (и PCl3)
• 6P + 5KClO3 5KCl + 3P2O5 (механоактивация)
• Красный фосфор способен реагировать с парами воды при нагревании в
присутствии катализатора:
• Черный фосфор химически инертен.
• Он получается из красного при нагревании до 200 С и давлении 12000
атм.
• Черный фосфор – термодинамически наиболее стабильная форма
фосфора.
7.
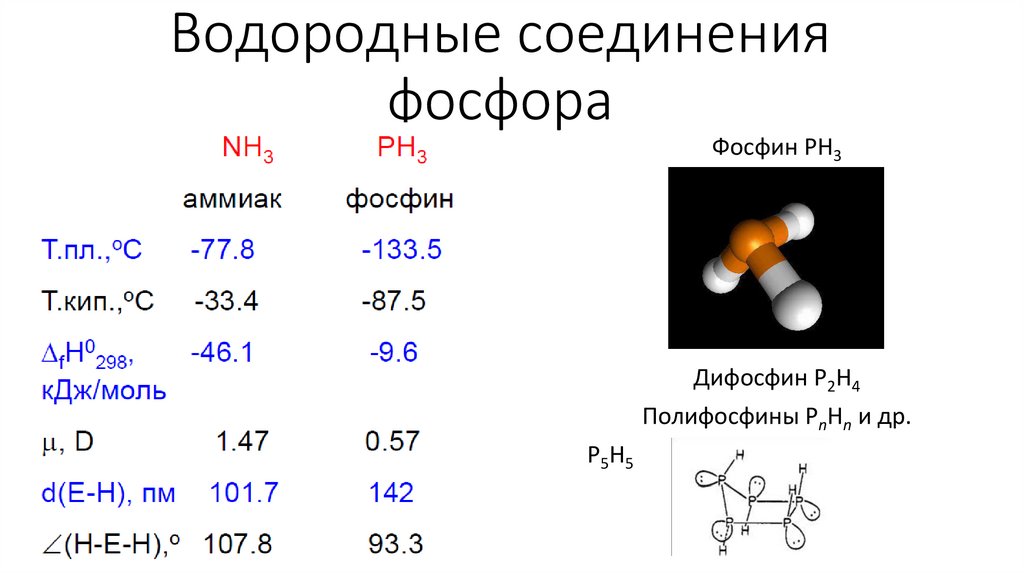
Водородные соединенияфосфора
Фосфин PH3
Дифосфин P2H4
Полифосфины PnHn и др.
P5H5
8.
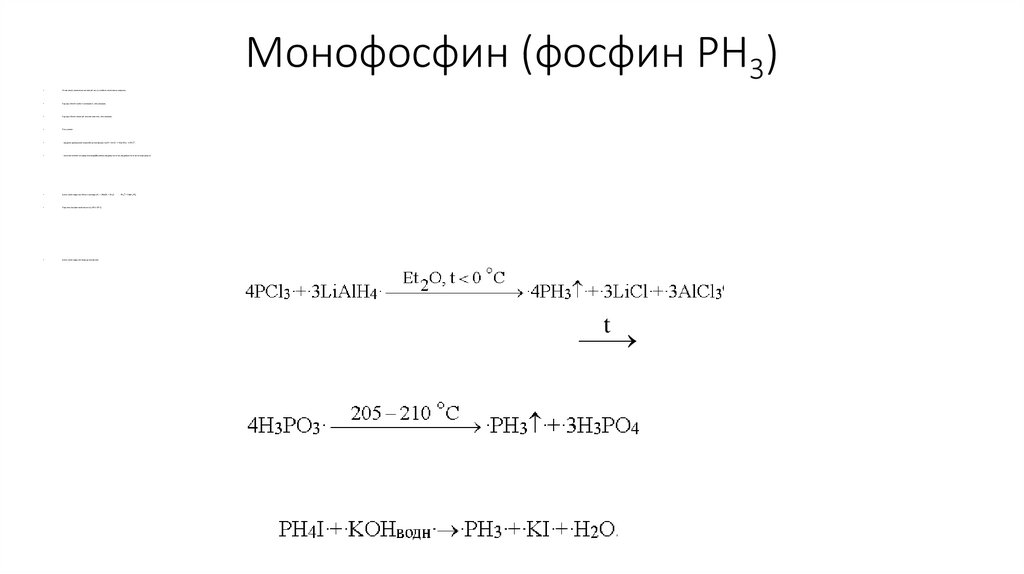
Монофосфин (фосфин PH3)Токсичный, химически активный газ со слабым чесночным запахом.
Гораздо более слабое основание, чем аммиак.
Гораздо более сильный восстановитель, чем аммиак.
Получение:
- гидролиз реакционноспособных фосфидов: Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3 .
- восстановление хлорида фосфора(III) алюмогидридом лития, гидридом лития или водородом:
Щелочной гидролиз белого фосфора: P4 + 3NaOH + 3H 2O
Пиролиз фосфоновой кислоты (205-210 С)
Щелочной гидролиз йодида фосфония:
PH 3 + 3NaH2PO2
t
9.
Химические свойства фосфина• Основность очень мала, из солей фосфония относительно устойчивы лишь
йодид и перхлорат, но и они нацело гидролизуются водой:
• PH4+ + H2O PH3 + H3O+
• Температура разложения PH4I 62 C
• Фосфин – сильный восстановитель
• nPH3 + 2nO2 (HPO3)n + nH2O
• 5PH3 + 8KMnO4 + 12H2SO4 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
• Триалкил и триарилфосфины – важные лиганды в металлорганической химии
• Гидрофосфилирование формальдегида
• PH3 + 4HCOH + HCl [P(CH2OH)4]Cl
• Тетракис-(гидроксиметил)фосфоний хлорид - основной компонент
карбамидформальдегидных и меланиноформальдегидных смол.
Синтез йодида
фосфония:
1) Образование P2I4 из
смеси белого фосфора и
йода:
P4 +4I2 2P2I4;
2) Добавление по каплям
воды к образовавшейся
смеси P2I4 и P4.
Йодид фосфония
возгоняется и оседает на
стенках колбы:
10P2I4 + 13P4 + 128H2O
40PH4I + 32H3PO4
10.
Фосфиды• Классификация фосфидов:
• 1) Реакционноспособные (ионные) – фосфиды щелочных, щелочноземельных металлов,
магния, лантаноидов. Склонны к гидролизу:
• Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3
• Mg3P2 + 6HCl 3MgCl2 + 2PH3.
• 2) Малореакционноспособные, металлоподобные. Характерны для d-элементов (никеля,
молибдена, благородных металлов). Коррозионно и износостойкие.
• Некоторые способы получения фосфидов:
• 3Fe + P (t) Fe3P
• Ca3(PO4)2 + 8C
• Ca3P2 + CrCl3
1200 С
Ca3P2 + 8CO
t
CrP + CaCl2
• Электрохимические способы.
11.
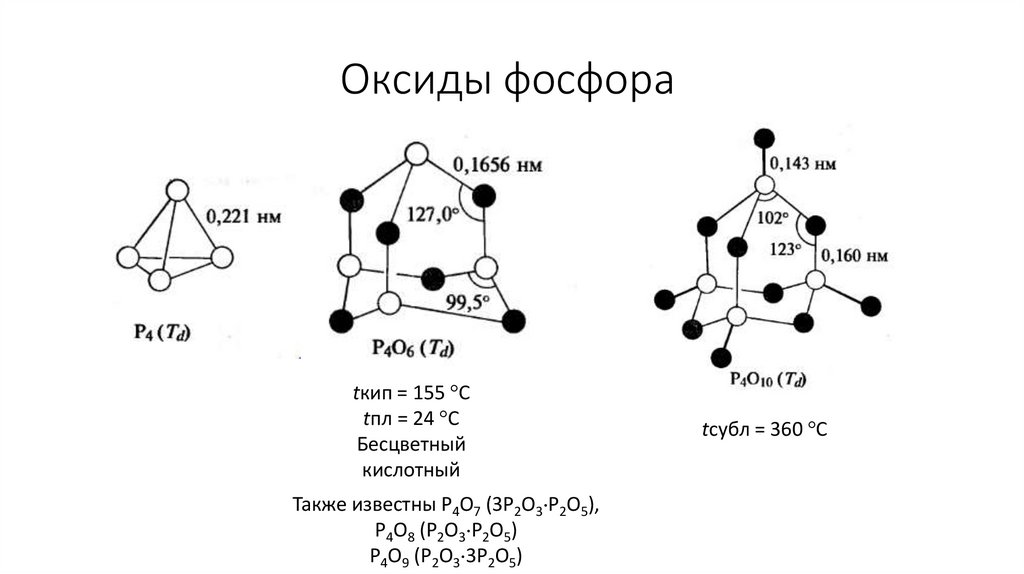
Оксиды фосфораtкип = 155 C
tпл = 24 C
Бесцветный
кислотный
Также известны P4O7 (3P2O3 P2O5),
P4O8 (P2O3 P2O5)
P4O9 (P2O3 3P2O5)
tсубл = 360 C
12.
P4O6 Получение – контролируемое окисление P4 ватмосфере, содержащей 75% O2 и 25% N2 при давлении 90
мм.рт.ст. и температуре 50 С с последующей отгонкой
продукта из смеси.
Кислотный оксид: P4O6 + 6H2O 4H3PO3 (на холоду)
Легко окисляется: P4O6 + 2O2 P4O10 (горит при
нагревании на воздухе, реакция катализируется
небольшими количествами элементарного фосфора)
При 25-50 С реакция сопровождается
хемилюминисценцией.
t
В горячей
воде диспропорционирует:
4H3PO3
3H3PO4 + PH3.
13.
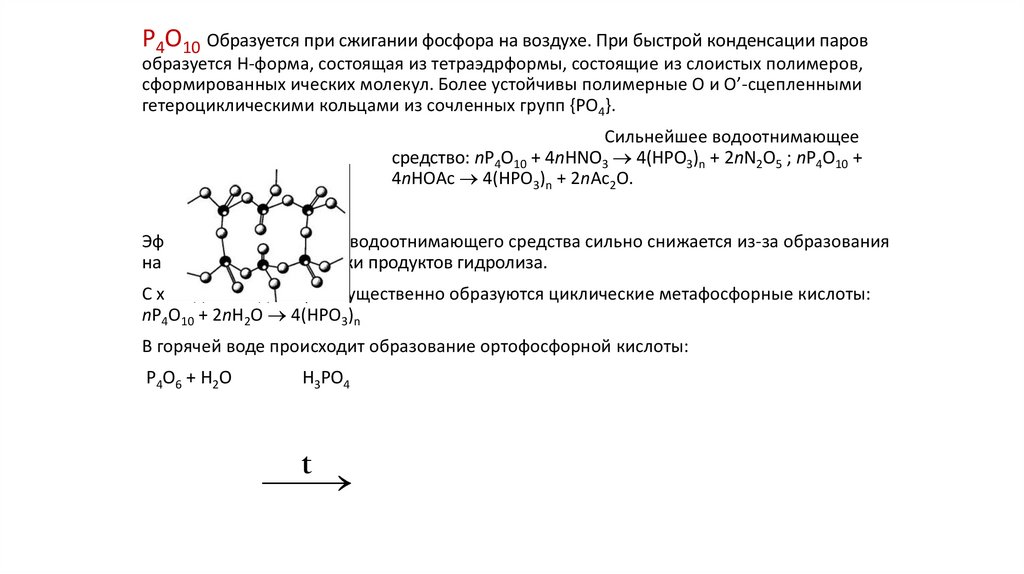
P4O10 Образуется при сжигании фосфора на воздухе. При быстрой конденсации паровобразуется H-форма, состоящая из тетраэдрформы, состоящие из слоистых полимеров,
сформированных ических молекул. Более устойчивы полимерные O и O’-сцепленными
гетероциклическими кольцами из сочленных групп {PO4}.
Сильнейшее водоотнимающее
средство: nP4O10 + 4nHNO3 4(HPO3)n + 2nN2O5 ; nP4O10 +
4nHOAc 4(HPO3)n + 2nAc2O.
Эффективность P4O10 как водоотнимающего средства сильно снижается из-за образования
на его поверхности плёнки продуктов гидролиза.
С холодной водой преимущественно образуются циклические метафосфорные кислоты:
nP4O10 + 2nH2O 4(HPO3)n
В горячей воде происходит образование ортофосфорной кислоты:
P4O6 + H2O
H3PO4
t
14.
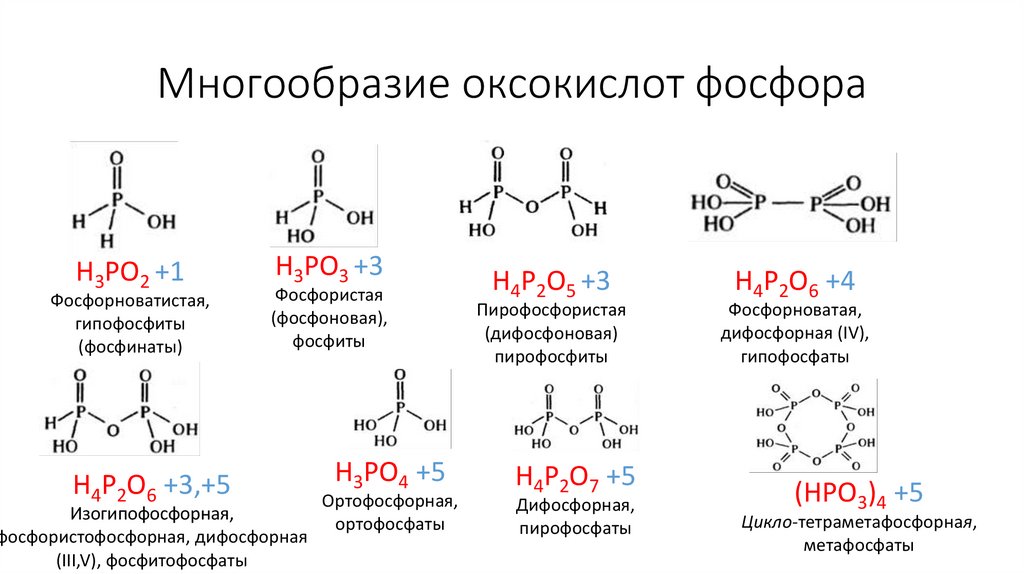
Многообразие оксокислот фосфораH3PO2 +1
Фосфорноватистая,
гипофосфиты
(фосфинаты)
H4P2O6 +3,+5
H3PO3 +3
Фосфористая
(фосфоновая),
фосфиты
Изогипофосфорная,
фосфористофосфорная, дифосфорная
(III,V), фосфитофосфаты
H3PO4 +5
Ортофосфорная,
ортофосфаты
H4P2O5 +3
Пирофосфористая
(дифосфоновая)
пирофосфиты
H4P2O7 +5
Дифосфорная,
пирофосфаты
H4P2O6 +4
Фосфорноватая,
дифосфорная (IV),
гипофосфаты
(HPO3)4 +5
Цикло-тетраметафосфорная,
метафосфаты
15.
• Все атомы фосфора в оксокислотах имеют координационноечисло 4 и содержат хотя бы одну связь фосфор кислород.
• Все атомы фосфора в оксокислоте имеют хотя бы одну группу
P OH, Такие группы способны к ионизации, сопровождающейся
отщеплением протона.
• Некоторые атомы фосфора иногда содержат связь P H. Атом
водорода, образующий такую связь, не способен отщепляться в
виде протона.
• Объединение атомов фосфора осуществляется чаще всего путем
образования связей P O P. В цепочечных и циклических
структурах, содержащих такие связи, отдельные тетраэдры
соединяются вершинами, а не рёбрами или гранями.
Значительно реже в структурах оксокислот фосфора образуется
связь P P.
16.
17.
Фосфорноватистая кислота и гипофосфитыПолучение раствора кислоты:
P4 + 3H2O + 3OHPH3 + 3H2PO2- (в растворах Ba(OH)2 или Ca(OH)2)
tионов Ba2+, Ca2+ (Ba2+ + SO42-, Ca2+ + C2O42-)
Удаление из раствора
Чистая H3PO2 не может быть выделена упариванием растворов по причине
t
диспропорционирования 2H3PO2
PH3 + H3PO
4
Применяют жидкостную экстракцию диэтиловым эфиром.
Чистая H3PO2 – легкоплавкие кристаллы.
E = -0.51 В
Одноосновна. Восстановитель.
NiSO4 + NaH2PO2 + H2O Ni (точнее аморфный сплав Ni P) + NaH2PO3 + H2SO4.
4AgNO3 + NaH2PO2 + 2H2O 4Ag + H3PO4 + NaNO3 + 3HNO3
18.
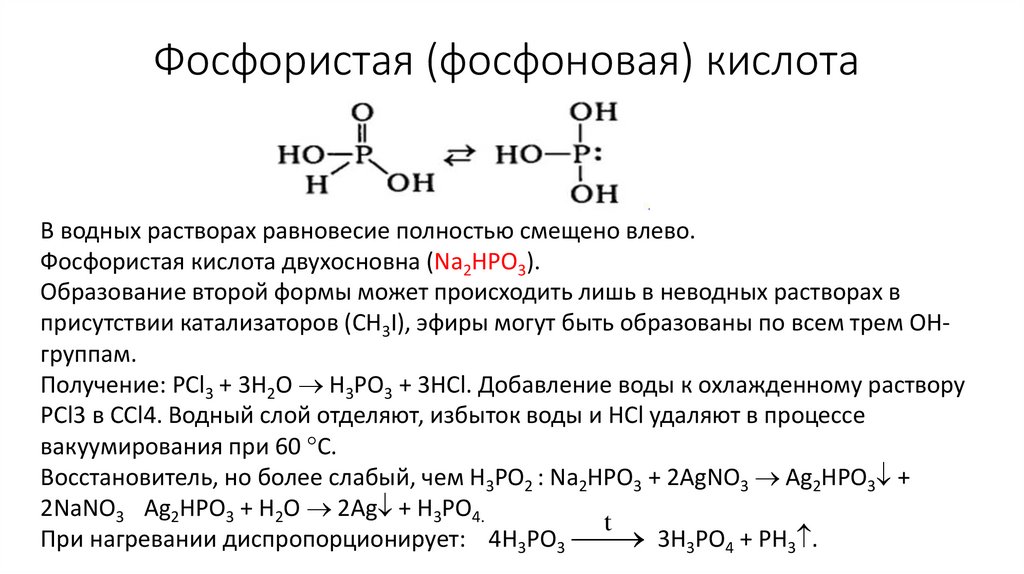
Фосфористая (фосфоновая) кислотаВ водных растворах равновесие полностью смещено влево.
Фосфористая кислота двухосновна (Na2HPO3).
Образование второй формы может происходить лишь в неводных растворах в
присутствии катализаторов (CH3I), эфиры могут быть образованы по всем трем OHгруппам.
Получение: PCl3 + 3H2O H3PO3 + 3HCl. Добавление воды к охлажденному раствору
PCl3 в CCl4. Водный слой отделяют, избыток воды и HCl удаляют в процессе
вакуумирования при 60 С.
Восстановитель, но более слабый, чем H3PO2 : Na2HPO3 + 2AgNO3 Ag2HPO3 +
2NaNO3 Ag2HPO3 + H2O 2Ag + H3PO4.
t
При нагревании диспропорционирует: 4H3PO3
3H3PO4 + PH3 .
19.
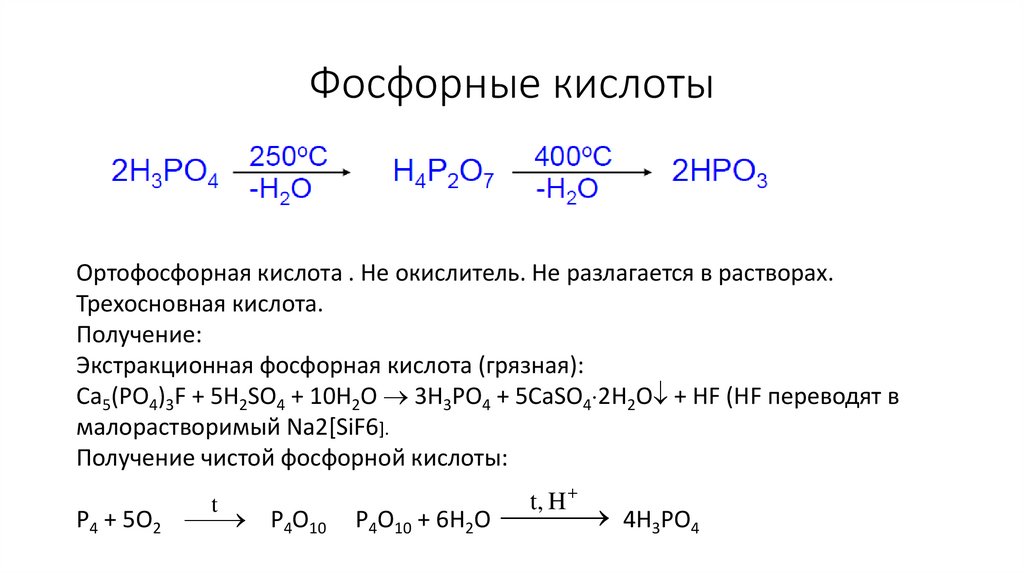
Фосфорные кислотыОртофосфорная кислота . Не окислитель. Не разлагается в растворах.
Трехосновная кислота.
Получение:
Экстракционная фосфорная кислота (грязная):
Ca5(PO4)3F + 5H2SO4 + 10H2O 3H3PO4 + 5CaSO4 2H2O + HF (HF переводят в
малорастворимый Na2[SiF6].
Получение чистой фосфорной кислоты:
t
P4O10
P4 + 5O2
t, H
P4O10 + 6H2O 4H3PO4
20.
Соли фосфорных кислотРастворимые соли ортофосфорной кислоты подвержены гидролизу:
Na3PO4 – сильнощелочная среда, pH = 12-13
Na2HPO4 – слабощелочная среда, pH = 9
NaH2PO4 – слабокислая среда (диссоциация H2PO4-), pH = 5
Для получения фосфатов предпочтительно использовать Na2HPO4
FeCl3 + Na2HPO4 FePO4 + 2NaCl + HCl.
Качественные реакции на соли фосфорных кислот
-
Действие AgNO3: Ag3PO4 – желтый (ПР(Ag3PO4) = 10-20), метафосфат и пирофосфат – белые.
-
-Метафосфорные кислоты свертывают белок, а пирофосфорная нет.
-
Разложение кислых солей ортофосфорной кислоты:2Na2HPO4
-
H2O; 2NaH2PO4
Na2H2P2O7 + H2O
t 160 С
Na2H2P2O7
n
2
Na4P2O7 +
120 300 С
(NaPO ) + H O
3 n
2
t 250 С
n
2
21.
Галогениды фосфора22.
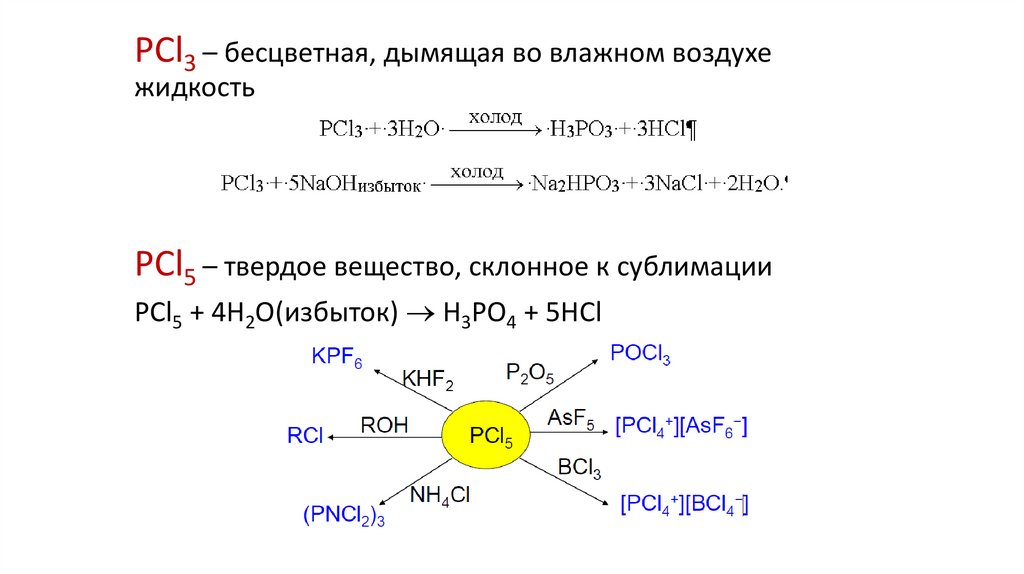
PCl3 – бесцветная, дымящая во влажном воздухежидкость
PCl5 – твердое вещество, склонное к сублимации
PCl5 + 4H2O(избыток) H3PO4 + 5HCl
23.
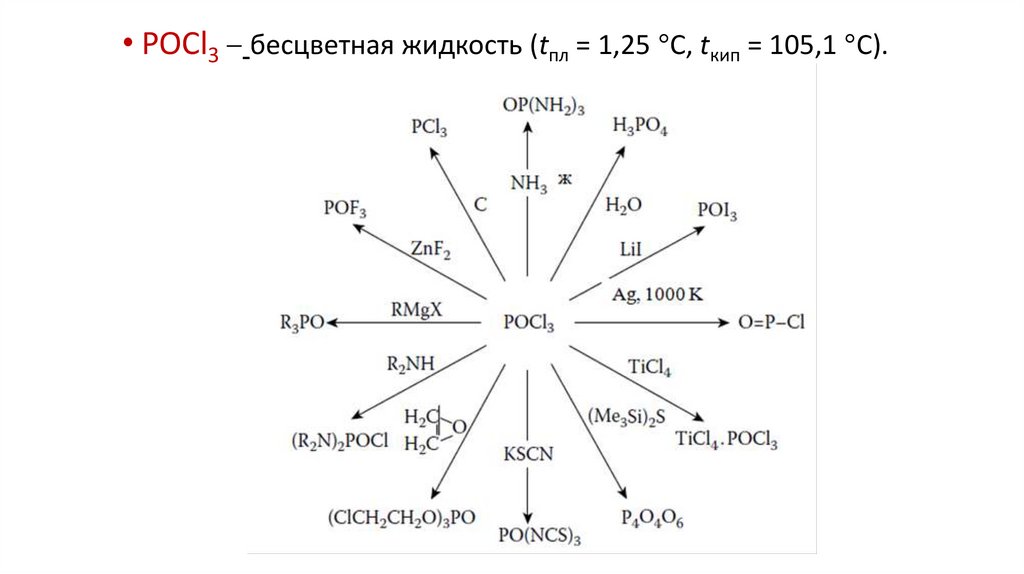
• POCl3 бесцветная жидкость (tпл = 1,25 C, tкип = 105,1 C).24.
Применение фосфора и его соединенийФосфорные удобрения











 chemistry
chemistry