Similar presentations:
Генно - инженерные препараты в терапии ревматических заболеваний
1. Генно-инженерные препараты в терапии ревматических заболеваний Семизарова И.В. КубГМУ, кафедра факультетской терапии
2.
Введение ГИБП стало главным прорывом влечении ревматических заболеваний
Основные ГИБП:
Блокаторы
ФНО альфа
Блокаторы
ИЛ- 1(анакинра)
Блокаторы
ИЛ- 6 (тоцилизумаб(актемра))
Модуляторы
активности Т-клеток (абатацепт)
CD20-моноклональные
антитела
(ритуксимаб (мабтера))
3.
Генно-инженерные биологическиепрепараты (ГИБП) в ревматологии
Белковые структуры, полученные при помощи генноинженерной технологии
Разновидности молекул
o Растворимые антагонисты рецепторов
o Антагонисты поверхностных клеточных рецепторов
o Моноклональные антитела к цитокинам или их
рецепторам
«цепт» (-cept) - рецепторы к Fc-фрагменту IgG1
«маб» (-mab)- моноклональные антитела (МАТ)
«-КСИмаб» (-«ximab») – химерные (мышиные) МАТ
«-зумаб» (-«zumab») – гуманизированные МАТ
«-умаб» (-«umab») – человеческие МАТ
4. Эффекты биологических препаратов:
1.Иммунодепрессивный (характернаселективность)
2.
3.
Противовоспалительный
Антидеструктивный (способны
полностью затормозить и даже
предотвратить разрушение суставов)
5.
Д.Е. КАРАТЕЕВ, Е.Л. ЛУЧИХИНА, 2013Быстрое развитие клинического эффекта
(ингибиторы ФНО)
Способность вызывать стойко низкую активность
РА и клиническую ремиссию
Способность эффективно тормозить
прогрессирование деформации суставов
6.
Фармакологические свойствабиологических препаратов из группы БПВП
Положительные свойства
Отрицательные свойства
высокая
угнетение
эффективность , в том числе
у резистентных к обычной терапии
пациентов
достоверно доказанное торможение
деструкции суставов - эти признаки
позволяют относить биологические
препараты к группе БПВП
особенностью группы является
быстрое (нередко в течение нескольких
дней) развитие улучшения
характерная черта биологических
средств — потенцирование эффекта в
сочетании с БПВП, в первую очередь с
метотрексатом.
противоинфекционного и
(потенциально)
противоопухолевого
иммунитета;
риск развития аллергических
реакций и индуцирования
аутоиммунных синдромов,
связанный с тем, что
биологические препараты по
химической структуре являются
белками;
высокая стоимость лечения.
7.
Ревматоидный артрит, анкилозирующий спондилит,псориатический артрит
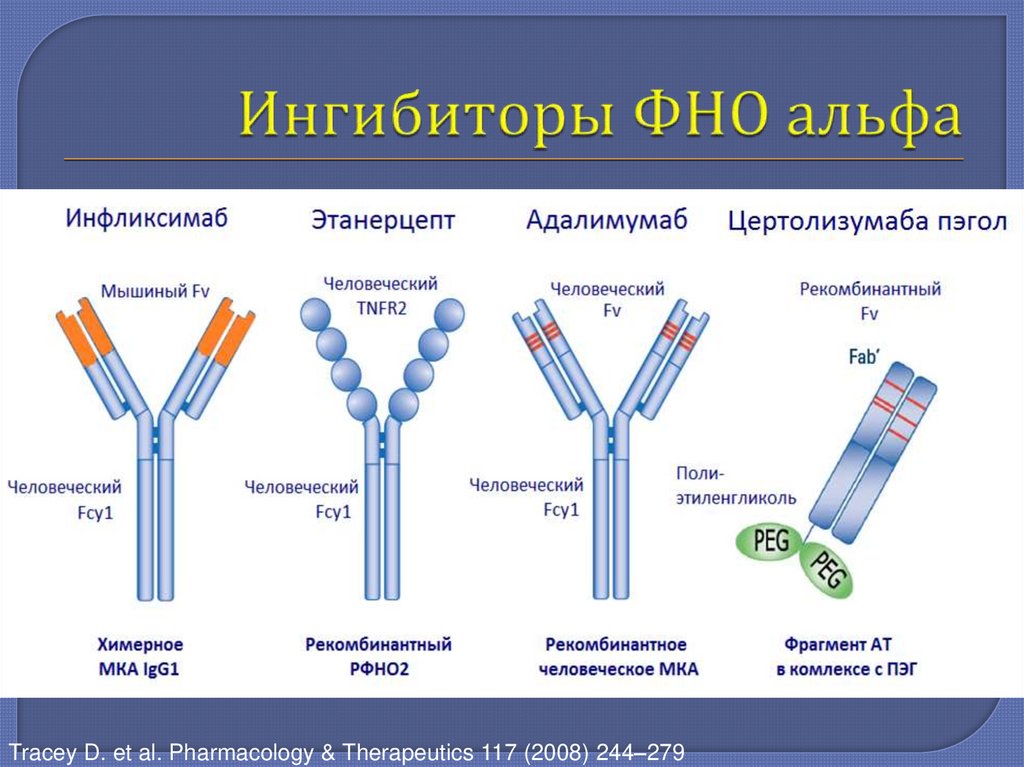
инфликсимаб
адалимумаб
этанерцепт
цертолизумаба
пэгол
Ревматоидный артрит
ритуксимаб
тоцилизумаб
абатацепт
голимумаб
8.
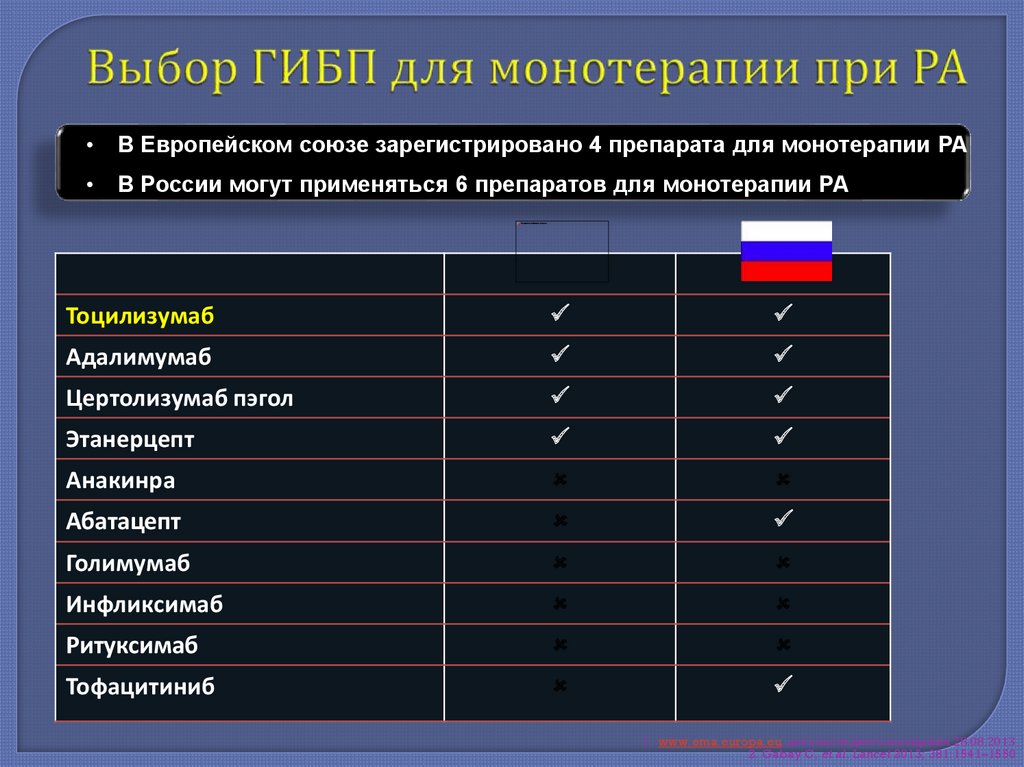
В Европейском союзе зарегистрировано 4 препарата для монотерапии РА
В России могут применяться 6 препаратов для монотерапии РА
Тоцилизумаб
Адалимумаб
Цертолизумаб пэгол
Этанерцепт
Анакинра
Абатацепт
Голимумаб
Инфликсимаб
Ритуксимаб
Тофацитиниб
1.. www.ema.europa.eu, дата последнего посещения 28.08.2013
2. Gabay C, et al. Lancet 2013; 381:1541–1550
9. Ингибиторы ФНО альфа
Tracey D. et al. Pharmacology & Therapeutics 117 (2008) 244–27910.
11.
12. Этанерцепт
– единственный растворимый рецепторк ФНО альфа. Первый ингибитор ФНО альфа,
зарегистрированный для лечения РА у взрослых в
1999г.
Димерная структура- человеческий рецептор к ФНО
альфа и человеческий рецептор к ФНО бетта,
соединённые между собой фрагментом Ig G1.
Особенность механизма действия Этанерцепта- не
образует прочных комплексов с мембранными
молекулами ФНО альфа. Клетки, несущие эти
молекулы(воспалительные гранулёмы –Т
лимфоциты и макрофаги)- остаются
жизнеспособными. Существенно снижается риск
развития туберкулёза. Этанерцепт не разрушает
клетки гранулём, ограничивающих микобактерии от
окружающих тканей и тем самым препятствует
распространению инфекции.
13.
Этанерцепт («Энбрел»)• Человеческие растворимые рецепторы к ФНОРецепторы ФНО
альфа
(центры связывания ФНО-α)
человеческий
• Показания*
o Ревматоидный артрит ( метотрексат)
o Ювенильный идиопатический артрит
(с 2-х лет)
o Анкилозирующий спондилит
o Псориатический артрит ( метотрексат)
o Псориаз (дети с 6 лет)
* http://grls.rosminzdrav.ru на 28.08.2014
Fc
фрагмент
14.
АктивированныеMf
р-ФНОр:Fc
ФНО
Механизм действия препарата заключается в связывании растворимых
форм ФНО-α и в предотвращении, таким образом, связывания этого
цитокина с рецепторами поверхности клетки.
15.
Этанерцепт («Энбрел»)особенности применения
• Подкожно
• Дозировка препарата
o ВЗРОСЛЫЕ: по 50 мг в неделю ИЛИ по 25 мг два
раза в неделю с интервалом в 3-4 дня
o ДЕТИ: по 0,8 мг в неделю (максимально 50 мг)
ИЛИ по 0,4 мг (максимально 25 мг) два раза в
неделю с интервалом в 3-4 дня
16.
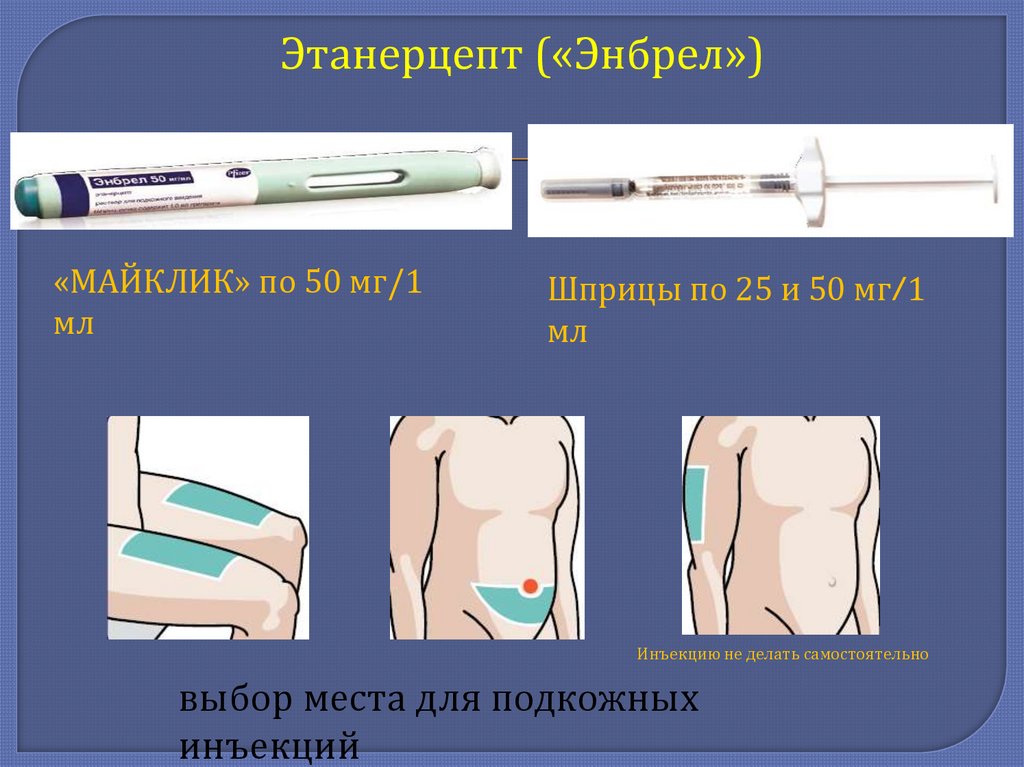
Этанерцепт («Энбрел»)формы введения
• Лиофилизат для приготовления раствора по
10 мг*
• Лиофилизат для приготовления раствора по
25 мг**
• Шприц с готовым раствором по 25 мг***
• Шприц с готовым раствором по 50 мг/1 мл
• Шприц-ручка с готовым раствором по 50 мг/1 мл
*для детей
* *Для пациентов менее 62,5 кг (включая
детей)
***Не поставляется в РФ
17.
Этанерцепт («Энбрел»)«МАЙКЛИК» по 50 мг/1
мл
Шприцы по 25 и 50 мг/1
мл
Инъекцию не делать самостоятельно
выбор места для подкожных
инъекций
18.
19.
Исследования препарата ЭНБРЕЛ при РА:прошлое, настоящее и будущее
Weinblatt et al
Эффективность и
безопасность препарата
ЭНБРЕЛ
PRESERVE снижение дозы/
TEMPO Эффективность и
отмена препарата ЭНБРЕЛ
безопасность препарата
PRIZE снижение дозы:
ЭНБРЕЛ и MTX
COMET
ЭНБРЕЛ + MTX, MTX или
монотерапия MTX по
плацебо
сравнению с MTX +
ERA Эффективность
DOSERA снижение дозы или отмена препарата
ЭНБРЕЛ
и безопасность
препарата ЭНБРЕЛ и
EMPIRE Ремиссия при РА на ранней
MTX
стадии
⃰*Приблизительно 150
продолжающихся/запланированных IIR в Европе
ADORE эффективность и
безопасность терапии
ЭНБРЕЛ + MTX по
сравнению с монотерапией
ЭНБРЕЛ
STRASS увеличенный интервал
дозирования по сравнению со
стандартным интервалом
EM T2T
LA комбинация с DMARD
Продолжение разработок и
инвестиций в исследования
препарата ЭНБРЕЛ при РА
ROCKiES (NCT01927757)
EARLY RA (NCT01558089)
NCT01691014
NCT01578850
NCT01578850
ANTIBODY-RA (NCT01981473)
Ранний РА
Развернутый РА
Даты являются датами окончания исследвоания в соответствии
с www.clinicaltrials.gov. Доступ осуществлен 10.11.2014
Хорошо контролируемой
заболевание
Не специфично к стадии
заболевания
MTX: метотрексат; РА:
ревматоидный артрит.
20.
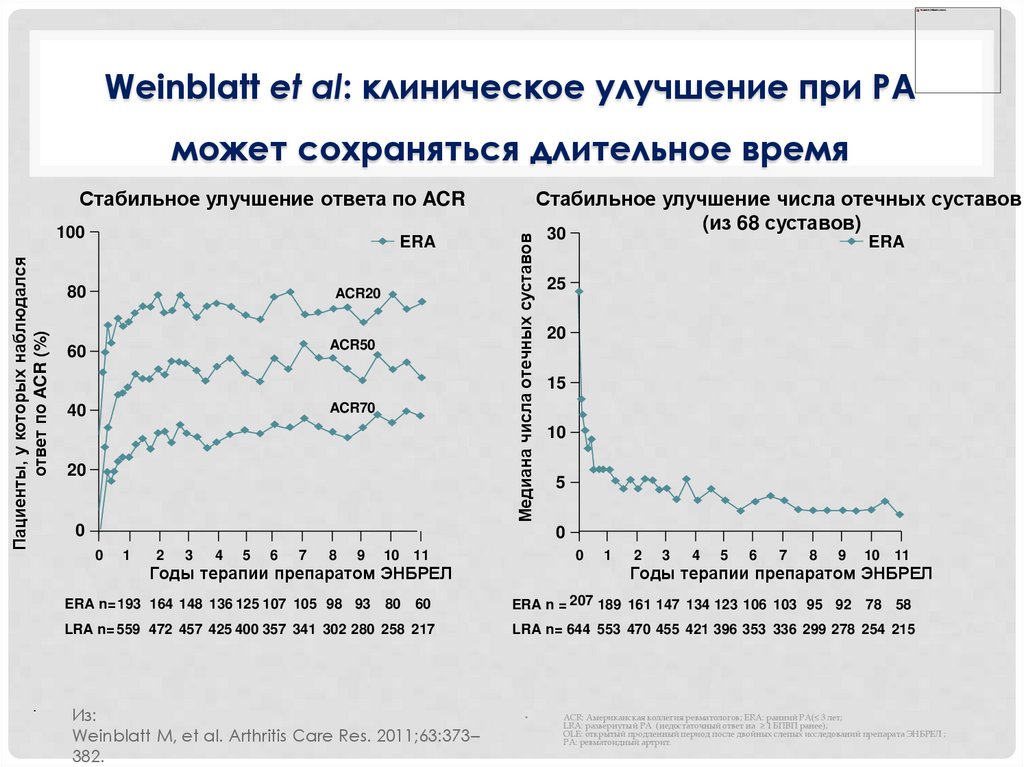
Weinblatt et al: клиническое улучшение при РАможет сохраняться длительное время
Пациенты, у которых наблюдался
ответ по ACR (%)
100
ERA
80
ACR20
ACR50
60
ACR70
40
20
Медиана числа отечных суставов
Стабильное улучшение ответа по ACR
0
ERA
25
20
15
10
5
0
0
1
2
3
4
5
6
7
8
9
10 11
0
Годы терапии препаратом ЭНБРЕЛ
ERA n= 193 164 148 136 125 107 105 98 93
80 60
LRA n= 559 472 457 425 400 357 341 302 280 258 217
.
Стабильное улучшение числа отечных суставов
(из 68 суставов)
30
Из:
Weinblatt M, et al. Arthritis Care Res. 2011;63:373–
382.
1
2
3
4
5
6
7
8
9
10 11
Годы терапии препаратом ЭНБРЕЛ
ERA n = 207 189 161 147 134 123 106 103 95 92
78 58
LRA n= 644 553 470 455 421 396 353 336 299 278 254 215
ACR: Американская коллегия ревматологов; ERA: ранний РА(≤ 3 лет;
LRA: развернутый РА (недостаточный ответ на ≥ 1 БПВП ранее);
OLE: открытый продленный период после двойных слепых исследований препарата ЭНБРЕЛ ;
РА: ревматоидный артрит.
21.
Рентгенологические показатели эффективности терапии через 36 недель дляпопуляции mITT в ходе открытого периода
Средний балл эрозии
(шкала: 0–280)
50,0
40,0
30,0
20,0
10,0
0,0
Средний балл
эрозии
Средний
mTSS
Средний модифицированный
общий балл Шарпа (mTSS)
(шкала: 0–448)
39,7
39,3
50,0
40,0
30,0
20,0
10,0
0,0
Исходный
Неделя 36
уровень
24,8
25,0
Исходный уровень
Неделя 36
Средний балл сужения суставной
щели (JSN)
(шкала: 0–168)
Средний
JSN
50,0
40,0
30,0
20,0
10,0
0,0
14,5
14,7
Исходный уровень
Неделя 36
Smolen J, et al. Lancet. 2013;381:918–929
mITT,
N=834
22.
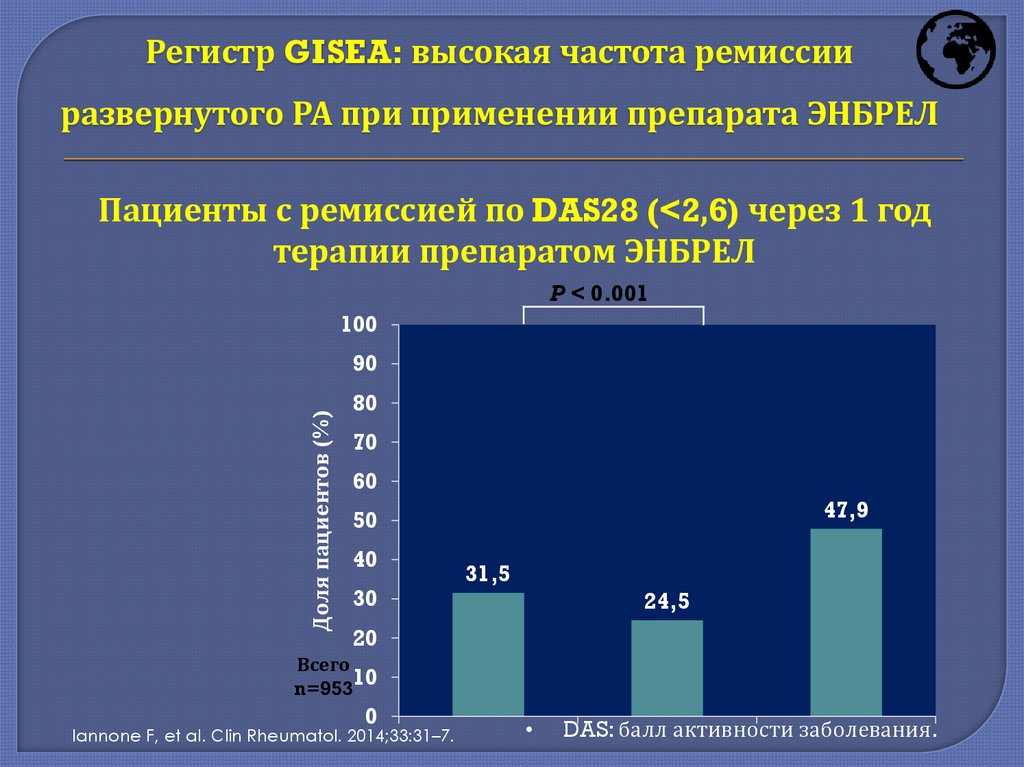
Регистр GISEA: высокая частота ремиссииразвернутого РА при применении препарата ЭНБРЕЛ
Пациенты с ремиссией по DAS28 (<2,6) через 1 год
терапии препаратом ЭНБРЕЛ
P < 0.001
100
Доля пациентов (%)
90
80
70
60
47,9
50
40
30
31,5
24,5
20
Всего
10
n=953
0
Iannone F, et al. Clin Rheumatol. 2014;33:31–7.
DAS: балл активности заболевания.
23.
Регистр DANBIO: клиническая ремиссия РАпри терапии препаратом ЭНБРЕЛ
100
Клиническая ремиссия через 6 и 12 месяцев терапии
Частота ответа (%)
90
80
70
60
Ремиссия по DAS28
Ремиссия по CDAI
50
40
30
20
33
26
18
13
10
0
6 месяцев
12 месяцев
N=425
61% пациентов, получавших ЭНБРЕЛ, одновременно получали MTX на
исходном уровне
Hetland M, et al. Arthritis Rheum. 2010;62:22–32.
• .
CDAI: индекс активности болезни Крона; DAS, балл активности заболевания.
24.
PRESERVE: ЭНБРЕЛ улучшает качествожизни пациентов
Процентное изменение PRO от исходного уровня до 36 недели
% изменения
40
33
25
20
0
-20
-40
-60
-34
-45
-51
-52
-55
-57
-54
-66
-80
1
1
1
1
1
1
1
2
2
Пациенты с развернутым РА, которые получали ЭНБРЕЛ + MTX,
демонстрировали значимое улучшение по всем показателям PRO
1. Smolen J, et al. Lancet 2013;381:918–929.
2. Smolen J, et al. EULAR, London, United Kingdom, 25–28
May, 2011;Poster 245.
BPI: краткий опросник боли; FACIT-слабость: функциональная оценка терапии хронического заболевания –
шкала слабости; HAQ: опросник оценки состояния здоровья; MOS: шкала исследования медицинских
результатов для сна;
PRO: результат по оценке пациента; РА: ревматоидный артрит; ВАШ: визуальная аналоговая шкала; WPAI:
опросник нарушения трудоспособности и повседневной деятельности при РА.
1
25.
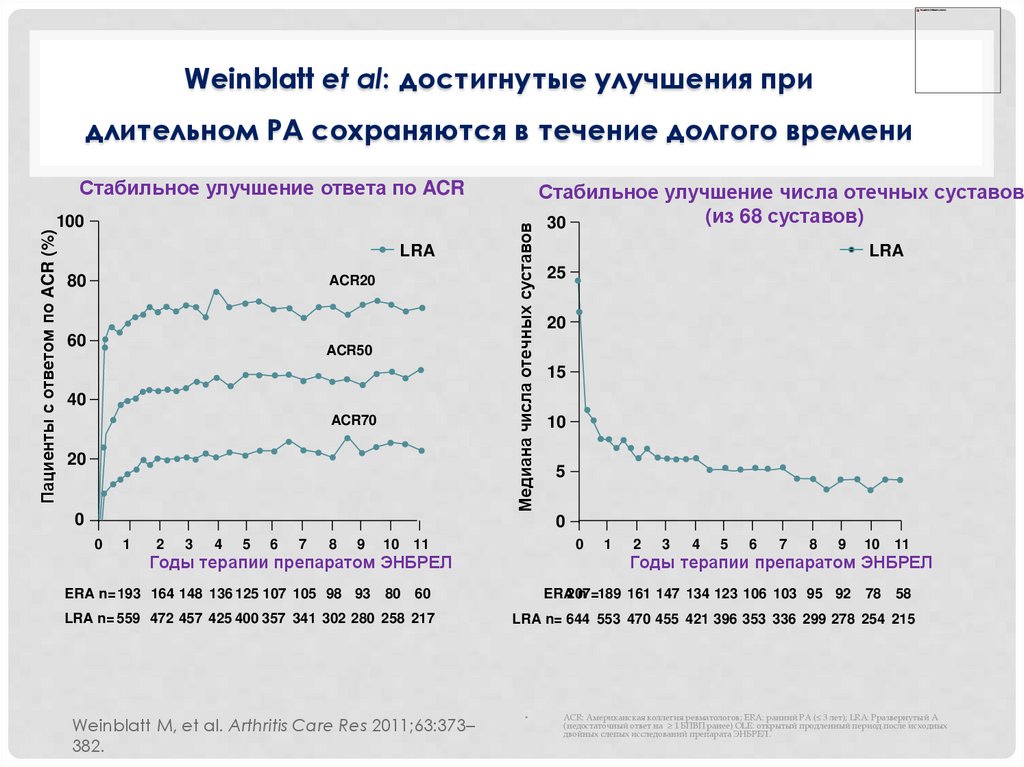
Weinblatt et al: достигнутые улучшения придлительном РА сохраняются в течение долгого времени
Пациенты с ответом по ACR (%)
100
LRA
80
ACR20
60
ACR50
40
ACR70
20
Медиана числа отечных суставов
Стабильное улучшение ответа по ACR
0
Стабильное улучшение числа отечных суставов
(из 68 суставов)
30
LRA
25
20
15
10
5
0
0
1
2
3
4
5
6
7
8
9
10 11
0
Годы терапии препаратом ЭНБРЕЛ
ERA n= 193 164 148 136 125 107 105 98 93
Weinblatt M, et al. Arthritis Care Res 2011;63:373–
382.
2
3
4
5
6
7
8
9
10 11
Годы терапии препаратом ЭНБРЕЛ
80 60
LRA n= 559 472 457 425 400 357 341 302 280 258 217
1
ERA207
n =189 161 147 134 123 106 103 95 92
78 58
LRA n= 644 553 470 455 421 396 353 336 299 278 254 215
ACR: Американская коллегия ревматологов; ERA: ранний РА (≤ 3 лет); LRA: Рразвернутый А
(недостаточный ответ на ≥ 1 БПВП ранее) OLE: открытый продленный период после исходных
двойных слепых исследований препарата ЭНБРЕЛ.
26.
Эффективность этанерцепта• Этанерцепт достоверно снижает скорость
рентгенологического прогрессирования
суставов при РА
• Этанерцепт – эффективный препарат для
достижения клинического ответа у
пациентов с РА
Kavanaugh A et al. Arthritis Rheum Vol. 64, No. 8, August 2012, pp 2504–2517
Kavanaugh A et al. Ann Rheum Dis 2012;0:1–10
27.
Клинический ответпри ревматоидном артрите
• Этанерцепт в комбинации с
метотрексатом достоверно
вызывает выраженный и
устойчивый клинический ответ
Keystone E, et al. Ann Rheum Dis. 2009;68:789-796
28.
Этанерцепт («Энбрел»)противопоказания*
o Повышенная чувствительность к этанерцепту
или любому другому компоненту препарата.
o Сепсис или риск возникновения сепсиса.
o Активная инфекция, включая хронические или
локализованные инфекции.
o Беременность и период грудного
вскармливания
o Возраст до 2-х лет
* http://grls.rosminzdrav.ru на 28.08.2014
29.
Лекарственныевзаимодействия
Не наблюдалось нежелательных взаимодействий
при одновременном применении препарата
Энбрел® с глюкокортикостероидами,
салицилатами (за исключением
сульфасалазина), нестероидными
противовоспалительными препаратами (НПВП),
анальгетиками или метотрексатом
30.
Нежелательныесочетания
Сульфасалазин
• У пациентов, которым на фоне лечения сульфасалазином
вводили Энбрел®, описано значительное снижение числа
лейкоцитов по сравнению с теми пациентами, которые
принимали только Энбрел® или только сульфасалазин.
• Другие ГИБП- сочетания с абатацептом и анакинрой не
повысили эффективность, но вызывали более частые
инфекционные осложнения
31.
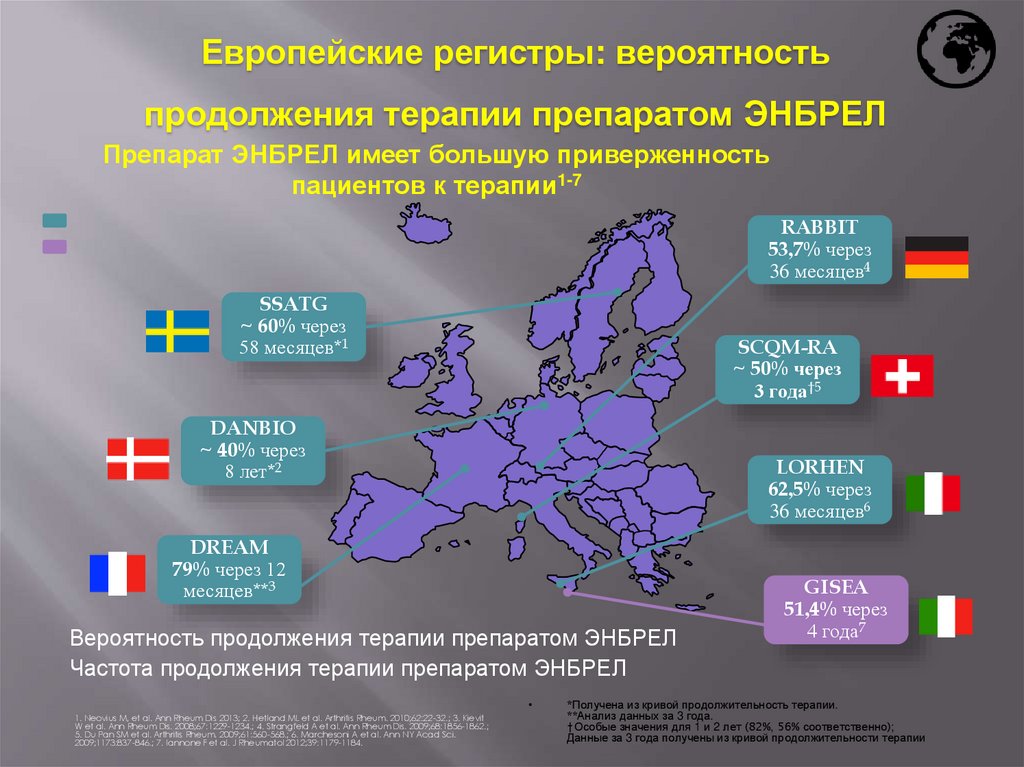
Европейские регистры: вероятностьпродолжения терапии препаратом ЭНБРЕЛ
Препарат ЭНБРЕЛ имеет большую приверженность
пациентов к терапии1-7
RABBIT
53,7% через
36 месяцев4
SSATG
~ 60% через
58 месяцев*1
SCQM-RA
~ 50% через
3 года†5
DANBIO
~ 40% через
8 лет*2
LORHEN
62,5% через
36 месяцев6
DREAM
79% через 12
месяцев**3
Вероятность продолжения терапии препаратом ЭНБРЕЛ
Частота продолжения терапии препаратом ЭНБРЕЛ
1. Neovius M, et al. Ann Rheum Dis 2013; 2. Hetland ML et al. Arthritis Rheum. 2010;62:22-32.; 3. Kievit
W et al. Ann Rheum Dis. 2008;67:1229-1234.; 4. Strangfeld A et al. Ann Rheum Dis. 2009;68:1856-1862.;
5. Du Pan SM et al. Arthritis Rheum. 2009;61:560-568.; 6. Marchesoni A et al. Ann NY Acad Sci.
2009;1173:837-846.; 7. Iannone F et al. J Rheumatol 2012;39:1179-1184.
GISEA
51,4% через
4 года7
*Получена из кривой продолжительность терапии.
**Анализ данных за 3 года.
†Особые значения для 1 и 2 лет (82%, 56% соответственно);
Данные за 3 года получены из кривой продолжительности терапии
32.
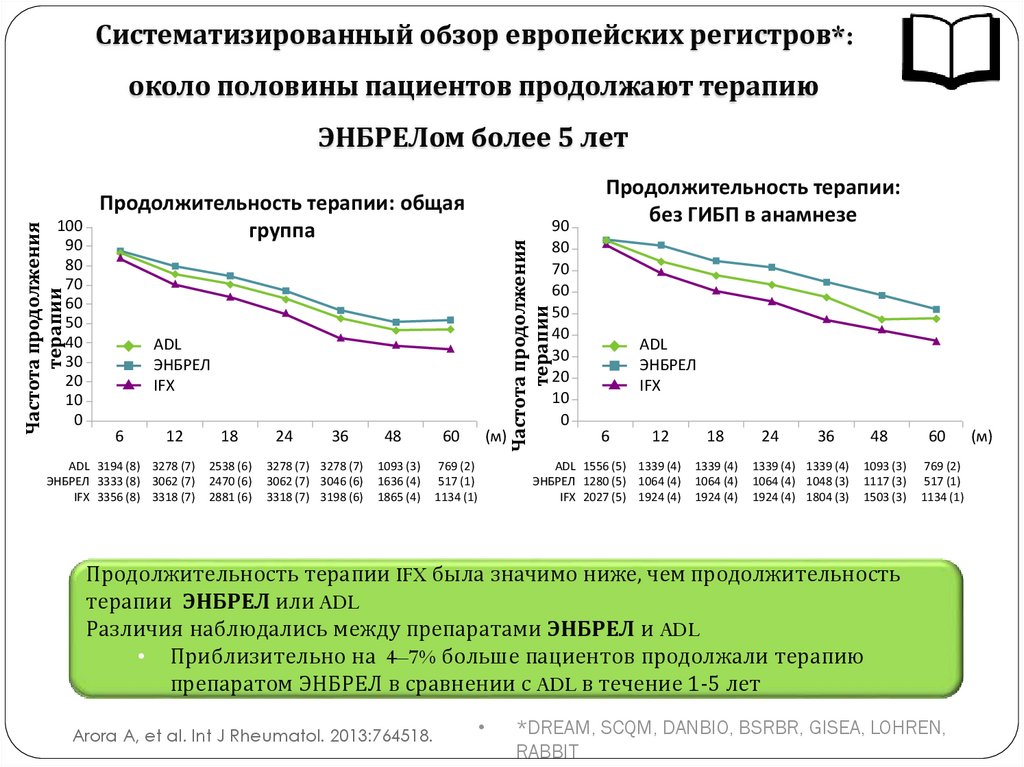
Систематизированный обзор европейских регистров*:около половины пациентов продолжают терапию
ЭНБРЕЛом более 5 лет
ADL
ЭНБРЕЛ
IFX
6
12
ADL 3194 (8) 3278 (7)
ЭНБРЕЛ 3333 (8) 3062 (7)
IFX 3356 (8) 3318 (7)
18
2538 (6)
2470 (6)
2881 (6)
24
36
3278 (7) 3278 (7)
3062 (7) 3046 (6)
3318 (7) 3198 (6)
48
1093 (3)
1636 (4)
1865 (4)
90
80
70
60
50
40
30
20
10
0
Частота продолжения
терапии
Частота продолжения
терапии
100
90
80
70
60
50
40
30
20
10
0
Продолжительность терапии: общая
группа
60
(м)
769 (2)
517 (1)
1134 (1)
Продолжительность терапии:
без ГИБП в анамнезе
ADL
ЭНБРЕЛ
IFX
6
12
ADL 1556 (5) 1339 (4)
ЭНБРЕЛ 1280 (5) 1064 (4)
IFX 2027 (5) 1924 (4)
18
1339 (4)
1064 (4)
1924 (4)
24
36
1339 (4) 1339 (4)
1064 (4) 1048 (3)
1924 (4) 1804 (3)
48
1093 (3)
1117 (3)
1503 (3)
60
769 (2)
517 (1)
1134 (1)
Продолжительность терапии IFX была значимо ниже, чем продолжительность
терапии ЭНБРЕЛ или ADL
Различия наблюдались между препаратами ЭНБРЕЛ и ADL
• Приблизительно на 4–7% больше пациентов продолжали терапию
препаратом ЭНБРЕЛ в сравнении с ADL в течение 1-5 лет
Arora A, et al. Int J Rheumatol. 2013:764518.
*DREAM, SCQM, DANBIO, BSRBR, GISEA, LOHREN,
RABBIT
(м)
33.
Мета-анализ: ЭНБРЕЛ не обладаетклинически значимой иммуногенностью
• 17 исследований иммуногенности при терапии
воспалительных заболеваний ингибиторами ФНО
• Во всех исследованиях было показано отсутствие
антител к препарату ЭНБРЕЛ или их низкий титр
антител без влияния на клинический ответ
o По мнению авторов это может указывать на наличие ‘связывающих
антител’ или ложноположительный результат, так как использовался
иммуноферментный анализ (ИФА) низкой специфичности
• Авторы пришли к выводу, что отсутствие
клинически значимой иммуногенности для
препарата ЭНБРЕЛ согласуется с большей
продолжительностью терапии в сравнении с
инфликсимабом или адалимумабом
34.
Систематизированный обзор: частота серьезных инфекцийпри терапии препаратом ЭНБРЕЛ сопоставима с контролем
при всех показаниях
3
2,86
2,5
2
2,18
1,5
1
0,5
Частота,
скорректированная по
экспозиции…
Частота,
скорректированная по
экпозиции…
Частота серьезных инфекций в контролируемых
двойных слепых исследованиях – все показания1
3,5
0
ЭНБРЕЛ‡
(n=4580)
Плацебо/БПВП
(n=2270)
5
4,5
4
3,5
3
2,5
2
1,5
1
0,5
0
Частота серьезных инфекций во всех
исследованиях1
3,75
3,61
РА
(n=6973)
Все пациенты
(n=13877)
‡Энбрел в контролируемых двойных слепых исследованиях по всем показаниям.
Инфекции являются одними из наиболее частых НЯ, связанных с
терапией и-ФНО
Частота серьезных инфекций в клинических исследованиях
ЭНБРЕЛа при всех показаниях сопоставима с контрольной
группой
Gottlieb AB, et al. J Drugs Dermatol 2011;.10:289–300
35.
Регистр BSRBR: более низкая смертность пациентов с РАпри терапии препаратом ЭНБРЕЛ по сравнению с БПВП
BSRBR: кривая выживаемости
при терапии ЭНБРЕЛом по
сравнению с БПВП (любая
причина)
Суммарная выживаемость
1.0
0.9
ЭНБРЕЛ (n=200)
БПВП (n=2864)
0.8
0.7
0.6
0
2
4
6
8
10
Выживаемость от
индексной даты
Morgan C, et al. Rheumatology (Oxford) 2014;.53:186–
194
Общий коэффициент смертности был ниже
при терапии препаратом ЭНБРЕЛ, чем при
терапии БПВП
(12,0 по сравнению с 20,1 явлений на 1000
pпациенто-лет)
У пациентов, получавших
ЭНБРЕЛ, был ниже риск
лимфопролиферативных
злокачественных
новообразований и сердечнососудистых явлений в сравнении
с когортой пациентов,
получавших стандартные БПВП
Долгосрочный риск серьезных
инфекций не отличался
36.
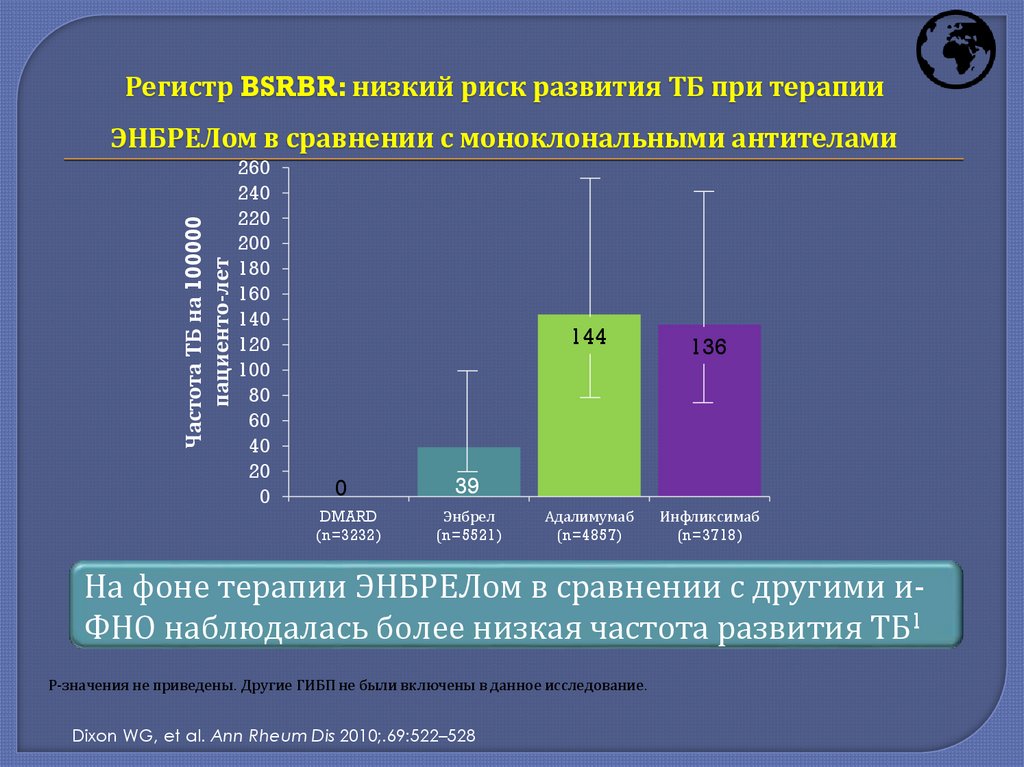
Регистр BSRBR: низкий риск развития ТБ при терапииЧастота ТБ на 100000
пациенто-лет
ЭНБРЕЛом в сравнении с моноклональными антителами
260
240
220
200
180
160
140
120
100
80
60
40
20
0
144
0
DMARD
(n=3232)
136
39
Энбрел
(n=5521)
Адалимумаб
(n=4857)
Инфликсимаб
(n=3718)
На фоне терапии ЭНБРЕЛом в сравнении с другими иФНО наблюдалась более низкая частота развития ТБ1
Р-значения не приведены. Другие ГИБП не были включены в данное исследование.
Dixon WG, et al. Ann Rheum Dis 2010;.69:522–528
37. Выводы
• Этанерцепт – эффективный препарат, которыйснижает клинико- лабораторную активность,
задерживает рентгенологическое
прогрессирование поражения суставов, повышает
качество жизни у пациентов с РА
• Профиль безопасности этанерцепта соответствует
профилю безопасности класса ингибиторов
фактора некроза опухоли альфа в целом
Kavanaugh A et al. Arthritis Rheum 2009;60(4):976-986
Kavanaugh A et al. Arthritis Rheum Vol. 64, No. 8, August 2012, pp 2504–2517
Kavanaugh A et al. Ann Rheum Dis 2012;0:1–10
38.
39.
Тофацитиниб(торговые наименованияXeljanz, Jakvinus) – низкомолекулярный
пероральный препарат,
блокирующий активность JAK киназы.
Тофацитиниб обратимо ингибирует JAK1 и JAK3
и обладает функциональной специфичностью по
сравнению с JAK2
• В марте 2013 г. тофацитиниб (Яквинус) стал первым ингибитором
JAK, получившим разрешение МЗ РФ
для применения у
пациентов с РА умеренной и тяжелой степени активности после
неэффективности или при непереносимости БПВП, включая
метотрексат
• Может применяться как в комбинации с МТХ, так и в качестве
монотерапии
40.
Международное непатентованное наименование: тофацитиниб
Торговое наименование: ЯКВИНУСTM
Фармакотерапевтическая группа: селективные иммунодепрессанты
Код АТХ: LO4AA
Лекарственная форма: таблетки, покрытые пленочной оболочкой
Механизм действия: мощный, селективный ингибитор семейства янускиназ, преимущественно 1 и 3, обладающий высокой селективностью в
отношении прочих киназ генома человека
• Зарегистрирован в России: 16.03.2013 ЛП - 002026
• для лечения взрослых пациентов с умеренным или тяжелым активным
РА с неадекватным ответом на БПВП, включая MTX
• Для лечения средней тяжести и тяжелого бляшечного псориаза у
взрослых пациентов, которым требуется назначение системной терапии
41.
ОСНОВНЫЕ ОТЛИЧИЯТОФАЦИТИНИБА ОТ ГИБП
По сравнению с ГИБП, которые являются
белками, тофацитиниб представляет собой
простую молекулу.
В отличие от всех ГИБП тофацитиниб
применяется внутрь.
Все антицитокины(ГИБП) оказывают лечебный
эффект за счет взаимодействия с цитокинами
или их рецепторами, тогда как тофацитиниб
блокирует передачу сигнала от рецепторов к
ядру клетки.
41
42.
Способ применения и дозыВнутрь вне зависимости от приема пищи
Яквинус можно применять в качестве монотерапии
или в комбинации с метотрексатом или другими
небиологическими БПВП
Рекомендованная доза составляет 5 мг два
в день
У некоторых пациентов может потребоваться
увеличение дозы до 10 мг два раза в день,
в зависимости от клинического ответа на терапию
раза
43.
Яквинус был изучен в рамках масштабнойклинической разработки в разных странах мира
• Масштабная, продолжающаяся программа исследований:
572 главных исследователя в 44 странах
• Тофацитиниб изучен у примерно 4 800 пациентов
Длительность
Количество пациентов
≥6 месяцев
≥1 год
≥2 года
>3 года
4053
3384
989
567
Примерно 1 000 пациентов были пролечены препаратом ЯКВИНУС в течение 2
лет или более*
Безопасность препарата ЯКВИНУС была изучена при проведении:
6 6 2
Исследований 2
фазы
Доказательных
исследований 3
фазы
Изучени
продолжается
е
при проведении
длительных
наблюдательны
х исследований
*Данные на 29 сентября 2011 г.
Рекомендательные заключения Комитета по применению Тофацитиниба для лечения ревматоидного артрита NDA 203214 КРАТКИЙ ВАРИАНТ
ДОКУМЕНТА, 9 мая 2012 г.
http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/ArthritisAdvisoryCommittee/UCM302960.pdf Доступ возможен с 24
января 2013 г.
44.
Болезнь-модифицирующая терапия с включениемТофацитиниба позволяет существенно снизить
активность РА и уменьшить выраженность
иммунных сдвигов у пациентов с резистентным
РА, не повышая риск лекарственных осложнений.
Высокий терапевтический эффект Тофацитиниба, в
его комбинации с метотрексатом и другими
традиционными БПВП у пациентов с РА,
резистентных к стандартным базисным средствам и
ГИБП разных групп , дают основание рассматривать
этот препарат как возможную альтернативу
биологическим агентам.


































 medicine
medicine








