Similar presentations:
Приготовление растворов
1.
Приготовление растворов для проведения23 и 24 задания
на ОГЭ по химии
2.
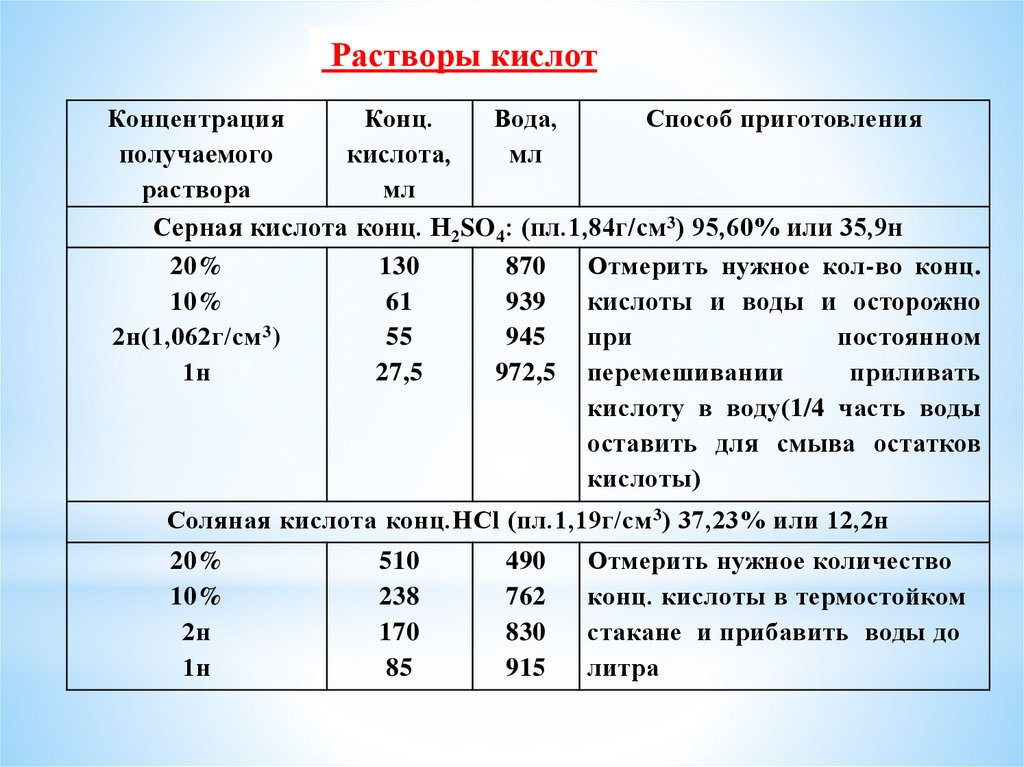
Растворы кислотКонцентрация
Конц.
Вода,
Способ приготовления
получаемого
кислота,
мл
раствора
мл
Серная кислота конц. Н2SO4: (пл.1,84г/см 3) 95,60% или 35,9н
20%
130
870
Отмерить нужное кол-во конц.
10%
61
939
кислоты и воды и осторожно
2н(1,062г/см 3)
55
945
при
постоянном
1н
27,5
972,5 перемешивании
приливать
кислоту в воду(1/4 часть воды
оставить для смыва остатков
кислоты)
Соляная кислота конц.HCl (пл.1,19г/см 3) 37,23% или 12,2н
20%
10%
2н
1н
510
238
170
85
490
762
830
915
Отмерить нужное количество
конц. кислоты в термостойком
стакане и прибавить воды до
литра
3.
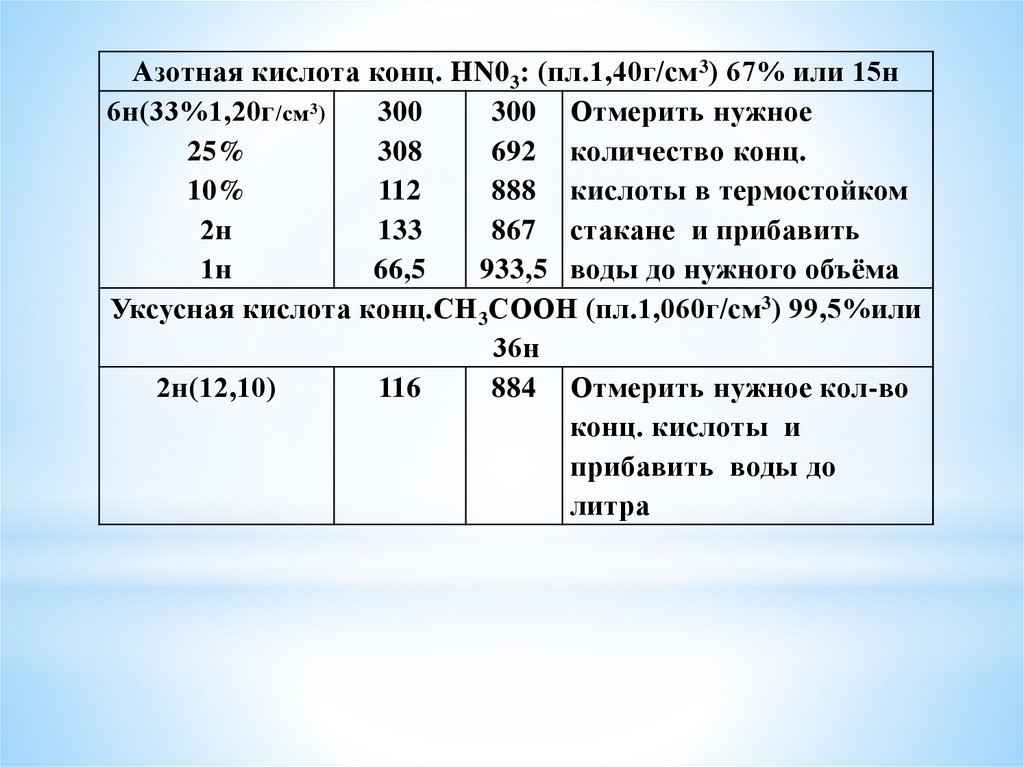
Азотная кислота конц. HN0 3: (пл.1,40г/см 3) 67% или 15н6н(33%1,20г /см3)
300
300 Отмерить нужное
25%
308
692 количество конц.
10%
112
888 кислоты в термостойком
2н
133
867 стакане и прибавить
1н
66,5
933,5 воды до нужного объёма
Уксусная кислота конц.СН 3СООН (пл.1,060г/см 3) 99,5%или
36н
2н(12,10)
116
884 Отмерить нужное кол-во
конц. кислоты и
прибавить воды до
литра
4.
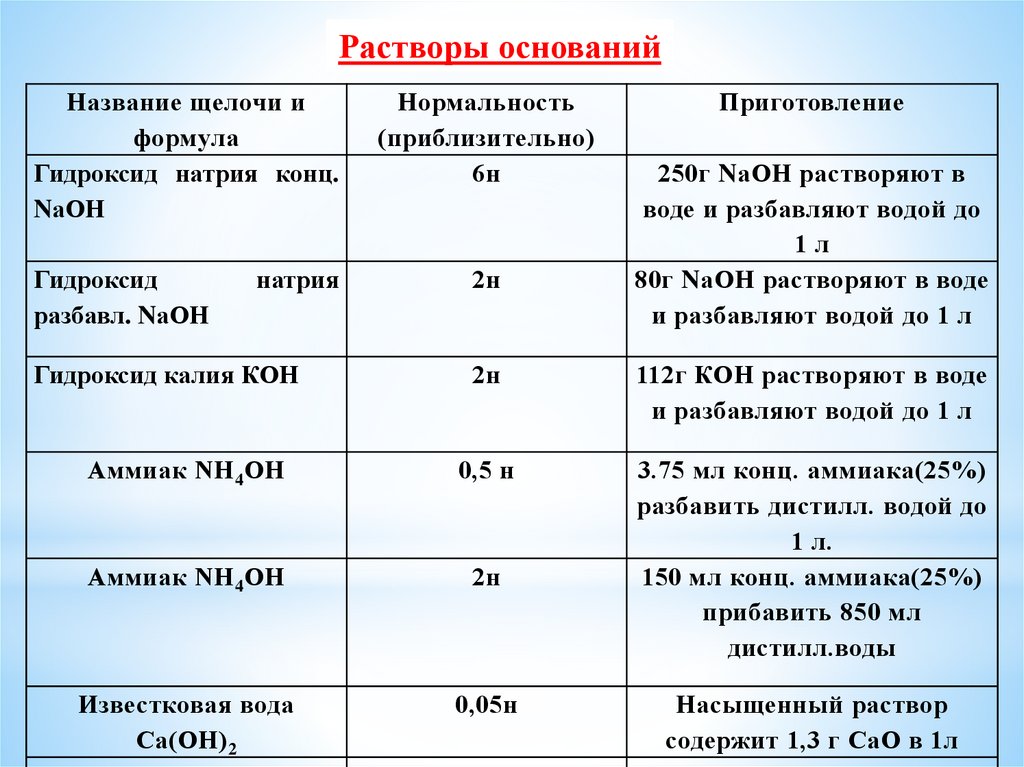
Растворы основанийНазвание щелочи и
формула
Гидроксид натрия конц.
NаОН
Гидроксид
разбавл. NаОН
натрия
Гидроксид калия КОН
Нормальность
(приблизительно)
6н
2н
Приготовление
250г NаОН растворяют в
воде и разбавляют водой до
1л
80г NаОН растворяют в воде
и разбавляют водой до 1 л
2н
112г КОН растворяют в воде
и разбавляют водой до 1 л
Аммиак NН 4ОН
0,5 н
Аммиак NН 4ОН
2н
3.75 мл конц. аммиака(25%)
разбавить дистилл. водой до
1 л.
150 мл конц. аммиака(25%)
прибавить 850 мл
дистилл.воды
Известковая вода
Са(ОН) 2
0,05н
Насыщенный раствор
содержит 1,3 г СаО в 1л
5.
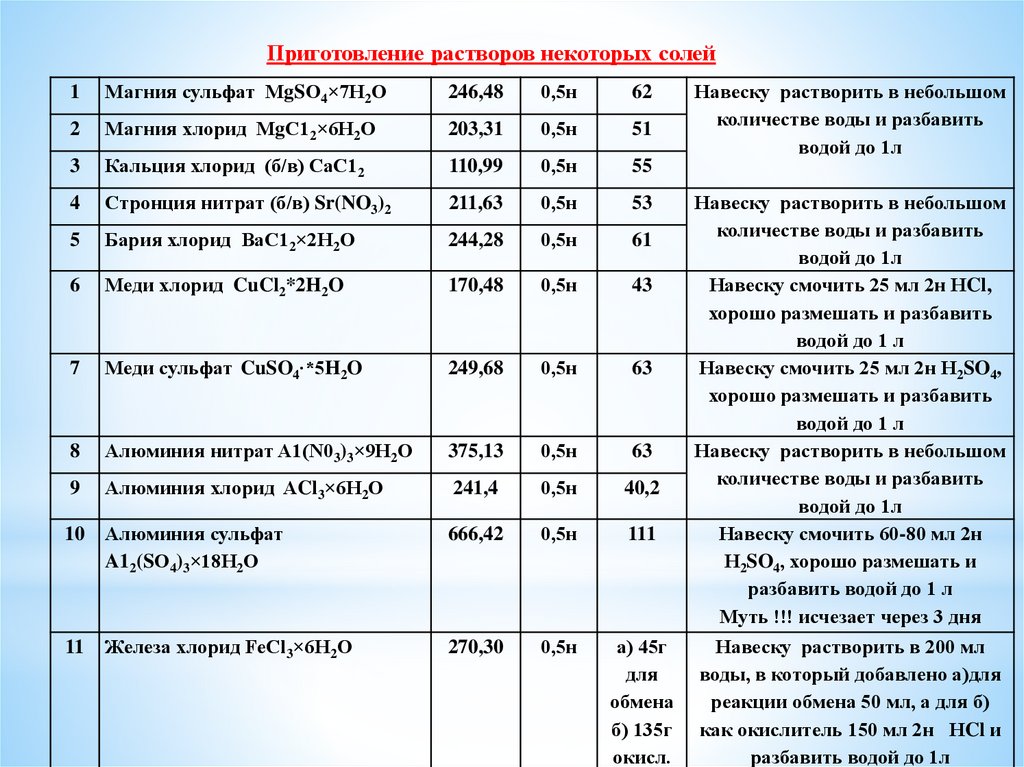
Приготовление растворов некоторых солей1
Магния сульфат МgSО4×7Н2О
246,48
0,5н
62
2
Магния хлорид МgС12×6Н2О
203,31
0,5н
51
3
Кальция хлорид (б/в) СаС12
110,99
0,5н
55
4
Стронция нитрат (б/в) Sr(NO3)2
211,63
0,5н
53
5
Бария хлорид ВаС12×2Н2О
244,28
0,5н
61
6
Меди хлорид CuCl2*2H2O
170,48
0,5н
43
7
Меди сульфат CuSO4∙*5H2O
249,68
0,5н
63
8
Алюминия нитрат A1(N03)3×9Н2О
375,13
0,5н
63
9
Алюминия хлорид ACl3×6Н2О
241,4
0,5н
40,2
10
Алюминия сульфат
A12(SО4)3×18Н2О
666,42
0,5н
111
11
Железа хлорид FeCl3×6Н2О
270,30
0,5н
а) 45г
для
обмена
б) 135г
окисл.
Навеску растворить в небольшом
количестве воды и разбавить
водой до 1л
Навеску растворить в небольшом
количестве воды и разбавить
водой до 1л
Навеску смочить 25 мл 2н НCl,
хорошо размешать и разбавить
водой до 1 л
Навеску смочить 25 мл 2н Н2SO4,
хорошо размешать и разбавить
водой до 1 л
Навеску растворить в небольшом
количестве воды и разбавить
водой до 1л
Навеску смочить 60-80 мл 2н
Н2SO4, хорошо размешать и
разбавить водой до 1 л
Муть !!! исчезает через 3 дня
Навеску растворить в 200 мл
воды, в который добавлено а)для
реакции обмена 50 мл, а для б)
как окислитель 150 мл 2н НCl и
разбавить водой до 1л
6.
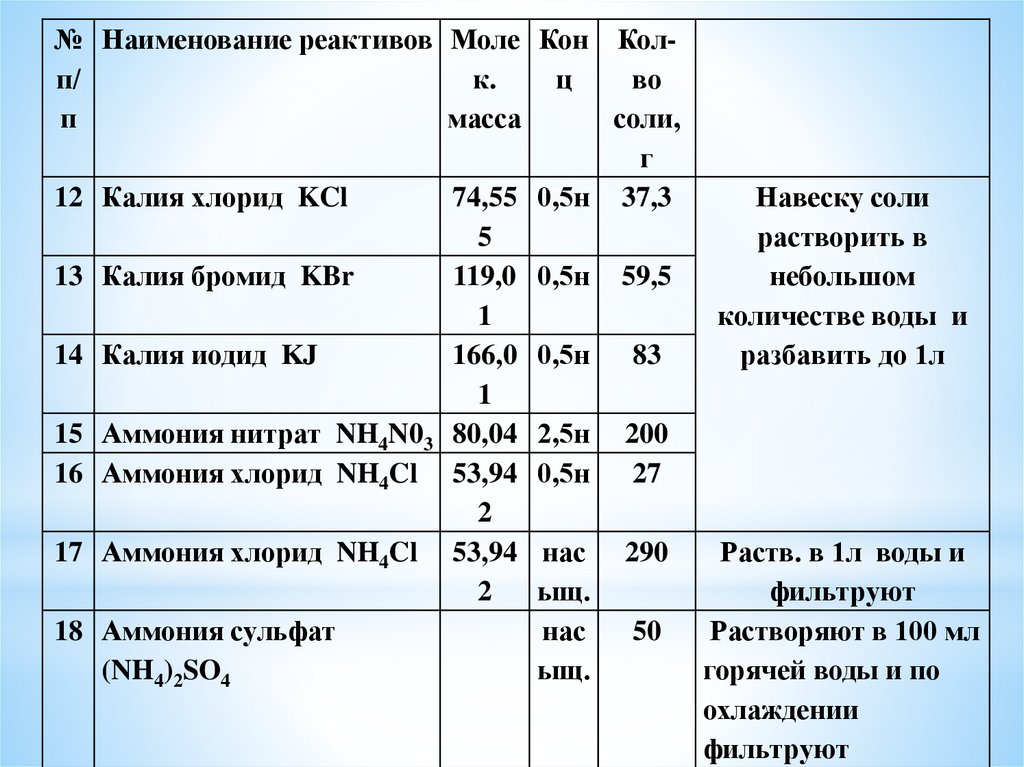
№ Наименование реактивов Моле Кон Колп/к.
ц
во
п
масса
соли,
г
12 Калия хлорид KCl
74,55 0,5н 37,3
Навеску соли
5
растворить в
13 Калия бромид KBr
119,0 0,5н 59,5
небольшом
1
количестве воды и
14 Калия иодид KJ
166,0 0,5н 83
разбавить до 1л
1
15 Аммония нитрат NH4N03 80,04 2,5н 200
16 Аммония хлорид NH4Cl 53,94 0,5н 27
2
17 Аммония хлорид NH4Cl 53,94 нас 290
Раств. в 1л воды и
2
ыщ.
фильтруют
18 Аммония сульфат
нас
50
Растворяют в 100 мл
(NH4)2SO4
ыщ.
горячей воды и по
охлаждении
фильтруют
7.
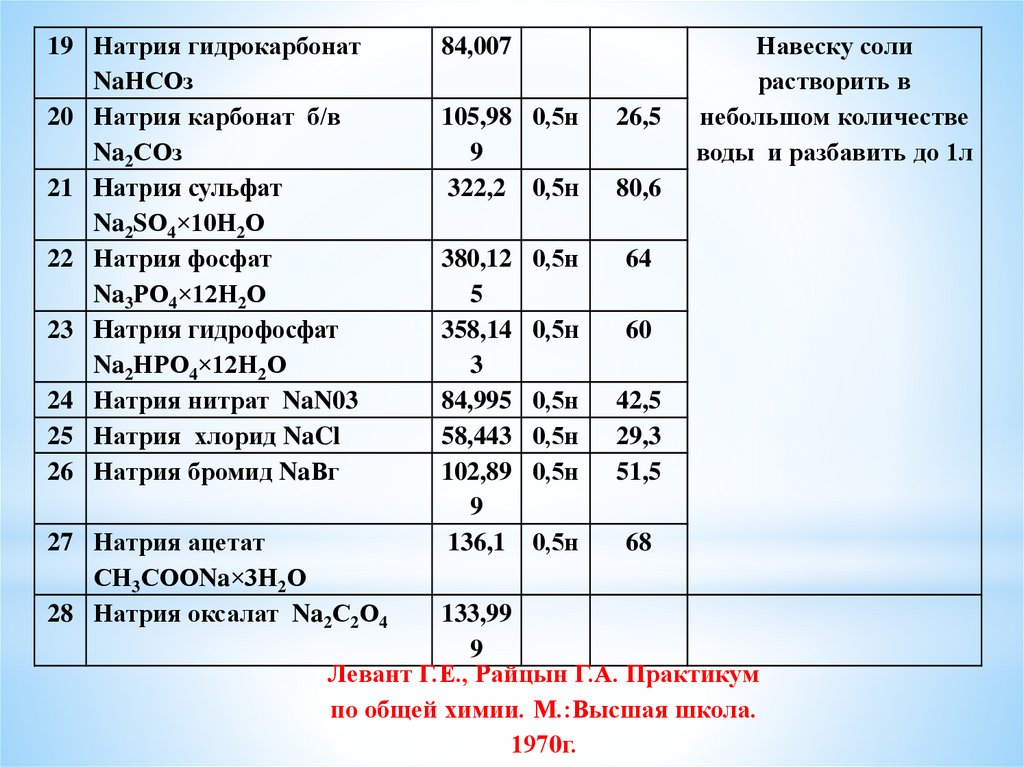
19 Натрия гидрокарбонатNaНСОз
20 Натрия карбонат б/в
Na2СОз
21 Натрия сульфат
Na2SО4×10Н2О
22 Натрия фосфат
Na3РО4×12Н2О
23 Натрия гидрофосфат
Na2НРО4×12Н2О
24 Натрия нитрат NaN03
25 Натрия хлорид NaCl
26 Натрия бромид NaВг
27 Натрия ацетат
СН3СООNa×3Н2О
28 Натрия оксалат Na2С2О4
84,007
105,98 0,5н
9
322,2 0,5н
380,12
5
358,14
3
84,995
58,443
102,89
9
136,1
26,5
Навеску соли
растворить в
небольшом количестве
воды и разбавить до 1л
80,6
0,5н
64
0,5н
60
0,5н
0,5н
0,5н
42,5
29,3
51,5
0,5н
68
133,99
9
Левант Г.Е., Райцын Г.А. Практикум
по общей химии. М.:Высшая школа.
1970г.
8.
Средства для нейтрализации химических ожоговОжог кислотами устраняется после промывания раны
холодной водой 2-3% раствором пищевой соды
Ожог щелочами устраняется после промывания холодной
водой 1% растворами слабых кислот – лимонной, уксусной
или борной


 chemistry
chemistry








