Similar presentations:
Классификация и номенклатура неор.соединений
1. Общая химия
Вас приветствует доценткафедры фундаментальной и
прикладной химии Кожухова
Татьяна Юрьевна
Мой компьютер пока конфликтует с программой
ZOOM и некоторые функции не работают. Поэтому, я
сегодня без видео и без голоса, но Вас я слышу. Очень
надеюсь, что на следующей неделе всё будет работать.
Сегодня работаем в режиме презентации, если есть
вопросы, то поднимаете руку, включаете микрофон и
задаете вопрос, а я отвечаю в чате.
2. Конференция в программе ZOOM рассчитана на 40 минут, поэтому работаем с 19:00 до 19:40, перерыв 5 минут, заново подключаемся к
конференции и работаем c19:45 до 20:20
3.
Пожалуйста, материалконспектируйте. Если не
успеваете (я переключаю
слайды быстрее), то
обязательно говорите, будем
возвращаться
4. Тема занятия: Классификация и номенклатура неорганических соединений
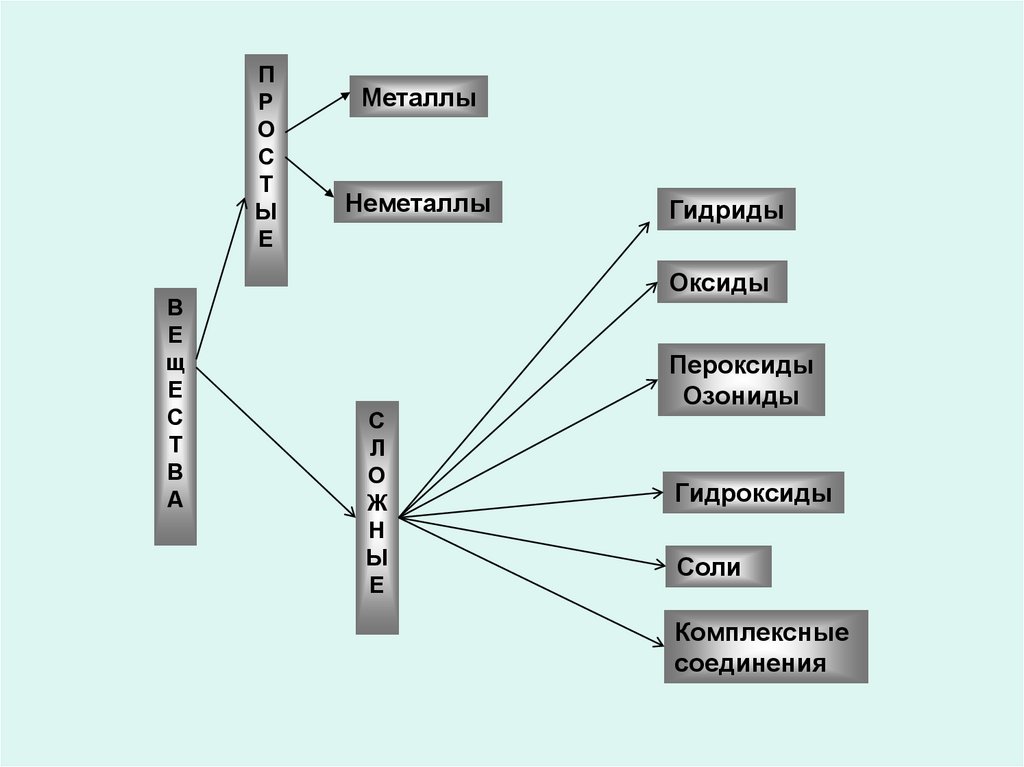
5.
ПР
О
С
Т
Ы
Е
В
Е
щ
Е
С
Т
В
А
Металлы
Неметаллы
Гидриды
Оксиды
С
Л
О
Ж
Н
Ы
Е
Пероксиды
Озониды
Гидроксиды
Соли
Комплексные
соединения
6.
Неорганические веществаПростые
Сложные
7.
8. Сложные вещества
ГидроксидыГидриды
Оксиды
Соли
Комплексы
PbO2
Пероксиды
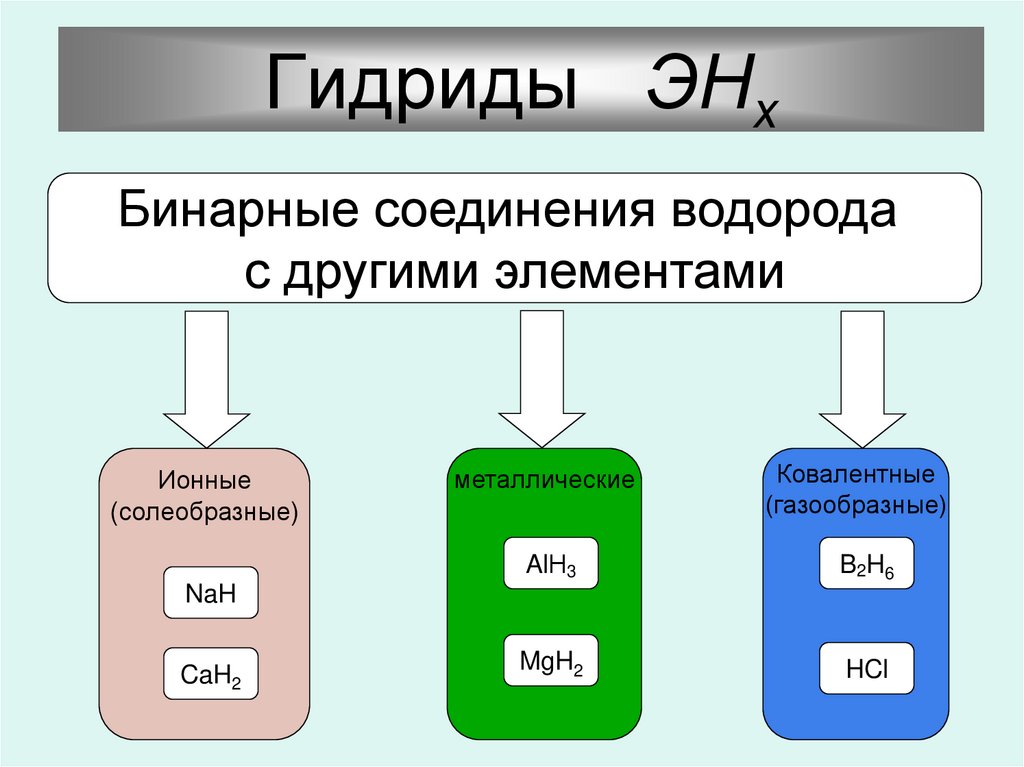
9.
Гидриды ЭНхБинарные соединения водорода
с другими элементами
Ионные
(солеобразные)
металлические
Ковалентные
(газообразные)
AlН3
B2H6
MgH2
HCl
NaH
CaH2
10. Ионные и металлические
Название гидридовИонные и металлические
• В именительном падеже называется
слово «гидрид» , затем в родительном
падеже название элемента
• «гидрид» + «название элемента»
• NaH – гидрид натрия
• AlH3 – гидрид алюминия
11. ковалентные
• Название элемента с окончанием «О» ,затем слово «водород»
• «название элемента» «водород»
• Н2S – сероводород
• HI - иодоводород
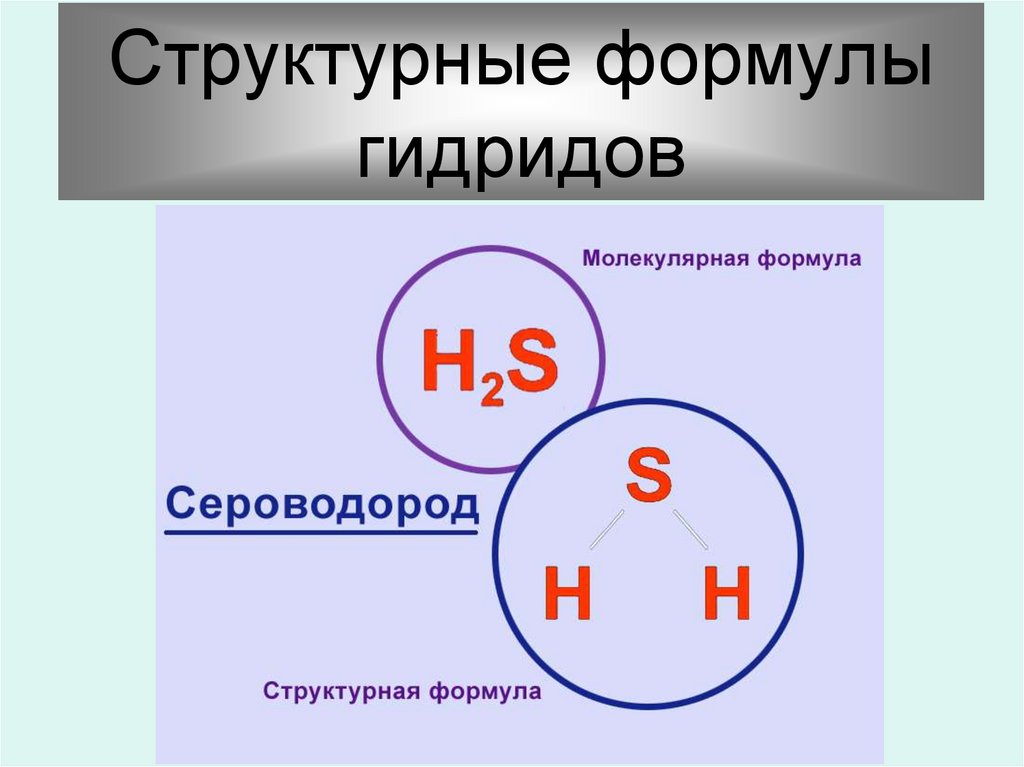
12.
Структурные формулыгидридов
13. Бинарные соединения элементов с кислородом, в которых кислород в степени окисления -2
Оксиды ЭхОyБинарные соединения элементов с кислородом, в
которых кислород в степени окисления
Горный хрусталь –
-2
Рубин
оксид кремния
Корунд
Пиролюзит –
оксид марганца(IV)
Разновидности
оксида алюминия
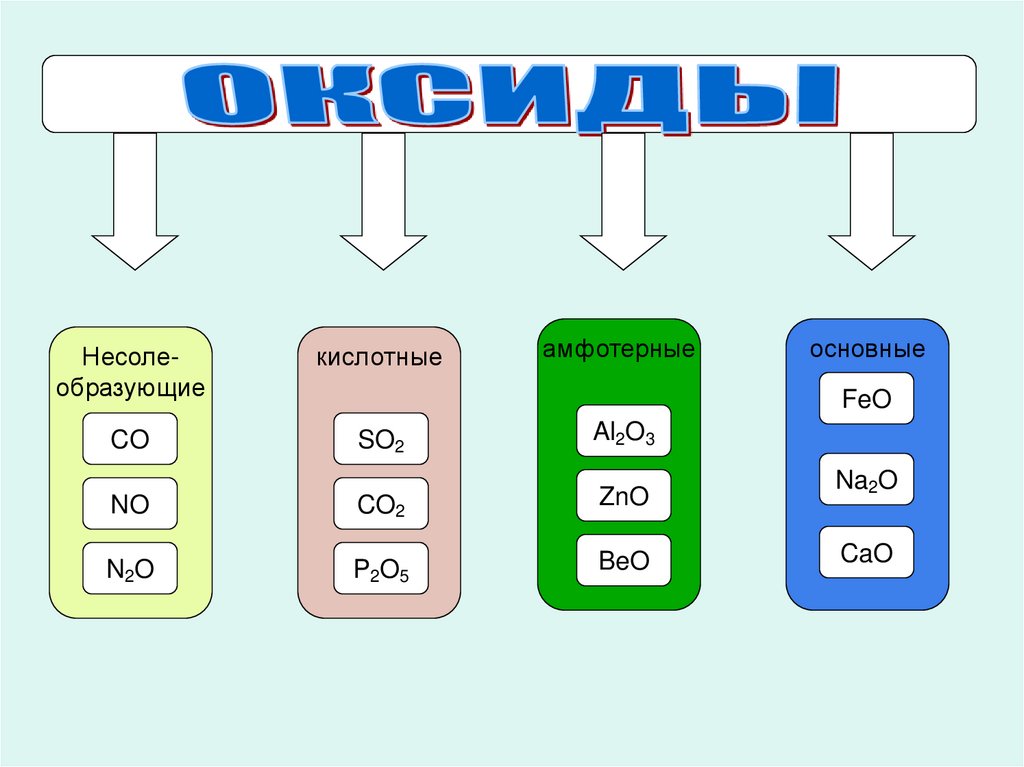
14.
амфотерныеНесолеобразующие
кислотные
CO
SO2
Al2O3
NO
CO2
ZnO
N2O
P2O5
BeO
основные
FeO
Na2O
CaO
15.
Название оксидов• В именительном падеже называется
слово «оксид» , затем в родительном
падеже название элемента с указанием
степени окисления или валентности
• «оксид» + «название элемента»
• Na2О – оксид натрия
• Fe2О3 – оксид железа (III)
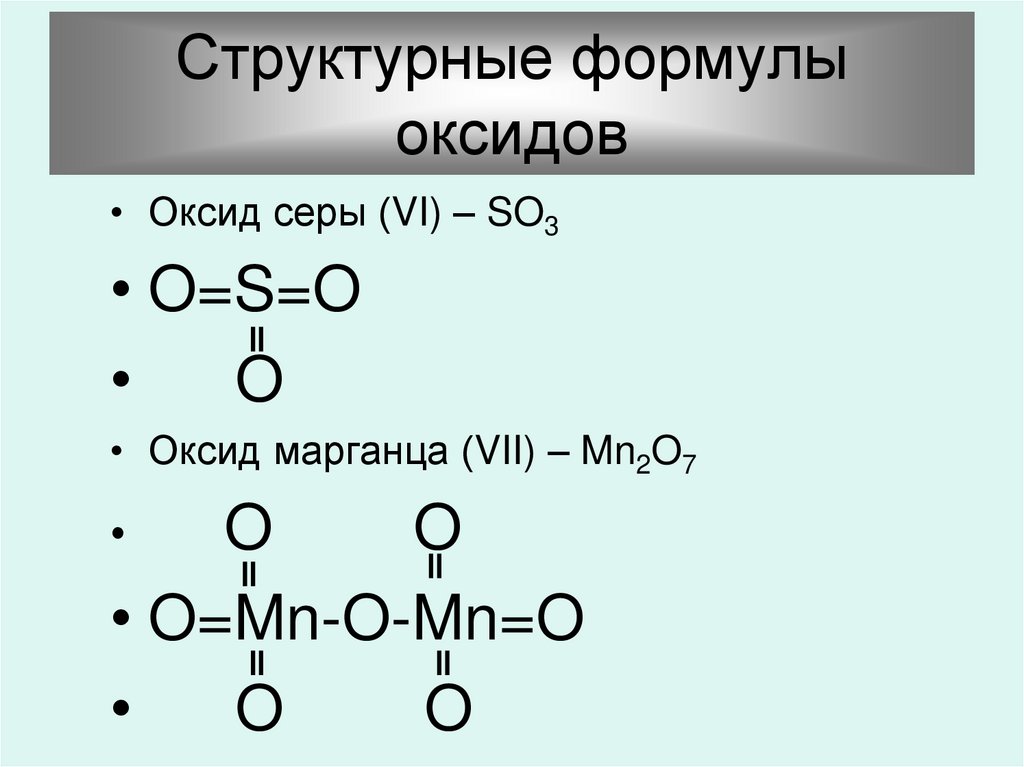
16. Структурные формулы оксидов
• Оксид серы (VI) – SO3• O=S=O
O
• Оксид марганца (VII) – Mn2O7
O
O
• O=Mn-O-Mn=O
O
O
17.
Пероксиды. ОзонидыПероксиды - соединения, в которых атомы
кислорода связаны и друг с другом и с атомами
более электроположительного элемента
Степень окисления кислорода в пероксидах -1,
валентность - II
Название: в именительном падеже называется
слово «пероксид», затем в родительном падеже
название элемента
Н2О2 - пероксид водорода
Н—О—О—Н
BaO2 – пероксид бария
18. Озониды – это соединения , состоящие из положительно заряженных ионов металла и отрицательно заряженных озонид-ионов О3-
Название: в именительном падеже называетсяслово «озонид», за ним следует название
элемента в родительном падеже
КО3 – озонид калия
NaO3 – озонид натрия
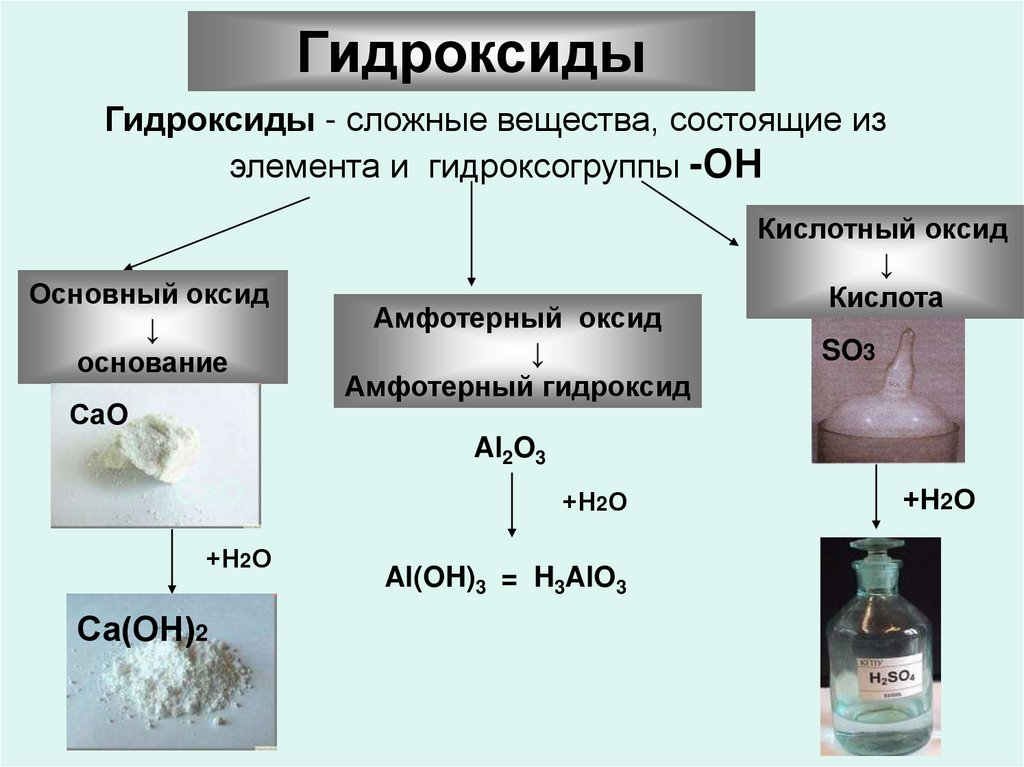
19.
ГидроксидыГидроксиды - сложные вещества, состоящие из
элемента и гидроксогруппы -ОН
Основный оксид
↓
основание
СаO
Амфотерный оксид
↓
Амфотерный гидроксид
Кислотный оксид
↓
Кислота
SO3
Al2O3
CаO
+Н2О
Са(ОН)2
+Н2О
Al(OH)3 = H3AlO3
+Н2О
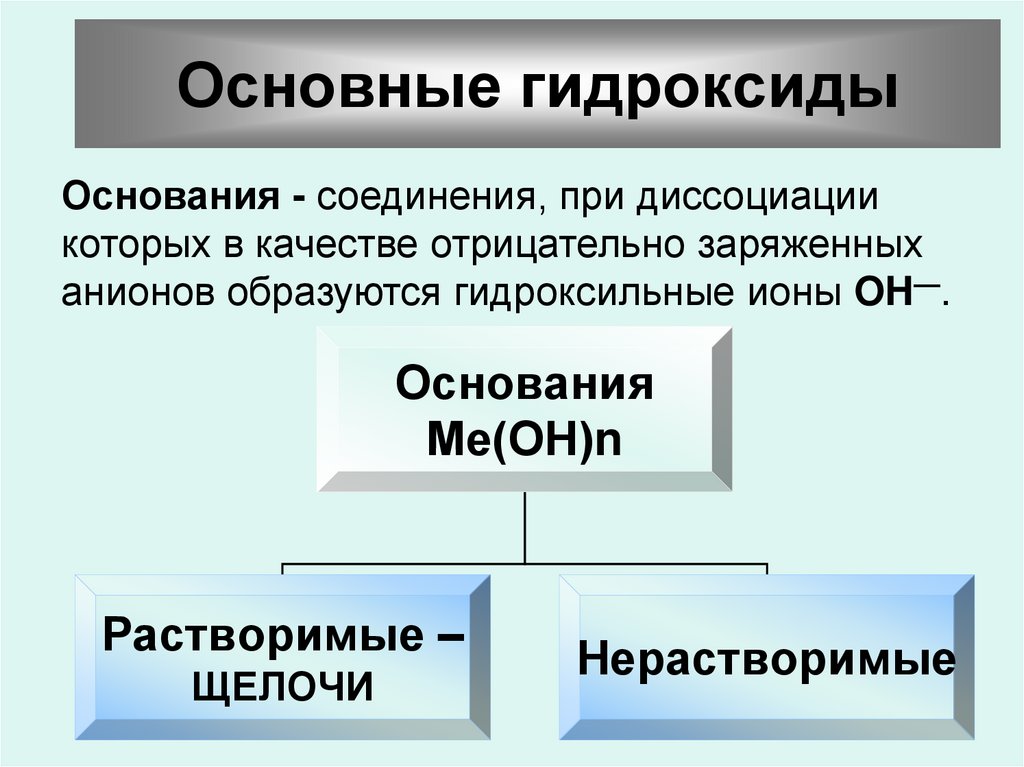
20. Основные гидроксиды
Основания - соединения, при диссоциациикоторых в качестве отрицательно заряженных
анионов образуются гидроксильные ионы OH—.
Основания
Ме(ОН)n
Растворимые –
ЩЕЛОЧИ
Нерастворимые
21. Названия оснований
• В именительном падеже называется слово«гидроксид» , затем в родительном падеже
название элемента с указанием степени
окисления или валентности
• «гидроксид» + «название элемента»
• NaОН – гидроксид натрия
• Ва(ОН)2 – гидроксид бария
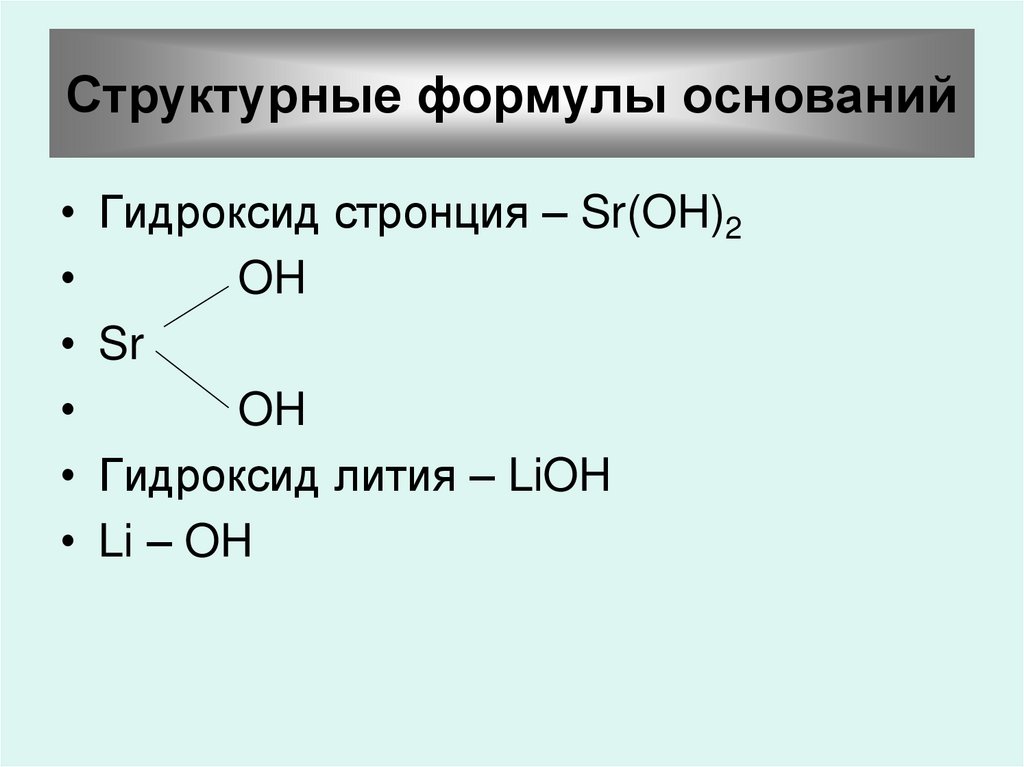
22. Структурные формулы оснований
Гидроксид стронция – Sr(OH)2
OH
Sr
OH
Гидроксид лития – LiOH
Li – OH
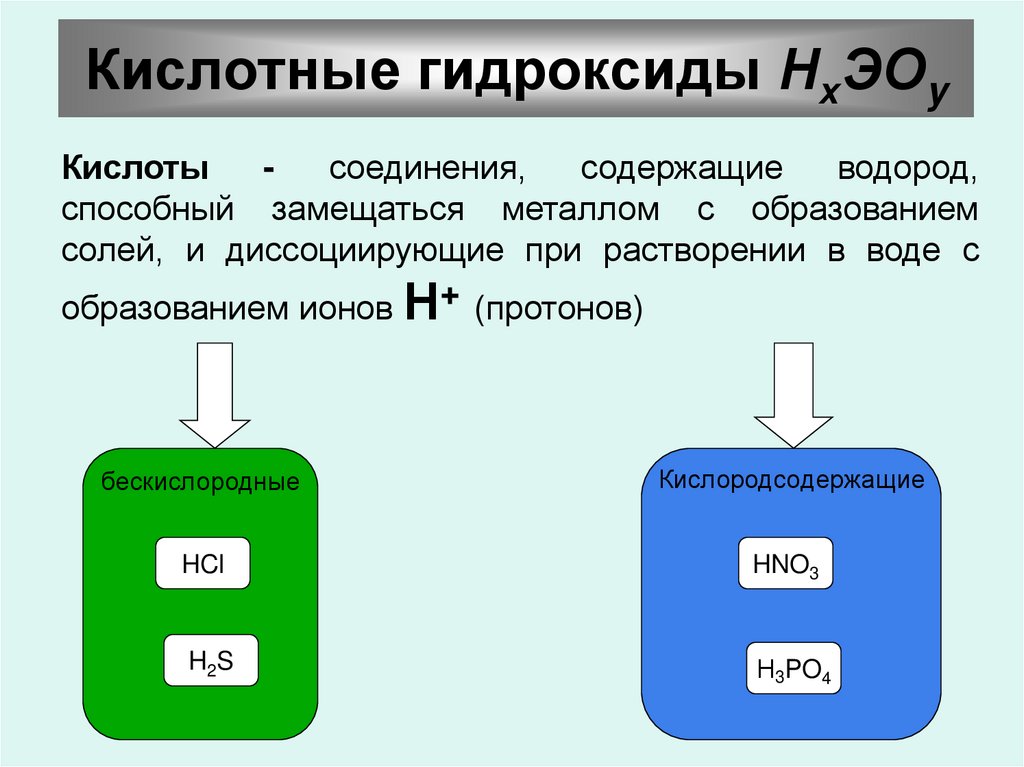
23. Кислотные гидроксиды НхЭОy
Кислотысоединения,
содержащие
водород,
способный замещаться металлом с образованием
солей, и диссоциирующие при растворении в воде с
образованием ионов Н+ (протонов)
бескислородные
Кислородсодержащие
HCl
HNO3
H2S
Н3PO4
24.
Названия бескислородных кислот• К названию элемента, образующего кислоту,
добавляется «оводородная» или
«истоводородная» , затем слово «кислота»
• «элемент» «оводородная» +
«кислота»
• НF – фтористоводородная кислота
• Н2S – сероводородная кислота
25. Названия кислородсодержащих кислот
• К русскому названию кислотооборазующегоэлемента добавляют определенный суффикс
и слово кислота:
• Если элемент проявляет высшую степень
окисления
добавляется
суффикс
с
окончанием -ая, -овая, -евая
• HNO3 – степень окисления
высшая = номеру группы = 5
–
Азотная кислота
азота
26.
Названия кислородсодержащихкислот
• Если элемент проявляет среднюю степень
окисления добавляется -истая, -нистая, вистая, -новатая
• HNO2 – степень окисления азота = +3
– Азотистая кислота
• В нисшей степени окисления
добавляется -новатистая
элемента
• HBrO – степень окисления брома = +1
– Бромноватистая кислота
27.
• Если элемент проявляет 4 различные степениокисления, то последовательно используют
суффиксы –н-, -новат-, -ист-, -новатист-:
HClO – хлорноватистая кислота
HClO2 – хлористая кислота
HClO3 – хлорноватая кислота
HClO4 – хлорная кислота
28.
• У d – элементов 7 группы (марганец,технеций, рений) в высшей степени
окисления элемента, кроме добавления
суффикса с окончанием, соответствующих
высшей степени окисления, добавляется
преффикс пер- :
• HMnO4 – марганец в высшей степени
окисления = +7
– Пермарганцевая кислота
29.
• Если в одной степени окисления элементобразует несколько кислот различающихся
количеством водорода и кислорода (воды), то
к названию добавляются префиксы:
• Мета – меньшее количество водорода
и кислорода;
• Мезо – среднее количество;
• Орто – максимальное количество.
• Н3РО4 – ортофосфорная кислота
• НРО3 – метафосфорная кислота
30.
• Если в одной степени окисленияэлемент образует несколько кислот,
отличающихся между собой числом
атомов кислотообразующего элемента,
то
к
названию
добавляется
числительное указывающее количество
атомов элемента:
• H2S2O5 – дисернистая кислота
• Н2Сr2O7 – дихромовая кислота
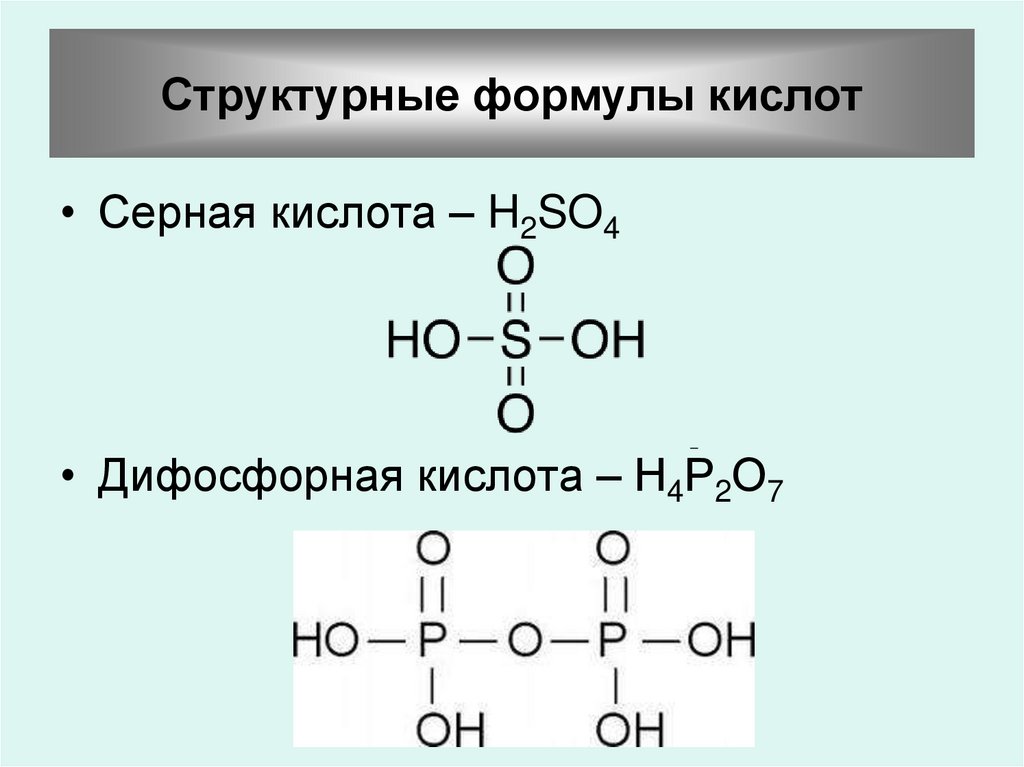
31. Структурные формулы кислот
• Серная кислота – H2SO4• Дифосфорная кислота – Н4Р2О7
32.
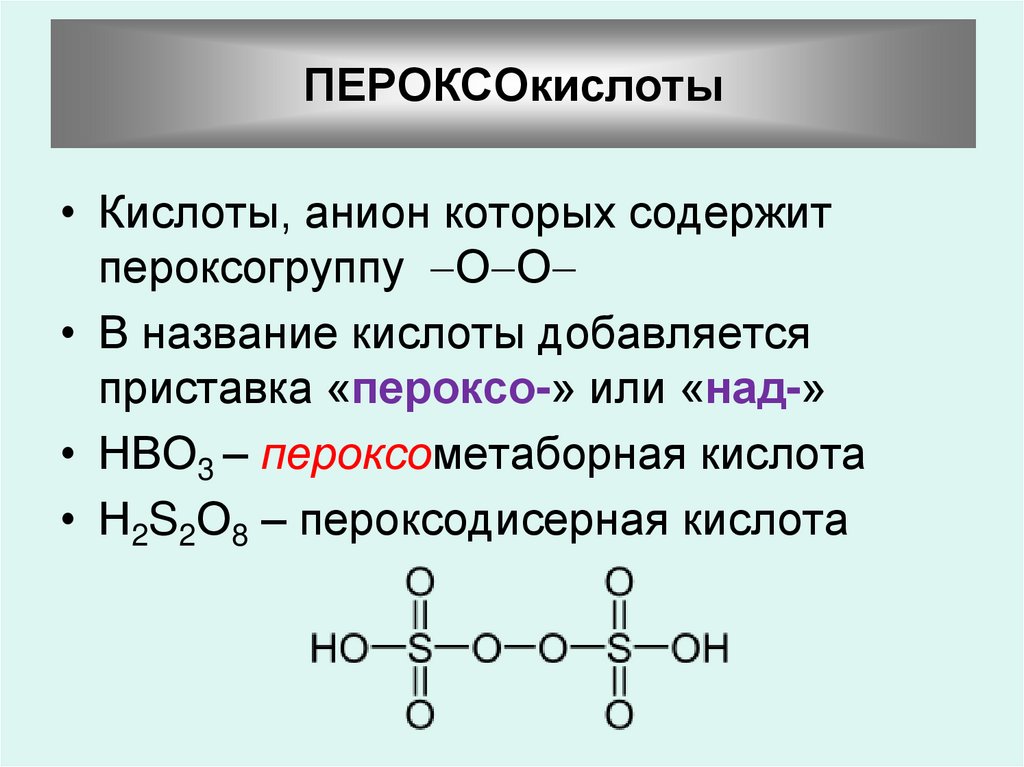
ПЕРОКСОкислоты• Кислоты, анион которых содержит
пероксогруппу О О
• В название кислоты добавляется
приставка «пероксо-» или «над-»
• НВО3 – пероксометаборная кислота
• Н2S2О8 – пероксодисерная кислота
33.
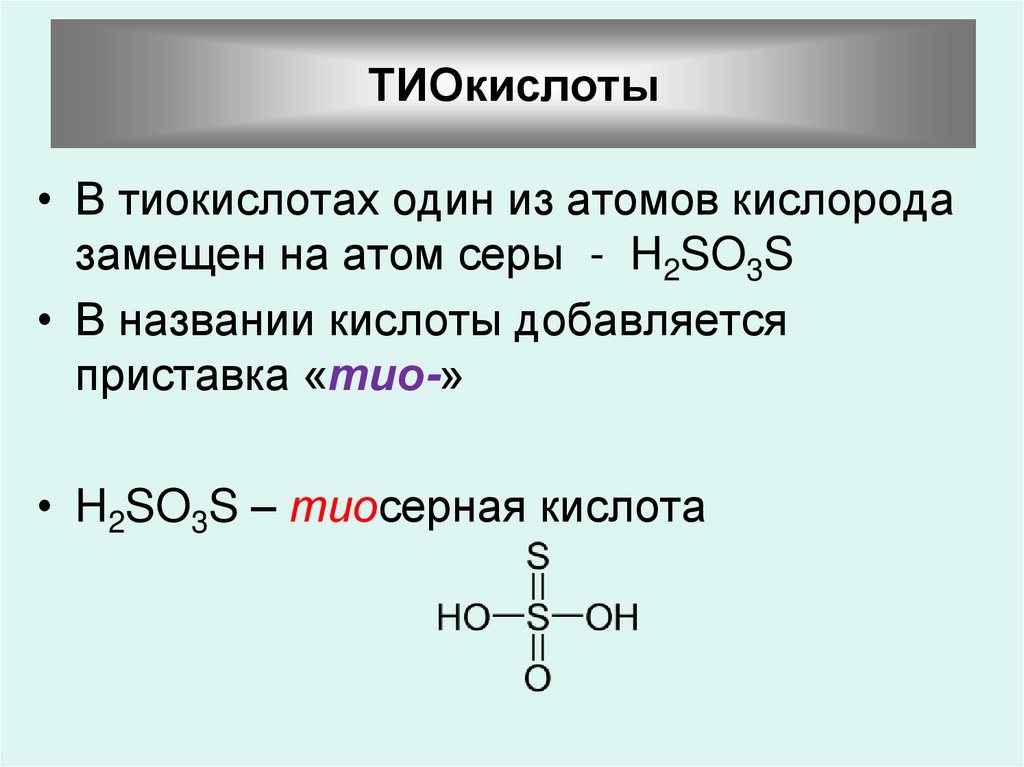
ТИОкислоты• В тиокислотах один из атомов кислорода
замещен на атом серы - H2SO3S
• В названии кислоты добавляется
приставка «тио-»
• H2SO3S – тиосерная кислота
34.
Амфотерные гидроксидыАмфотерные гидроксиды – это сложные
вещества, которые имеют свойства кислот и
свойства оснований.
Zn(OH)2 = H2ZnO2
гидроксид цинка = цинковая кислота
Al(OH)3 = H3AlO3
гидроксид алюминия = алюминиевая кислота
35.
Назовите следующиегидроксиды
HAsO2
H4PbO4
HCrO2
H2Cr2O7
HNO4
H3SbO4
36.
Назовите следующиегидроксиды
• HAsO2 – метамышьяковистая
• H4PbO4 - ортосвинцовая
37.
Назовите следующиегидроксиды
• HCrO2 – метахромистая
• H2Cr2O7 - дихромовая
38.
Назовите следующиегидроксиды
• HNO4 – пероксоазотная
• H3SbO4 - ортосурьмяная
39.
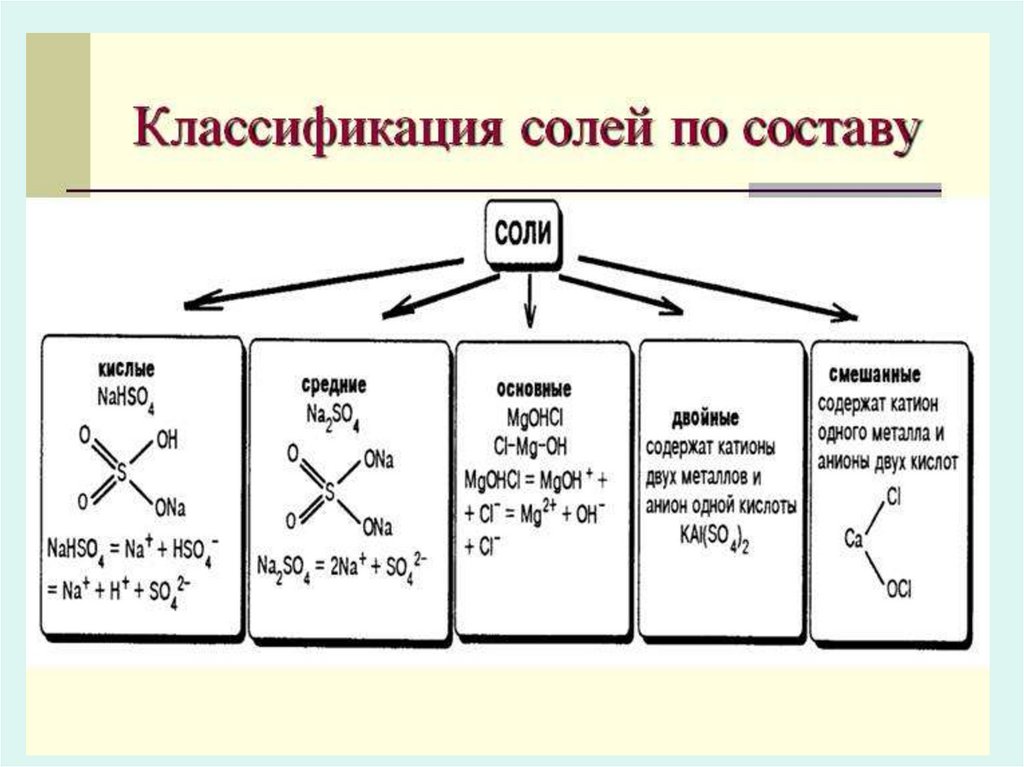
СОЛИСоли — это сложные вещества,
диссоциирующие на катионы металлов и
анионы кислотных остатков
Магнезиткарбонат магния
Доломит –
магний-кальций карбонат
Малахит –
гидроксокарбонат меди
Пирит –
дисульфид железа(II)
Киноварь –
сульфид ртути
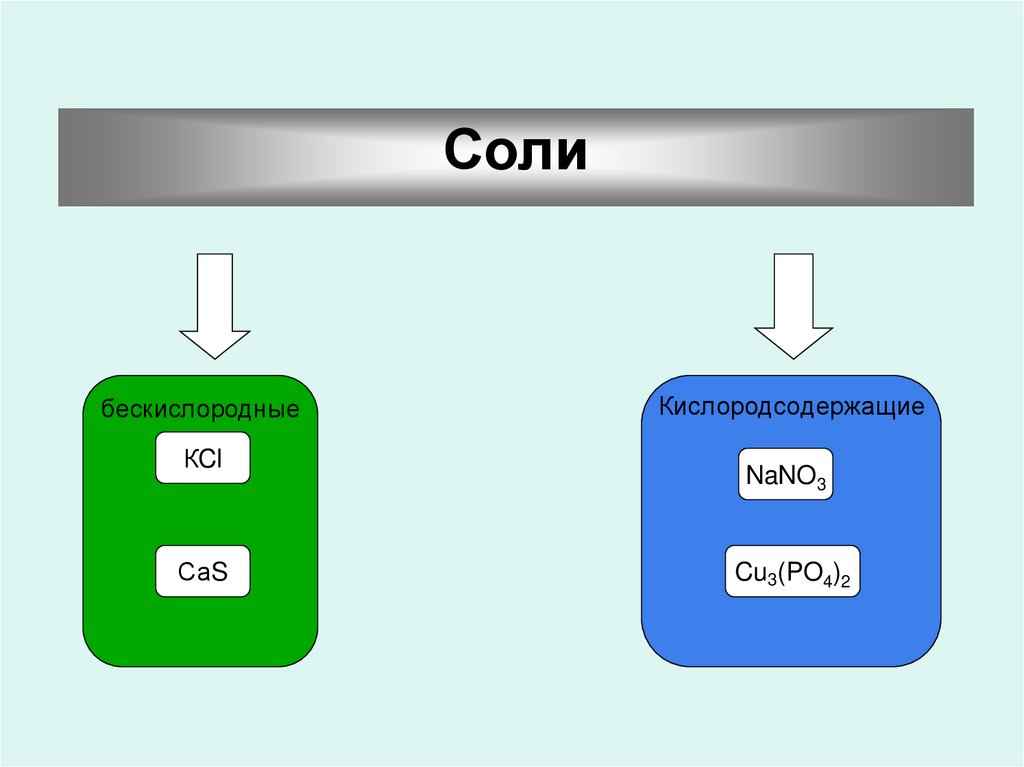
40.
Солибескислородные
КCl
СаS
Кислородсодержащие
NaNO3
Cu3(PO4)2
41.
Бескислородные соли42.
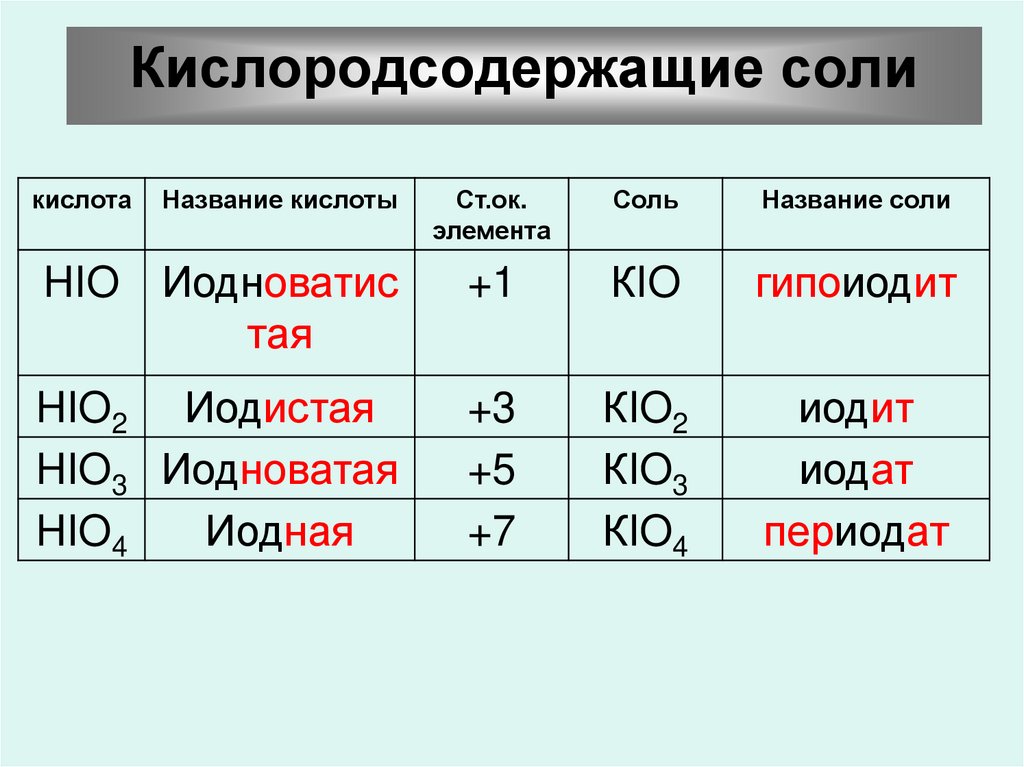
Кислородсодержащие соли43.
Кислородсодержащие соликислота
Название кислоты
Ст.ок.
элемента
Соль
Название соли
HIO Иодноватис
тая
+1
КIO
гипоиодит
HIO2 Иодистая
HIO3 Иодноватая
HIO4
Иодная
+3
+5
+7
КIO2
КIO3
КIO4
иодит
иодат
периодат
44.
45.
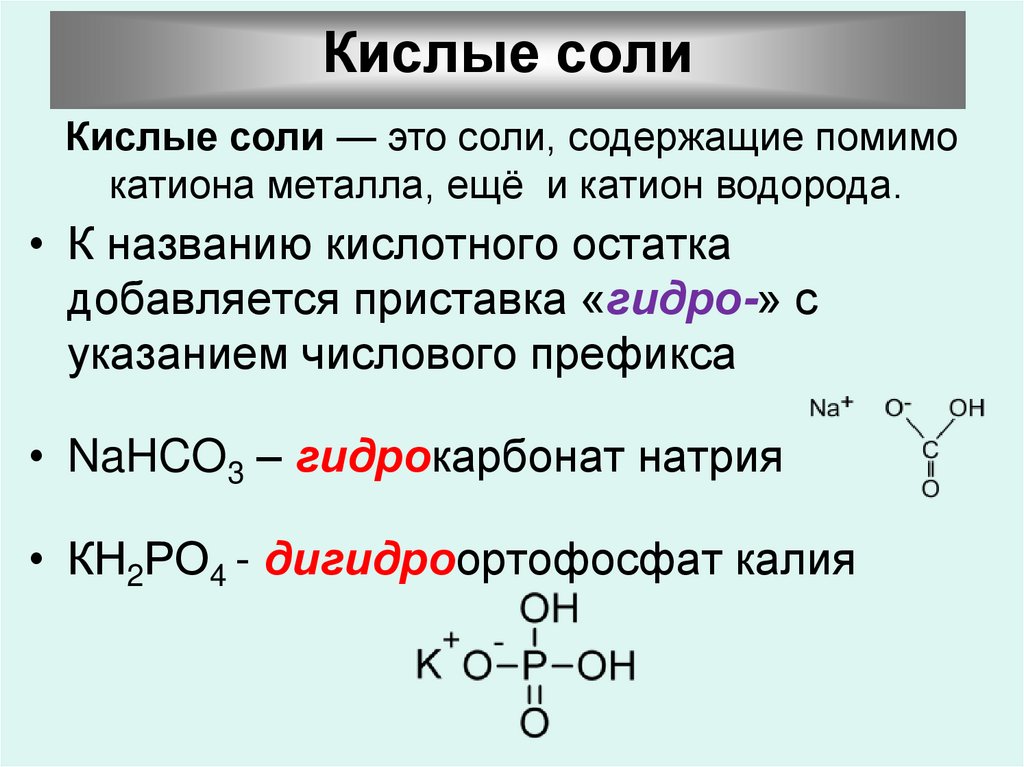
Кислые солиКислые соли — это соли, содержащие помимо
катиона металла, ещё и катион водорода.
• К названию кислотного остатка
добавляется приставка «гидро-» с
указанием числового префикса
• NaHCO3 – гидрокарбонат натрия
• КН2РО4 - дигидроортофосфат калия
46. Основные соли
солиОсновные соли (гидроксосоли) — это продукты неполного
замещения гидроксидных групп в молекулах многокислотных
оснований кислотными остатками
• К названию металла добавляется
приставка «гидроксо-» с указанием
числового префикса
• (СаОН)3РО4 – ортофосфат
гидроксокальция
• Fe(OH)2NO3 – нитрат
дигидроксожелеза (III)
47.
Двойные соли• В состав соли входит два различных
катиона:
– NaCr(SO4)2
Название катионов таких солей: на первое
место ставится катион с меньшей
степенью окисления, затем через дефис
катион с большей степенью окисления
NaCr(SO4)2 - cульфат натрия – хрома (III)
48.
Смешанные соли• В состав соли входит два различных
кислотных остатка:
– FeCl2NO3
• Названия анионов таких солей состоят из
названий кислотных остатков, стоящих в
алфавитном порядке, через дефис:
– FeCl2NO3 – нитрат-хлорид железа (III)
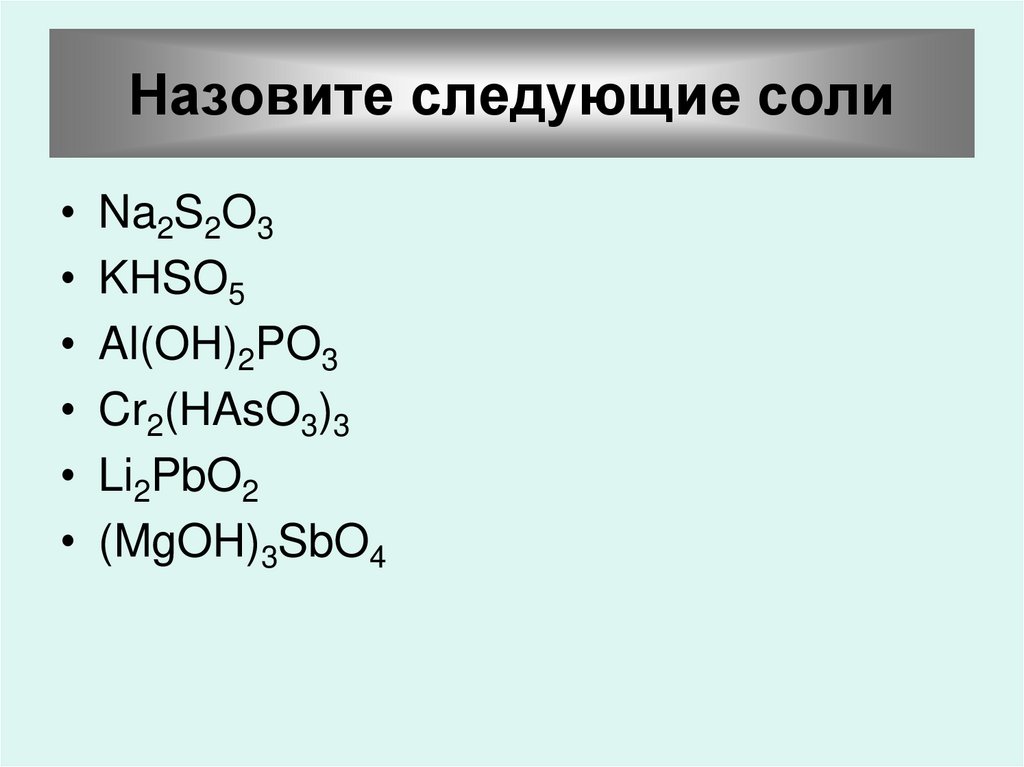
49. Назовите следующие соли
Na2S2O3
KHSO5
Al(OH)2PO3
Cr2(HAsO3)3
Li2PbO2
(MgOH)3SbO4
50. Назовите следующие соли
• Na2S2O3 - тиосульфат натрия• KHSO5 – гидропероксосульфат калия
• Al(OH)2PO3 – метафосфат
дигидроксоалюминия
• Cr2(HAsO3)3 – гидроортоарсенит хрома (III)
• Li2PbO2 – ортоплюмбит лития
• (MgOH)3SbO4 – ортоантимонат
гидроксомагния
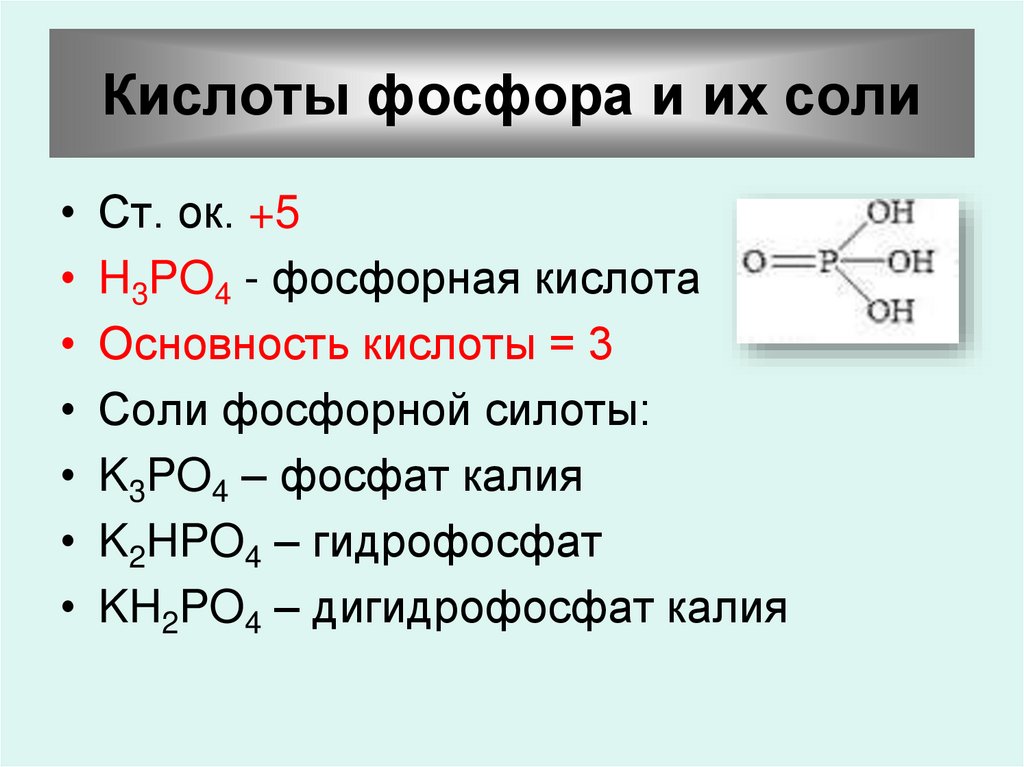
51. Кислоты фосфора и их соли
Ст. ок. +5
H3PO4 - фосфорная кислота
Основность кислоты = 3
Соли фосфорной силоты:
K3PO4 – фосфат калия
K2HPO4 – гидрофосфат
KH2PO4 – дигидрофосфат калия
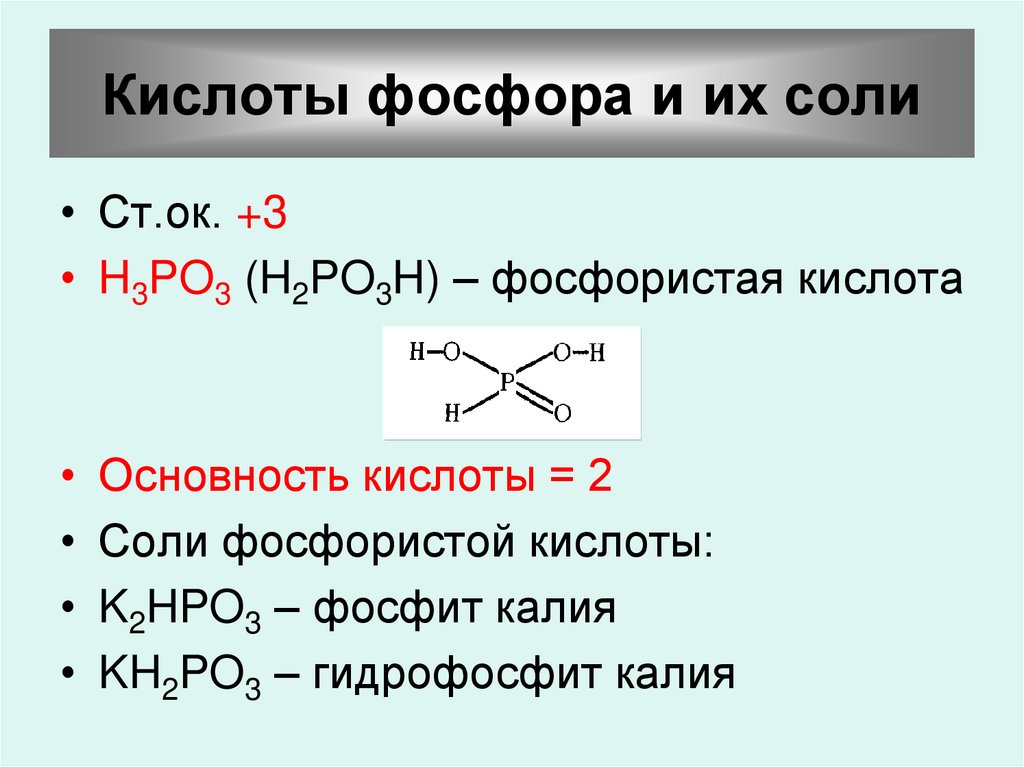
52. Кислоты фосфора и их соли
• Ст.ок. +3• H3PO3 (H2PO3H) – фосфористая кислота
Основность кислоты = 2
Соли фосфористой кислоты:
K2HPO3 – фосфит калия
KH2PO3 – гидрофосфит калия
53. Кислоты фосфора и их соли
• Ст.ок. + 1• H3PO2 (HPO2H2) – фосфорноватистая
кислота
Основность кислоты = 1
Соли фосфорноватисной кислоты:
KH2PO2 – гипофосфит калия
Кислых солей не образует!!!
54.
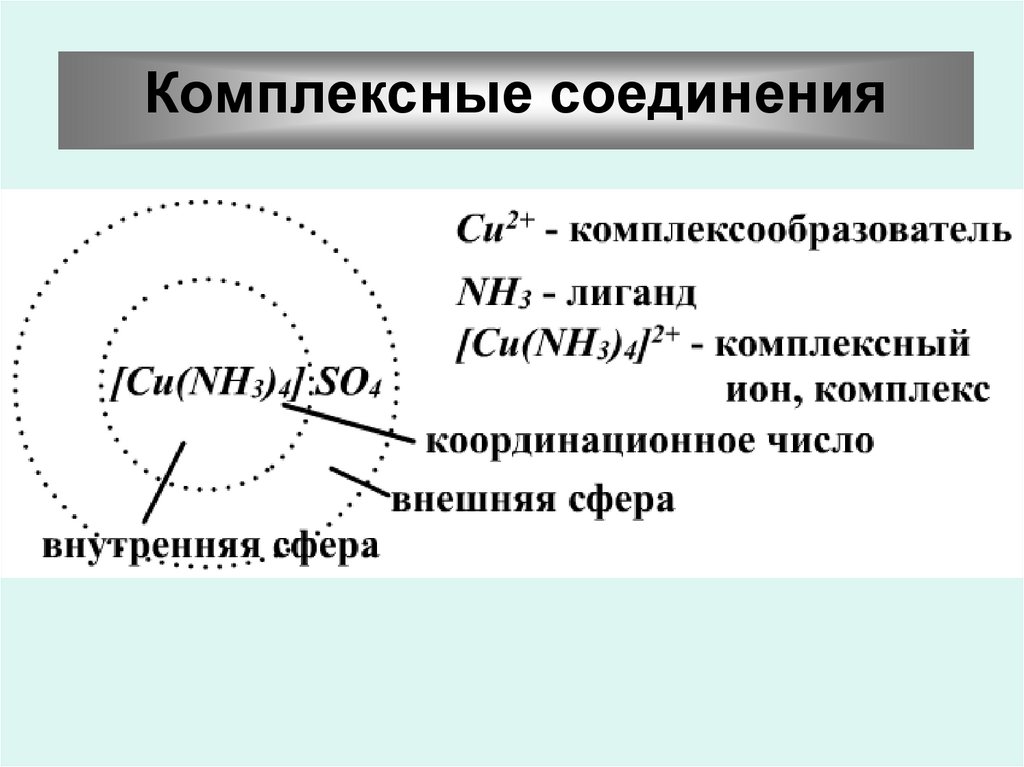
Комплексные соединения55.
Название комплексныхсоединений
1. Первым в именительном падеже называют
анион, затем катион в родительном.
2. При названии комплексного иона сначала
перечисляют внутрисферные лиганды, а после
них комплексообразователь (центральный атом).
Первыми среди лигандов называют нейтральные
молекулы – NH3, H2O, а затем отрицательные
ионы. Названия последних состоят из названия
аниона и окончания "о".
Например: J- – иодо, СО32- – карбонато, Cl- – хлоро, СN– циано, NО2- – нитро, NО3- – нитрато, О2- – оксо, ОН- –
гидроксо.
56.
Катионный комплексКомплексообразователь имеет русское название
в родительном падеже, его степень окисления
указывается в скобках после названия.
Например:
[Cu(NH3)4](ОН)2 – гидроксид тетраамминмеди (ІІ)
[PtCl(NH3)5]Cl3 – хлорид пентаамминхлороплатины (ІV)
57.
Анионный комплексКомплексообразователю
даётся
латинское
название
с добавлением суффикса "ат" и
указывает его степень окисления.
Например:
К2[CuBr4] – тетрабромокупрат (ІІ) калия
Nа[PtCl3NH3] – амминтрихлороплатинат (ІІ)
натрия
58.
Нейтральный комплексКомплексообразователю
даются
название в именительном падеже,
называют обычным способом
русское
лиганды
Например:
[PtCl4(NH3)2] – диамминтетрахлороплатина (IV)
[Fе(СО)5] – пентакарбонилжелезо (0)
59.
Нейтральный комплексСоединения, содержащие комплексный катион
и
анион.
Названия
таких
соединений
составляют по указанным выше правилам для
катионных и анионных комплексов
Например:
[Pt(NH3)4][PtCl4] – тетрахлороплатинат (ІІ)
тетраамминплатины (ІІ)
[Со(NH3)6][Cr(CN)6] – гексацианохромат (ІІІ)
гексаамминкобальта (III)
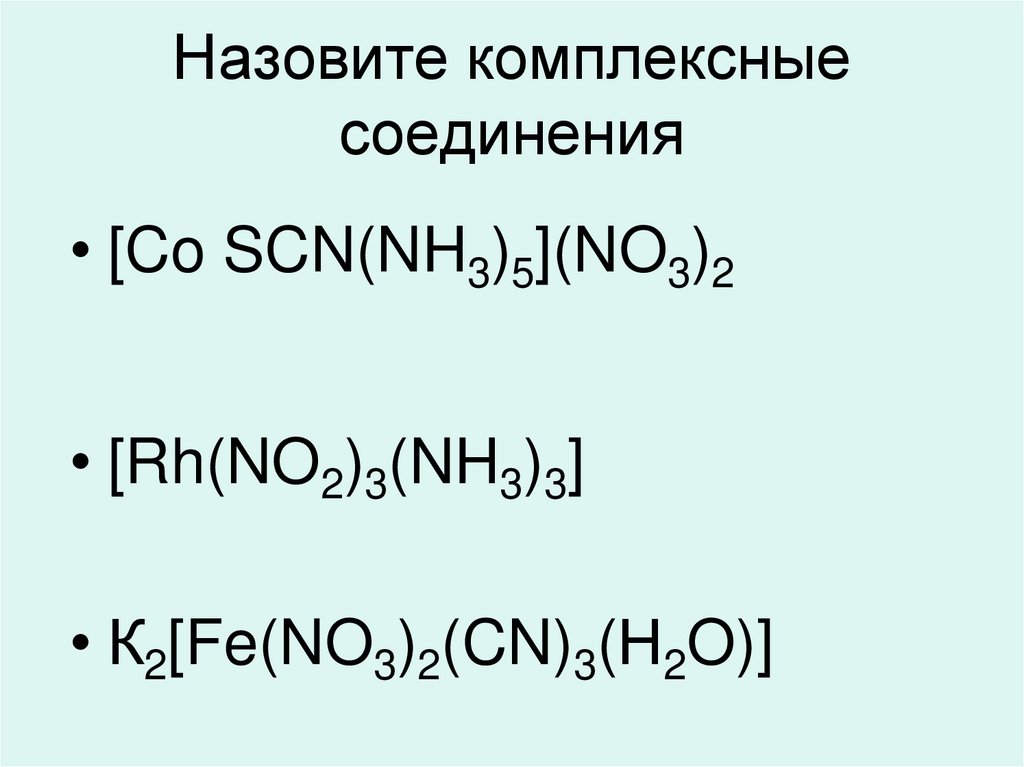
60. Назовите комплексные соединения
• [Co SCN(NH3)5](NO3)2• [Rh(NO2)3(NH3)3]
• К2[Fe(NO3)2(CN)3(Н2O)]
61. Решение
• [Co SCN(NH3)5](NO3)2• нитрат пентаамминороданокобальта (III)
• [Rh(NO2)3(NH3)3]
• Триамминотринитрорутений (III)
• К2[Fe(NO3)2(CN)3(Н2O)]
• аквотрицианодинитратоферрат (III)
калия
62. Химические свойства оксидов
Основный оксидКислотный оксид
• +Н2О → щелочь
• +Н2О → кислота
• + кислотный оксид
→ соль
• + основный оксид →
соль
• + кислота → соль +
Н2О
• + Н2 → Ме + Н2О
• + щелочь → соль +
Н2О
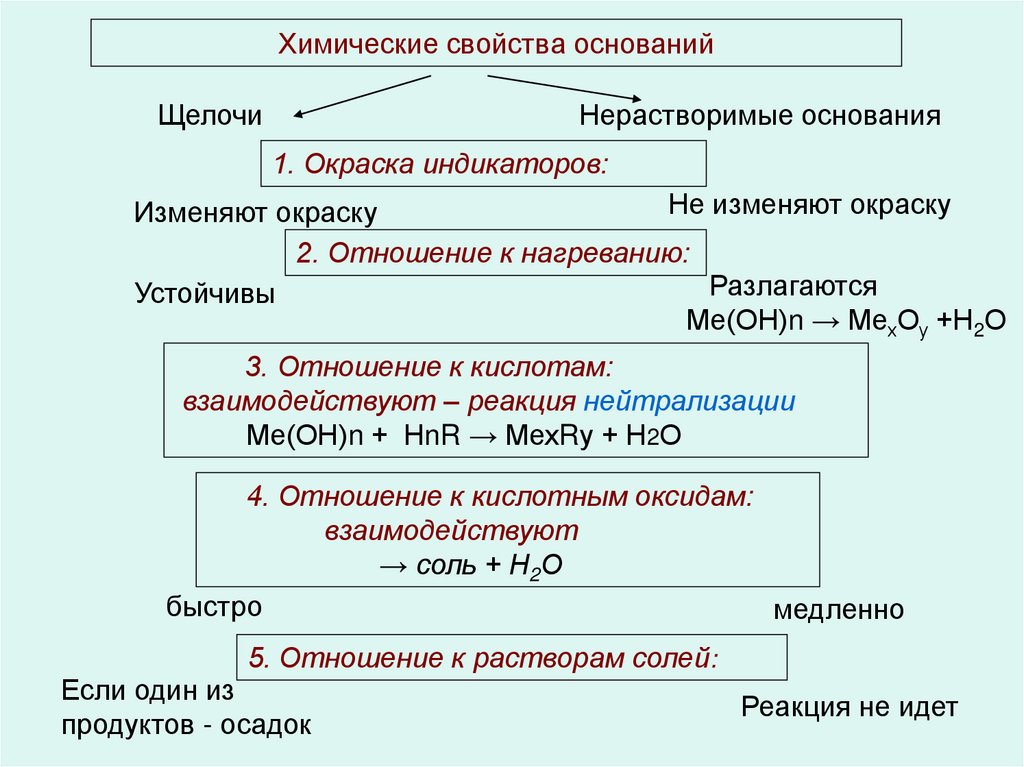
63. Химические свойства оснований
ЩелочиНерастворимые основания
1. Окраска индикаторов:
Не изменяют окраску
Изменяют окраску
2. Отношение к нагреванию:
Разлагаются
Устойчивы
Ме(ОН)n → МехОу +Н2О
3. Отношение к кислотам:
взаимодействуют – реакция нейтрализации
Ме(ОН)n + НnR → МехRу + Н2О
4. Отношение к кислотным оксидам:
взаимодействуют
→ соль + Н2О
быстро
медленно
5. Отношение к растворам солей:
Если один из
продуктов - осадок
Реакция не идет
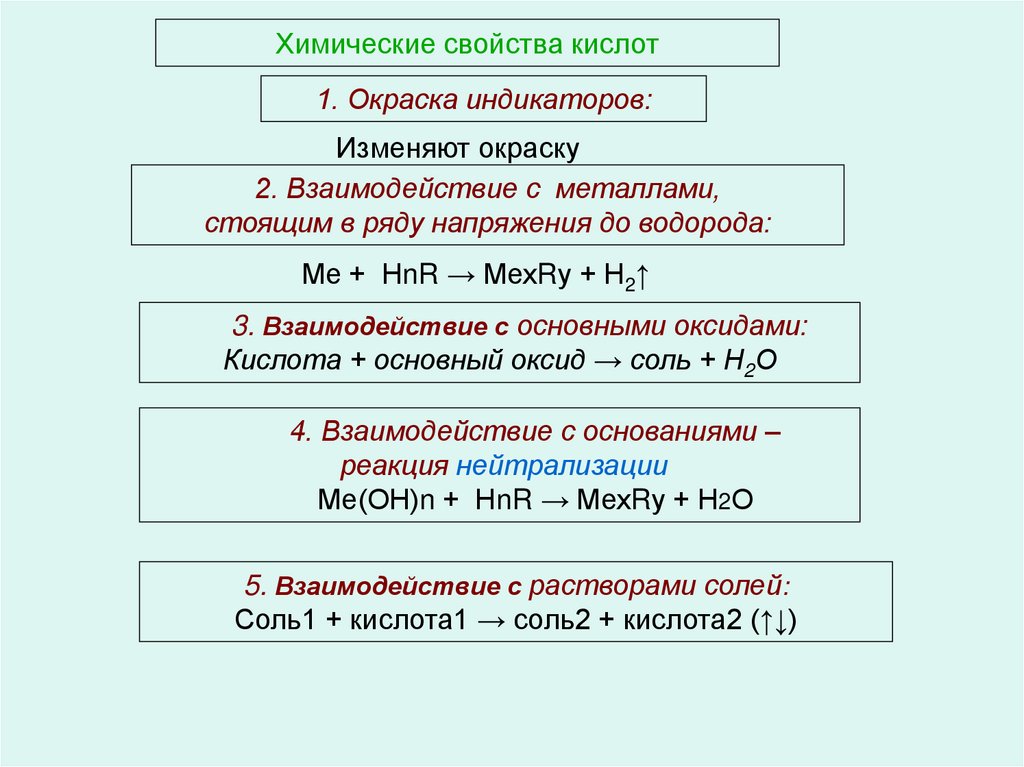
64. Химические свойства кислот
1. Окраска индикаторов:Изменяют окраску
2. Взаимодействие с металлами,
стоящим в ряду напряжения до водорода:
Ме + НnR → МехRу + Н2↑
3. Взаимодействие с основными оксидами:
Кислота + основный оксид → соль + Н2О
4. Взаимодействие с основаниями –
реакция нейтрализации
Ме(ОН)n + НnR → МехRу + Н2О
5. Взаимодействие с растворами солей:
Соль1 + кислота1 → соль2 + кислота2 (↑↓)








































 chemistry
chemistry








