Similar presentations:
Окислительновосстановительные реакции
1.
Окислительновосстановительныереакции
2. Окислительно-восстановительные реакции (ОВР) -
Окислительновосстановительные реакции(ОВР) –
химические реакции, в
которых происходит
изменение степеней
окисления атомов, входящих
в состав реагирующих
веществ.
3. Степень окисления
Степень окисления атомовэлементов простых веществ равна
нулю
Степень окисления водорода в
соединениях +1, кроме гидридов
Степень окисления кислорода в
соединениях -2, кроме пероксидов
и соединений с фтором
Сумма всех степеней окисления
атомов в соединении равна нулю
Сумма всех степеней окисления
атомов в ионе равна значению
заряда иона
Mgº, Cl2º, O2º
+1
+1
-1
HCl, H2O, NaH
-2
-1
+2
H2O, Н2О2, OF2
+1 +6 -2
H2SO4
2(+1)+6+4(-2)=0
+6 -2
SO4
6+4(-2)=-2
4. Распознавание уравнений ОВР
Запишите значения степеней окисленияатомов всех элементов в уравнении реакции
Определите изменяется ли степень
окисления атомов элементов.
+2 -2
+1 -1
+2 -1
+1 -2
PbO + 2HCl → PbCl2 + H2O
Степень окисления не изменяется => реакция не окислительновосстановительная
+4 -2
+1 -1
+2 -1
0
+1
-2
PbO2 + 2HCl → PbCl2 + Cl2 + 2H2O
Степень окисления изменяется => реакция окислительновосстановительная
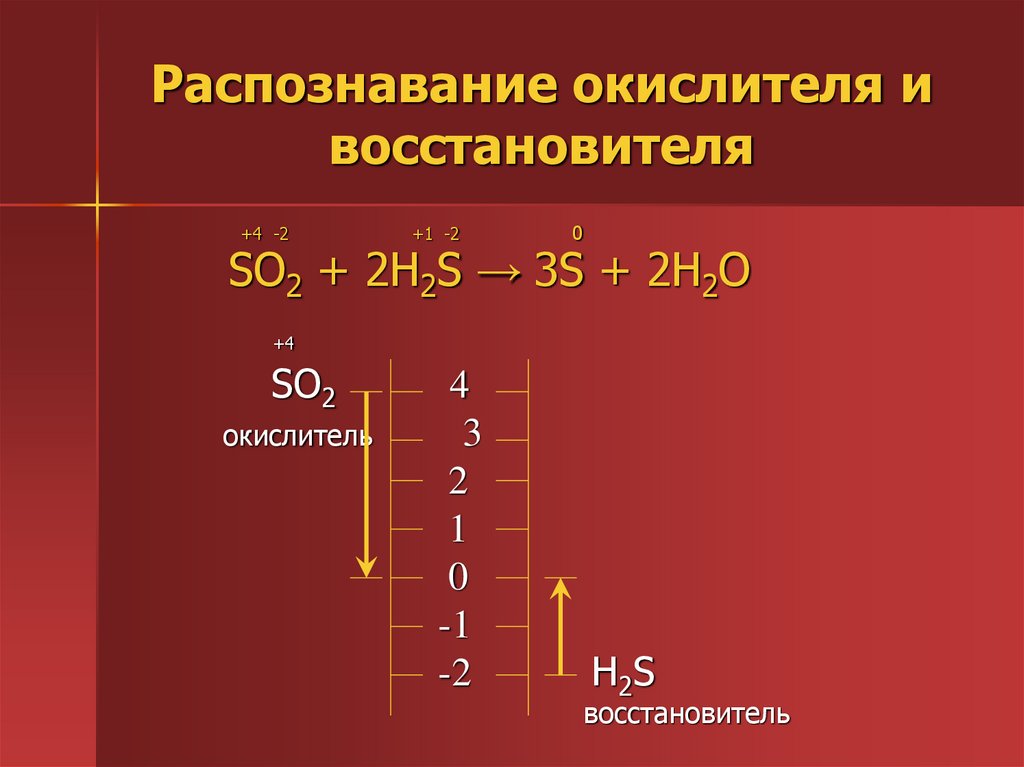
5. Распознавание окислителя и восстановителя
+4 -2+1 -2
0
SO2 + 2H2S → 3S + 2H2O
+4
SO2
окислитель
4
3
2
1
0
-1
-2
H2S
восстановитель
6. Метод электронного баланса
+4 -2+1
0
-2
SO2 + 2H2S → 3S + 2H2O
+4
0
S →S
_
+4
0
S +4 e → S
1
_
+4 → 0
взял e – восстановление
+4 +(-4)=0
-2
0
S →S
-2 → 0
-2 - (-2)=0
_
-2
0
S–2e→S
_
отдал e – окисление
2





 chemistry
chemistry








