Similar presentations:
Структура електронної оболонки атома
1.
2.
Простір поблизу ядра,в якому наймовірніше
перебування електорна,
називається орбіталлю
Орбіталь ― це
всього-на-всього
область простору
3.
Електрони перебувають навколо ядратільки в русі, займаючи певний простір,
який можна уявити за допомогою
геометричних фігур
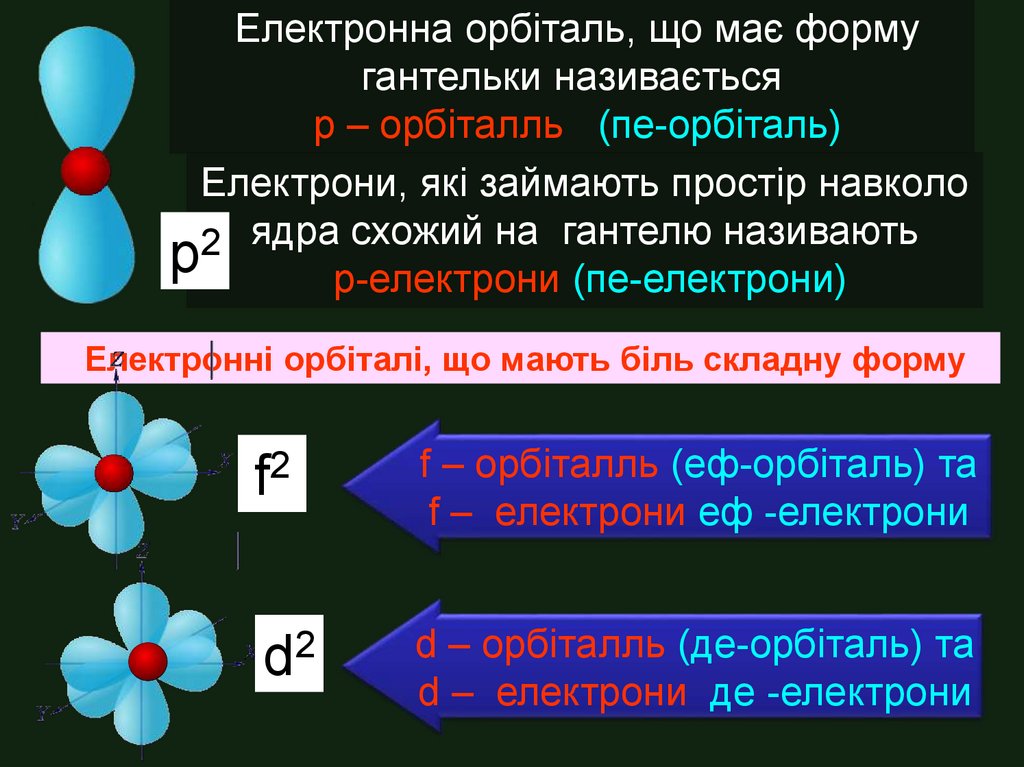
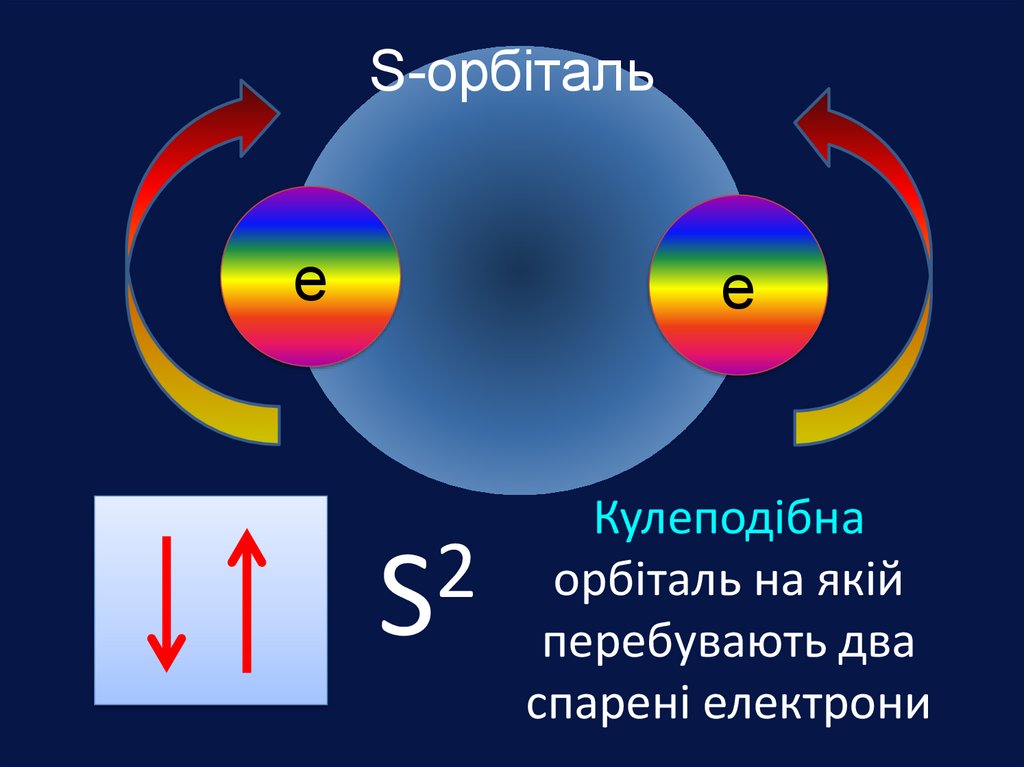
Електронна орбіталь, що має форму
кулі називається s- орбіталль
(ес-орбіталь)
↑↓
s2
Електрони, які займають простір навколо
ядра схожий на кулю називають s-електрони
Графічно орбіталі прийнято позначати
квадратом в якому вказують стрілками
електрони, що рухаються та надписом
4.
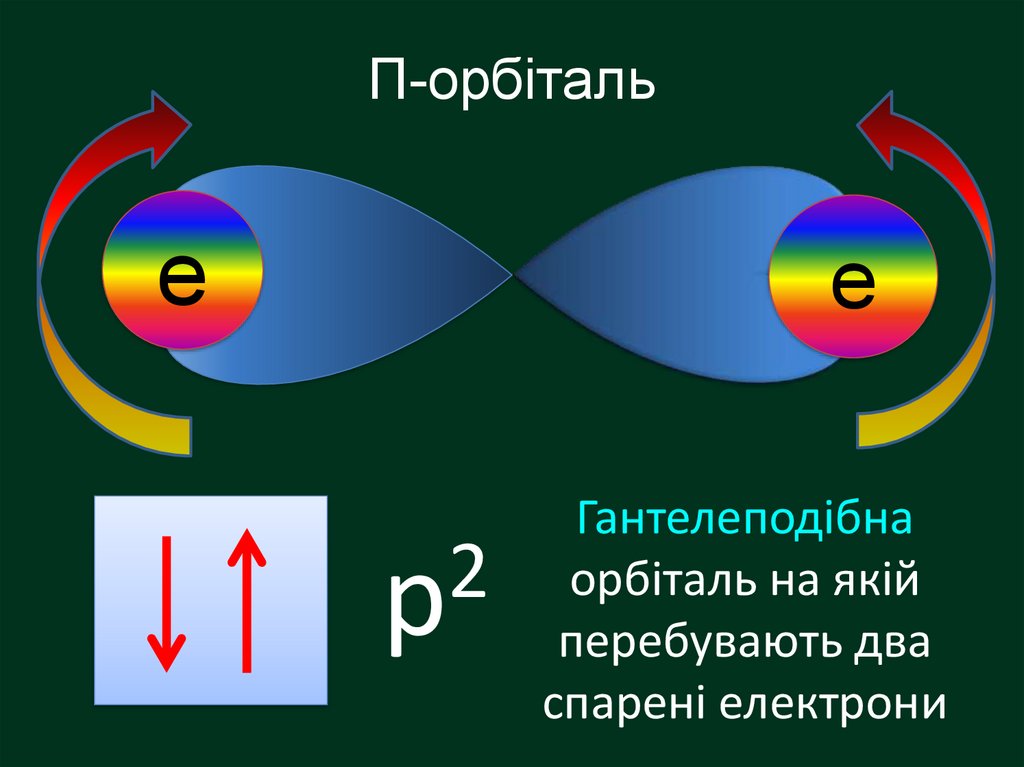
Електронна орбіталь, що має формугантельки називається
р – орбіталль (пе-орбіталь)
Електрони, які займають простір навколо
ядра схожий на гантелю називають
2
р
р-електрони (пе-електрони)
Електронні орбіталі, що мають біль складну форму
f2
f – орбіталль (еф-орбіталь) та
f – електрони еф -електрони
d2
d – орбіталль (де-орбіталь) та
d – електрони де -електрони
5.
На одній орбіталіможе перебувати
лише два електрони
Вони називаються
спарені
електрони
обертаються навколо
осі в протилежні
сторони.
↑↓
Рух електрона
навколо осі
називається спін
6.
S-орбіталье
е
2
S
Кулеподібна
орбіталь на якій
перебувають два
спарені електрони
7.
П-орбіталье
е
2
p
Гантелеподібна
орбіталь на якій
перебувають два
спарені електрони
8.
Електронні хмари, що утворюютьсяокремими електонами в атомі, разом
утворюють електронну хмару атома —
електронну оболонку .
9.
Єлектронна оболонка —це сукупність електронів,
що рухаються навколо ядра
та утримуються в атомі
силами притягання ядра.
Модель атома описується будовою
електронної оболонки.
Для її уявлення необхідно знати
найважливішу характеристику електрона,
яку можна точно визначити (розрахувати).
Такою характеристикою є енергія.
10.
Нільс Бор (1885—1962),данський фізик-теоретик,
один із творців сучасної
квантової механіки
стверджував, що
електрони можуть
обертатися не на будьякий орбіталі, а тільки на
суворо визначених
відстанях від ядра,
утворюючи певні шари з
електронів.
Електронні шари
(енергетичні рівні)
11.
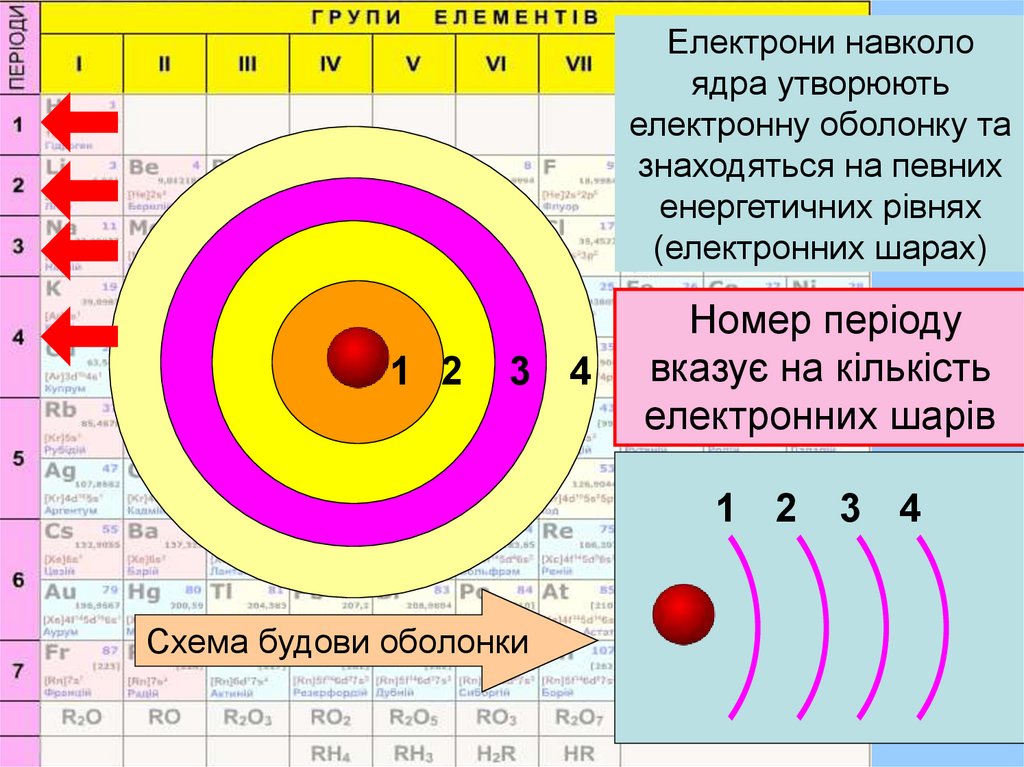
Електрони з однаковою енергієюоб'єднуються в електронні шари
(енергетичні рівні), які позначають n.
Кількість електронних шарів
(енергетичних рівнів) атома, на яких
перебувають електрони, дорівнює
номеру періода, де міститься
елемент.
12.
Електрони навколоядра утворюють
електронну оболонку та
знаходяться на певних
енергетичних рівнях
(електронних шарах)
1 2
3 4
Номер періоду
вказує на кількість
електронних шарів
1 2
Схема будови оболонки
3 4
13.
Електрони розміщуютьсянавколо ядра на
електронних шарах
(енергетичних рівнях)
Номер періоду вказує на
кількість електронних шарів
(енергетичних рівнів)
елемента
14.
На електронних шарахрозміщені орбіталі певної
форми
s
р
d
15.
H1
He
У елементів першого періоду
Гідрогену та Гелію один електронний шар
на якому перебувають електрони з
кулеподібною формою орбіталі (s-електрони);
↓↑
1s2
Спарені електрони однієї орбіталі
зображують у квадратику, який має
назву енергетична комірка, у вигляді
протилежно спрямованих стрілок
Цифра перед буквою вказує на
номер енергетичного рівня
16.
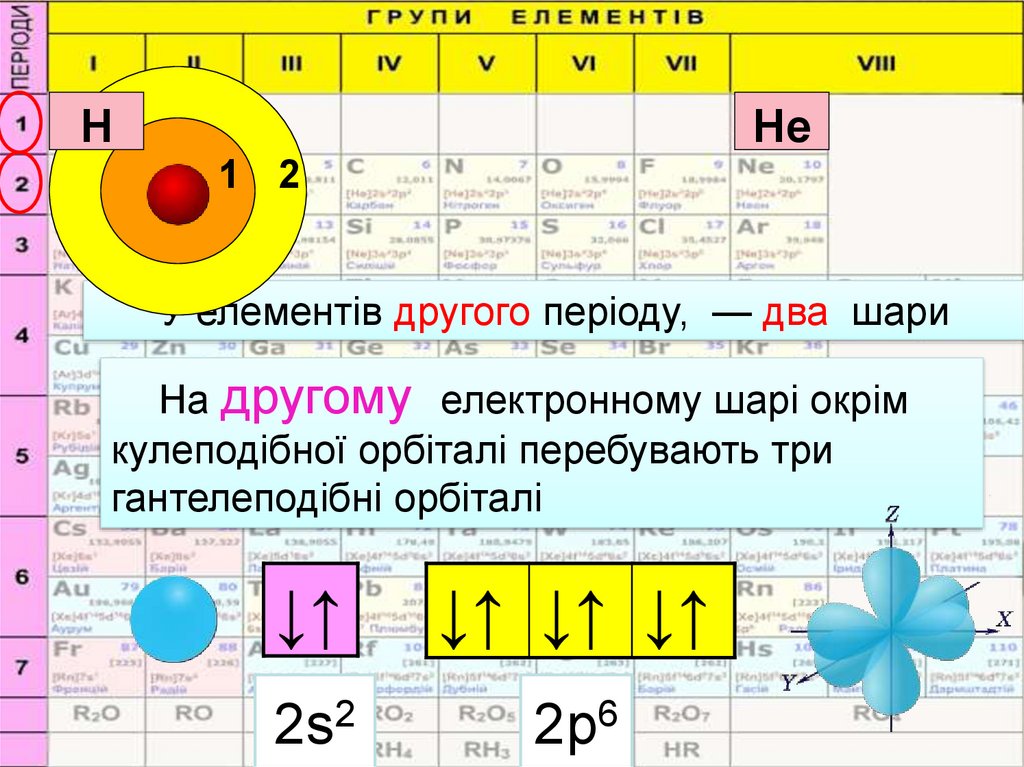
HHe
1 2
У елементів другого періоду, — два шари
На другому електронному шарі окрім
кулеподібної орбіталі перебувають три
гантелеподібні орбіталі
↓↑
↓↑ ↓↑ ↓↑
2s2
2р6
17.
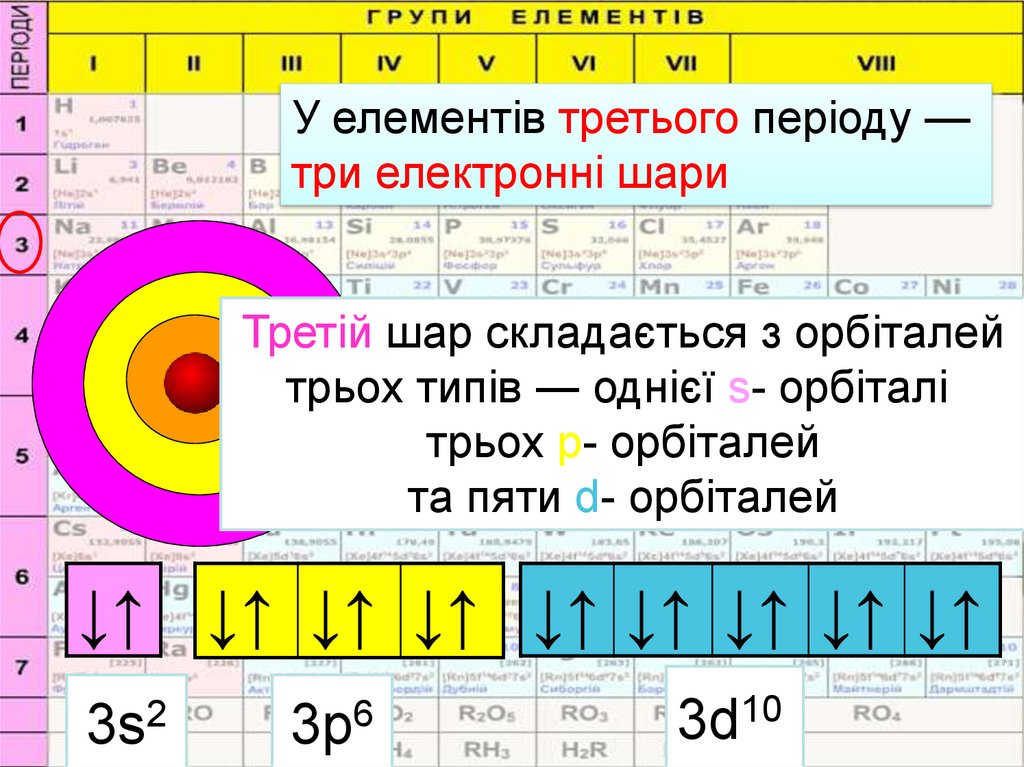
У елементів третього періоду —три електронні шари
Третій шар складається з орбіталей
типів ― однієї s- орбіталі,
1 2трьох
3
трьох р- орбіталей
та пяти d- орбіталей
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
3s2
3р6
3d10
18.
1 У елементів четвертого періоду— чотири2 електронні шари
3
Четвертий шар складається з орбіталей
4 чотирох типів ― однієї s- орбіталі,, трьох р1 2 3 4
орбіталей, пяти d- орбіталей та семи fорбіталей
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
4s2
4р6
4d10
↓↑
↓↑
↓↑
4f14
↓↑
↓↑
↓↑
↓↑
19.
Першийшар складається
з орбіталі
Кожний
електронний
шар
одного типу ― s-орбіталі
складається з певної кількості
певної зформи
Другийорбіталей
шар складається
орбіталей
двох типів ― s і р орбіталей
Третій шар складається з орбіталей
трьох типів ― s, р і d орбіталей
Четвертий шар складається з орбіталей
чотирох типів ― s, р, d, f орбіталей
20.
Який номерє форм
Назвіть шару,
формистільки
орбіталей,
які
орбіталей,
його утворюють
розмішеніщо
на електронних
шарах
Семен Пішов До Федори
1
s
2
s, р
3
s, р, d
4
s, р, d, f
21.
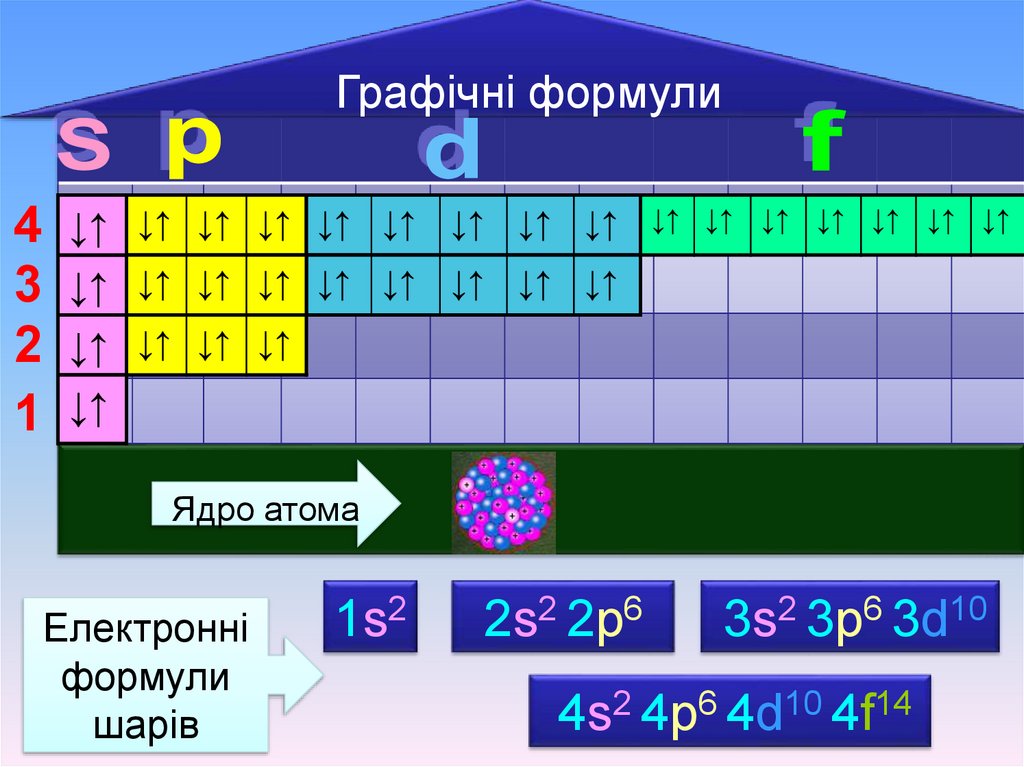
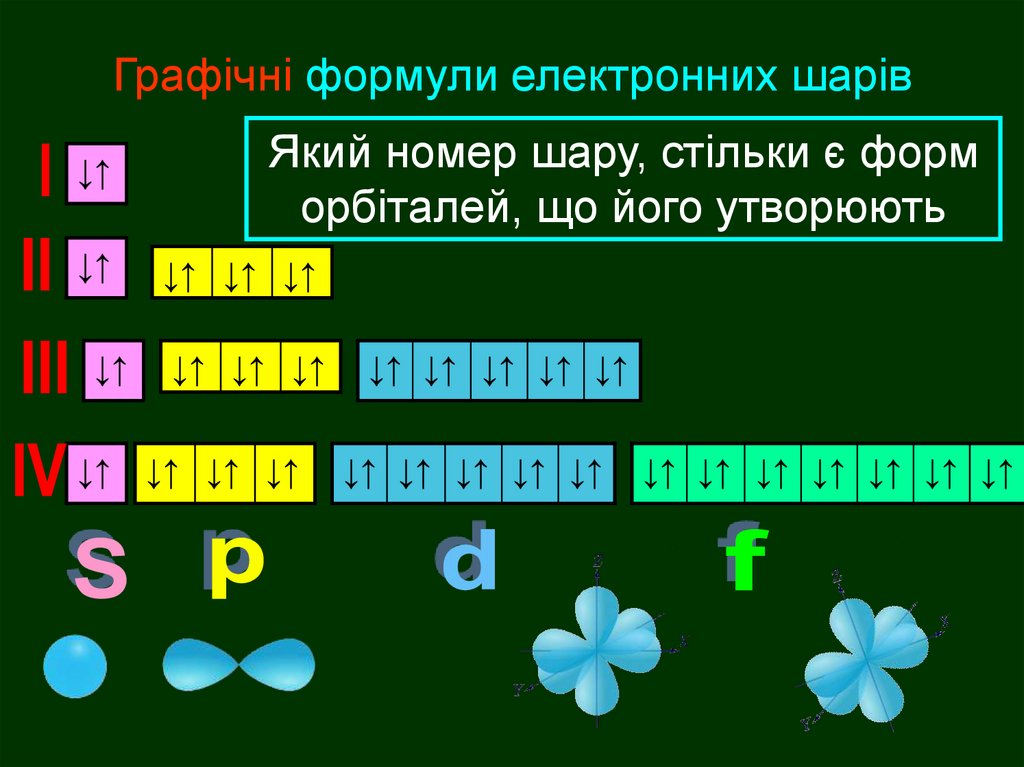
Графічні формули4
3
2
1
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑
↓↑
Ядро атома
Електронні
формули
шарів
1s2
2s2 2р6
3s2 3р6 3d10
4s2 4р6 4d10 4f14
22.
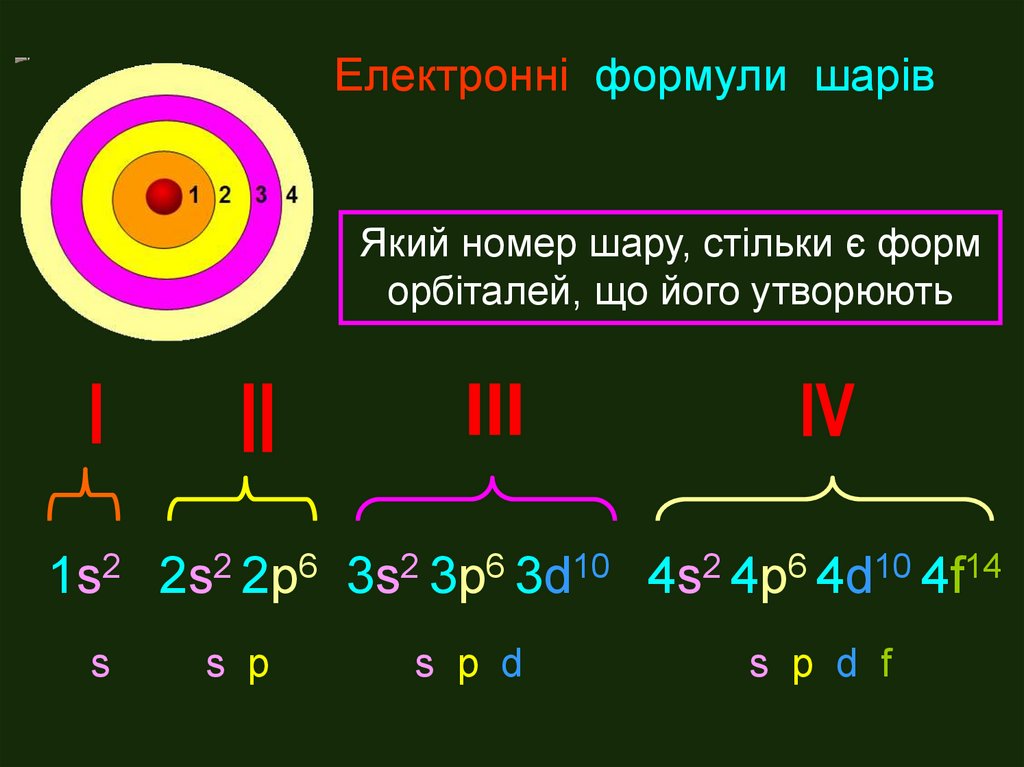
Електронні формули шарівЯкий номер шару, стільки є форм
орбіталей, що його утворюють
1s2 2s2 2р6 3s2 3р6 3d10 4s2 4р6 4d10 4f14
s
s р
s р d
s р d f
23.
Електронна формула атома це записрозподілу орбіталей певної форми на
електронних шарах та кільткості
електронів електронів на орбіталях
2
2
6
2
6
1
1s 2s 2р 3s 3р 4s
ЇЇ ще називають електронна конфігурація атома
коефіцієнт ― цифра перед буквою, що відображає
номер електронного шару (номер періоду)
буква ― вказує на форму орбіталі
цифра над буквою ― вказує на кількість електронів
на орбіталях певної форми
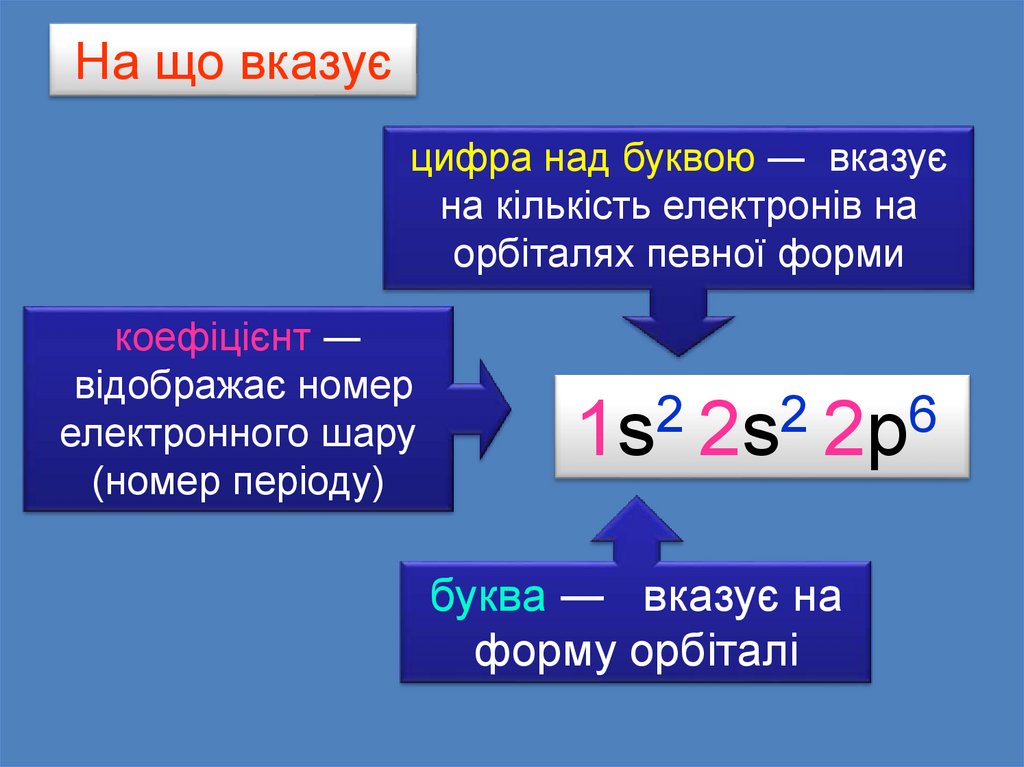
24.
На що вказуєцифра над буквою ― вказує
Цифра
над
буквоюна
на кількість
електронів
орбіталях певної форми
коефіцієнт ―
відображає номер
Коефіцієнт
електронного
шару
(номер періоду)
2
2
6
1s 2s 2р
буква ― вказує на
формуБуква
орбіталі
25.
Для запису електронної формулипевного атома необхідно:
Підрахувати кількість електронів в атомі
(Z ― дорівнює порядковому номеру)
1s2 2s2 2р6 3s2 3р4
2+2+6+2+4
Z=16
Врахувати кількість електронних шарів
(дорівнює номеру періода)
1s2 2s2 2р6 3s2 3р4 кількість шарів― 1,2,3
26.
Іноді записують електронні формули вскороченому вигляді. Для цього
відокремлюють ту частину формули,
яка відповідає будові атома найближчого
інертного газу.
В електронній формулі атома Сульфуру
можна виділити електрони, які відповідають
будові атома Неону: 1s2 2s2 2р6 3s2 3р4
Тому електорнну формулу
можна записати так: S Ne 3s2 3р4
27.
↑↓енергетична комірка де позначені
спарені електрони однієї орбіталі у вигляді
протилежно спрямованих стрілок, що
вказують на рух електронів навкруги своєї
осі в протилежні сторни
клітинка ― орбіталь,
стрілки ― електрони, що обертаються навколо осі,
вільна клітинка ― вільна орбіталь
Відображення розподілу електронів
за енергетичними комірками
називають графічною формулою
28.
Графічні формули електронних шарів↓↑
↓↑
↓↑
↓↑
Який номер шару, стільки є форм
орбіталей, що його утворюють
↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
29.
Завдання: побудуйте електронну таграфічну формулу атома Силіцію
+14
Атом Силіцію має 14 електронів,
які розміщуються на рьох
електронних шарах
2
2
6
1s 2s 2р
2
2
3s 3р
Графічна формула зовнішнього
електронного шару
↓↑
↓
↑
3s2 3р2
30.
Завдання: зобразіть електронні формулиелементів другого періоду B, C, N
+5
↓↑
↓
↓↑
В
2 3
+6
↓↑ ↓↑ ↓
С
2 4
+7
1s2
2s2 2р1
1s2
↓
2s2 2р2
↓↑
↓
↓
↓
↓↑
N
2 5
1s2 2s2 2р3
31.
В елементів другого періоду,які мають два електронні шари
на першому шарі міститься s-орбіталь
на другому шарі міститься одна s-орбіталь
та три р- орбіталі гантелеподібної форми
↓↑ ↓↑ ↓↑ ↓↑ ↓↑
1s2
2s2
2р6
32.
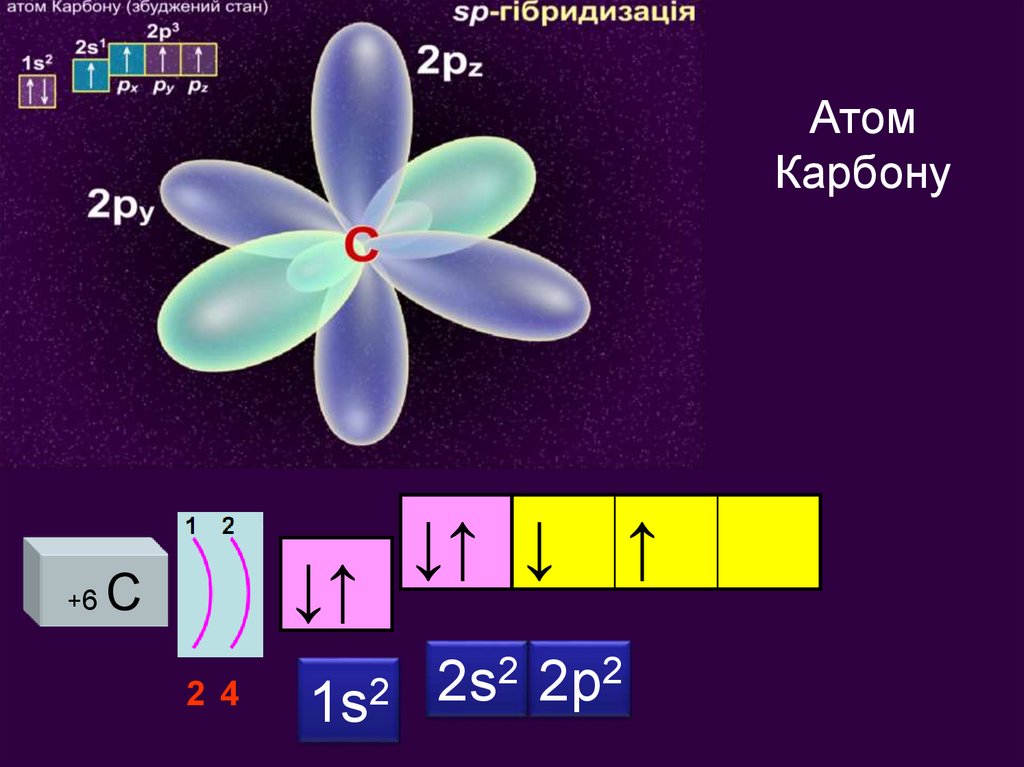
АтомКарбону
Запишіть електронні
та графічні формулу
для атома Карбону
+6
↓↑
С
2 4
1s2
↓↑ ↓
2s2 2р2
↑
33.
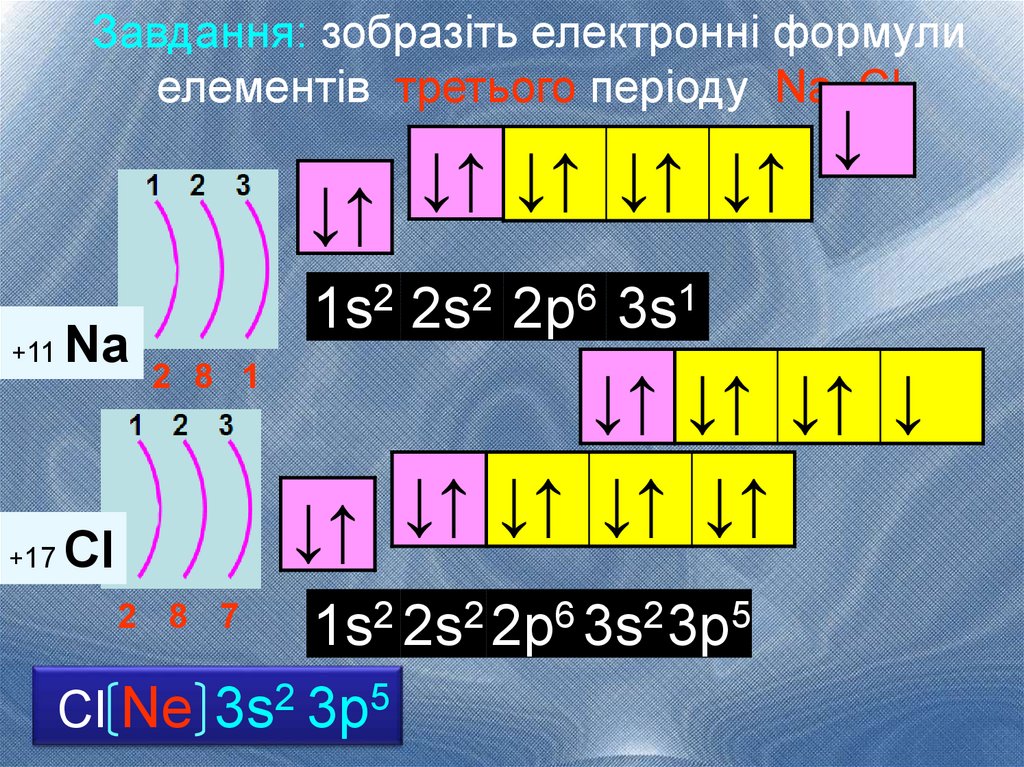
Завдання: зобразіть електронні формулиелементів третього періоду Na, Cl
↓↑
+11
+17
Na
↓↑ ↓↑ ↓↑ ↓↑
↓
1s2 2s2 2р6 3s1
2 8 1
↓↑ ↓↑ ↓↑ ↓
↓↑
↓↑
↓↑
↓↑
↓↑
Cl
1s2 2s2 2р6 3s2 3р5
Cl Ne 3s2 3р5
2 8 7
34.
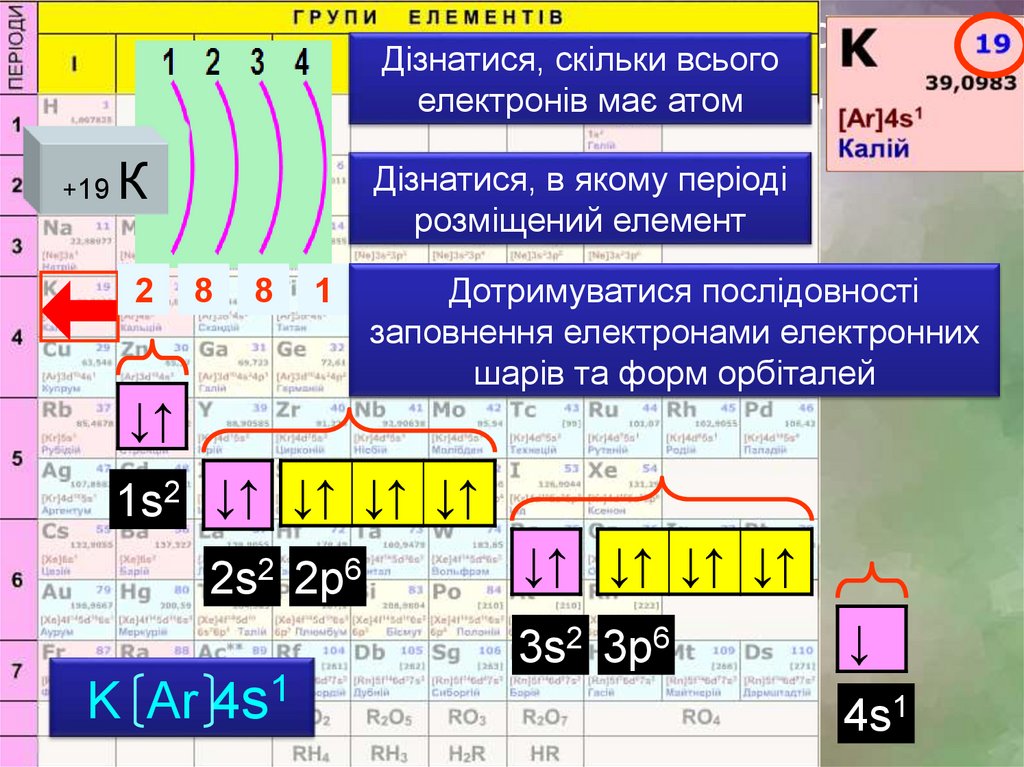
Завдання: зобразіть електронні формулиДізнатися, скільки всього
елементівелектронів
четвертого
періоду
має атом
скориставшись правилом
+19
К
2
Дізнатися, в якому періоді
розміщений елемент
8
8
1
Дотримуватися послідовності
заповнення електронами електронних
шарів та форм орбіталей
↓↑
1s2 ↓↑ ↓↑ ↓↑ ↓↑
2s2 2р6
↓↑ ↓↑ ↓↑ ↓↑
3s2 3р6
K Ar 4s1
↓
4s1
35.
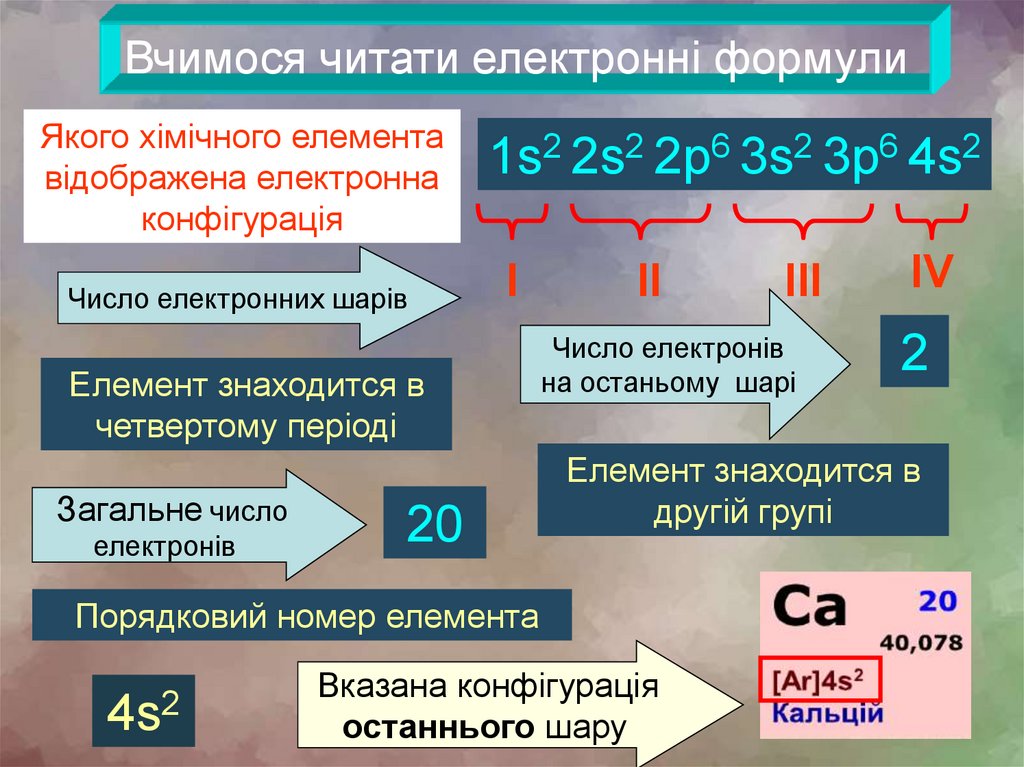
Вчимося читати електронні формулиЯкого хімічного елемента
відображена електронна
конфігурація
Число електронних шарів
1s2 2s2 2р6 3s2 3р6 4s2
І
Елемент знаходится в
четвертому періоді
Загальне число
електронів
20
ІІ
Число електронів
на останьому шарі
ІV
2
Елемент знаходится в
другій групі
Порядковий номер елемента
4s2
ІІІ
Вказана конфігурація
останнього шару
36.
Завдання: Зовнішній рівень атомаелемента має будову 3s23р2.
Визначте що це за елемент.
А) Карбон; Б) Магній;
В) Сульфур; Г) Силіцій;
3
5
В
Номер групи вказує на
кількість електронів
на останьому
електронному шарі
37.
Кількість електронів наостаньому електронному шарі
відповідає номеру групи
ГРУПИ
38.
кількість електронних шарів, які маєатом відповідає номеру ПЕРІОДА
ГРУПИ
39.
Завдання: назвіть елемент, атом якогомає таку конфігурацію.
2
2
6
2
1
1s 2s 2р 3s 3р
2+2+6+2+1= 13
Це число відповідає
порядковому номеру атома
Алюміній
40.
Завдання: визначіть в якому періодіта групі знаходиться елемент



























 chemistry
chemistry








