Similar presentations:
Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2)
1. РОЗДІЛ І ОСНОВИ ПРОЦЕСІВ ГОРІННЯ
Тема 1 Загальні відомості проприроду процесу горіння
Лекція 2
ПОЛУМ’Я. ПРОЦЕСИ, ЩО
ВІДБУВАЮТЬСЯ У ПОЛУМ’Ї
2. План лекції
1. Будова полум’я• 1.1. Зони полум’я
• 1.2. Температурний режим полум’я
• 1.3. Колір дифузійного полум’я
2. Основні теорії, що пояснюють процеси
в полум’ї
• 2.1. Перекісна теорія окислення
• 2.2. Ланцюгова теорія окислення
3. 1. БУДОВА ПОЛУМ’Я
Полум’я – це газовий об’єм, в якому відбуваютьсявсі процеси, що пов’язані з підготовкою горючої
суміші до горіння і сам процес горіння.
Види полум'я:
кінетичне та дифузійне;
ламінарне та турбулентне.
wd 2
Нпол k
Висота ламінарного полум'я:
D
де
w - швидкість витікання газу;
d - діаметр пальника;
D - коефіцієнт дифузії.
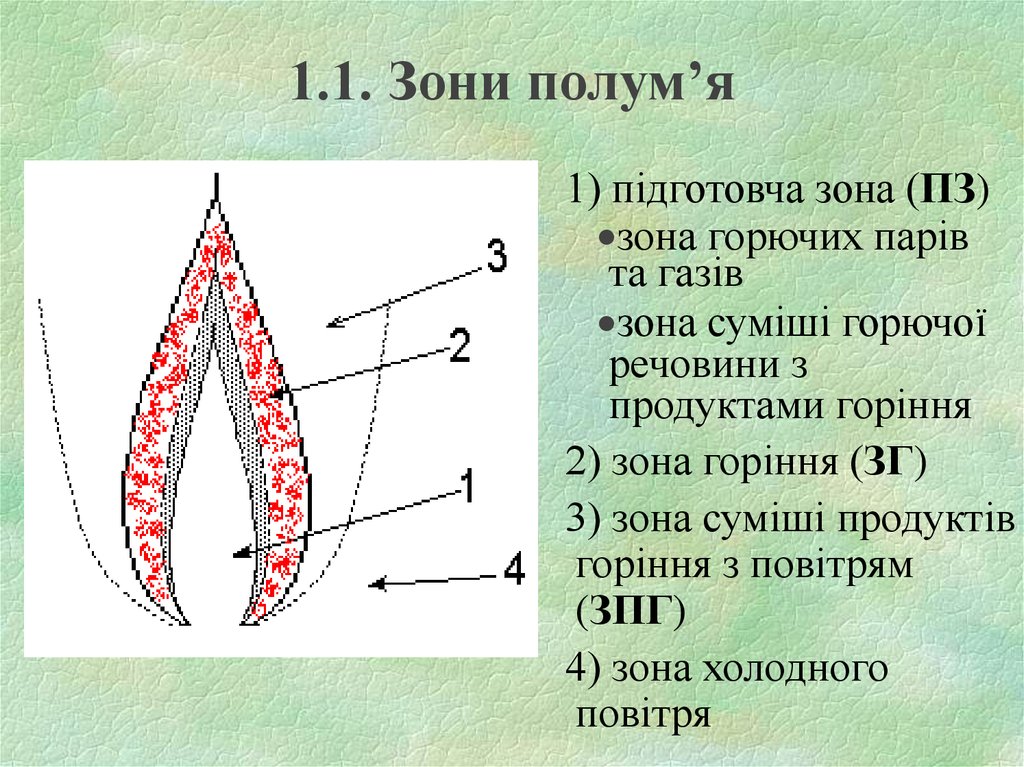
4. 1.1. Зони полум’я
1) підготовча зона (ПЗ)зона горючих парів
та газів
зона суміші горючої
речовини з
продуктами горіння
2) зона горіння (ЗГ)
3) зона суміші продуктів
горіння з повітрям
(ЗПГ)
4) зона холодного
повітря
5.
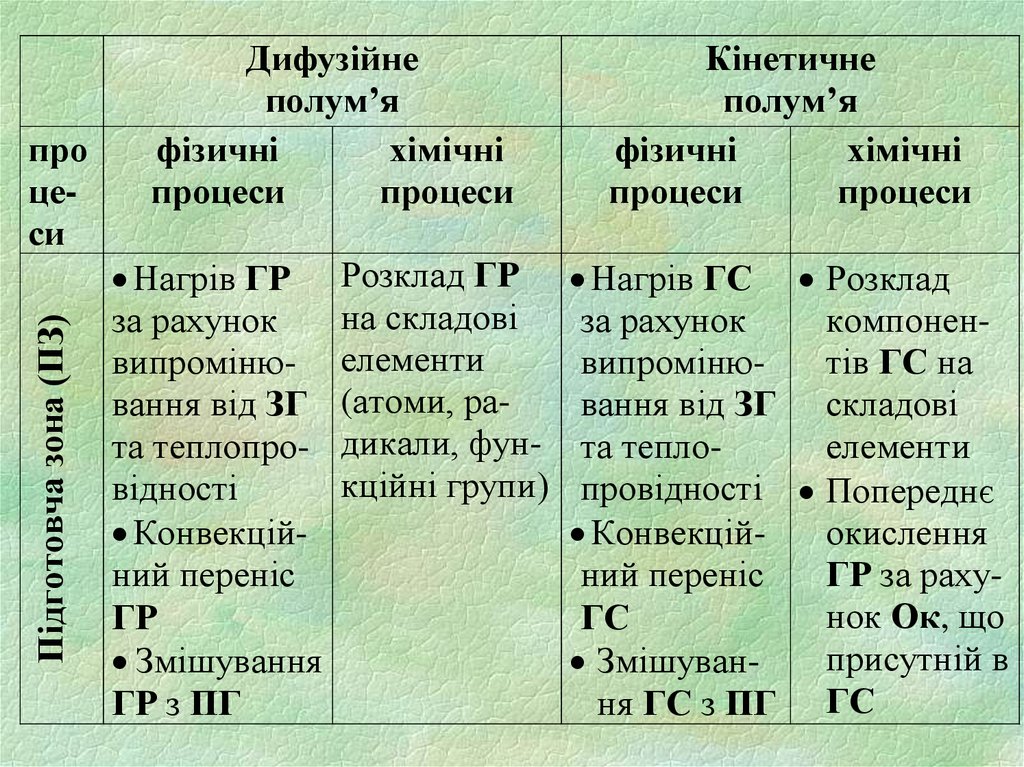
Підготовча зона (ПЗ)про
цеси
Дифузійне
полум’я
фізичні
хімічні
процеси
процеси
Нагрів ГР
за рахунок
випромінювання від ЗГ
та теплопровідності
Конвекційний переніс
ГР
Змішування
ГР з ПГ
Розклад ГР
на складові
елементи
(атоми, радикали, функційні групи)
Кінетичне
полум’я
фізичні
хімічні
процеси
процеси
Нагрів ГС Розклад
за рахунок
компоненвипромінютів ГС на
вання від ЗГ складові
та теплоелементи
провідності Попереднє
Конвекційокислення
ний переніс
ГР за рахунок Ок, що
ГС
присутній в
Змішування ГС з ПГ ГС
6.
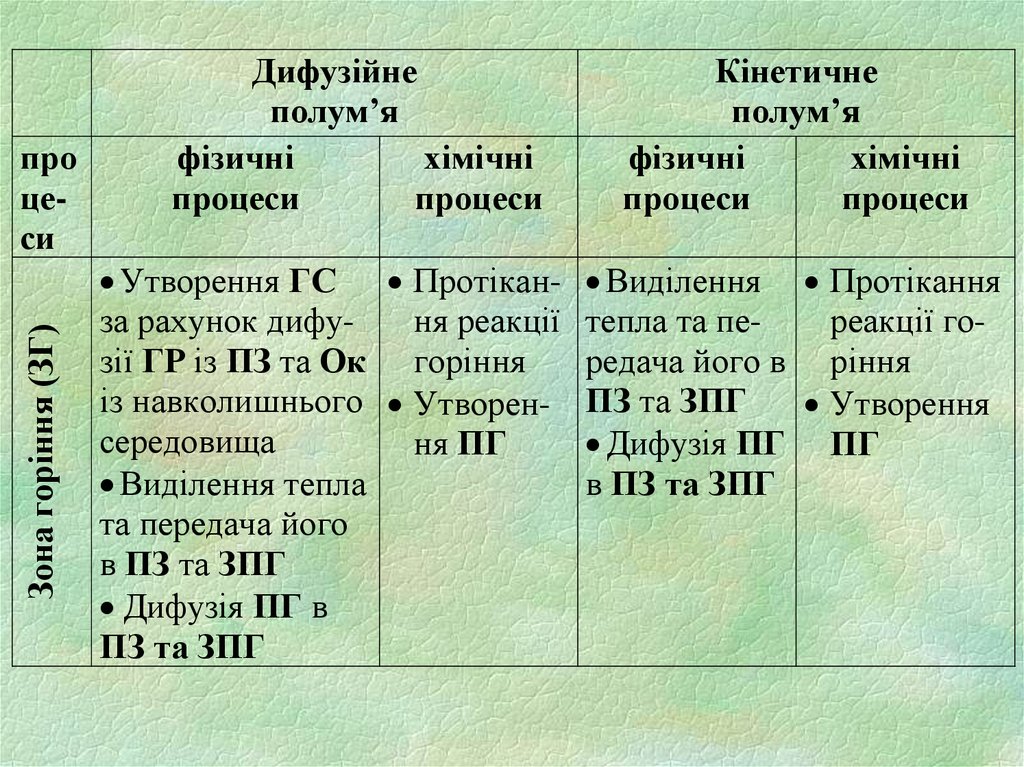
Зона горіння (ЗГ)про
цеси
Дифузійне
полум’я
фізичні
хімічні
процеси
процеси
Утворення ГС Протіканза рахунок дифуня реакції
зії ГР із ПЗ та Ок горіння
із навколишнього Утворенсередовища
ня ПГ
Виділення тепла
та передача його
в ПЗ та ЗПГ
Дифузія ПГ в
ПЗ та ЗПГ
Кінетичне
полум’я
фізичні
хімічні
процеси
процеси
Виділення Протікання
тепла та переакції горедача його в ріння
ПЗ та ЗПГ
Утворення
Дифузія ПГ ПГ
в ПЗ та ЗПГ
7.
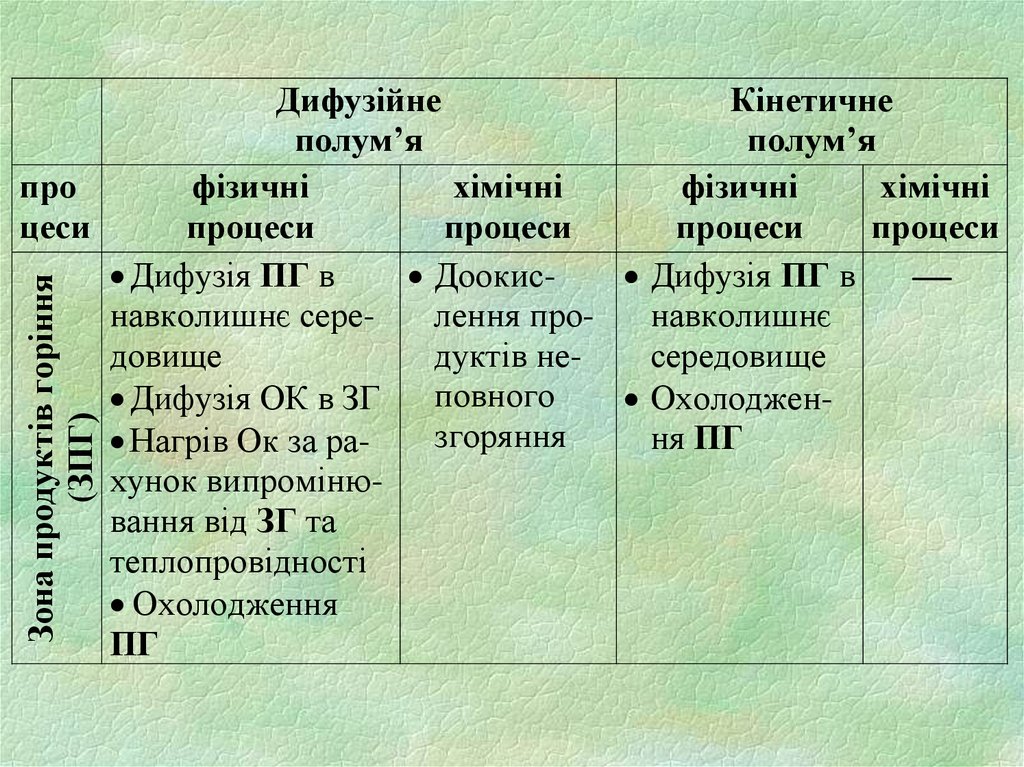
Зона продуктів горіння(ЗПГ)
Дифузійне
Кінетичне
полум’я
полум’я
про
фізичні
хімічні
фізичні
хімічні
цеси
процеси
процеси
процеси
процеси
Дифузія ПГ в
Доокис Дифузія ПГ в
навколишнє серелення пронавколишнє
довище
дуктів несередовище
повного
Дифузія ОК в ЗГ
Охолоджензгоряння
ня ПГ
Нагрів Ок за рахунок випромінювання від ЗГ та
теплопровідності
Охолодження
ПГ
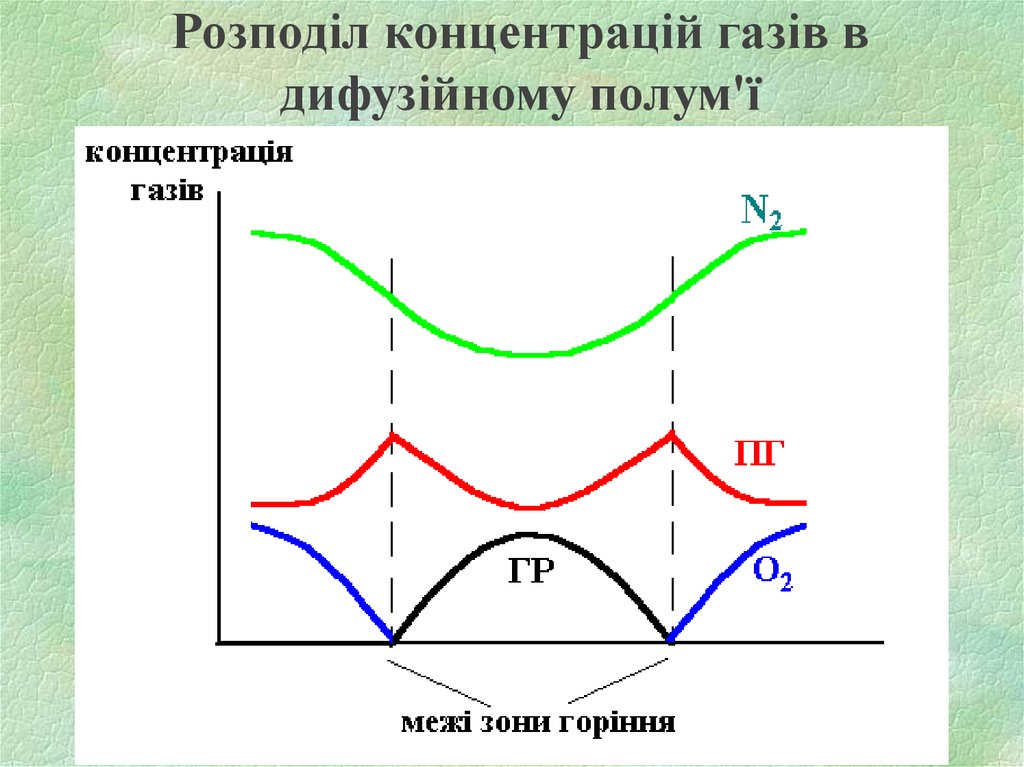
8. Розподіл концентрацій газів в дифузійному полум'ї
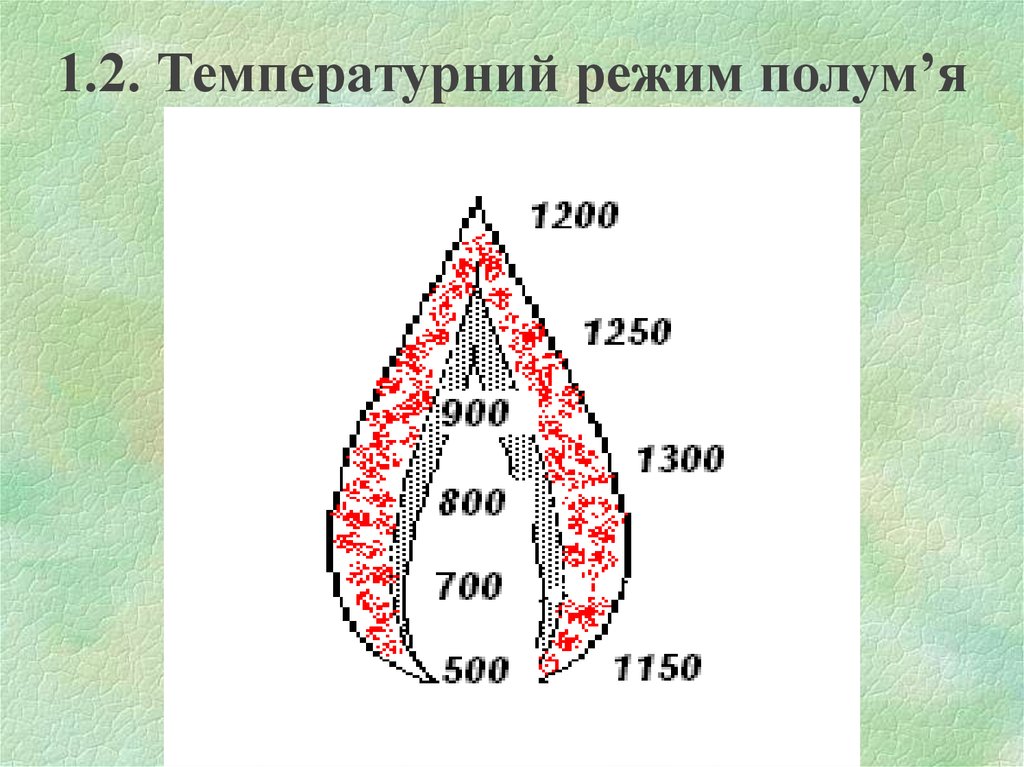
9. 1.2. Температурний режим полум’я
10.
Температура в ПЗ значно нижча, ніж в ЗГ.Температура ЗГ найбільша, але неоднакова в
різних по висоті точках полум’я. Пояснюється це
зміною складу суміші в зоні горіння та витратами
тепла на нагрів компонентів, які поступають в цю
зону.
Температура в ЗПГ падає за рахунок розбавлення
гарячих продуктів горіння холодним повітрям, яке
дифундує із навколишнього середовища.
Температура дифузійного полум’я завжди менша,
ніж кінетичного. Це пояснюється тим, що
тепловтрати із ЗГ за рахунок випромінювання у
кінетичного полум’я значно менші, ніж у
дифузійного.
11. 1.3. Колір дифузійного полум’я
Термічнерозкладання
речовин
підготовчій зоні:
СН2О2 = СО+ ОН+ Н ;
С3Н6О = СО +2С +6Н;
С8Н18 = 8С + 18Н
Окислення в зоні горіння:
СО +0,5 О2 = СО2 ;
ОН + 0,5 О2 =Н2О;
Н+ 0,5 О2 = Н2О.
в
12.
Залежність кольору дифузійного полум’явід вмісту деяких компонентів
Характер світін-
Вміст компонентів
ня полум’я
в горючій речовині, %
оксиген
карбон
безкольорове
більше 50
до 50
яскраве, не коптить
від 25 до 50
від 50 до 75
яскраве, коптить
менше 25
більше 75
13.
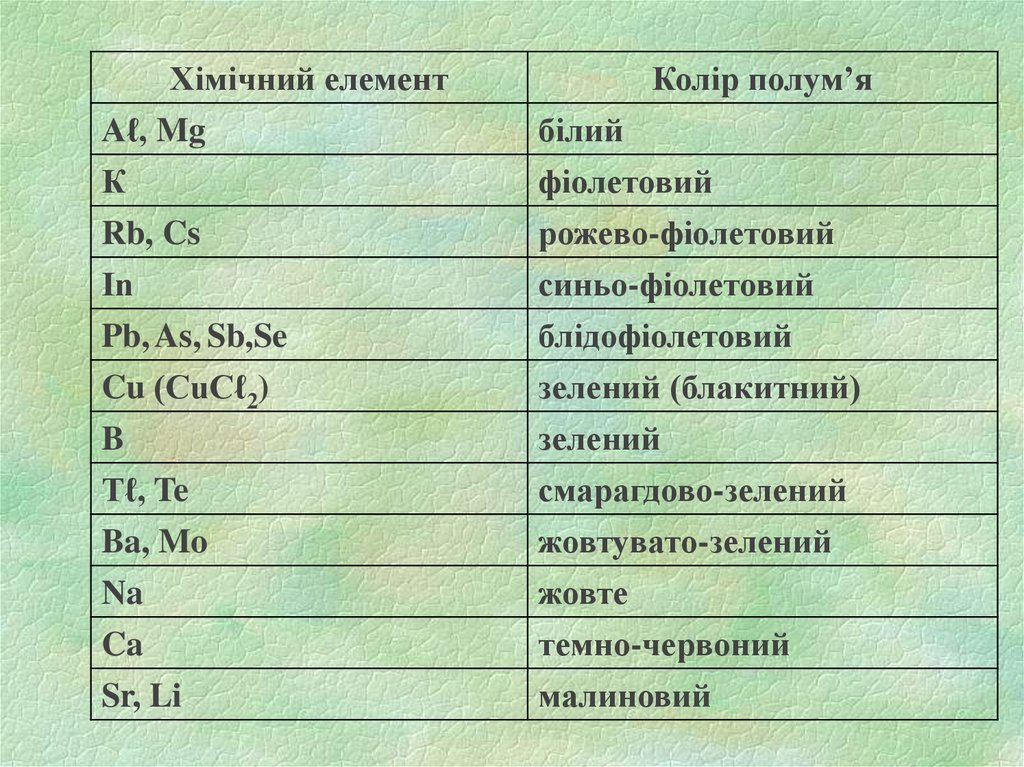
Хімічний елементAℓ, Mg
К
Rb, Cs
Іn
Pb, As, Sb,Se
Cu (CuCℓ2)
B
Tℓ, Te
Ba, Mo
Na
Ca
Sr, Li
Колір полум’я
білий
фіолетовий
рожево-фіолетовий
синьо-фіолетовий
блідофіолетовий
зелений (блакитний)
зелений
смарагдово-зелений
жовтувато-зелений
жовте
темно-червоний
малиновий
14. 2. ОСНОВНІ ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕСИ В ПОЛУМ’Ї
2.1. Ланцюгова теорія окисленняактивація
ланцюг .реакція
ГР Ок АЦП ПГ
Активні центри полум'я (АЦП) це частки
(атоми, радикали чи функціональні групи), які
мають енергію, більшу, ніж Еакт , що обумовлює
їх високу реакційну спроможність.
Ланцюговими називають процеси, у яких
перетворення вихідних речовин у продукти
реакції здійснюється шляхом регулярного
чергування декількох реакцій за участю АЦП.
15. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ
Зародження (ініціювання) ланцюгів - стадіяланцюгової реакції, в якій утворюються вільні
радикали з валентнонасичених молекул:
Н2 + О2 = Н* + НО•2
Продовження ланцюга - стадія ланцюгової
реакції, що йде із збереженням вільної
валентності (один АЦП вступає в реакцію,
внаслідок якої один АЦП утворюється):
ОН* + Н2 = Н2О + Н*
16.
Розгалуження ланцюгів - стадія ланцюговогопроцесу, у якій перетворення активних
проміжних продуктів реакції призводить до
збільшення числа вільних радикалів (один АЦП
вступає в реакцію, внаслідок якої утворюється
два чи більше АЦП):
Н* + О2 = ОН* + *О*
Обрив ланцюга - стадія ланцюгового процесу, що
призводить до зникнення вільної валентності.
Н* + ОН* + М = Н2О + М
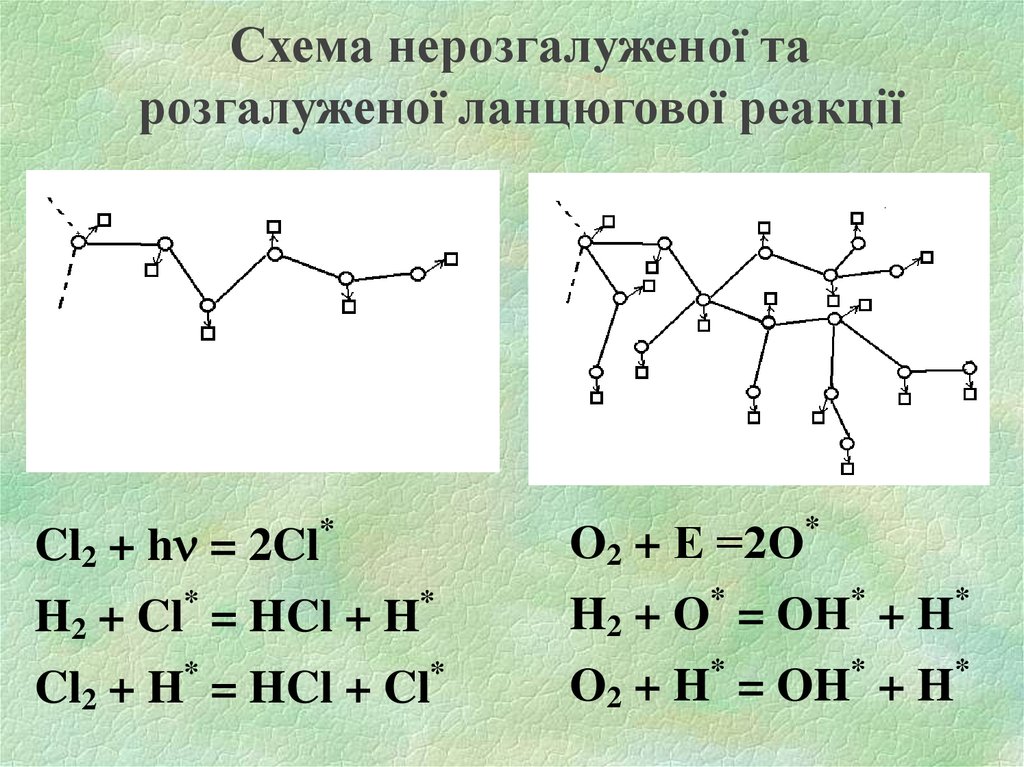
17. Схема нерозгалуженої та розгалуженої ланцюгової реакції
O2 + Е =2О*
Cl2 + h = 2Cl
*
*
H2 + Cl = HCl + H
*
*
Cl2 + H = HCl + Cl
*
*
*
H2 + O = OH + H
*
O2 + H* = OH* + H*
18.
Швидкість ланцюгової реакції:лр = о + f – g
о - швидкість початкового ініціювання (утворення)
АЦП,
f - швидкість розгалуження ланцюга;
g - швидкість обриву ланцюга.
Умовою виникнення горіння є значне
перебільшення швидкості реакції розгалуження
над швидкістю обриву ланцюга f >> g. При
цьому загальна швидкість процесу лр різко
збільшується, реакція окислення переходить у
процес горіння.
19.
2.2. Перекисна теорія окисленняГР + Ок перекис ПГ
O=O + Е – O – + – O – + 488 кДж
O=O + Е – O – O –
+ 323 кДж
R CH2 CH2 R+
R CH2 CH2 R
O
O
O O
R CH2 O O CH2 R
R-CH2 – О – О – CH2 –R
R-O-O-H
R-O-O-H + R-O-O-H
2 R –CH2 – О –
RO* +ОН*
RO* +H2O +RO2*
20. Пожежна небезпека органічних перекисей
1. Сильні окисникиС4H100 + 12Н202 = 4СО2+17Н2О - H
2. Легко займаються від малопотужних
джерел запалювання та згоряють із
великою швидкістю.
3. Чутливі до тертя, удару або нагрівання.
4. Нестабільні в процесі зберігання.
Можуть розкладатися за нормальної
температури з вибухом.
21. Завдання на самопідготовку:
1. Вивчити теоретичний матеріал1.1. Демидов, Шандыба, Щеглов:Горение и свойства горючих веществ,
стор. 48-52
1.2. Демидов, Саушев:- Горение и
свойства горючих веществ, с.- 64-70; 9598.
2. Підготуватися до практичного заняття
і лабораторної роботи.













 physics
physics chemistry
chemistry








