Similar presentations:
Вода в атмосфере
1. Вода в атмосфере
Лекция2. Вода в атмосере
В атмосфере вода содержится в трехсостояниях:
‐ газообразном (водяной пар),
‐ капельно‐жидком,
‐ твердом (кристаллы льда).
3. Водяной пар
В атмосферу непрерывно поступаетводяной пар, образующийся в
результате испарения с поверхности
воды и почвы и
вследствие транспирации (испарение
растительностью)
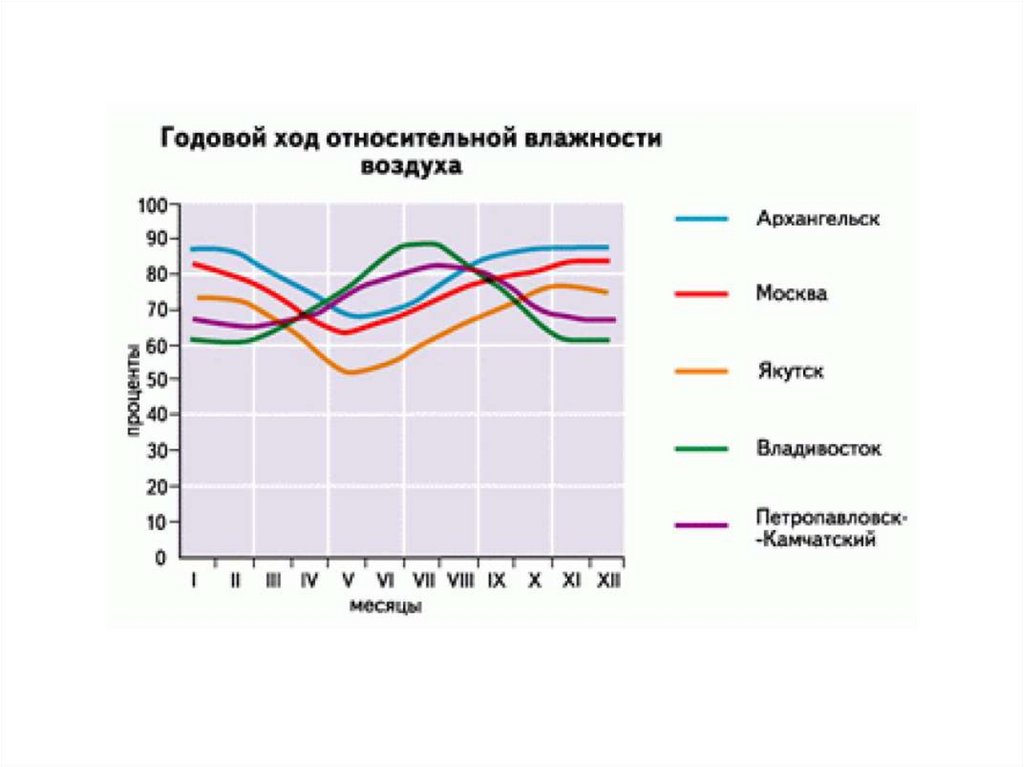
4. Влажность воздуха
Это – содержание водяного пара ввоздухе.
Содержание водяного пара в воздухе
зависит от:
‐ испарения с земной поверхности,
‐ атмосферной циркуляции,
‐ температуры воздуха.
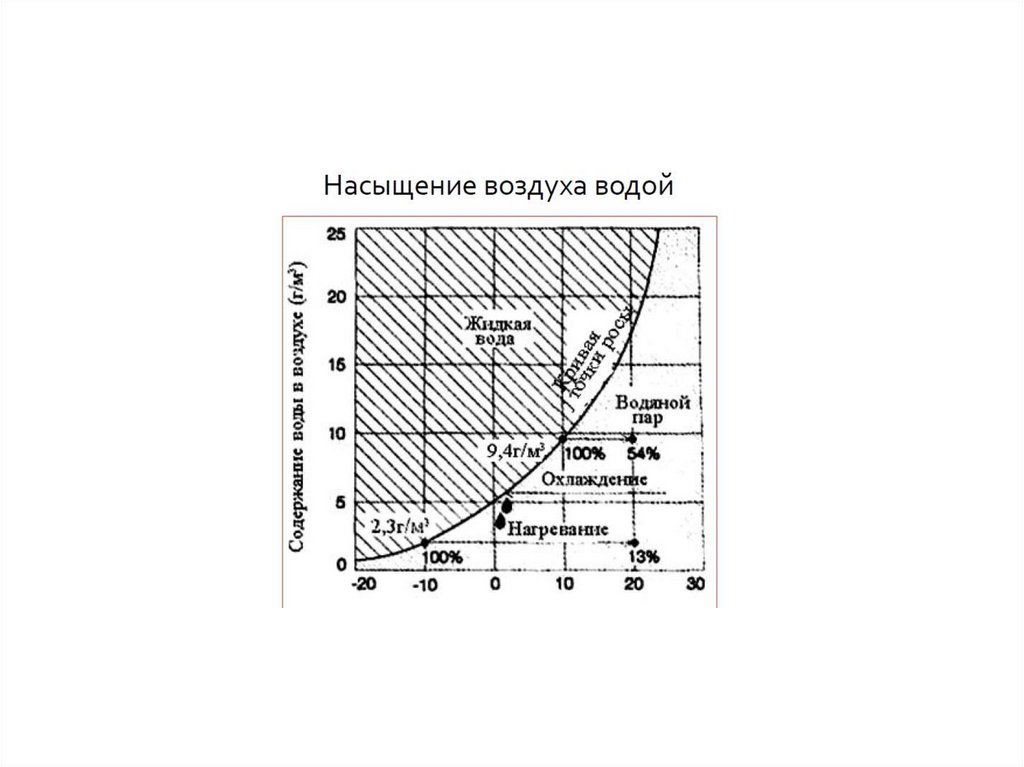
5. Влажность воздуха
Абсолютная влажность воздухахарактеризует содержание водяного
пара в воздухе (влагосодержание).
Относительная влажность –
соотношение между фактическим
влагосодержанием воздуха и
предельно возможным
(насыщенным состоянием)
6.
7.
8. Состояние насыщения
В воздухесодержится максимальное для данных
условий количество водяного пара,
воздух при этом называют насыщенным
Для каждого значения температуры
существует предельно возможное
содержание водяного пара
9.
10.
11.
ПримерСледует ли ожидать выпадения росы летним вечером, если температура
снизилась с 300 С в 12 часов дня до 150 С, если в полдень относительная
влажность воздуха составляла = 40% ?
Решение.
Для решения задачи необходимо воспользоваться справочными данными о
влажности воздуха. Равновесное парциальное давление паров воды в воздухе
равно:
при 300 С Рабс.= 0,04187 атм.;
при 150 С Рабс = 0,01683 атм.
Определим парциальное давление паров воды в полдень:
Р (Н2 О; 30 С) = Р(30 С)абс *
Р (Н2 О; 300 С) = 0,04187 * 40/100 = = 0,01675 атм.
Сравним полученное значение с равновесным парциальным давлением паров воды
при 150 С:
Р (Н2 О; 300 С) = 0,01675 атм. 0,01683 атм. = Р(150 С)абс
Следовательно, пары воды конденсироваться не будут, роса не образуется.
12.
ПримерОпределите среднее время пребывания паров воды в атмосфере, если, по оценкам
специалистов, в атмосфере находится 12900 км3 воды, а на поверхность суши и океана
выпадает в виде атмосферных осадков в среднем 577 * 1012 м3 воды в год.
Решение
Среднее время пребывания компонентов в атмосфере в случае установления
динамического равновесия можно определить по уравнению:
=А/Q
где: - время пребывания вещества в атмосфере в единицах времени, А - количество
вещества в атмосфере в единицах массы; Q - скорость поступления или вывода вещества
из атмосферы (в единицах массы на единицу времени).
Для условий задачи имеем:
= 12900 * 109/ 577*1012 ,
где 109 - коэффициент перевода куб. км в куб. м.
= 2,23 * 10-2 года = 8,16 дня
Ответ: среднее время пребывания воды в атмосфере составляет 8,16 дня
13.
ПримерОпределите соотношение скоростей процессов газофазного и
жидкофазного окисления SO2, если принять, что основной вклад в эти
процессы вносят следующие реакции:
SO2(г) + ОН (г) = HSO3(г) (1);
SO2(P-P) + H2O2(P-P) = H2SO4(Р-Р) (2).
Константы скоростей реакций окисления равны:
К1 =9 * 10-13 см3 / молекула * с; К2 = 1 * 103 л * моль/с.
Концентрация примесей в газовой фазе составляют:
[OH] = 5 * 106 см-3; [SO2] = 10-4 % (об.); [H2О2] = 10-7% (об.)
Расчеты провести для атмосферного воздуха, имеющего температуру
250С и содержащего: а) 0; б) 0,0001; в) 0,01 г свободной воды в каждом литре
воздуха. Считать, что при растворении в воде концентрация SO2 в газовой
фазе не меняется. Газы считать идеальными и подчиняющимися закону
Генри. Давление принять равным 1 атм.
14.
РешениеСкорость окисления SO2 в газовой фазе можно определить по уравнению:
V1 = K1 [OH] [SO2],
где: К1 константа скорости реакции; [OH] и [SO2] - значения концентрации
реагентов в газовой фазе.
Для определения скорости реакции переведем значение концентрации SO2
выраженное в объемных процентах, в см-3:
[SO2](см-3) = [SO2] (% об.) * Nав.* Т0 / 100 * Vм * Т1
[SO2](см-3) = 10-4 * 6, 02 * 1023 * 273 / 100 * 22,4 * 103 * 298
[SO2] = 2,46 * 1013 см-3.
Скорость газофазного окисления составит:
V1 = 9 * 10-13 * 5 * 106 * 2,46 *1013 = 1,1* 108 молекул/см3 * с.
15.
В случае отсутствия свободной (капельножидкой) воды в атмосфере (вариант а)окисление в жидкой фазе происходить не может и скорость процесса полностью
определяется скоростью газофазового окисления. В случае присутствия капельножидкой
воды в воздухе окислению в жидкой фазе предшествует растворение газов в воде.
Концентрацию соответствующих компонентов в растворе, в соответствии с законом
Генри, можно определить по уравнению:
Ci = Kг.i * Pi ,
где Ci - концентрация соответствующего компонента в растворе, Kг.i - значение
константы Генри для компонента (приводятся в справочной литературе); Pi - парциальное
давление соответствующего компонента в газовой фазе.
Окислению SO2 в жидкой фазе предшествует растворение SO2 и Н2О2 в воде.
Константы Генри для этих газов при 25С составляют (см. Приложение):
Кг (SO2) = 5,4 моль/л * атм. ,
Кг(Н2О2) = 1*105 моль/л * атм.
16.
Парциальное давление легко найти, зная объемную долю соответствующегокомпонента в газовой фазе и общее давление воздуха:
Р(SO2) = 10-4 * 10-2 * 1 = 10-6 атм.
Р (Н2О2) = 10-7 * 10-2 * 1 = 10-9атм.
Концентрации компонентов в растворе составят:
С(SO2) = 5,4 * 10-6 моль/л
С (Н2О2) = 1 * 105 * 10-9 = 10-4 моль/л.
Скорость процесса окисления SO2 в жидкой фазе можно определить по уравнению:
V2 = K2 * С(SO2) * С (Н2О2)
V2 = 1 * 103 * 5,4 * 10-6 * 10-4 = 5,4 * 10-7 моль/л * с.
Полученное значение скорости окисления SO2 в жидкой фазе показывает, что в
каждом литре раствора в секунду будет окисляться 5,4 *10-7 молей SO2 .
17.
Эту величину трудно сравнивать с полученным выше значением скоростиокисления SO2 в газовой фазе, которое показывает количество молекул,
окисляющихся в каждом кубическом сантиметре воздуха в секунду. Поэтому, зная
содержание свободной воды в воздухе и принимая плотность раствора равной
плотности воды, приведем значение скорости окисления SO2 в жидкой фазе к
сопоставимым единицам измерения:
V2 (молекул/см3 * с) = V2(моль/л * с) * n * Nав. / ρ,
где: V2 - скорость окисления SO2 в соответствующих единицах измерения; n –
содержание капельножидкой воды в воздухе; (г (воды)/см3(воздуха)); Nав. - число
Авогадро; ρ - плотность воды (г/л);
Подставив соответствующие численные значения, получим зависимость
скорости окисления от содержания влаги в воздухе:
V2 = 5,4 * 10-7 * n * 6,02 * 1023 / 1000 = 32,5 * 1013 * n
18.
В случае, когда содержание воды в воздухе составит 0,0001г/л (вариант б),соотношение скоростей окисления SO2 в газовой и жидкой фазах составит:
= V1/ V2 = 1,1 * 108 / 3,25 * 1014 * 0.0001 * 10-3 =3,4.
В случае n = 0.01 г/л (вариант в) это соотношение составит:
= V1/ V2 = 1,1 * 108 / 3,25 * 1014 * 0.01 * 10-3 =0,034
Ответ: а) при отсутствии капельножидкой воды в воздухе скорость
окисления диоксида серы определяется процессом окисления в газовой фазе;
б) при содержании влаги в воздухе, равном 0,0001 г/л, скорость окисления
SO2 в газовой фазе будет превышать скорость жидкофазного окисления в 3
раза; в) при содержании влаги в воздухе, равном 0,01 г/л, окисление будет
протекать с большей скоростью в жидкой фазе. В этом случае, соотношение
скоростей окисления SO2 в газовой и жидкой фазах будет равно 0,03.
19. Испарение и испаряемость
Испарение (фактическое испарение) –это количество водяного пара
фактически испарившегося с
поверхности
20. Скорость испарения
Это толщина слоя воды, испарившейсяза единицу времени (например, за сутки)
с данной поверхности (выражается в мм).
Зависит от:
1) температуры испаряющей
поверхности;
2) скорости ветра.
21. Испаряемость
Это возможное испарение.Это максимально возможное испарение,
не ограниченное запасами влаги
22.
23. Тропические широты
Дефицит увлажнения – небольшоефактическое испарение при высоких
температурах и испаряемости
24. Полярные широты
Переувлажнение – небольшоефактическое испарение при низких
температурах и испаряемости.
25. Конденсация в атмосфере
Конденсация — переход воды из газообразного вжидкое состояние — происходит в атмосфере в виде
образования мельчайших капелек, диаметром
порядка нескольких микронов.
Более крупные капли образуются путем слияния
мелких капелек или путем таяния ледяных
кристаллов.
Конденсация начинается тогда, когда воздух достигает
насыщения, а это чаще всего происходит в
атмосфере при понижении температуры.
26. Конденсация в атмосфере
Количество водяного пара, недостаточное для насыщения, спонижением температуры до точки росы становится
насыщающим.
При дальнейшем понижении температуры избыток водяного
пара сверх того, что нужно для насыщения, переходит в
жидкое состояние.
Возникают зародыши облачных капелек, т. е. начальные
комплексы молекул воды, которые в дальнейшем растут до
величины облачных капелек.
Если точка росы лежит значительно ниже нуля, то
первоначально возникают такие же зародыши, на которых
растут переохлажденные капельки; но затем эти
зачаточные капельки замерзают, и на них происходит
развитие ледяных кристаллов.
27.
Для воздуха, не очень далекого от насыщения,вполне достаточно подняться вверх на несколько
сотен метров, в крайнем случае на одну-две
тысячи метров, чтобы в нем началась
конденсация.
Механизмы такого подъема воздуха различны.
Воздух может подниматься в процессе
турбулентности в виде неупорядоченных вихрей.
Может подниматься в более или менее сильных
восходящих токах конвекции.
Может происходить и подъем больших количеств
воздуха на атмосферных фронтах, причем
возникают облачные системы, покрывающие
площади в сотни тысяч квадратных километров.
Подъем воздуха может происходить и в гребнях
атмосферных волн, вследствие чего также могут
возникать облака на тех высотах, где существует
волновое движение.
28.
В зависимости от механизма подъема воздухавозникают и различные виды облаков.
При образовании туманов главной причиной
охлаждения воздуха является уже не
адиабатический подъем, а отдача тепла из
воздуха к земной поверхности.
В атмосферных условиях происходит не только
образование капелек, но и сублимация —
образование кристаллов, переход водяного пара в
твердое состояние.
Твердые осадки, выпадающие из облаков, обычно
имеют хорошо выраженное кристаллическое
строение; всем известны сложные формы
снежинок — шестилучевых звездочек с
многочисленными разветвлениями.
29. Ядра конденсации
Образование капелек при конденсации в атмосферевсегда происходит на некоторых центрах,
называемых ядрами конденсации.
Если зародыш капельки возникает без ядра, он
оказывается неустойчивым;
молекулы, образовавшие комплекс, тут же разлетаются
снова.
Роль ядра конденсации заключается в том, что оно
вследствие своей гигроскопичности увеличивает
устойчивость образовавшегося зародыша капельки.
Если воздух искусственно освободить от ядер
конденсации, то конденсации не будет даже при
большом перенасыщении.
30. Ядра конденсации
Ядра конденсации в атмосфере всегдаесть, и потому сколько-нибудь
значительные перенасыщения не
наблюдаются.
Аэрозольные примеси к воздуху в
значительной части могут служить и
ядрами конденсации.
Важнейшими ядрами являются частички
растворимых гигроскопических солей,
31.
Конденсация происходит также нагигроскопических твердых частичках и
капельках, являющихся продуктами сгорания
или органического распада.
Это аэрозоли соединений азота, серы,
аммония и пр. В промышленных центрах в
атмосфере содержится особенно большое
число таких ядер конденсации. По-видимому,
роль ядер конденсации играют также
негигроскопические, но смачиваемые,
достаточно крупные частички.
Число ядер конденсации в одном кубическом
сантиметре воздуха у земной поверхности
порядка тысяч и десятков тысяч.
С высотой число ядер быстро убывает. На
высоте 3—4 км ядра конденсации считаются
только сотнями.
32. Облака
В результате конденсации внутри атмосферы возникаютскопления продуктов конденсации — капелек и
кристаллов.
Их называют облаками.
Размеры облачных элементов — капелек и кристаллов —
настолько малы, что их вес уравновешивается силой
трения еще тогда, когда они имеют очень малую скорость,
падения.
Установившаяся скорость падения капелек получается
равной лишь долям сантиметра в секунду.
Скорость падения кристаллов еще меньше. Это относится к
неподвижному воздуху.
Турбулентное движение воздуха приводит к тому, что столь
малые капельки и кристаллы вовсе не выпадают, а
длительное время остаются взвешенными в воздухе,
смещаясь то вниз, то вверх вместе с элементами
турбулентности.
33. Облака
Облака переносятся воздушными течениями.Если относительная влажность в воздухе,
содержащем облака, убывает, то облака
испаряются.
При определенных условиях часть облачных
элементов укрупняется и утяжеляется
настолько, что выпадает из облака в виде
осадков.
Таким путем вода возвращается из атмосферы
на земную поверхность.
34. Облака
Отдельные облака существуют подчас очень короткоевремя.
Например, индивидуальное существование кучевых
облаков иногда исчисляется всего 10—15 минутами.
Это значит, что недавно возникшие капельки, из
которых состоит облако, снова быстро испаряются.
Но даже когда облако наблюдается очень долго, это не
означает, что оно есть неизменное образование,
длительное время состоящее из одних и тех же
частичек.
В действительности облака находятся в процессе
постоянного новообразования и исчезновения
(испарения; часто неправильно говорят — таяния).
Одни элементы облака испаряются, другие
возникают заново.
35. Туманы
При конденсации непосредственно уземной поверхности скопления
продуктов конденсации называют
туманами. Принципиальной разницы в
строении облаков и туманов нет.
36. Микроструктура и водность облаков
По своему строению облака делятся натри класса:
1. Водяные (капельные) облака.
2. Смешанные облака.
3. Ледяные (кристаллические) облака .
37.
Водяные (капельные) облака, состоят только из капелек. Они могутсуществовать не только при положительных температурах, но и
при температурах ниже нуля; в этом случае капельки будут
находиться в переохлажденном состоянии, что в атмосферных
условиях вполне обычно.
Смешанные облака, состоящие из смеси переохлажденных капелек
и ледяных кристаллов при умеренных отрицательных
температурах.
Ледяные (кристаллические) облака, состоящие только из ледяных
кристаллов при достаточно низких температурах.
38. Размеры облачных капель
Варьируют в широких пределах, от долей микрона до сотенмикронов.
В зависимости от условий образования и от стадии развития
облако может состоять из капелек как сравнительно
однородных, так и весьма различных по размерам.
Путем конденсации радиус облачных капелек может
увеличиваться примерно до 20 mk. Однако при таянии
кристаллов и при взаимном слиянии капелек в облаках
могут получаться капли радиусом
до 100—200 mk.
При таких размерах капли начинают выпадать из облака в
виде мороси или дождя. Радиус капель дождя может
достигать и тысяч микронов, т. е. нескольких
миллиметров.
39. Кристаллы в облаках
Кристаллы разнообразны по форме и размерам. Замерзаниекапелек при низких температурах дает так называемые
полные кристаллы — ледяные шестиугольные
(гексагональные) пластинки или призмы диаметром
10—20 mk.
При дальнейшей сублимации (кристаллизации) они будут
расти и могут получать на углах разветвления (лучи);
на этих разветвлениях образуются новые, и кристаллы
превращаются в шести лучевые звезды (снежинки) или
иного вида кристаллы сложной и разнообразной
структуры.
Величина их может достигать нескольких миллиметров в
диаметре.
40. Водность облаков
Это содержание в них воды в жидком или твердом виде.Количество капелек в единице объема облачного воздуха
сравнительно невелико: от сотен на кубический сантиметр в
нижней тропосфере до единиц на кубический сантиметр в
высоких слоях тропосферы.
Содержание кристаллов в облаках еще меньше — порядка 0,1 на
один кубический сантиметр.
В водяных облаках на каждый кубический метр облачного воздуха
приходится от 0,2 до 5 г воды.
В кристаллических облаках водность значительно меньше — сотые
и тысячные доли грамма на каждый кубический метр.
Это связано с тем, что, хотя количество капелек или кристаллов в
единице объема облачного воздуха значительно, элементы эти
так малы, что содержание воды в жидком виде в облаках
невелико.
41.
Проверь себяВопросы к лекции
1.
От чего зависит влажность атмосферного воздуха?
2.
Как определяют влажность воздуха?
3.
Чем отличаются понятия испарение и испаряемость?
4.
Когда и почему происходит процесс конденсации в
атмосфере?
5. Что является ядрами конденсации в атмосфере и какова
их роль в образовании облаков?
6.
Что такое туманы и чем они отличаются от облаков?
7.
Какое минимальное время могут существовать кучевые
облака?
8.
Что такое смешанные облака?
9.
Какой размер имеют кристаллы льда в облаках?
10.
Что такое водность облаков? В каких облаках водность
больше в водяных или в кристалических?







































 geography
geography








