Similar presentations:
Закон сохранения массы веществ
1. Закон сохранения массы веществ
2. Изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
3. Проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы
Проделал множество опытов по прокаливаниюметаллов в запаянных ретортах и всякий раз масса
окалины оказывалась больше массы
прокаливаемого металла. Бойль заключил, что
материя огня проходит через стекло и соединяется
с металлом.
Вот что записал учёный после одного из своих опытов в
1673 году:
«После двух часов нагревания был открыт запаянный
кончик реторты, причём в неё ворвался с шумом
наружный воздух. По нашему наблюдению при этой
операции была прибыль в весе на 8 гранов…»
4. Сформулировал закон в 1748 г. Ломоносов предположил «Все перемены в натуре случающиеся такого суть состояния, что сколько чего
у одного телаотнимется, столько же присовокупится к другому.
Так, ежели где убудет материи, то умножится в
другом месте; сколько часов положит кто на
бдение, столько же сну отнимет...» (из письма
Леонарду Эйлеру).
Экспериментально доказал в 1756 г.
Повторил опыты Р. Бойля по прокаливаю
металлов. Но он проводил опыты в реторте,
которая была герметически запаяна.
Взвешивание реторты до и после реакции
показало - масса её не изменилась.
5. Независимо от Ломоносова сформулировал закон сохранения массы веществ в 1789 г.
6. ФОРМУЛИРОВКА ЗАКОНА
Масса веществ, вступивших вхимическую реакцию, равна
массе образовавшихся веществ
7. ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ
СосудЛандольта
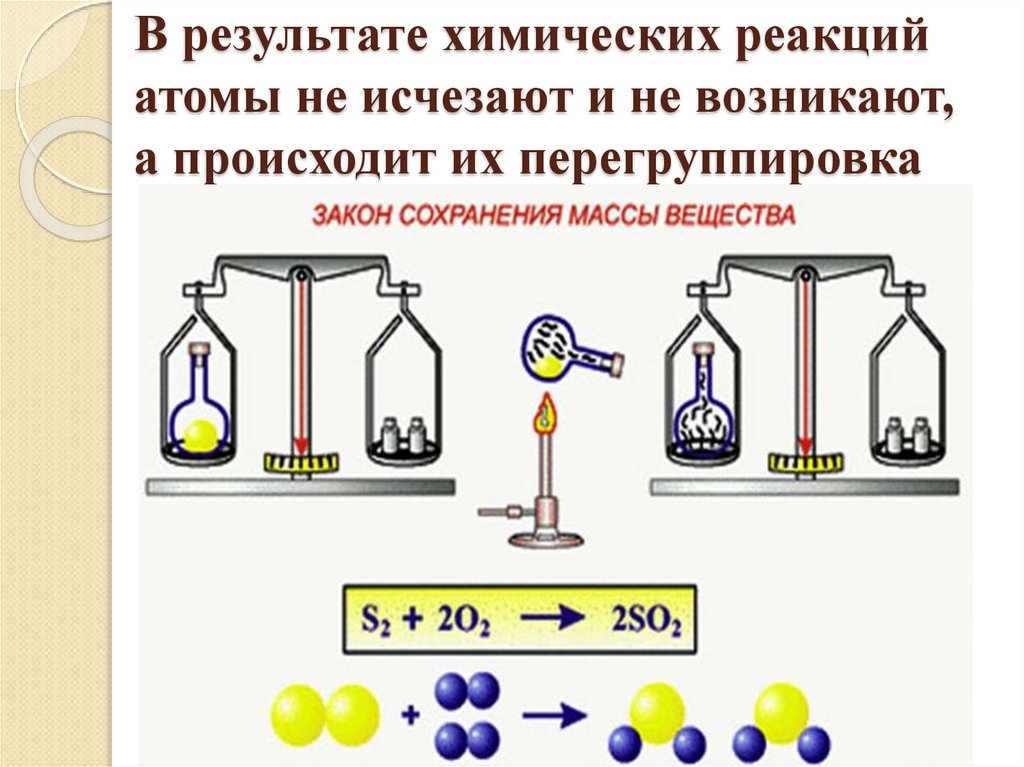
8. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка
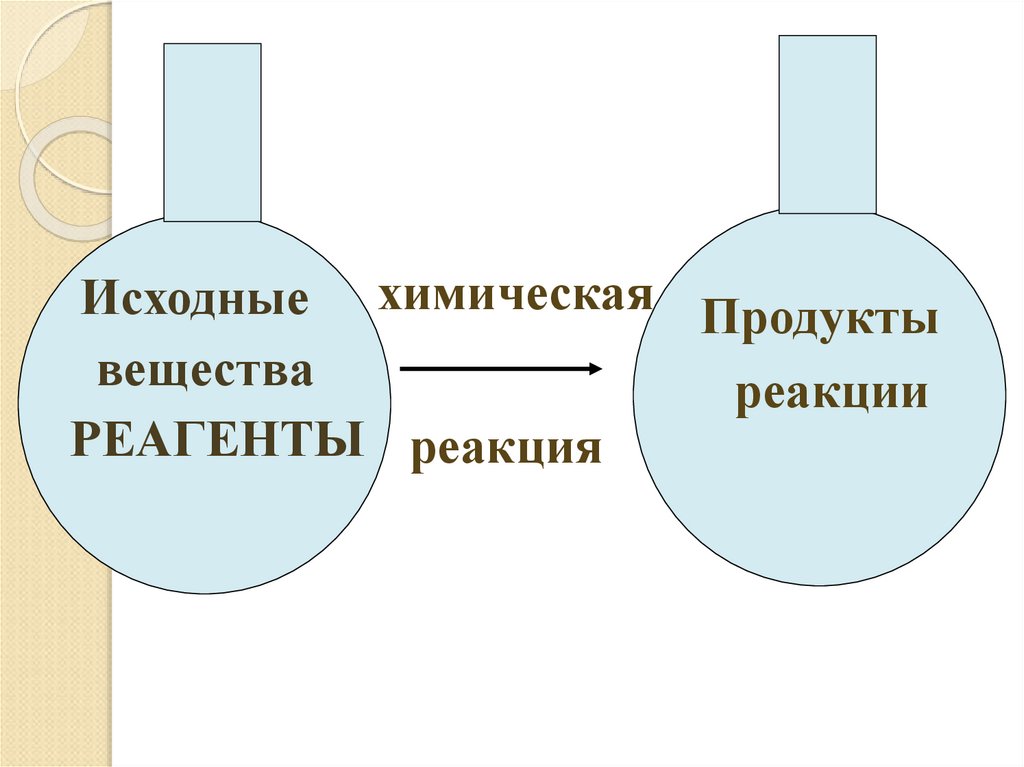
9.
Исходные химическая Продуктывещества
реакции
РЕАГЕНТЫ реакция
10. Значение открытия закона сохранения массы веществ
Способствовало развитиюхимии как
науки
На основе этого закона составляют
уравнения химических реакций,
проводят практические расчеты
11. По закону сохранения масс 7 + 4 = 11 Надо получить 44 кг, т.е. в 4 раза больше. Значит исходных веществ надо тоже в 4 раза
Сколько потребуется исходных веществ, чтобыполучить сульфид железа массой 44 кг, если
железо и сера вступают в реакцию в
соотношении7 : 4?
По закону сохранения масс
7 + 4 = 11
Надо получить 44 кг,
т.е. в 4 раза больше.
Значит исходных веществ надо тоже в 4 раза больше
7 * 4 =28
4 * 4 =16
Ответ: 28кг и 16 кг.
12.
Решить задачи1.
Медь соединяется с серой в массовом
отношении 2 : 1. Сколько меди и серы
потребуется для приготовления 21 г
сульфида меди (II)?
2.
При разложении 4,34 г оксида ртути
(II) образовалось 4,02 г ртути. Чему
равна масса выделившегося при этом
кислорода?
13. Домашнее задание
ДОМАШНЕЕ ЗАДАНИЕ§ 19, выполнить задания на с. 65.











 chemistry
chemistry








