Similar presentations:
Особенности проведения изотопного анализа спектральными методами
1. ОСОБЕННОСТИ ПРОВЕДЕНИЯ ИЗОТОПНОГО АНАЛИЗА СПЕКТРАЛЬНЫМИ МЕТОДАМИ
В основе спектральных методов анализа лежит использованиеспособности атомов или молекул поглощать и испускать
электромагнитное излучение.
Характеристики электромагнитного излучения:
Длина волны [мкм, нм, м, Å].
Частота [с-1]: с , где с=3 108 м/с – скорость света в
вакууме;
1
~
-1
-1
-1
Волновое число [м , нм , см ]:
Энергия электромагнитного излучения:
E h
hc
где h=6,63 10-34 Дж с – постоянная Планка.
● Спектры классифицируются:
По природе вещества, взаимодействующего с
электромагнитным излучением – на атомные и молекулярные.
По характеру спектров – на абсорбционные и эмиссионные.
2. Атомные эмиссионные спектры
Простейший случай данного метода – это атомный эмиссионныйанализ водорода. Принимая планетарную модель строения атома,
n=1 n=2 n=3
атом водорода можно представить как:
Е
e
1s
n=4
Еион=13,5 эВ
n=2
1
10,2 эВ
3s
Серия Лаймана:
n=3
2
2s
1
hc
121,6нм
En 2 En1
Дальняя УФ область
n=1
Серия
Лаймана
Серия
Бальмера
Спектр водорода
Серия Бальмера:
hc
2
656,2нм
En 2 En1
Видимая область
3.
Длины волн имеют дискретный характер и подчиняются распределениюБальмера-Ридберга :
1
1
1
~
R 2 2
nj
ni
nj , ni –
уровень, с которого и на который
переходит электрон соответственно;
R – постоянная Ридберга.
Постоянная Ридберга для бесконечно тяжелого ядра:
R
2 2 e 4 me
h3
е – заряд электрона,
mе – масса покоя электрона,
h=6,625 10-34 Дж с – постоянная Планка.
Изотопный анализ методом атомной эмиссионной спектроскопии связан с
существованием двух видов изотопических эффектов:
изотопическое смещение, обусловленное различием объема ядер изотопов
( наблюдается главным образом в спектрах тяжелых элементов (М> 80) и
увеличивается с ростом массы ядра;
изотопическое смещение, обусловленное различием масс изотопов.
4.
Массовый изотопический эффект присущ любой спектральной линии атомов,но наиболее выражен для легких элементов.
Модель Бора о совместном движении атомного ядра и электронной оболочки
относительно неподвижного общего центра тяжести всей системы:
М
mе
Центр
масс
Система характеризуется приведенной
массой :
me M
me
1
1
1
me M 1 me
m M
e
M
Подставим в уравнение постоянной Ридберга
2 2 e 4 2 2 e 4 me
R
R
m
m
h3
h3 1 e 1 e
M
M
Изменение постоянной Ридберга
с изменением массы:
вместо me :
Уравнение Бальмера-Ридберга
me
1
me
M H m p 1840
R = 1,0973731 10-7 м-1;
RН = 1,0967758 10-7 м-1;
RНе = 1,0972227 10-7 м-1.
5.
Относительное изотопическое смещение линий водорода :~
me
~
mp
1
1
M1 M 2
Изотопическое смещение для пары протий-дейтерий равно:
для Н -линии серии Бальмера
H D
O
1 1 1
1
656,2
0,5 0,178(нм) 1,78 A
1840 1 2
1840
для Н -линии серии Лаймана
H D
O
1 1 1
1
121,6
0,5 0,033(нм) 0,33 A
1840 1 2
1840
Для изотопного анализа водорода используют серию Бальмера.
6.
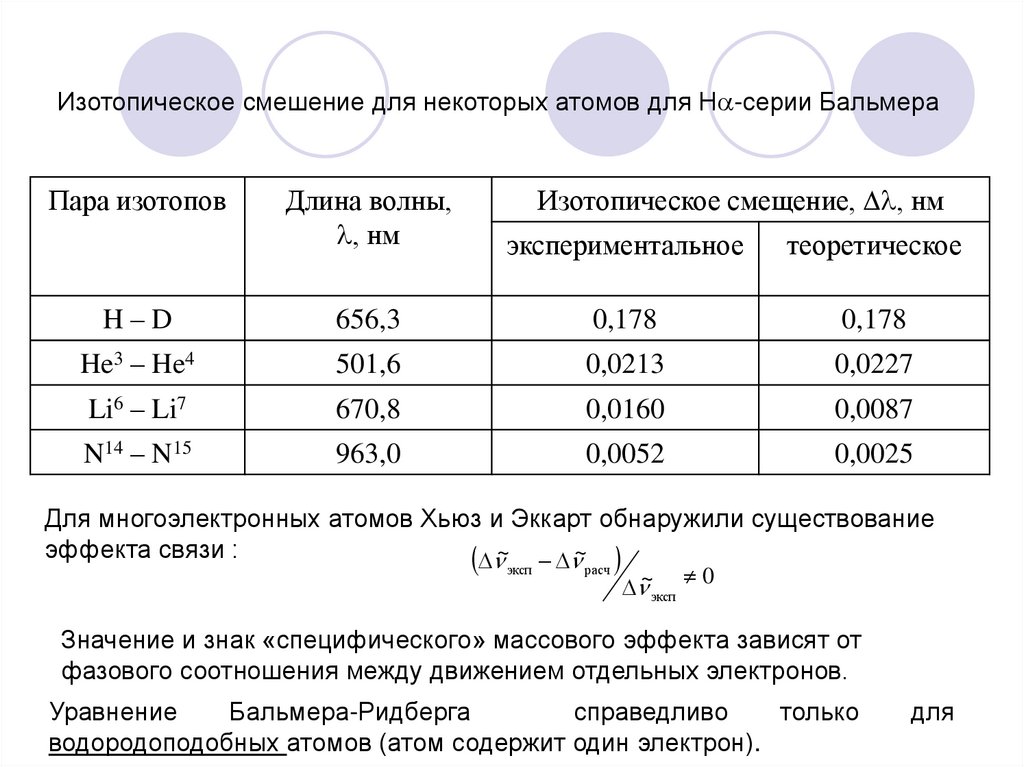
Изотопическое смешение для некоторых атомов для Н -серии БальмераПара изотопов
Изотопическое смещение, , нм
Длина волны,
, нм
экспериментальное
теоретическое
H–D
656,3
0,178
0,178
He3 – He4
501,6
0,0213
0,0227
Li6 – Li7
670,8
0,0160
0,0087
N14 – N15
963,0
0,0052
0,0025
Для многоэлектронных атомов Хьюз и Эккарт обнаружили существование
эффекта связи :
~эксп ~расч ~ 0
эксп
Значение и знак «специфического» массового эффекта зависят от
фазового соотношения между движением отдельных электронов.
Уравнение
Бальмера-Ридберга
справедливо
только
водородоподобных атомов (атом содержит один электрон).
для
7.
Разрешение спектральных линийНеобходимая разрешающая способность в спектральных методах
рассчитывается по формуле:
P
Разрешающая способность приборов с дифракционной решеткой:
Pпр m N
где m – порядок спектра,
N – количество штрихов, освещающихся анализируемым светом
Пример:
ДСФ-8-3: дифракционная решетка 1800 штр./мм длиной 100 мм. Если m=1
Pпр 1 1800 100 1,8 105
Для пары Н-D:
P
656.2
3.68 103
0.178
Для пары 14N -15N:
P
963,0
1,85 105
0,0052
8.
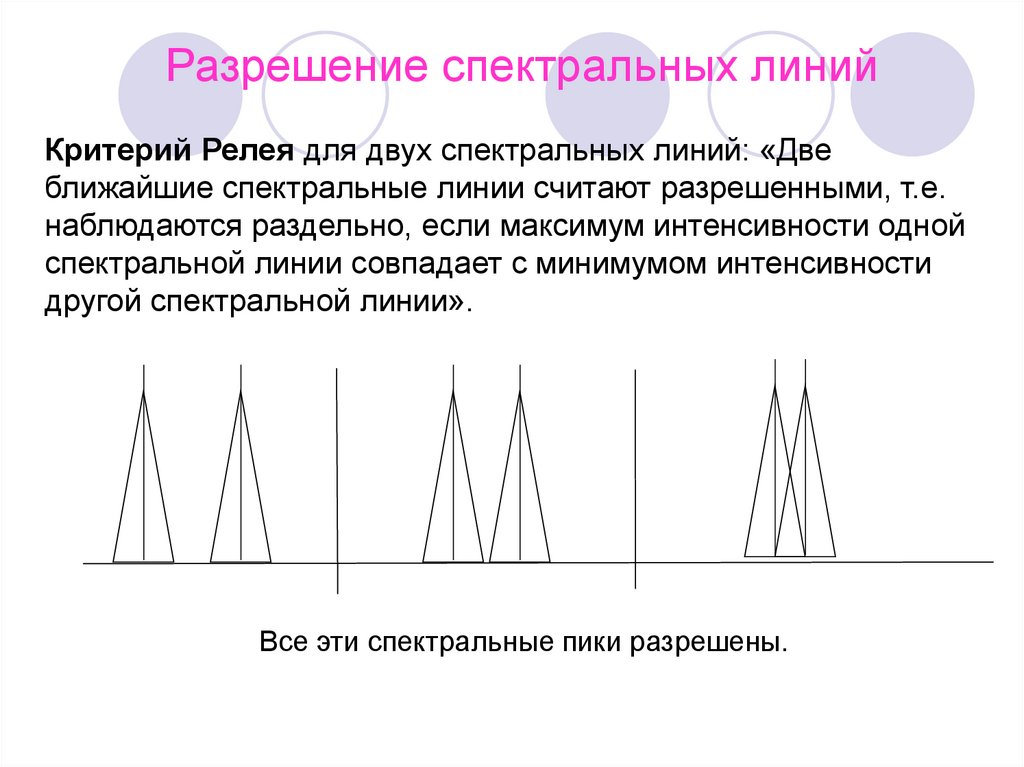
Разрешение спектральных линийКритерий Релея для двух спектральных линий: «Две
ближайшие спектральные линии считают разрешенными, т.е.
наблюдаются раздельно, если максимум интенсивности одной
спектральной линии совпадает с минимумом интенсивности
другой спектральной линии».
Все эти спектральные пики разрешены.
9. Применение атомной спектроскопии для анализа ОЧВ
С помощью атомной эмиссионной спектроскопии можноопределять до 70 элементов.
При элементном анализе уравнением Бальмера-Ридберга
пользоваться нельзя, поэтому характеристики спектральных
линий получают экспериментально.
Простые спектры: щелочные металлы, Cu, Ag, Be,
щелочноземельные металлы, Zn, Al, As, Ga и др.
Сложные спектры: Ti, Zr, Hf, Cr, Mo, Mn, Re, Fe, Co, Ni и др.)
Неметаллы: B, C, S, Se, P, I, Ge, Si.
10. Атомный абсорбционный анализ
В этом методе свет от дискретного источника излучения,проходя через атомный пар вещества, поглощается в
соответствии с законом Ламберта-Бугера –Бера и по
степени ослабления излучения определяют концентрацию
примеси (анализ веществ ОСЧ).
Поглощение света селективно для каждого элемента и
определяется расположением атомных уровней. Для
каждого источника света метод является одноэлементным.
Метод
атомно-абсорбционной
спектроскопии
применяется также для анализа изотопов таких элементов,
как, например, Li, B, Hg, U и др.
11.
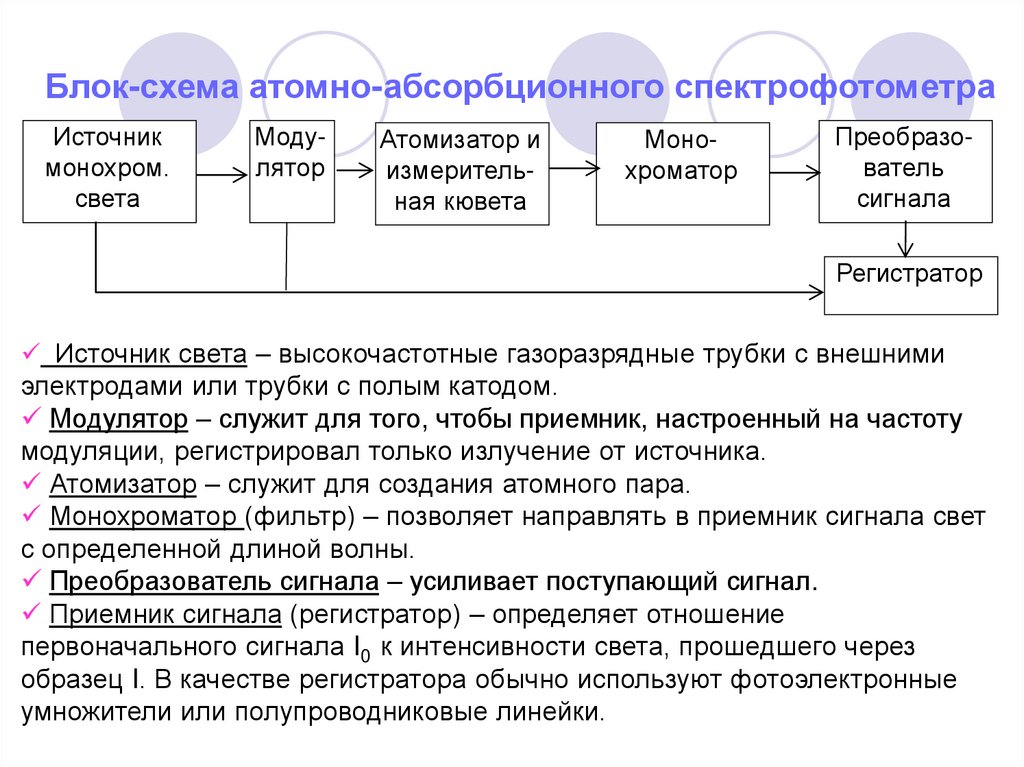
Блок-схема атомно-абсорбционного спектрофотометраИсточник
монохром.
света
Модулятор
Атомизатор и
измерительная кювета
Монохроматор
Преобразователь
сигнала
Регистратор
Источник света – высокочастотные газоразрядные трубки с внешними
электродами или трубки с полым катодом.
Модулятор – служит для того, чтобы приемник, настроенный на частоту
модуляции, регистрировал только излучение от источника.
Атомизатор – служит для создания атомного пара.
Монохроматор (фильтр) – позволяет направлять в приемник сигнала свет
с определенной длиной волны.
Преобразователь сигнала – усиливает поступающий сигнал.
Приемник сигнала (регистратор) – определяет отношение
первоначального сигнала I0 к интенсивности света, прошедшего через
образец I. В качестве регистратора обычно используют фотоэлектронные
умножители или полупроводниковые линейки.
12.
Преимущество атомно-абсорбционного метода для изотопногоанализа состоит в том, что не нужен спектральный прибор с высокой
разрешающей способностью, как в случае атомно-эмиссионного
анализа.
Для определения концентрации изотопа необходимо измерить
поглощение света в области резонансной линии для смеси изотопов,
находящихся в атомарном состоянии.
Метод применяют, когда изотопическое смещение в резонансной
линии больше ширины линии, излучаемой источником света и
ширины абсорбционной линии. При создании поглощающего слоя с
помощью разряда в полом катоде ширина линий находится в
пределах 0,01 – 0,04 Å.
Изотопный анализ этим методом возможен для H, He, Li, B, Hg,
Th и U.
13. Молекулярная спектроскопия
Молекулярные спектры не применяются для анализа веществОСЧ.
Методы молекулярного спектрального анализа широко
используются для качественного анализа, а также при
изотопном содержании дейтерия в воде и N15 в азоте.
Изотопические эффекты в молекулярных спектрах
обусловлены зависимостью энергии вращения и колебания от
массы атомов, входящих в их состав.
14.
Энергетическая диаграмма двухатомной молекулыМолекула колеблется в пределах потенциальной ямы в диапазоне от rmin
до rmax. На последнем уровне молекула диссоциирует на атомы.
Е
Еполн=Еэл+Екол+Евр.
А–В
Электронновозбужденное
Едис’ состояние
v’=1
v’=0
Для молекулы водорода:
Еэл : Екол : Евр 1 :
АВ А + В
2
1
Едис
v=1
Основное
состояние
v=0
rmin r*
rmax
(r*)’
v=1, J=0
rA-B
Еэл=32,1 эВ, Екол=0,27 эВ; Евр=0,025 эВ.
Еэл определяет положение линии спектра
в шкале длин волн, а Екол и Евр – тонкую
и сверхтонкую структуру полос.
1. Колебательно-вращательные – ИК область
2. Электронно-колебательные спектры - УФ область
3. Вращательные - микроволновая область .
J=3
J=2
Колебательные спектры:
3
J=1
v=0, J=0
me
m
: e
M H2 M H2
Вращательные спектры:
~c
1
2πс
k
I r2
15. Вращательные спектры
Изотопическое смещение обусловлено тем, что вращательныймомент молекулы зависит от ее приведенной массы:
I r2
Для двух изотопозамещенных молекул с приведенными массами 1
и 2, используя модель
жесткого ротатора, изотопическое
смещение равно:
1
h
~12 ( J ' ) 2 J '
2
8 2 cr 2 2 1
где - ~12 разность волновых чисел; J’ – вращательное квантовое
число; h – постоянная Планка, с – скорость света в вакууме;
r – межатомное расстояние
Для двухатомной молекулы с массами атомов М1 и М2 приведенная
масса рассчитывается по формуле:
M1 M 2
M1 M 2
Изотопическое смещение во вращательных спектрах линейно
возрастает с увеличением вращательного квантового числа J’.
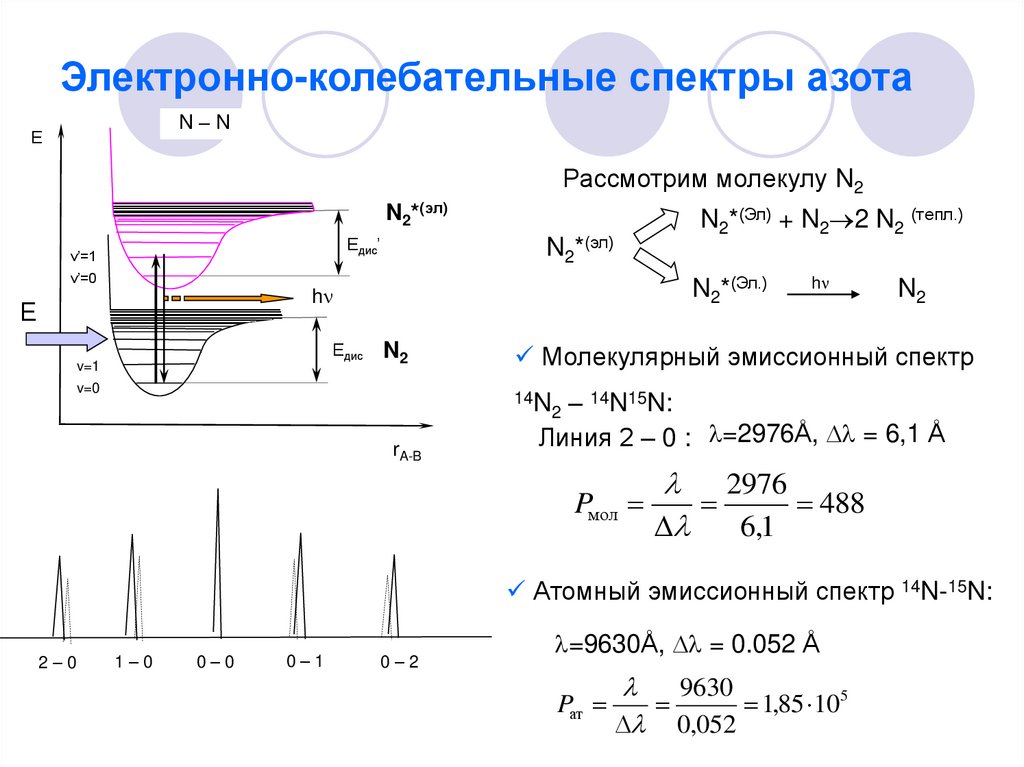
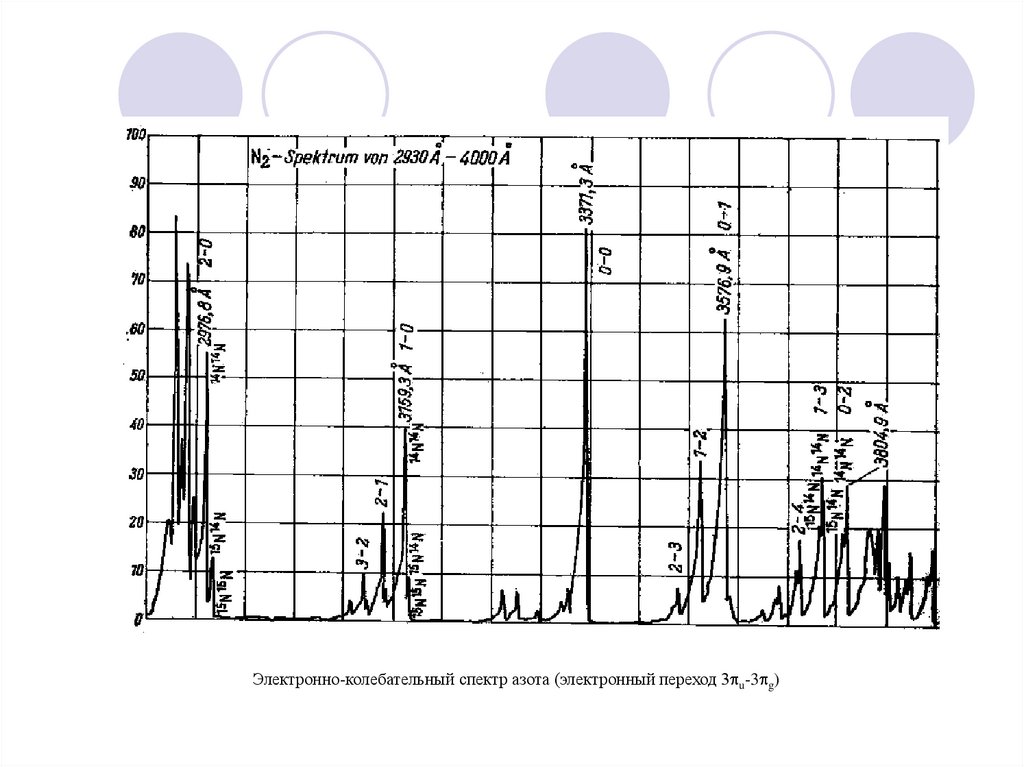
16. Электронно-колебательные спектры азота
N–NЕ
Рассмотрим молекулу N2
N2*(Эл) + N2 2 N2 (тепл.)
N2*(эл)
Едис’
v’=1
N2*(эл)
v’=0
N2*(Эл.)
h
Е
Едис
v=1
N2
v=0
h
N2
Молекулярный эмиссионный спектр
– 14N15N:
Линия 2 – 0 : =2976Å, = 6,1 Å
14N
2
rA-B
Pмол
2976
488
6,1
Атомный эмиссионный спектр 14N-15N:
2–0
1–0
0–0
0–1
0–2
=9630Å, = 0.052 Å
Pат
9630
1,85 105
0,052
17.
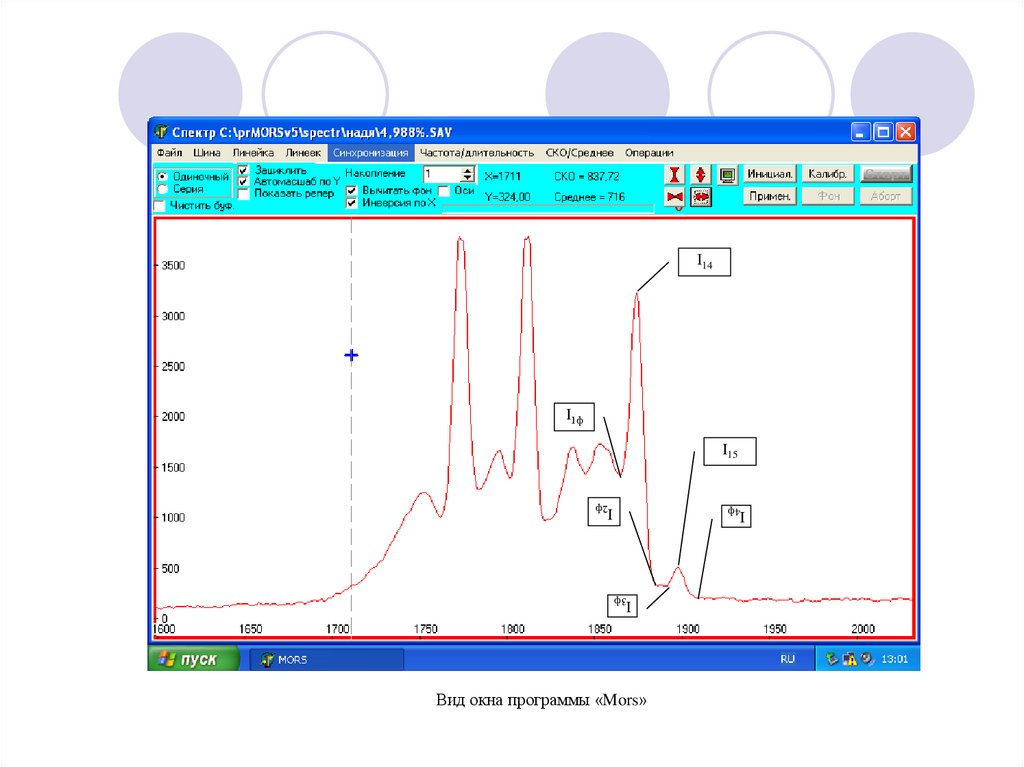
Электронно-колебательный спектр азота (электронный переход 3 u-3 g)18.
I14I1ф
I15
I2ф
I4ф
I3ф
Вид окна программы «Mors»
19. Колебательная спектроскопия для определения изотопного состава воды
Колебательная спектроскопия ИК-спектроскопия.ИК-спектроскопия
варианте.
используется
обычно
в
абсорбционном
Молекулярная специфичность - за исключением оптических
изомеров не существует двух химических веществ, обладающих
одинаковыми спектрами.
Предел обнаружения 4 10-6 г.
При анализе ОЧВ ИК-спектроскопия может использоваться только
в сочетании с хроматографией, когда ИК-прибор выполняет роль
детектора.
ИК-спектроскопия - стандартный метод определения содержания
дейтерия (ТУ).
20.
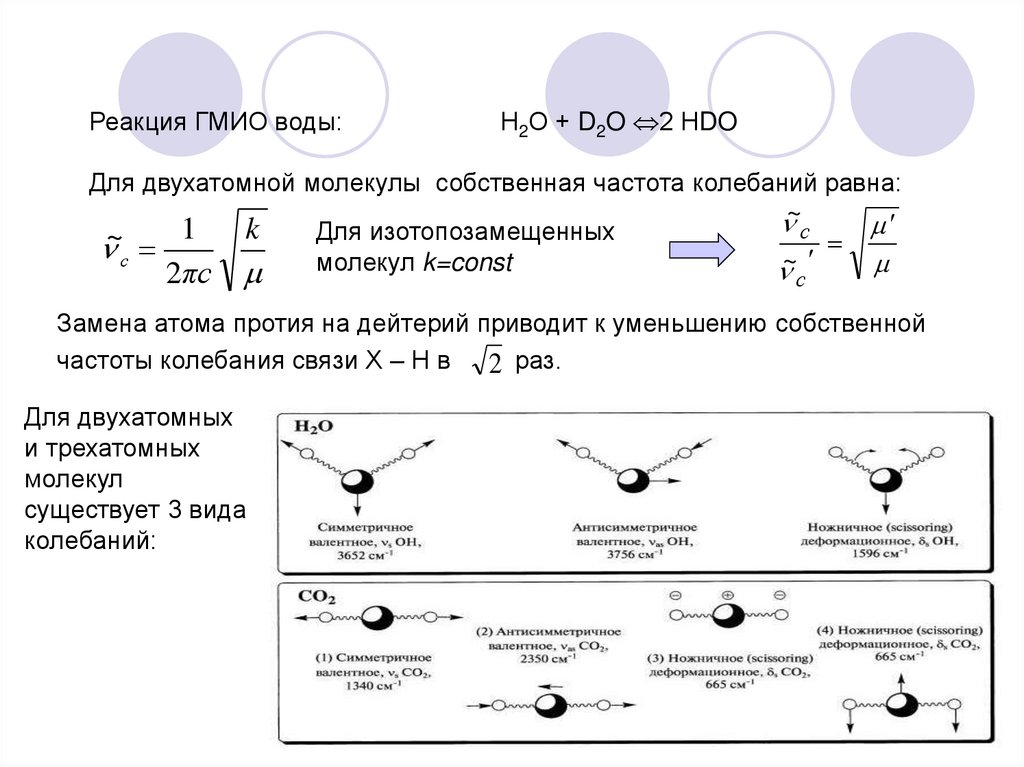
Реакция ГМИО воды:Н2О + D2O 2 НDO
Для двухатомной молекулы собственная частота колебаний равна:
~
с
1
k
Для
изотопозамещенных
~
с
~
молекул k=const
2πс
с
Замена атома протия на дейтерий приводит к уменьшению собственной
частоты колебания связи Х – Н в 2 раз.
Для двухатомных
и трехатомных
молекул
существует 3 вида
колебаний:
21.
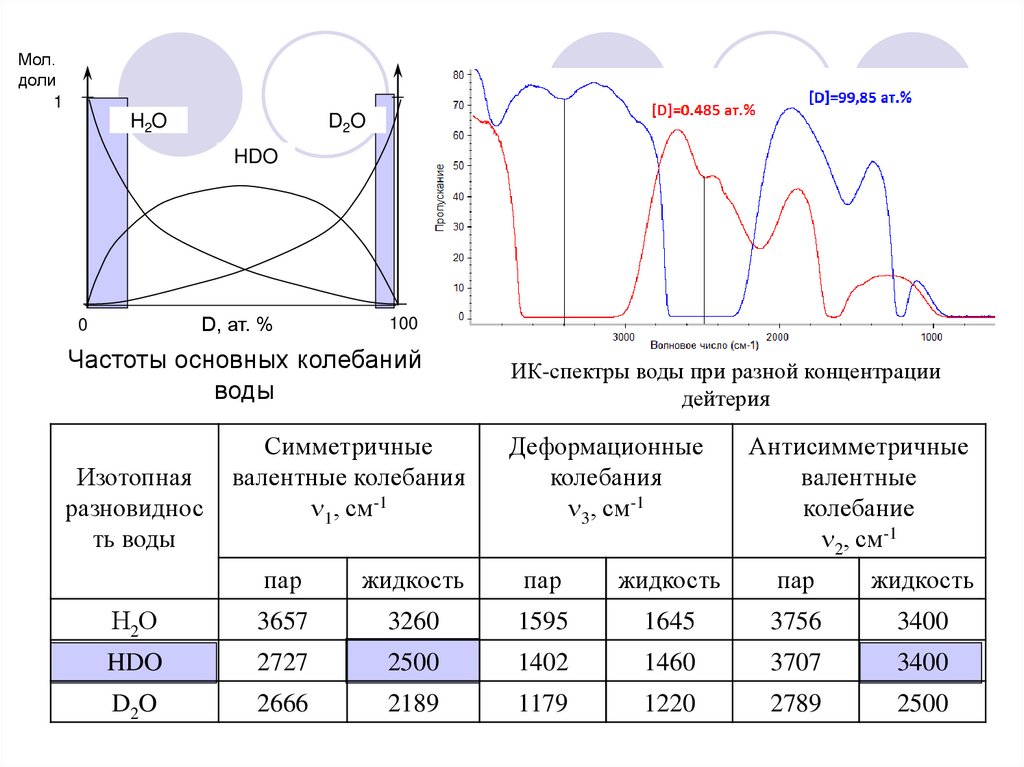
Мол.доли
1
H2O
D2O
HDO
D, ат. %
0
100
Частоты основных колебаний
воды
Изотопная
разновиднос
ть воды
Симметричные
валентные колебания
1, см-1
ИК-спектры воды при разной концентрации
дейтерия
Деформационные
колебания
3, см-1
Антисимметричные
валентные
колебание
2, см-1
пар
жидкость
пар
жидкость
пар
жидкость
Н2О
3657
3260
1595
1645
3756
3400
HDO
2727
2500
1402
1460
3707
3400
D2O
2666
2189
1179
1220
2789
2500
22. Область малых концентраций дейтерия (до 5 ат.%).
[D2O] 0.1= 2500 см-1
Аналитическая форма – HDO.
Для определения концентрации снимают калибровочную зависимость
в координатах:
A2500 f ([ D])
Вследствие малой точности, уравнение
Ламберта-Бугера-Бера не используют.
A lg
I 0,
I
c l
Область высоких концентраций дейтерия (> 98 ат.%).
[H2O] 0
Аналитическая форма – HDO.
3= 3400 см-1
Для определения концентрации дейтерия снимают калибровочную
зависимость в координатах: A
f ([ D]) в узкой области [D]
3400
Содержание дейтерия в
тяжелой воде:
Реакторная вода - 99,85 ат.%
Исследования - 99,99 ат.%
Улавливание нейтрино - 99,995 ат.%
23. Область средних концентраций (5 – 15 ат. %)
Присутствуют 3 изотопные формы: H2O, HDO, D2O.Снимают спектр при 1= 2500 см-1 (поглощение молекулами HDO и D2O).
Снимают спектр при 3= 3400 см-1 (поглощение молекулами HDO и Н2O).
Решают систему уравнений:
A2500 D2O cD2O l HDO cHDO l
A3400 H 2O cH 2O l HDO cHDO l
c H2O c HDO c D2O 1
Вместо уравнения материального баланса
можно использовать уравнение константы
равновесия:
2
c HDO
K
c H 2 O c D2 O
Рассчитывают мольные, а затем – атомную концентрацию дейтерия.
24. Определение дейтерия в широкой области концентраций на ИК-Фурье спектрометре Thermo Scientific Nicolet iS10
Разборная кюветаНеразборная кювета
Характеристики:
Стандартный спектральный диапазон, см-1
Разрешение, см-1
Линейность ординаты (ASTM E1421)
Точность по волновому числу, см-1
СКО случайной составляющей погрешности
установки волновых чисел, см-1
- 7800-350;
- 0,4;
- 0,1% T;
- 0,01;
0,01
25.
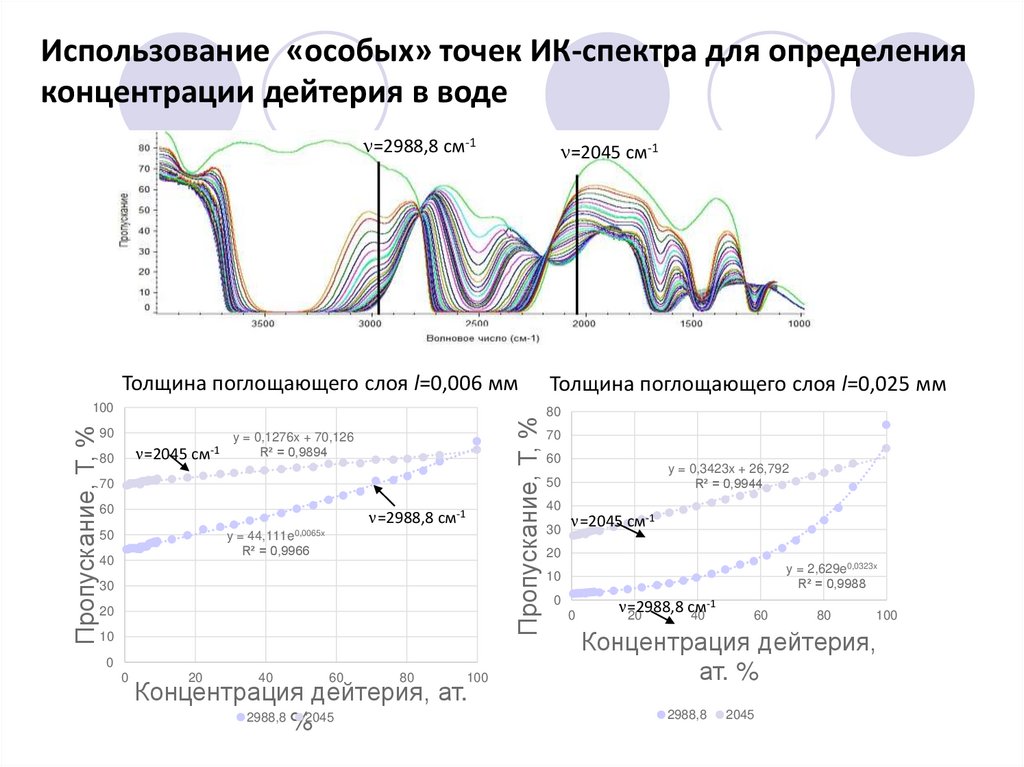
Использование «особых» точек ИК-спектра для определенияконцентрации дейтерия в воде
=2988,8 см-1
=2045 см-1
Толщина поглощающего слоя l=0,006 мм
90
=2045 см-1
80
Пропускание, Т, %
Пропускание, Т, %
100
y = 0,1276x + 70,126
R² = 0,9894
70
60
=2988,8 см-1
50
y = 44,111e0,0065x
R² = 0,9966
40
30
20
10
0
0
20
40
60
80
100
Концентрация дейтерия, ат.
2988,8 2045
%
Толщина поглощающего слоя l=0,025 мм
80
70
60
y = 0,3423x + 26,792
R² = 0,9944
50
40
30
=2045 см-1
20
y = 2,629e0,0323x
R² = 0,9988
10
0
0
-1
=2988,8
см
20
40
60
80
100
Концентрация дейтерия,
ат. %
2988,8
2045
26.
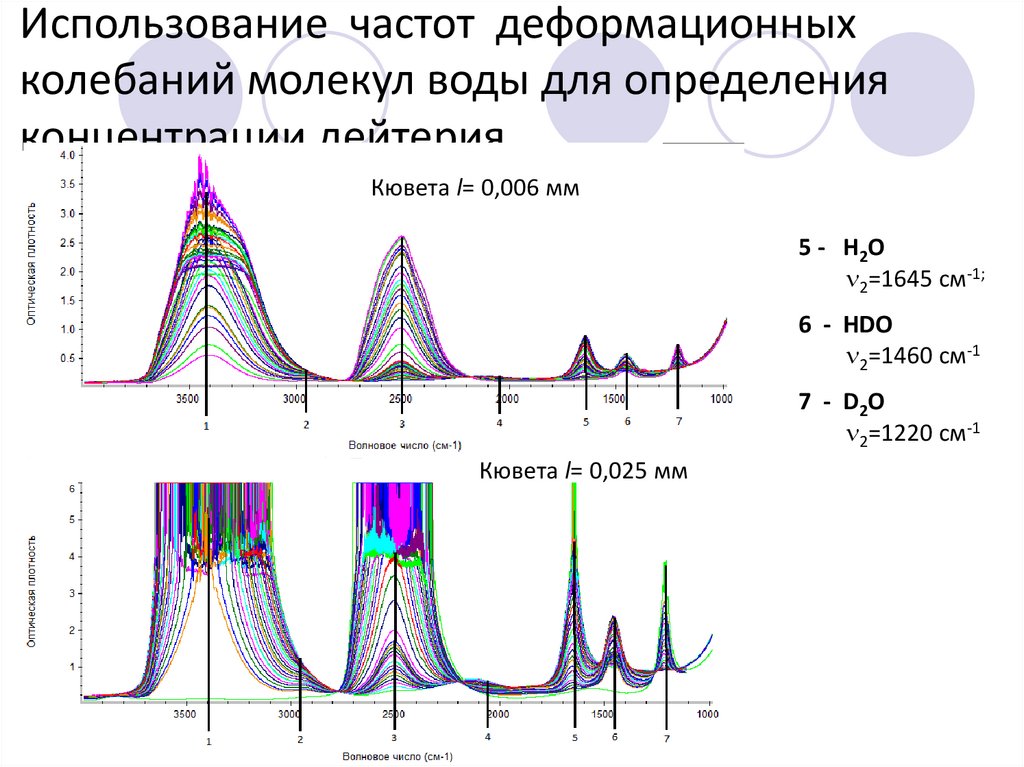
Использование частот деформационныхколебаний молекул воды для определения
концентрации дейтерия
Кювета l= 0,006 мм
5 - Н2О
2=1645 см-1;
6 - HDO
2=1460 см-1
7 - D 2O
2=1220 см-1
Кювета l= 0,025 мм
27. Зависимость оптической плотности для линий поглощения, соответствующих деформационным колебаниям молекул воды, от концентрации
дейтерияТолщина поглощающего слоя l=0,006 мм
Толщина поглощающего слоя l=0,025 мм
0,8
3,5
y = 0,0003x2 - 0,0629x + 3,2142
R² = 0,9996
y = 8E-05x2 - 0,0149x + 0,7014
R² = 0,998
2=1645
0,6
3
см-1
y = 6E-05x2 - 0,0007x
R² = 0,9979
0,5
0,4
0,3
y=
2=1460
-0,0001x2
+ 0,0127x
R² = 0,992
см-1
0,2
2=1220 см-1
0,1
0
0
20
40
60
80
100
Концентрация дейтерия, ат. %
Относительная ошибка определения [D]:
При = 1645 см-1
отн 11%
При = 1460 см-1
отн 11%
При = 1220 см-1
отн 3,5%
Оптическая плотность, А
Оптическая плотность, А
0,7
2=1645 см-1
2,5
2
1,5
y = 0,0003x2 - 0,0002x
R² = 0,999
y = -0,0006x2 + 0,0622x
R² = 0,9935
2=1460 см-1
1
2=1220 см-1
0,5
0
0
20
40
60
80
100
Концентрация дейтерия, ат. %
Относительная ошибка определения [D]:
При = 1645 см-1
отн 3,6%
При = 1460 см-1
отн 5,5%
При = 1220 см-1
отн 5,9%
28.
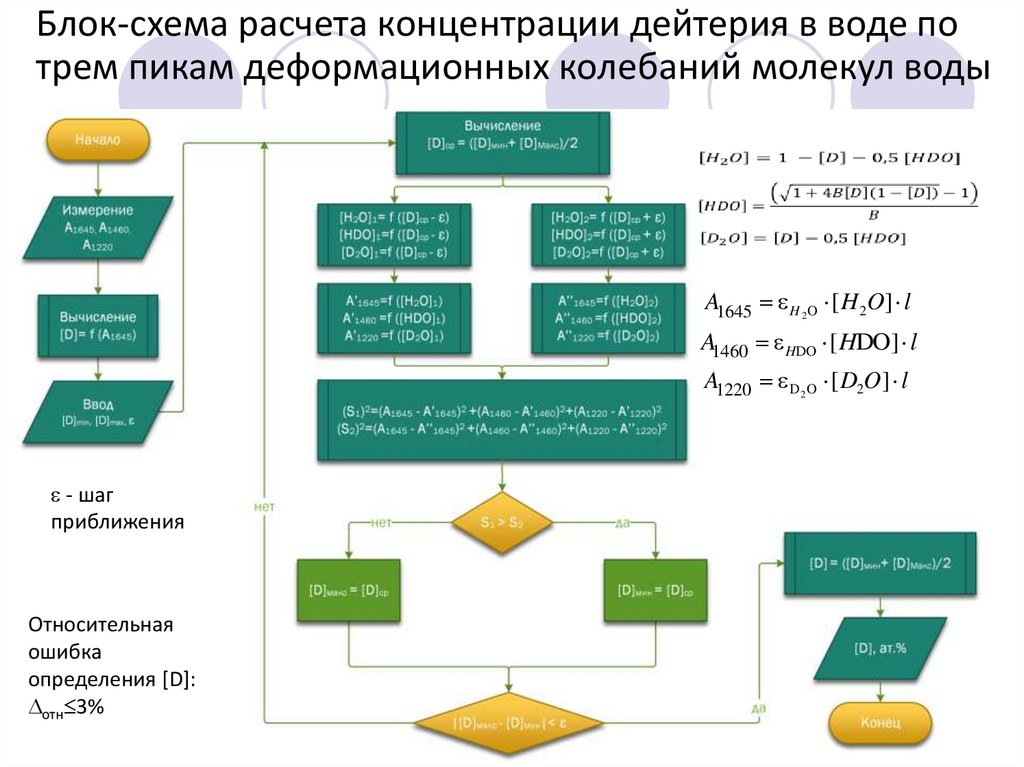
Блок-схема расчета концентрации дейтерия в воде потрем пикам деформационных колебаний молекул воды
A1645 H 2 O [ H 2O] l
A1460 HDO [ HDO] l
A1220 D 2 O [ D2O] l
- шаг
приближения
Относительная
ошибка
определения [D]:
отн 3%