Similar presentations:
Биохимия минерализованных тканей полости рта
1. БИОХИМИЯ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ ПОЛОСТИ РТА
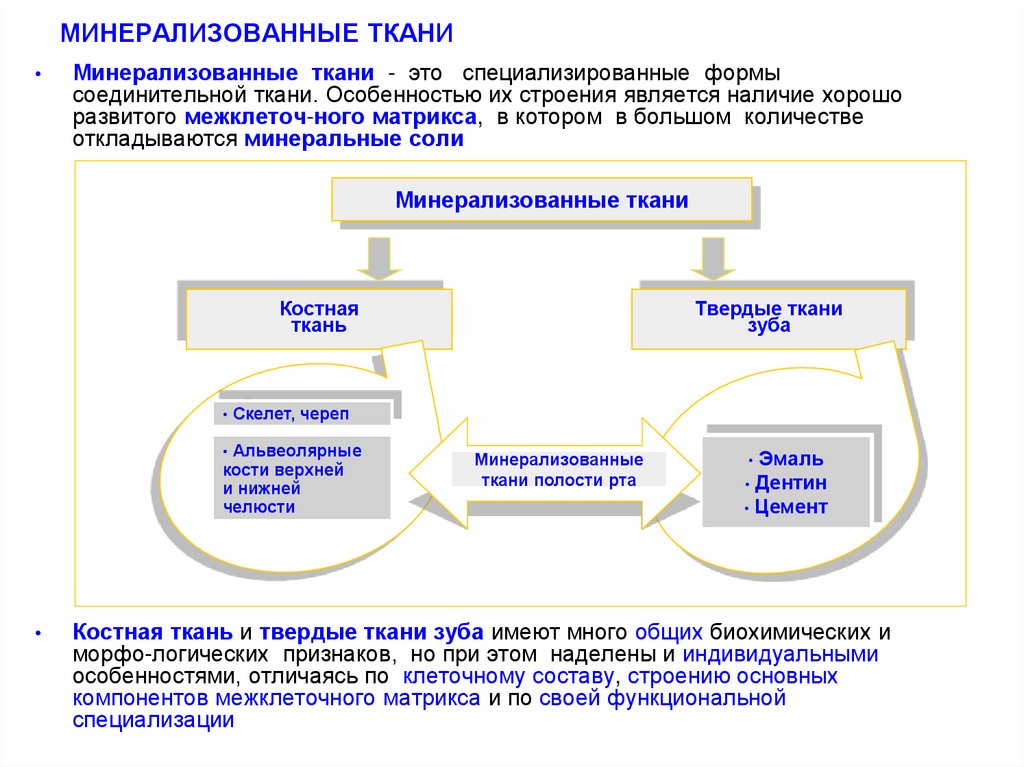
2. МИНЕРАЛИЗОВАННЫЕ ТКАНИ
Минерализованные ткани - это специализированные формы
соединительной ткани. Особенностью их строения является наличие хорошо
развитого межклеточ-ного матрикса, в котором в большом количестве
откладываются минеральные соли
Минерализованные ткани
Костная
ткань
Скелет, череп
Альвеолярные
кости верхней
и нижней
челюсти
Твердые ткани
зуба
Минерализованные
ткани полости рта
Эмаль
• Дентин
• Цемент
Костная ткань и твердые ткани зуба имеют много общих биохимических и
морфо-логических признаков, но при этом наделены и индивидуальными
особенностями, отличаясь по клеточному составу, строению основных
компонентов межклеточного матрикса и по своей функциональной
специализации
3. ФУНКЦИИ И ОСОБЕННОСТИ СТРОЕНИЯ КОСТНОЙ ТКАНИ
Костная ткань (textus osseus) является сложно организованным и активно
функционирующим образованием, обладающим:
- опорно-защитной
- резервуарно-депонирующей
- метаболической функциями
Костная ткань образует скелет, формируя тело человека, выполняет функцию фиксации и защиты органов, расположенных в черепе, в грудной и тазовой полостях
Кости служат местом депонирования кальция и фосфора, а костный мозг
является центральным органом кроветворения и созревания клеток иммунной системы
Выполнение таких многочисленных функций обеспечивается особенностями строения и сложным химическим составом компонентов костной ткани, придающим ей высокую прочность, упругость, способность сопротивляться нагрузкам
4. ПРОЦЕНТНОЕ СООТНОШЕНИЕ КОМПОНЕНТОВ КОСТНОЙ ТКАНИ
Клетки – до 5%- остеобласты
- остеоциты
- остеокласты
Межклеточное вещество - 95%
- органические вещества - 30%
- минеральные вещества - 45%
- вода - 25%
Костная ткань состоит из клеток и выраженного межклеточного вещества, которое
включает остеоид - органический матрикс, построенный из коллагеновых волокон, и
основное минерализованное вещество, состоящее преимущественно из гликопротеинов и протеогликанов
• Органический компонент костной ткани составляет около 30%, неорганический~
70%
• Основным минералом костей является – гидроксиапатит, который выступает главным хранилищем в организме кальция – 99% и фосфора – 85%
• В сочетании друг с другом органические и неорганические компоненты создают прочную опорную ткань, способную сопротивляться сжатию, растяжению и другим механическим нагрузкам
5. СОСТАВ МЕЖКЛЕТОЧНОГО ВЕЩЕСТВА
Коллагеновые волокнаОсновное минерализованное вещество
- гидроксиапатит
- протеогликаны, гликопротеины, фосфолипиды, цитрат
Особенности организации межклеточного матрикса, структура входящих в него
органических и минеральных компонентов, а также способность к гидратации
определяют степень жесткости и упругости минерализованных тканей, что
отражается на их сопротивляемости нагрузкам, устойчивости к ударам, прочности на разрыв и способности снижать трение соприкасающихся поверхностей
6. ОСОБЕННОСТИ СОСТАВА МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ ЗУБА
Минерализованные ткани зуба, кроме зрелой эмали, содержат
небольшое количество специфических клеток:
- дентин содержит одонтобласты
- цемент зуба – цементобласты
Эти клетки участвуют в образовании внеклеточной органической
матрицы, состоящей из:
- -коллагена
коллагена
- -протеогликанов
протеогликанов
гликопротеинов
- -гликопротеинов
фосфолипидов
- -фосфолипидов
цитрата
- -цитрата
Эмаль зуба образуется клетками эктодермального происхождения амелобластами, что отличает ее от других минерализованных
тканей, имеющих мезодермальное происхождение
По окончании морфогенеза зрелая эмаль представляет бесклеточную минерализованную ткань, неспособную к обновлению и восстановлению после травм и повреждений
7. СТРОЕНИЕ И СВОЙСТВА МЕЖКЛЕТОЧНОГО МАТРИКСА
Межклеточный матрикс (substantia intercellularis) минерализованных тканей
состоит из волокнистых структур и основного вещества, включающего
органические и неорганические компоненты
Физико-химические свойства межклеточного матрикса (МКМ), его структура и
химический состав в значительной степени определяют функции минерализованных тканей
Важнейшими органическими составляющими МКМ, в котором происходит
образование и отложение кристаллов гидроксиапатита, являются коллаген,
гликопротеины, протеогликаны, а также фосфолипиды и цитрат
Специфическое взаимодействие этих молекул обеспечивает образование
высокоупорядоченной трехмерной структуры межклеточного матрикса (МКМ)
Среди белков межклеточного матрикса выделяют фибриллярные белки 2-х
функциональных типов – коллагены, имеющие преимущественно структурную
функцию, и белки семейства фибронектина и ламинина, имеющие адгезивные свойства. Последние, в свою очередь, наряду с многочисленными протеогликанами и гликопротеинами, наделенными различной функциональной
специализацией, составляют многочисленную группу неколлагеновых белков
межклеточного матрикса минерализованных тканей
коллаген: 75% и более
Неколлагеновые
белки
неколлагеновые белки
Коллаген
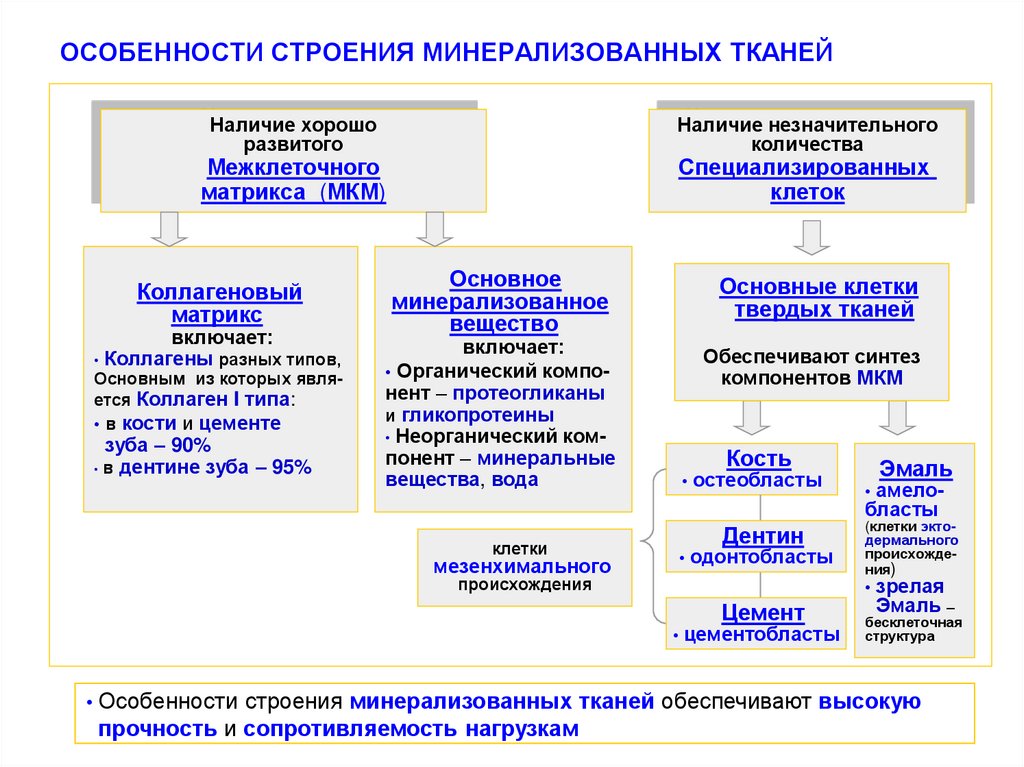
8. ОСОБЕННОСТИ СТРОЕНИЯ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Наличие хорошоразвитого
Наличие незначительного
количества
Межклеточного
матрикса (МКМ)
Коллагеновый
матрикс
включает:
• Коллагены разных типов,
Основным из которых является Коллаген I типа:
• в кости и цементе
зуба – 90%
• в дентине зуба – 95%
Специализированных
клеток
Основное
минерализованное
вещество
Основные клетки
твердых тканей
включает:
• Органический компонент – протеогликаны
и гликопротеины
• Неорганический компонент – минеральные
вещества, вода
Обеспечивают синтез
компонентов МКМ
Кость
остеобласты
Дентин
клетки
мезенхимального
одонтобласты
происхождения
амелобласты
(клетки эктодермального
происхождения)
Цемент
Эмаль
цементобласты
зрелая
Эмаль –
бесклеточная
структура
Особенности строения минерализованных тканей обеспечивают высокую
прочность и сопротивляемость нагрузкам
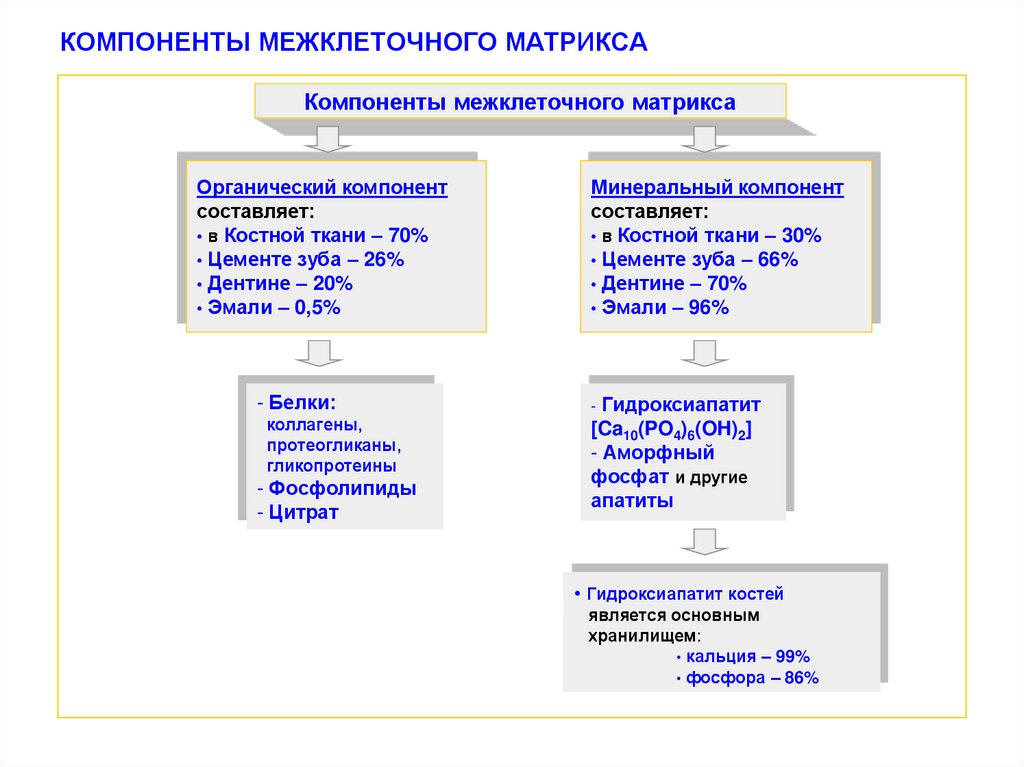
9. КОМПОНЕНТЫ МЕЖКЛЕТОЧНОГО МАТРИКСА
Компоненты межклеточного матриксаОрганический компонент
составляет:
• в Костной ткани – 70%
• Цементе зуба – 26%
• Дентине – 20%
• Эмали – 0,5%
- Белки:
коллагены,
протеогликаны,
гликопротеины
- Фосфолипиды
- Цитрат
Минеральный компонент
составляет:
• в Костной ткани – 30%
• Цементе зуба – 66%
• Дентине – 70%
• Эмали – 96%
Гидроксиапатит
[Ca10(PO4)6(OH)2]
- Аморфный
фосфат и другие
апатиты
-
• Гидроксиапатит костей
является основным
хранилищем:
• кальция – 99%
• фосфора – 86%
10.
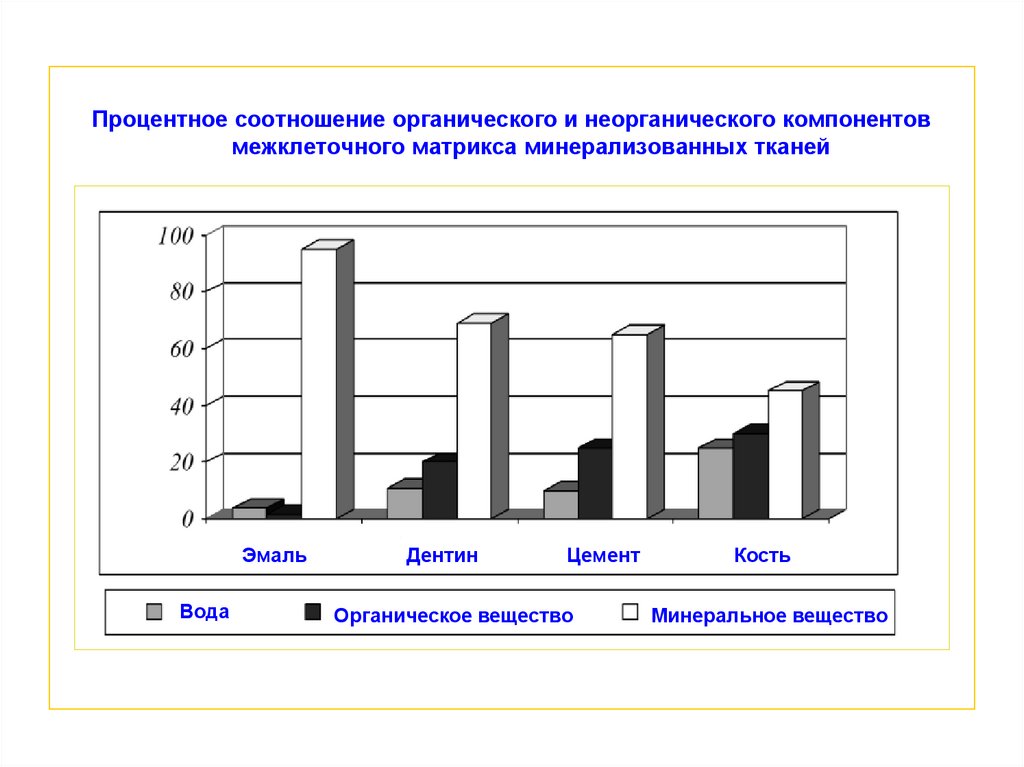
Процентное соотношение органического и неорганического компонентовмежклеточного матрикса минерализованных тканей
Эмаль
Вода
Дентин
Цемент
Органическое вещество
Кость
Минеральное вещество
11. ОСОБЕННОСТИ СОСТАВА МЕЖКЛЕТОЧНОГО ВЕЩЕСТВА РАЗНЫХ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Основное отличие межклеточного матрикса отдельных минерализованных
тканей заключается в разном соотношении минерального и органического
компонентов, что отражается на степени их минерализации
Показатель минерализации твердых тканей возрастает в последовательности:
кость < цемент < дентин < эмаль
< цемент
< дентин
< эмаль
кость <кость
цемент
< дентин
< эмаль
Количество органического вещества в межклеточном матриксе твердых тканей
изменяется в обратной последовательности: эмаль < дентин < цемент < кость
< дентин
< цемент
< кость
эмальэмаль
< дентин
< цемент
< кость
12. БЕЛКИ МКМ ТВЕРДЫХ ТКАНЕЙ
Коллагены разных типов- структурная функция
Неколлагеновые
белки
Фибронектин, ламинин
- адгезивная функция
Фибриллярные
белки МКМ
Протеогликаны и
гликопротеины
- разная функциональная
специализация
Костная ткань и твердые ткани зуба отличаются по количеству и составу
коллагеновых и неколлагеновых белков
13. СТРУКТУРА КОЛЛАГЕНОВ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Коллагеныструктура
Фибриллообразующие
Сетевидные
Образующие
микрофибриллы
тип
I, II, III, V, XI
IV, VIII, X
VI
Ассоциированные
с фибриллами
IX, XII, XIV
Костная ткань и твердые ткани зуба отличаются по составу и
количеству коллагенов и неколлагеновых белков межклеточного
матрикса
Основным белком всех минерализованных тканей является
коллаген I типа
В межклеточном матриксе костной ткани, кроме коллагена I типа,
присутствуют следы коллагенов V, XI, XII типов
В дентине зуба и костях полости рта присутствуют также коллагены
III, IV, V, VI типов
Большое разнообразие коллагенов характерно для цемента зуба, в
котором определяются I, II, III, V, IX, XII, XIV типы
14. КОЛЛАГЕНЫ. СТРУКТУРА И ФУНКЦИИ
Коллагены являются самыми распространенными белками в человеческом
теле и входят в состав таких органов и тканей как кости скелета, зубы, кожа,
сухожилия, связки, хрящи, кровеносные сосуды. Коллагены составляют около
30% от общего количества белка в организме человека.
Коллагены - это полиморфные белки, которые отличаются по первичной и
пространственной структурам, по функциям и локализации в организме
В настоящее время идентифицировано ~ 25 разновидностей коллагеновых αцепей, которые кодируются отдельными структурными генами
В разных органах и тканях экспрессируются разные комбинации этих генов и,
соответственно, образуются разные типы коллагенов – изоколлагены
Для коллагенов характерна интенсивная посттрансляционная модификация,
выраженность которой зависит от органа и ткани, и изменяется с возрастом
В зависимости от структуры, коллагены делятся на фибриллообразующие,
заякоренные фибриллы, микрофибриллы, сетевидные, ассоциированные с
фибриллами
Наиболее распространенными являются коллагены I, II, III, IV типов
Коллагены I, II, III, V, XI типов имеют форму фибрилл, построенных из структурных единиц – тропоколлагенов
Коллагены IX, XII, XIV типов относятся к белкам, ассоциированным с коллагеновыми фибриллами
Коллагены IV, V, X типов составляют группу сетьформирующих коллагенов
Коллаген VI типа относится к образующим микрофибриллы
15. ОСОБЕННОСТИ СТРОЕНИЯ КОЛЛАГЕНОВ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Коллагены являются гликопротеинами с разным аминокислотным составом и
количеством углеводов
Молекула коллагенов разных типов имеет общий принцип организации и представляет собой суперспираль, состоящую из 3-х α-цепей
В состав молекулы коллагена могут входить 3 одинаковые или 3 разные αп/п цепи, отличающиеся по количеству гидроксилированных остатков пролина
и лизина, и по степени их гликозилирования
Молекулы зрелого коллагена характеризуются низким содержанием серосодержащих и ароматических аминокислот
Синтезируются коллагены специальными бластными клетками и поступают в
МКМ, где из них образуются фибриллы высокой прочности, нерастворимые в
воде, солевых растворах, в слабых растворах кислот и щелочей
Основным белком костной ткани является коллаген І типа, который составляет около 90% органического матрикса кости. Этот тип коллагена формирует
прочные нерастворимые коллагеновые волокна, участвующие в процессе минерализации. Кроме коллагена І типа в матриксе костей присутствуют следы
коллагенов V, XI, XII типов
16. СТРОЕНИЕ КОЛЛАГЕНА I ТИПА
Коллаген I типа: [α1(І)]2α2(І) является гетерополимером, состоящим из разных
α-полипептидных цепей
В формуле:
римская цифра в скобках обозначает тип коллагена
арабские цифры - разные α-цепи
индекс за скобкой - количество идентичных α-цепей:
тип коллагена
количество идентичных α-цепей
[α1(І)]2α2(І)
разные α-цепи
Тройная спираль коллагена I типа включает 2е α1-цепи и 1у α2-цепи, которые
отличаются по аминокислотному составу и последовательности аминокислот в
полипептидной цепи
3 α-цепи в коллагене I типа параллельны и имеют необычную укладку в пространстве
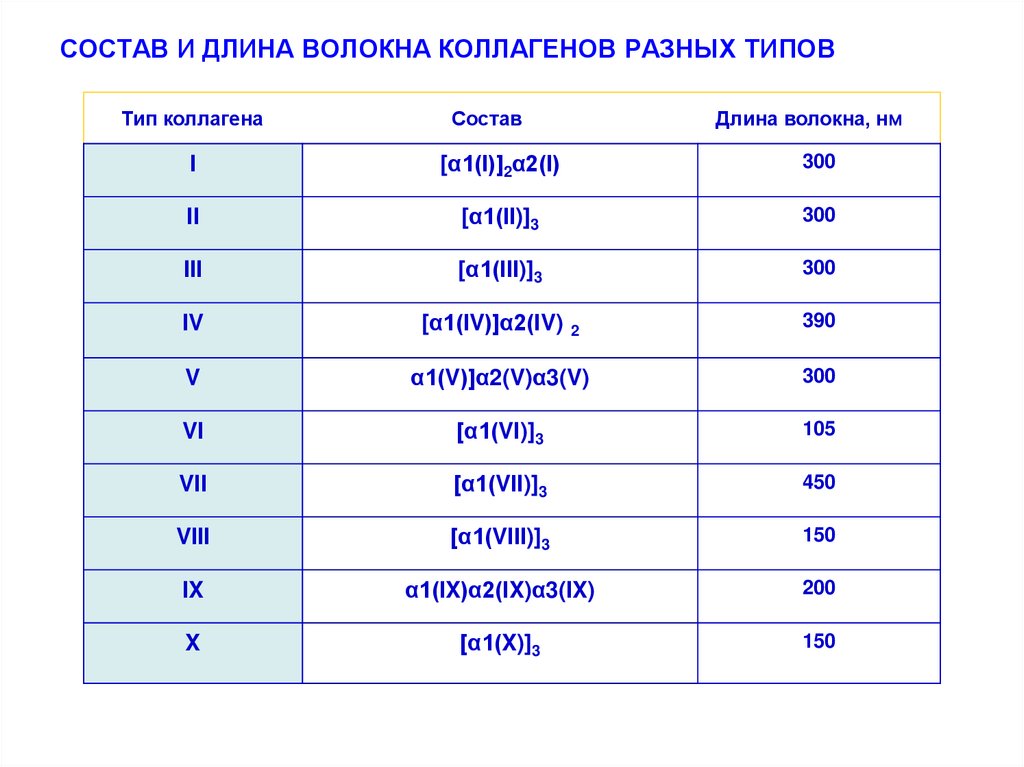
17. СОСТАВ И ДЛИНА ВОЛОКНА КОЛЛАГЕНОВ РАЗНЫХ ТИПОВ
Тип коллагенаСостав
Длина волокна, нм
I
[α1(І)]2α2(І)
300
II
[α1(ІI)]3
300
III
[α1(ІII)]3
300
IV
[α1(ІV)]α2(ІV)
2
390
V
α1(V)]α2(V)α3(V)
300
VI
[α1(VI)]3
105
VII
[α1(VІI)]3
450
VIII
[α1(VIІI)]3
150
IX
α1(ІX)α2(ІX)α3(IX)
200
X
[α1(X)]3
150
18. ОСОБЕННОСТИ КОЛЛАГЕНА I ТИПА КОСТНОЙ ТКАНИ
Особенностью коллагена І типа костной ткани (остеоколлагена) является:высокое содержание оксипролина, свободных ε–аминогрупп остатков лизина и
оксилизина
меньшее количество поперечных связей, формируемых посредством аллизина
остеоколлаген менее гликозилирован и остатки гидроксилизина соединены с
галактозой, а не с галактозилглюкозой - дисахаридом, характерным для других
типов коллагенов
в остеоколлагене повышенно содержание фосфата, большая часть которого
связана с остатками серина
возможным отличием коллагена І типа кости является наличие фосфорилированного N-концевого пропептида, который частично сохраняется в минерализованном матриксе
глицин
гидроксипролин
пролин
аланин
гидроксипролин
пролин
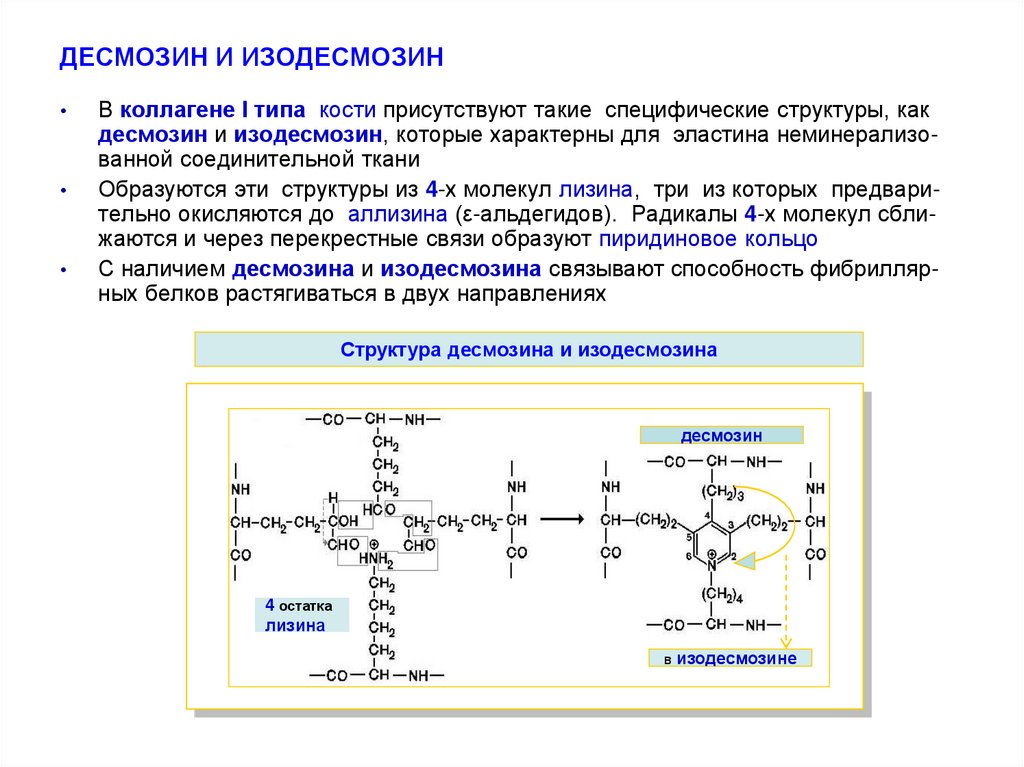
19. ДЕСМОЗИН И ИЗОДЕСМОЗИН
В коллагене І типа кости присутствуют такие специфические структуры, как
десмозин и изодесмозин, которые характерны для эластина неминерализованной соединительной ткани
Образуются эти структуры из 4-х молекул лизина, три из которых предварительно окисляются до аллизина (ε-альдегидов). Радикалы 4-х молекул сближаются и через перекрестные связи образуют пиридиновое кольцо
С наличием десмозина и изодесмозина связывают способность фибриллярных белков растягиваться в двух направлениях
Структура десмозина и изодесмозина
десмозин
4 остатка
лизина
в
изодесмозине
20. ДЕСМОЗИН И ИЗОДЕСМОЗИН - В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Десмозин (пиридинолин) и изодесмозин (изопиридинолин) обеспечивают
стабильность коллагенового матрикса и являются специфическими компонентами зрелого коллагена І типа костной ткани
Пиридиновые структуры являются устойчивыми образованиями и при резорбции кости освобождаются в свободной форме или в составе пептидных фрагментов коллагена, отражая деструктивные процессы физиологического и
патологического характера
Костная ткань является основным источником пиридинолина биологических
жидкостей организма человека
В остеоколлагене соотношение пиридинолин/изопиридинолин соответствует 4:1 и такое же соотношение сохраняется в моче
С возрастом количество десмозина и изодесмозина в моче ↓
В клинической практике определение уровня пиридиновых структур в
крови и моче используется для оценки резорбции костной ткани и
диагностики остеопороза, первичного гиперпаратиреоза, остеомаляции,
гипотиреоза, гиперкальциемии у пациентов со злокачественными
опухолями
21. КОЛЛАГЕНОВЫЙ СОСТАВ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Минерализованная тканьКостная ткань
Цемент зуба
Дентин зуба
Кости полости рта
Типы коллагенов
I, V, XI, XII
I, II, III, V, XII, XIV
III, IV, V, VI
I, III, IV, V, VI
В минерализованных тканях зуба – дентине и цементе основным белком органического матрикса также является коллаген І типа, на долю которого приходится 95% и 90%, соответственно
В структуре коллагена І типа дентина зуба, как и в костной ткани, присутствует
десмозин
Наряду с коллагеном І типа в твердых тканях зуба выявляются и другие типы.
Так, в дентине содержатся коллагены III, IV, V, VI типов, в цементе - II, III, V, IX,
XII, XIV типов
В костях полости рта содержатся коллагены III, IV, V, VI типов
22. ОСОБЕННОСТИ СТРОЕНИЯ КОЛЛАГЕНОВ РАЗНЫХ ТИПОВ
Коллагены II, III,V, XI типов, как и коллаген І, относятся к фибриллообразующим
коллагенам. Коллаген ІІ - [α1(ІІ)]3 отличается низким содержанием оксилизина,
< 1%, и большим количеством углеводов > 10%. Колла-ген ІІІ - [α1(ІІІ)]3 мало
гликозилирован, содержит большое количество оксипролина и в α-цепях присутствует цистеин. Коллаген V является гетерополимером и состоит из разных
полипептидных цепей - [α1(V)α2(V)α3(V)]
Коллагены IX, XII, XIV типов относятся к белкам, ассоциированным с фибриллярными коллагенами, ограничивающими размеры фибрилл коллагенов I, II типов
и участвующими в пространственной организации и ориентации фибрилл. Особенностью их структуры является сочетание глобулярных и фибриллярных доменов. Так, α-цепи коллагена IX типа включают 3 фибриллярных и 4 глобулярных домена, которые связываются ковалентными связями с фибриллами коллагена ІІ типа. Аналогично, коллаген XII взаимодействует с фибриллярным коллагеном І. Коллаген IX типа содержит много (+)- заряженных групп, через которые
происходит взаимодействие с гиалуроновой кислотой и хондроитинсульфатами
Коллагены IV, VIII, X типов относятся к сетевидным коллагенам. Коллаген IV
состоит их разных п/п цепей - α1(ІV)[α2(ІV)]2 и имеет области, содержащие
«неколлагеновые» аминокислотные последовательности
Коллагены VIII и X типов состоят из 3-х одинаковых полипептидных цепей [α1(VІІІ)]3 и [α1(X)]3, соответственно. В этих коллагенах сохраняются N- и Сконцевые пропептиды, которые участвуют в образовании сетевидных структур
Коллаген VI типа образует микрофибриллы, которые способны связываться с
внеклеточными фибриллярными коллагенами и гликозаминогликанами. В коротких α-цепях этого коллагена, как и в коллагене IV типа, часто встречается последовательность из 3 аминокислот: (-арг-гли-асп-), обеспечивающая их взаимодействие с адгезивными белками
23. ПЕРВИЧНАЯ СТРУКТУРА α–ЦЕПЕЙ КОЛЛАГЕНА
Коллаген образуется из секретируемого остеобластами предшественника – проколлагена, представляющего собой тройную суперспираль, состоящую из 3-х
левозакрученных α-цепей, каждая из которых содержит около 1000 а/к
Каждой 3-й а/к в α-цепи коллагена является глицин, около 1/4 а/к составляют
пролин или 4-гидроксипролин, около 11% - аланин и 1% – 5-гидроксилизин
Такие аминокислоты, как гистидин, метионин и тирозин представлены в зрелом
коллагене в небольшом количестве, а цистеин и триптофан – отсутствуют
В целом, первичная структура α-цепей коллагена имеет необычный аминокислотный состав и представляет собой многократно повторяющийся на протяжении
всей длины полипептидной цепи «структурный мотив» из 3-х аминокислот:
(-гли-x-y-)n, где в положении x часто находится пролин, в положении y – оксипролин, оксилизин, или другие а/к
В каждой α-цепи коллагена встречается около 330 таких повторов
Оксипролин и оксилизин образуются в результате котрансляционной модификации соответствующих аминокислот, которая происходит еще до завершения
синтеза полипептидной цепи коллагена
Пролин является иминокислотой и вызывает изгибы в п/п цепи, стабилизируя левозакрученную спиральную конформацию. В результате своеобразного состава
α-цепей, расстояние между остатками а/к по оси α-спирали в коллагене увеличечено и, по сравнению с туго закрученной α-спиралью глобулярных белков, α-спираль коллагена более вытянута, и на 1-н ее виток приходится 3 аминокислотных
остатка, тогда как в глобулярных белках - 3,6
Н2N-СН2-СООН
Глицин
2
Пролин
Гидроксипролин
Лизин
НО-СН
Гидроксилизин
24. ОБРАЗОВАНИЕ ТРОПОКОЛЛАГЕНА
3-и α-спирали объединяются и образуют правозакрученную суперспиральную молекулу тропоколлагена, имеющего форму стержня длиной 300 нм и диаметром
1,5 нм. Все 3-и α-спирали располагаются параллельно и удерживаются рядом за
счет возникающих между ними поперечных водородных связей
В местах пересечения α-спиралей локализуется глицин, который не имеет бокового радикала, что обеспечивает максимальное сближение α-спиралей и образование плотно упакованной тройной спирали тропоколлагена
Радикалы 2-х других а/к из триады (-х и -у), при скручивании α-цепей, оказываются на наружной поверхности тройной спирали молекулы тропоколлагена
Пролин и гидроксипролин α-спиралей ограничивают вращение полипептидного
стержня и увеличивают стабильность тройной спирали
Дополнительно структура тропоколлагена стабилизируется за счет образования
водородны х связей между α-цепями при участии гидроксипролина и гидроксилизина
Молекула тропоколлагена
1,5 нм
300 нм
25. ОБРАЗОВАНИЕ КОЛЛАГЕНОВЫХ ФИБРИЛЛ
Из сформировавшихся молекул тропоколлагена происходит сборка коллагеновых фибрилл, в которых одна нить молекул тропоколлагена сдвинута по отношению к другой примерно на ¼ длины
Между концом одной молекулы и началом другой образуется просвет в 40 нм,
который в костной ткани является центром минерализации
Важную роль в образовании коллагеновых фибрилл играют модифицированные
аминокислоты - гидроксипролин и гидроксилизин. НО-группы гидроксипролина
соседних цепей тропоколлагена образуют водородные связи, укрепляющие структуру фибрилл. Радикалы лизина и гидроксилизина обеспечивают образование
прочных поперечных сшивок между молекулами тропоколлагена, еще сильнее
стабилизирующих и укрепляющих структуру коллагеновых фибрилл. Кроме этого к гидроксильным группам гидроксилизина последовательно присоединяются
углеводные остатки, влияющие на механические свойства тканей
Коллагеновые фибриллы формируют коллагеновые волокна разной толщины,
характеризующиеся малой растяжимостью и большой прочностью на разрыв
Коллагеновые фибриллы разных тканей отличаются по структурной организации,
толщине и по способу укладки. Так, в сухожилиях они собраны в параллельные
пучки, которые располагаются вдоль главной оси, в коже - подобно прутьям в
плетеных изделиях, в рыхлой соединительной ткани – в виде волнообразно изогнутых округлых или уплощенных тяжей, в костной ткани - подобно чередующимся слоям в фанере
26. СТРОЕНИЕ КОЛЛАГЕНОВОГО ВОЛОКНА
Коллагеновые микрофибриллы содержат 5 рядов молекул тропоколлагена,
коллагеновые фибриллы включают 9 – 12 микрофибрилл
Фибриллы представляют собой поперечно исчерченные структуры толщиной в
среднем 5-100 нм, с периодом повторяемости темных и светлых участков 6467 нм. Причиной исчерченности является способ укладки молекул тропоколлагена во время фибриллогенеза – каждая молекула смещена относительно соседней на ¼ своей длины
В состав коллагенового волокна (толщиной 1-10 мкм), в зависимости от топографии, входят от нескольких до нескольких десятков фибрилл. Волокна при
участии гликозаминогликанов и гликопротеинов складываются в пучки толщиной
до 150 мкм
Коллагеновые волокна при варке образуют клейкое вещество (греч. кola– клей),
что и определило название этих волокон
Коллагеновое волокно
Поперечная
исчерченность
27. БИОСИНТЕЗ И СОЗРЕВАНИЕ КОЛЛАГЕНА
Синтез и созревание коллагена представляют сложный процесс, состоящий
из целого ряда последовательных превращений, который начинается в клетках
и завершается в межклеточном матриксе
Соответственно, выделяют 2 этапа синтеза и созревания (процессинга) коллагена - внутриклеточный и внеклеточный
Внутриклеточный этап
В остеобластах на полирибосомах происходит синтез препро–α-цепей, содержащих на N-конце гидрофобный «сигнальный» пептид (лидерная последовательность из 100 а/к), который облегчает перемещение пептидных цепей в
просвет эндоплазматического ретикулума
После отщепления «сигнального» пептида специфической протеиназой образуются про–α-цепи, которые в полости ЭПР гидроксилируются по определенным
остаткам пролина и лизина, и соединяются водородными связями, формируя
тройную спираль проколлагена. На N- и С-концах проколлаген содержит пропептиды, первичная структура которых лишена характерного «коллагенового
мотива» и в которых остатки цистеина образуют внутрицепочечные S-S связи,
а в С-пропептиде – и межцепочечные S-S связи. N- и С-концевые пропептиды
образуют глобулярные домены, которые выполняют функцию «монтажных устройств»,обеспечивающих правильную ориентацию α-цепей относительно друг
друга и формирование третичной структуры коллагена. Внутри- и межцепочечные дисульфидные связи в С-концевом участке также важны для предотвращения образования крупных коллагеновых фибрилл, которые могли бы нарушать
функции клеток и тканей в целом
28.
Гидроксилирование остатков пролина и лизина является результатом котрансляционного превращения соответствующих аминокислот в составе пептидных
цепей проколлагена. Модификация пролина и лизина происходит еще в процессе синтеза полипептидной цепи и прекращается после образования тройной
спирали
Гидроксильные группы гидроксипролина участвуют в образовании водородных
связей между α-цепями, что необходимо для стабилизации тройной спирали
зрелого коллагена, а гидроксилирование остатков лизина важно для последуюдующего образования ковалентных связей между молекулами тропоколлагена
при сборке коллагеновых фибрилл
Реакцию гидроксилирования остатков пролина и лизина катализируют проколлагеноксигеназы (пролилоксигеназа, лизилоксигеназа), связанные с мембранами микросом
В реакции используются О2, α-кетоглутарат и в качестве кофермента выступает
аскорбиновая кислота, поддерживающая в активном центре этих ферментов
ион Fe2+ в восстановленном состоянии. При этом образуется дегидроаскорбат,
обратное превращение которой в аскорбат происходит при участии восстановленного глутатиона (Г-SH) - трипептида, состоящего из 3-х а/к - (γглу-цис-гли)
2
лизин
пролин
α-кетоглутарат
α-кетоглутарат
аскорбат
4-гидроксипролин
сукцинат
сукцинат
дегидроаскорбат
оксилизин
29. НАРУШЕНИЯ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА
Оксипролин и оксилизин являются маркерными аминокислотами зрелого коллагена. Гидроксилирование остатков пролина повышает стабильность и температуру плавления коллагена – показатель, влияющий на эластичность коллагеновых волокон
При дефиците аскорбиновой кислоты (витамин С) нарушается гидроксилирорование остатков пролина и лизина в α-цепях проколлагена. В результате образуются менее прочные коллагеновые волокна и развиваются симптомы цинги:
хрупкость и ломкость кровеносных капилляров, множественные кровоизлияния
под кожу и слизистые, кровоточивость десен, анемия, отечность, мышечная слабость, боли в суставах, поражение костей, нарушение заживления ран
Нарушение синтеза коллагена в дентине и пульпе зуба приводит к развитию
множественного кариеса, ослаблению периодонтальных связок, расшатыванию
и выпадению зубов. При ярко выраженной картине заболевания нарастают явления гингивита и некротический процесс может охватывать область зева,
мягкое небо, пищевод, челюстные кости
30. ГЛИКОЗИЛИРОВАНИЕ ОСТАТКОВ ГИДРОКСИЛИЗИНА В ПРОКОЛЛАГЕНЕ
После завершения гидроксилирования происходит гликозилирование проколлагена при участии специфических гликозилтрансфераз, которые образуют ковалентную О-гликозидную связь между 5-ОН группой гидроксилизина и углеводным компонентом, чаще галактозой или галактозилглюкозой
Начинается гликозилирование еще до спирализации α-цепей и завершается
после образования тройной спирали. Число углеводных единиц в коллагене и
их состав зависит от вида ткани
Далее из эндоплазматического ретикулума молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные гранулы и выделяются в
межклеточное пространство
О
||
-NН-СН-С|
(СН2)2
|
НС-ОН
|
СН2
|
NН2
Гидроксилизин
УДФ-галактоза
УДФ-глюкоза
УДФ
УДФ
ГликозилГликозилтрнсфераза
трансфераза
О
||
-NН-СН-С|
(СН2)2
|
НС-О-Гал-Глю
|
СН2
|
NН2
Гликозилированный
гидроксилизин
31. ВНЕКЛЕТОЧНЫЙ ЭТАП СИНТЕЗА КОЛЛАГЕНА
При участии специфических проколлагенпептидаз от проколлагена І, ІІ, ІІІ типов
происходит отщепление N- и С-концевых пропептидов, в результате чего образуется молекула тропоколлагена, которая и является структурной единицей коллагеновых фибрилл
У коллагенов ІV, VІІІ, X типов концевые пропептиды не отщепляются и играют важную роль в образовании сетеподобных структур
Молекула тропоколлагена имеет палочкообразную форму и состоит из 3-х спирально навитых друг на друга α-цепей, которые имеют равную длину и каждая содержит около 1000 аминокислотных остатков
Молекулы тропоколлагена связываются между собой не конец в конец, а через
промежутки с образованием просветов в 40 нм. В твердых тканях эти просветы
выполняют роль центров минерализации, где откладываются кристаллы фосфата кальция
Далее, ступенчато расположенные параллельные ряды молекул тропоколлагена
формируют коллагеновые фибриллы, которые укрепляются и стабилизируются
внутри- и межцепочечными ковалентными «лизин-лизин» сшивками при участии
фермента – РР и В6- зависимой, Cu2+-содержащей лизилоксидазы. Витамины
РР и В6 участвуют в реакции в форме коферментов – НАД+ и пиридокальфосфат, соответственно. Лизилоксидаза синтезируется в клетке в виде профермента
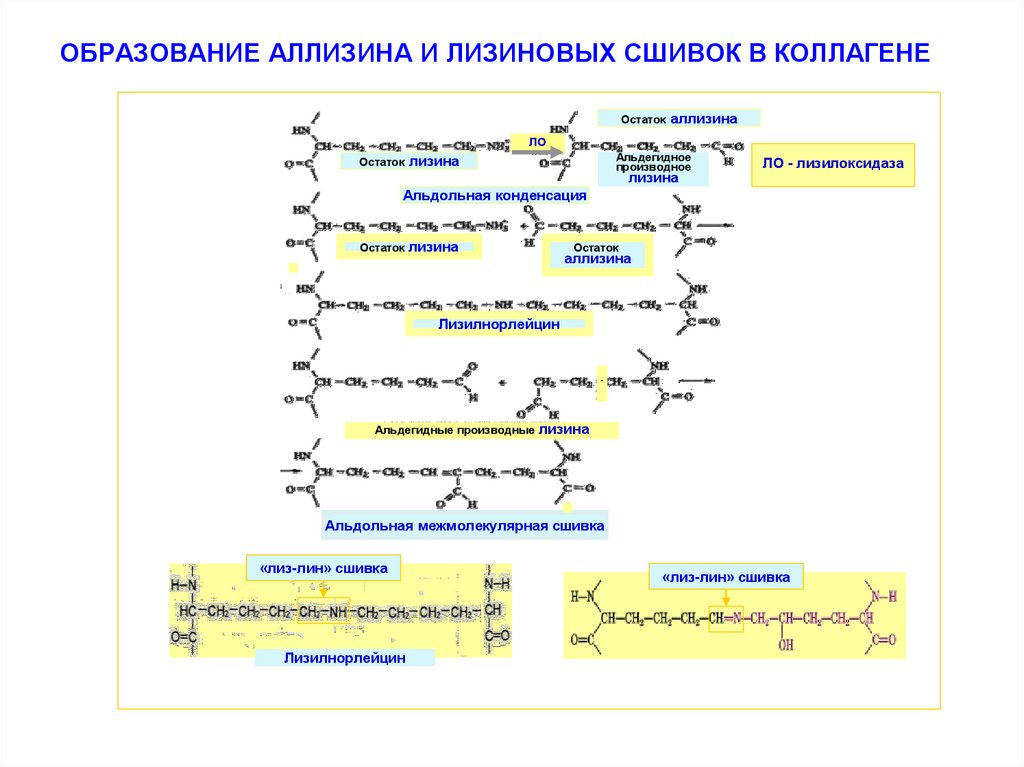
и после связывания с ионами меди включается в везикулы и выводится из клетки. Вне клетки лизилоксидаза катализирует окислительное дезаминирование εаминогрупп в некоторых остатках лизина и гидроксилизина молекулы коллагена с
образованием реактивных альдегидов - аллизина и гидроксиаллизина
Образовавшиеся альдегиды участвуют в формировании ковалентных связей между собой, а также с другими остатками лизина или гидроксилизина соседних молекул тропоколлагена. В результате возникают внутри- и межмолекулярные поперечные «лизин-лизин» сшивки, стабилизирующие фибриллы коллагена
32. ОБРАЗОВАНИЕ АЛЛИЗИНА И ЛИЗИНОВЫХ СШИВОК В КОЛЛАГЕНЕ
Остатокаллизина
ЛО
Остаток
Альдегидное
производное
лизина
лизина
ЛО - лизилоксидаза
Альдольная конденсация
Остаток
лизина
Остаток
аллизина
Лизилнорлейцин
-
Альдегидные производные
лизина
Альдольная межмолекулярная сшивка
«лиз-лин» сшивка
Лизилнорлейцин
«лиз-лин» сшивка
33. ЭТАПЫ ФОРМИРОВАНИЯ КОЛЛАГЕНОВОГО ВОЛОКНА
3 α–цепиколлагена
Тропоколлагеновые
нити
Коллагеновые
волокна
64 нм
Глицин
Пролин
Глицин
Глицин
Глицин
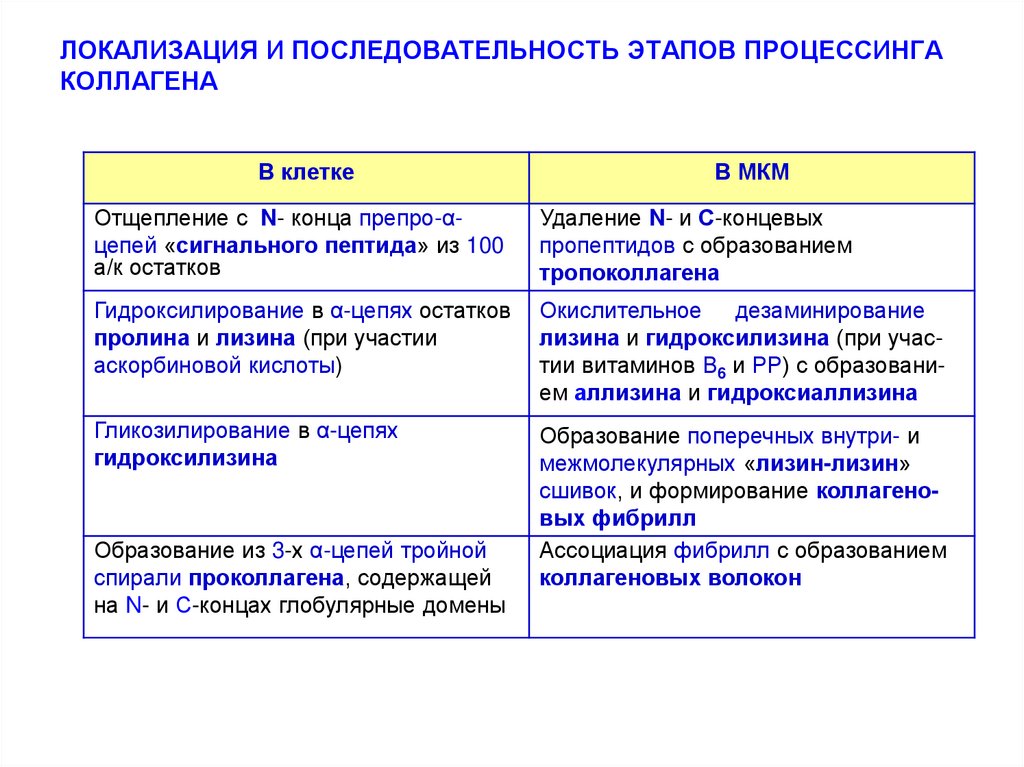
34. ЛОКАЛИЗАЦИЯ И ПОСЛЕДОВАТЕЛЬНОСТЬ ЭТАПОВ ПРОЦЕССИНГА КОЛЛАГЕНА
В клеткеВ МКМ
Отщепление с N- конца препро-αцепей «сигнального пептида» из 100
а/к остатков
Удаление N- и С-концевых
пропептидов с образованием
тропоколлагена
Гидроксилирование в α-цепях остатков
пролина и лизина (при участии
аскорбиновой кислоты)
Окислительное дезаминирование
лизина и гидроксилизина (при участии витаминов В6 и РР) с образованием аллизина и гидроксиаллизина
Гликозилирование в α-цепях
гидроксилизина
Образование поперечных внутри- и
межмолекулярных «лизин-лизин»
сшивок, и формирование коллагеновых фибрилл
Ассоциация фибрилл с образованием
коллагеновых волокон
Образование из 3-х α-цепей тройной
спирали проколлагена, содержащей
на N- и С-концах глобулярные домены
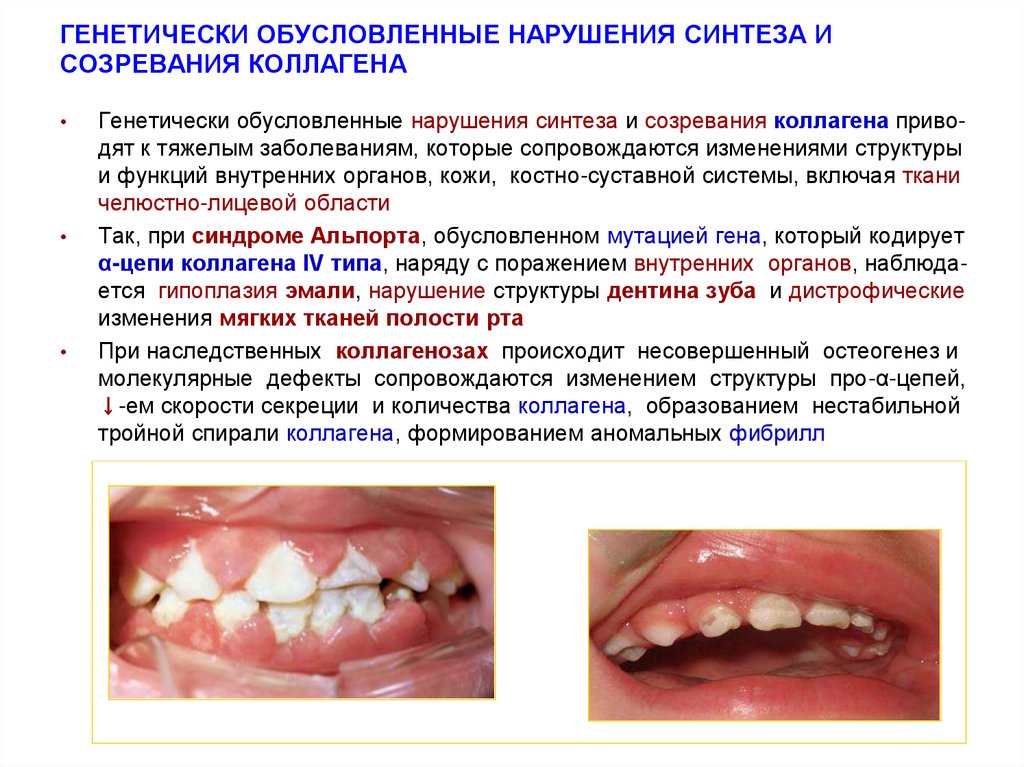
35. ГЕНЕТИЧЕСКИ ОБУСЛОВЛЕННЫЕ НАРУШЕНИЯ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА
Генетически обусловленные нарушения синтеза и созревания коллагена приводят к тяжелым заболеваниям, которые сопровождаются изменениями структуры
и функций внутренних органов, кожи, костно-суставной системы, включая ткани
челюстно-лицевой области
Так, при синдроме Альпорта, обусловленном мутацией гена, который кодирует
α-цепи коллагена IV типа, наряду с поражением внутренних органов, наблюдается гипоплазия эмали, нарушение структуры дентина зуба и дистрофические
изменения мягких тканей полости рта
При наследственных коллагенозах происходит несовершенный остеогенез и
молекулярные дефекты сопровождаются изменением структуры про-α-цепей,
↓-ем скорости секреции и количества коллагена, образованием нестабильной
тройной спирали коллагена, формированием аномальных фибрилл
36. РАСПАД КОЛЛАГЕНА. ПОКАЗАТЕЛИ ОБМЕНА КОЛЛАГЕНА
Период полужизни коллагена составляет несколько недель - месяцев. Распад
коллагена происходит при участии Са2+, Zn2+-зависимой коллагеназы, которая
расщепляет α-цепи между остатками глицина и лейцина, или изолейцина. Образующиеся фрагменты коллагена становятся растворимыми и подвергаются действию других пептидаз
Са2+, Zn2+-зависимая коллагеназа относится к группе матриксных металлопротеиназ (ММП), участвующих в катаболизме разных коллагенов и неколлагеновых
белков межклеточного матрикса. В эту группу входит более 20 металлопротеиназ, среди которых выделяют 4-е основных подсемейства – коллагеназы, желатиназы, стромелизины, металлоэластаза. В гидролизе разных типов коллагена
участвуют разные матриксные металлопротеиназы. В частности, в расщеплении
коллагенов I, II, III, VII, VIII, X типов участвует ММП-1, в гидролизе коллагена IV,
V, VII, X, XI типов - ММП-2, коллагена IV, VII, IX типов - ММП-3. ММП-7 обеспечивает гидролиз коллагена IV типа, ММП-9 - коллагена IV,V типов, ММП-13 и ММП14 - коллагена I, II, III типов
Синтез и активность ММП контролируется цитокинами, прогестероном, эстрогенами, тканевыми специфическими белками
С возрастом развивается резистентность к коллагеназе, ↑-ся структурная стабильность коллагеновых волокон
Са2+, Zn2+-зависимая коллагеназа активируется при повреждениях коллагена,
происходящих,например, при неферментативном гликозилировании а/к остатков,
и осуществляет при этом гидролиз неправильно ориентированных в межклеточном матриксе молекул коллагена
Деструкция МКМ при коллагенозах,остеомиелите, лейкозе, метастазировании
опухолей, пульпите, пародонтите и других заболеваниях, сопровождается ↑ем активности матриксных металлопротеиназ
37. ПОКАЗАТЕЛИ ОБМЕНА КОЛЛАГЕНА
·
Показателями обмена коллагена являются: содержание в моче и крови гидроксипролина и пролина, N- и C-телопептидов, пиридинолина и дезоксипиридинолина
Количество этих показателей ↑-ся при распаде коллагена и нарушениях его
созревания
Увеличение оксипролина в моче (>50 мг/сутки - у взрослых) отмечается при остеопатии, остеомаляции, остеопорозе, гиперпаратиреоидизме, метастазах в кости, акромегалии
Количество пиридиновых структур в моче отражает активность деструктивных
процессов в кости. В норме концентрация пиридинолина в моче составляет 2060 нмоль/ммоль креатинина - у мужчин и 22-89 нмоль/ммоль креатинина – у женщин. Для дезоксипиридинолина эти значения составляют: 4-19 и 4-21, соответ-но
↑-е С-терминального пептида в сыворотке крови выявляется при остеопорозе,
коррелируя с активностью процесса, при метастазах в кости, злокачественной
опухоли паращитовидных желез. В норме этот показатель составляет у мужчин 0,300-0,584 нг/мл, у женщин - 0,299-0,573. С возрастом содержание С-телопептида в крови ↑. Во время менопаузы у женщин его уровень в крови ↑-ся ~ в 2 раза
Концентрация в моче N-телопептида, который образуется при расщеплении коллагеназой коллагена I, является специфическим маркером интенсивности резорбции костной ткани. Количество N-телопептида в моче ↑-ся при остепорозе, гиперпаратиреозе, болезни Педжета. В норме его уровень в моче у мужчин составляет 23-110, у женщин – 13-96 нмоль эквивалента коллагена кости/ммоль креат.
При старении происходит ↓-е скорости обмена коллагена и изменение его физико-химических свойств. ↑-ся число поперечных «сшивок» между молекулами
тропоколлагена, ↓-ся эластичность и способность к набуханию. В МКМ происходит ↓-е соотношения гликозаминогликанов/коллагена и количества связанной
воды. Все эти возрастные изменения приводят к ↓-ю механической прочности
соединительной и минерализованных тканей




























 biology
biology








