Similar presentations:
Молекулы и атомы. Откуда и что мы про них знаем?
1.
General Physics NRNU MEPhIМолекулярная физика.
Лекция 01 (04)
3 марта 2021
Молекулы и атомы
Откуда и что мы про них знаем?.
Лектор: доцент НИЯУ МИФИ,
Андрей Станиславович ОЛЬЧАК
2.
Предмет молекулярной физикиСегодня мы знаем, что :
на микроскопическом уровне все вещество - твердые тела, жидкости,
газы, любые биологические объекты и мы сами – все дискретно – то
тесть, состоит из частиц (молекул и атомов) настолько малых, что
видеть мы их не можем.
Но: на макроскопическом уровне (в масштабах, доступных нашим
органам чувств) тела, состоящие из огромного множества частиц, часто
воспринимаются как сплошная непрерывная среда (твердое тело,
жидкость или газ), характеризующаяся макроскопическими
измеряемыми параметрами (плотность[кг/м3] , давление [Н/м2],
температура [0К или 0С] и другие, о которых по ходу дела расскажем...)
Главная тема нашего курса в марте-мае: термодинамика и
статистическая физика, которые занимаются явлениями и процессами,
наблюдаемыми на макроскопическом уровне, но объясняющимися
именно молекулярной, дискретной микро-структурой вещества
3.
Предмет молекулярной физикиО каких конкретно явлениях и процессах идет речь?
• Тепловые явления и макроскопические параметры вещества
- нагревание и охлаждение, температура, давление
• Агрегатные состояния вещества
- взаимопревращения твердого тела, жидкости и газа
• Связь тепловых явлений и механического движения –
- теплота, работа и энергия, тепловые двигатели
• Явления переноса
- теплопроводность, вязкость, звук
Свойства веществ, связанные с их атомно-молекулярным составом и
структурой составляющих их молекул, а также взаимопревращение
веществ по причинам изменения структуры составляющих их
молекул, НЕ являются предметом молекулярной физики.
Этим пусть занимается отдельная наука - химия….
4.
Термодинамика и статистическая физикаЭпизод_01-1
Откуда мы знаем про молекулы и атомы?.
Как развивались представления об
устройстве вещества.
5.
История представлений об устройстве вещества.
Аристотель и его последователи считали,
что все вещество состоит 4-х т.н.
«первоэлементов»:
Сухой и холодный – «ЗЕМЛЯ»
Влажный и холодный – «ВОДА»
Влажный и горячий – «ВОЗДУХ»
Сухой и горячий – «ОГОНЬ»
Их смеси в разных пропорциях и
формируют все разнообразие наблюдаемых
веществ и форм материи.
Аристотель дополнил в систему еще 5-ый
элемент – «ЭФИР» и который мыслился
как «источник всякого движения».
Интересно, что в Индии и Китае бытоывли
аналогичные представления о структуре
материи с теми-же 5 элементами.
Aristotle
(384–322 b.C)
6.
История представлений об устройстве вещества.
Democritus (IV age b.C.) –
современник Аристотеля
Атомы движутся в Великой Пустоте, хаотично,
сталкиваются и вследствие соответствия форм,
размеров, положений и порядков либо сцепляются, либо
разлетаются. Образовавшиеся соединения держатся
вместе и таким образом производят возникновение
сложных тел.
Разнообразие тел обусловлено как различием слагающих
их атомов, так и различием порядка сборки,
как из одних и тех же букв слагаются разные слова.
7.
История представлений об устройстве вещества.
В Средние века представления Аристотеля до XVIII века.оставались
основой образования и в Мусульманском, и в Христианском мире.
Экспериментальными исследованиями занимаются в основном алхимики,
стремясь получить дорогое золото и дающий бессмертие «философский
камень» из разных исходных материалов,
Их смешивают и «подвергают анализу» (нагревают, сжигают), стараясь
разложить на простейшие элементы – и находит такие, которые
дальнейшему разложению на еще более простые не поддаются.
К 1500 году таких простейших элементов известно уже 13.
Это прежде всего золото, серебро, медь, олово, цинк,
железо, свинец, ртуть – чистые металлы, с которыми люди
знакомы с далекой древности.
А также сера, которую в Китае использовали для
изготовления пороха еще в 1-м тысячелетии н.э.,
изученные уже в Средние века сурьма (antimonium),
мышьяк (arsenicum) и висмут (bот немецкого «weisse
masse» - белая масса, которую находили шахтеры на
рудниках) и углерод (зола от сжигания угля и древесины)
Алхимические символы.
1 — олово; 2 — свинец;
3 — золото; 4 — сера;
5 — ртуть; 6 — серебро;
7 — железо
8.
История представлений о строении вещества.
В Новое время (XVI-XVIII в.в.) из алхимии рождается наука химия.
К концу XVIII века ищвестно уже более 30 простых веществ (химических
элементов). Среди них важнейшие элементы: водород, азот, кислород,
платина, фосфор и даже уран.
В XVII-XVIII в.в. активно развивалась т.н. теория флогистона (от греч.
φλογιστός — горючий, воспламеняемый), согласно которой в любом веществе
имеется особая «тонкая материя» флогистон - носитель тепла, который
перетекает от более горячего тела (где его больше) к более холодному (где
его меньше), выравнивая их температуры, и улетучивается при горении.
Горение рассматривалось как процесс разложения вещества.
Малое количество золы, образующееся при горении угля, давало повод
сторонникам этой теории предполагать, что уголь - это почти чистый
флогистон + немного земли (золы). .
Теория флогистона ( калорик, теплород) к концу XVIII века в
Европейской науке считалась общепризнанной «стандартной моделью».
Ее противников презирали…
9.
История представлений об устройстве вещества.
Antoine L. de Lavoisier Jean Baptiste Joseph Fourier Pierre-Simon de Laplace
(1743-1794)
(1768-1830)
(1749-1827)
Создатели и главные сторонники теории флогистона. Все французы.
Парижская академия наук была главным авторитетом в науке 18 века.
10.
История представлений об устройстве вещества.
Francis Beacon
(1561 – 1621)
Robert Boyle
(1627-1691)
Mikhail Lomonosov
(1711 – 1765)
Isaac Newton
(1643-1726)
«Флогистон – диссиденты» XVII-XVIII веков : сторонники взгляда на
теплоту как на форму движения..
11.
История представлений об устройстве вещества.
Важный удар по теории флогистона нанесли публичные
эксперименты графа Румфорда и Хемфри Дэви, поставленные и
продемонстрированные публично в Лондоне в самом конце XVIII века.
В опыте Румфорда (1798) в чугунной отливке для
пушки, помещенной в бочку с водой, высверливали
жерло тупым (!) сверлом. Через 2 часа вода в бочке
закипала. Без подвода тепла, без огня – только за
счет движения сверла.
Benjamin Thompson,
Count Rumford
(1753-1814)
12.
История представлений об устройстве вещества.
В аналогичном опыте Хемфри Дэви (1799) два куска
льда под колоколом с откачанным воздухом (чтобы
исключить какой-бы то ни было контакт с любыми
телами, от которых ко льду мог бы «перетечь
флогистон») с помощью специального механического
привода терлись друг о друга. В результате лед
плавился и полученная вода приобретала
температуру около +40 по Цельсию. .
После опытов Румфорда и Дэви оспаривать связь
Humphry Davy
теплоты и движения стало трудно. Однако было
(1778-1829)
неясно, что именно движется в недрах нагревающегося
вещества.
Решающие наблюдения были произведены в начале XIX века не
физиками и не химиками, а занимавшимся описанием и систематизацией
своей коллекции тропических растений ботаником Робертом Броуном,
наблюдавшим странные «прыжки» частиц пыльцы под микроскопом. .
13.
История представлений о молекулах и атомахБроуновское движение. 1827 год
Robert Brown
1773-1858
Броун объяснил хаотическое движение частиц пыльцы на поверхности
кюветы с водой тем, что их толкают еще более мелкие (и оттого
невидимые), но быстро движущиеся частицы, из которых и состоит вода. .
Сегодня мы называем эти частицы молекулами..
14.
История представлений об устройстве вещества.
К этому времени (1827 г.) было известно уже более 50
химических элементов, а шведский химик Jöns Jakob
Berzelius (1779-1848) даже уже предложил в 1814 году
систему химической символики, основанную на
обозначении элементов одной или двумя буквами его
латинского названия, которая используется по сей день.
Стремительно множащееся количество «первичных элементов»,
получаемых разложением сложных веществ, породило идею о
«двухуровневой структуре» строения вещества – из атомов и молекул.
Молекула - это наименьшая частица вещества, определяющая его
свойства (химические) и способная к самостоятельному существованию.
Примеры: молекулы воды, или поваренной соли, или этилового спирта.
Молекулы построены из атомов как слова из букв.
Атом — наименьшая частица химического элемента, входящая в
состав простых и сложных веществ. Примеры: вода – Н2О, поваренная
соль – NaСl, этиловый спирт – С2Н5ОН, кислород – О2 и т.д.
15.
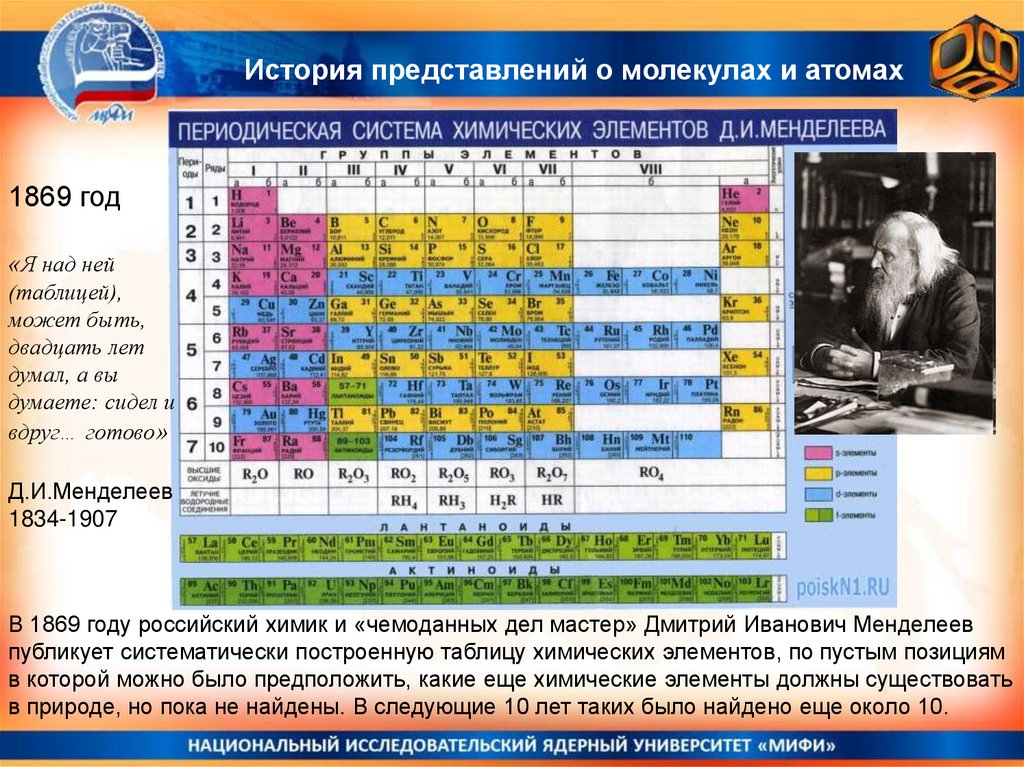
История представлений о молекулах и атомах1869 год
«Я над ней
(таблицей),
может быть,
двадцать лет
думал, а вы
думаете: сидел и
вдруг… готово»
Д.И.Менделеев
1834-1907
В 1869 году российский химик и «чемоданных дел мастер» Дмитрий Иванович Менделеев
публикует систематически построенную таблицу химических элементов, по пустым позициям
в которой можно было предположить, какие еще химические элементы должны существовать
в природе, но пока не найдены. В следующие 10 лет таких было найдено еще около 10.
16.
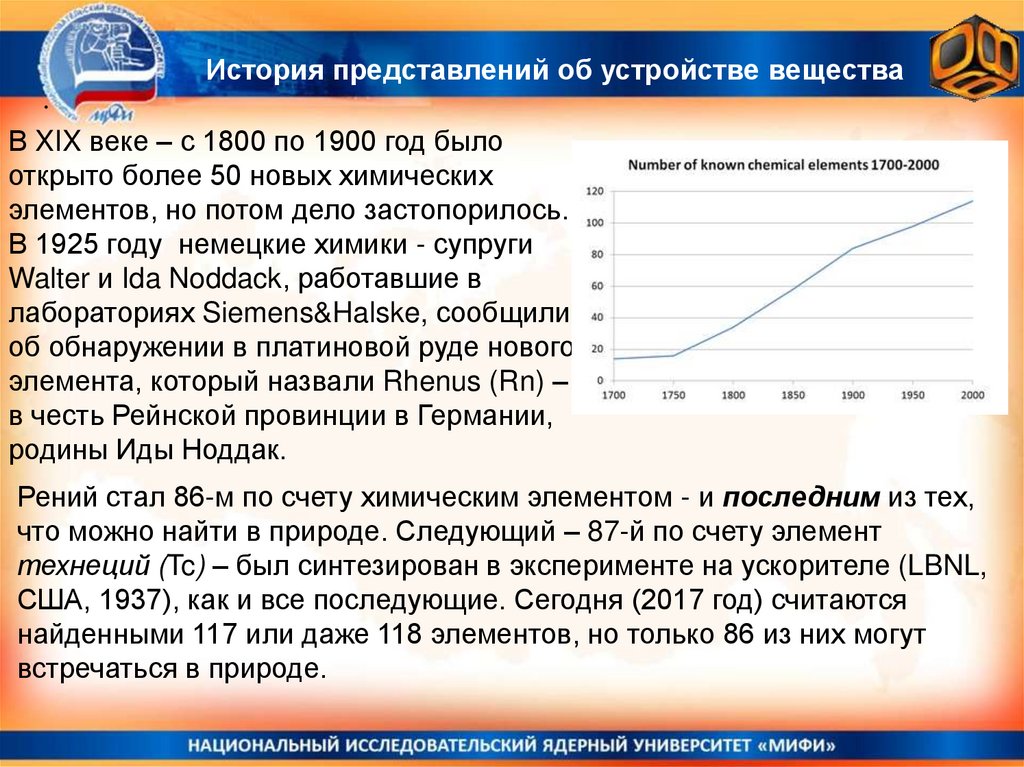
История представлений об устройстве вещества.
В XIX веке – с 1800 по 1900 год было
открыто более 50 новых химических
элементов, но потом дело застопорилось.
В 1925 году немецкие химики - супруги
Walter и Ida Noddack, работавшие в
лабораториях Siemens&Halske, сообщили
об обнаружении в платиновой руде нового
элемента, который назвали Rhenus (Rn) –
в честь Рейнской провинции в Германии,
родины Иды Ноддак.
Рений стал 86-м по счету химическим элементом - и последним из тех,
что можно найти в природе. Следующий – 87-й по счету элемент
технеций (Tc) – был синтезирован в эксперименте на ускорителе (LBNL,
США, 1937), как и все последующие. Сегодня (2017 год) считаются
найденными 117 или даже 118 элементов, но только 86 из них могут
встречаться в природе.
17.
История представлений о молекулах и атомахХХ век опять изменил представления о структуре материи. Была
установлена сложная составная структура атома и неприменимость к
описанию ее классической механики и электродинамики.
Antoine Henri
Becquerel
1853-1908
Pierre Curie
1859-1906
Maria
Sklodowska-Curie
1867-1934
ХХ век…
Но это уже СОВСЕМ другая
история….
Ernest Rutherford
(1871-1937)
18.
Термодинамика и статистическая физикаЭпизод 01-2
Что мы знаем про атомы и молекулы?
(параметры и характеристики)
19.
Атомы и молекулы)Молекула - наименьшая частица вещества, определяющая его
свойства и способная к самостоятельному существованию.
Молекулы построены из атомов.
Атом — наименьшая частица простого вещества (химического
элемента), входящая в состав и простых, и сложных веществ.
Молекулы состоят из атомов как
слова из букв. И как из нескольких
десятков букв можно составить сотни
тысяч разных слов, так и из
нескольких десятков .
Встречающихся в природе атомов
можно составить сотни тысяч разных
молекул, образующих разные
вещества с разными физическими и
химическими свойствами.
20.
Атомы и молекулы)Полученное методом силовой атомной спектроскопии
изображение молекулы пентацена C22H14
http://lenta.ru/news/2009/08/28/micro/v1.jpg
21.
Размеры молекул и атомовТипичный размер атомов: d ~ 10-10 м ; молекул ~>10-10-8 м
Единица измерения атомных расстояний: 1 Ангстрем = 10-10 м
1Å
5Å
22.
Масса молекул и атомовАтомная единица массы (1 а.е.м. = 1 Дальтон (Да)) приблизительно
равна массе самого легкого имеющегося в природе атома – атома
водорода
1 а.е.м. = 1Да = ~ MH = 1,66 ·10-27 кг
Массу других атомов и молекул определяют их массовые числа (А),
которые для атома каждого химического элемента указаны в таблице
Менделеева:
• Для водорода Н1: АН1 = 1
Для молекулярного водорода Н2: АН2 = 2
• Для воды Н2О: АН2О = 18
• Для углекислого газа СО2: АСО2 = 44
и т.д.
Пример: масса молекулы азота N2: MN2 = 28Да = 4,67·10-26кг
23.
Количество веществаКоличество вещества - это число
составляющих его атомов и/или молекул.
Для любых макроскопически заметных
количеств это число огромно. Считать
молекулы штуками – не удобно. Потому их
считают молями. Единица измерения
количества вещества в физике – моль
(mole). В одном моле вещества содержится
NA штук молекул.
NA = 6,02x1023 штук = 1 моль =
число Авогадро
Выбор этого числа привязан к
международной системе мер SI: 1 моль
атомарного водорода имеет массу почти
точно равную 1 грамм.
Amadeo Avogadro
1776-1856
Точное значение числа Авогадро,
рекомендованное CODATA
в 2015 году (с погрешностью):
NA = 6,02214082(11)·1023 моль−1.
Предполагается, что в новой версии
системы SI (в 2018 году) число
Авогадро будет установлено точно (без
привязки к физико-химическим
измерениям)
24.
Количество веществаОдин моль вещества – это NA = 6,02x1023 штук молекул
Молярная масса μ[г/моль] любого вещества - это масса одного моля
этого вещества, выраженная в граммах.
Для атомарного водорода μН
=
1 г/моль.
Молярная масса μ[г/моль] любого вещества численно равна его
массовому числу (см. таблицу Менделеева и справочники).
Примеры: μН
=
1 г/моль;
μН2 =
2 г/моль; μН20
=
18 г/моль
Количество вещества ν [моль] можно определить, зная массу вещества
М и его молярную массу μ[г/моль] :
ν[моль] = N штук молекул / NA = M[г] / μ[г/моль]
25.
Размеры молекул и атомов (эксперимент)Рассмотрим результат разлива капли нефти на поверхности воды
вода
Толщина монослоя (~размер молекулы) d
~ V/S ~ 3·10-10 м
26.
Термодинамика и статистическая физикаЭпизод 01-3
Вещество конденсированное и
разреженное.
27.
Конденсированное и разреженное веществоВещество, с которым мы имеем дело при обычных земных условиях,
может находиться в двух принципиально разных состояниях:
• Плотноупакованном (конденсированном), когда молекулы
(атомы) прижаты вплотную к друг-другу (твердые тела, жидкости, биообъекты). Сильное межмолекулярное взаимодействие при этом
удерживает их вместе, но дальнейшее сжатие практически не
возможно и возможности движения частиц очень ограничены
• Разреженное (газ). Когда молекулы находятся в беспрестанном,
действительно хаотическом движении и (в среднем) достаточно далеко
друг от друга, взаимодействуя только при столкновениях
В первую очередь для газа формулировалась изначально МКТ.:
Вещество состоит из микрочастиц – атомов и/или молекул
Атомы и молекулы (очевидно) взаимодействуют друг с другом и…
..находятся в состоянии беспрестанного хаотического движения
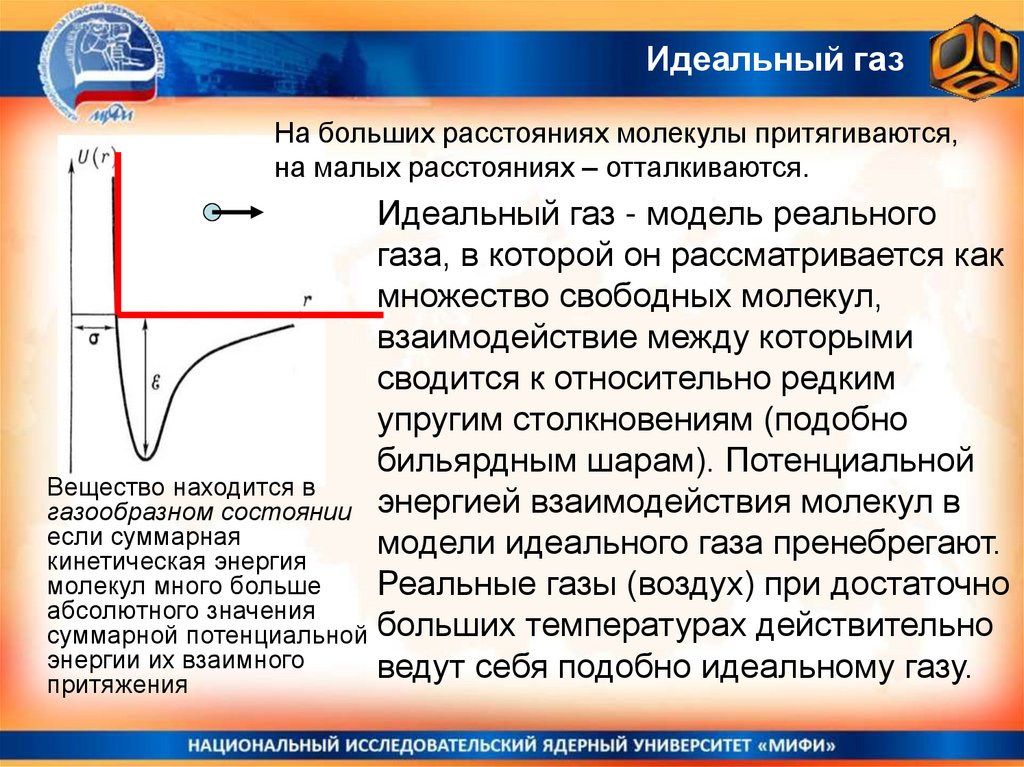
28. Потенциальная энергия взаимодействия молекул
Существование двух существенно разно-плотных состояний вещества газообразного и конденсированного – качественно объясняется тем, чтопотенциальная энергия взаимодействия молекул имеет зависимость от
расстояния между ними, похожую на показанную на рисунке.
Очевидно, что состояние со средними
межмолекулярными состояниями близкими к
r0
минимуму функции U(r~r0) устойчиво, а при
попытке еще больше сжать вещество r~>а
будут возникать значительные силы
отталкивания, препятствующие этому.
При больших r>>r0 расстояниях между молекулами силы
взаимодействия имеют характер притяжения, но слабого.
Если молекулы быстро движутся, это взаимодействие будет
неощутимым и молекулы будут двигаться каждая сама по
себе, лишь изредка сталкиваясь друг с другом (это газ!)
29.
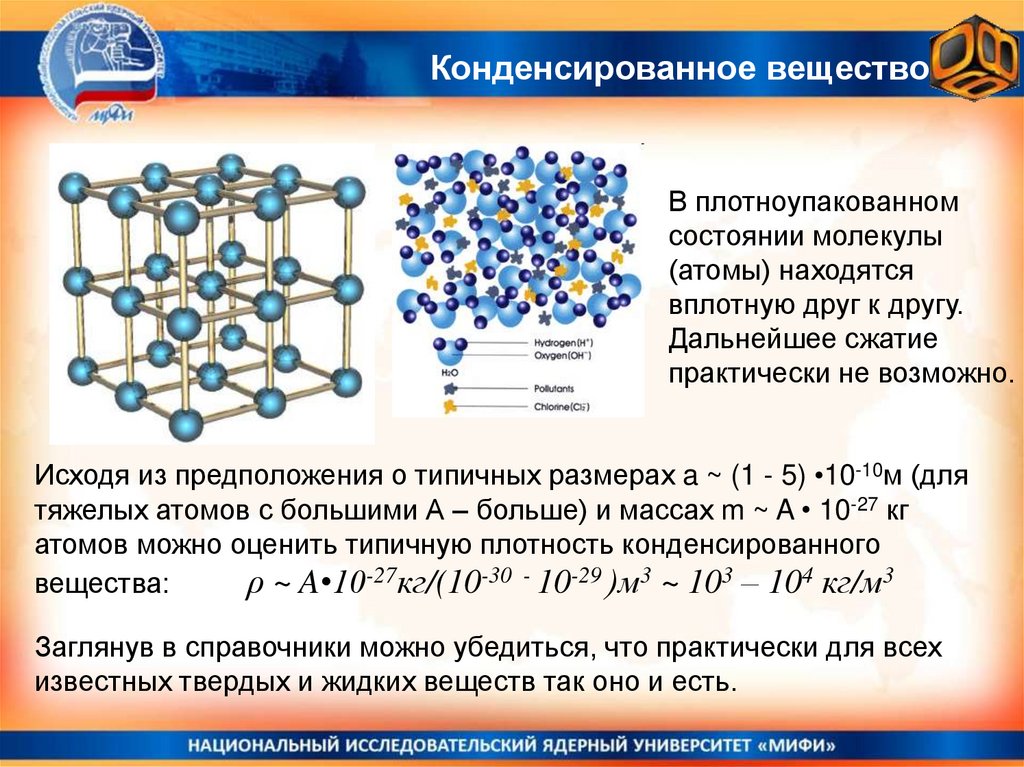
Конденсированное веществоВ плотноупакованном
состоянии молекулы
(атомы) находятся
вплотную друг к другу.
Дальнейшее сжатие
практически не возможно.
Исходя из предположения о типичных размерах a ~ (1 - 5) •10-10м (для
тяжелых атомов с большими А – больше) и массах m ~ A • 10-27 кг
атомов можно оценить типичную плотность конденсированного
вещества:
ρ ~ A•10-27кг/(10-30 - 10-29 )м3 ~ 103 – 104 кг/м3
Заглянув в справочники можно убедиться, что практически для всех
известных твердых и жидких веществ так оно и есть.
30.
Разреженное состояние вещества: газОценим теперь типичные межмолекулярные расстояния d в самом
распространенном газе – атмосферном воздухе при нормальных
атмосферных условиях.
Известен экспериментальный факт (закон Авогадро): при нормальных
условиях (давление равно давлению в земной атмосферы на уровне моря,
температура равна 00C) один моль газа занимает объем VА =~ 22,4 л.
Оценка концентрации молекул в воздухе n = NА/ VА ~ 1/d3 = 3,7· 1025 м-3
, Откуда d ~ 3 · 10-9 м ~ 10a. Расстояния d между молекулами газа
примерно в 10 и более раз больше, чем в жидкостях и твердых телах, а их
плотности должны различаться в 1000 и более раз, что так и есть.
ПРИМЕР: плотность воздуха = 1,3 кг/м3 , а плотность воды (вещество с
меньшей молекулярной массой, чем воздух) - 103 кг/м3
31.
General Physics NRNU MEPhIМолекулярная физика.
Лекция 02 (05)
10 марта 2021
Идеальный газ – самая простая модель
самого простого состояния вещества.
Лектор: доцент НИЯУ МИФИ,
Андрей Станиславович ОЛЬЧАК
32.
Разреженное состояние вещества: газГаз: расстояние между молекулами много больше размера
молекул (d>>r ~ в 10 раз в нормальных условиях и более).
ПРИМЕР: плотность воздуха = 1,3 кг/м3
Газ может неограниченно расширяться, не сохраняя ни
объема, ни формы. Газ занимает весь предоставленный
ему объем.
Взаимодействие молекул газа - столкновения.
Удары молекул газа о стенки сосуда или о поверхность
помещенного в газ тела создают давление газа
33.
Идеальный газНа больших расстояниях молекулы притягиваются,
на малых расстояниях – отталкиваются.
Идеальный газ - модель реального
газа, в которой он рассматривается как
множество свободных молекул,
взаимодействие между которыми
сводится к относительно редким
упругим столкновениям (подобно
бильярдным шарам). Потенциальной
Вещество находится в
газообразном состоянии энергией взаимодействия молекул в
если суммарная
модели идеального газа пренебрегают.
кинетическая энергия
молекул много больше
Реальные газы (воздух) при достаточно
абсолютного значения
суммарной потенциальной больших температурах действительно
энергии их взаимного
ведут себя подобно идеальному газу.
притяжения
34.
Идеальный газТраектория движения молекулы в случае газообразного
состояния вещества
35.
МакропараметрыЛюбые тела ( в том числе газы) в макроскопических
количествах состоит из огромного числа молекул.
Этот факт одновременно и усложняет, и облегчает описание
поведения макроскопических тел.
Для практического описания состояний разреженных газов,
близких к идеальному, используется всего несколько
усредненных макро-параметров:
V [м3] – объем
M [кг] - масса; ρ[кг/м3] = M/V – плотность вещества
P [Н/м2] – давление
T [К] – температура
μ [г/моль] – молярная масса; ν [моль] = M/μ = количество вещества
S - энтропия
36.
Среднее значение квадрата скорости молекулY
Бессмысленно пытаться проследить за
движением всех молекул - их слишком много.
Скорости разных молекул могут быть любыми,
но среднее значение скорости (или, что
важнее, квадрата скорости) - вполне
определенное и устойчивое:
<V> = 0 (в среднем газ покоится)
Z
X <V2> = (V 2 + V 2 + V 2 + ..+ V 2 )/ N > 0
1
2
3
N
В силу хаотичности движения молекул,
средние значения квадратов проекций
скоростей на оси X, Y, Z одинаковы:
<V2> = <Vx2 > + < Vy2 > + < Vz2 > ;
<Vx2 > = < Vy2 > = < Vz2 > = <V2> / 3
37.
Давление идеального газаПосле упругого удара о стенку молекулы массы m,
она отлетает , сменив знак компоненты скорости,
перпендикулярной стенке и передав ей импульс
Y
V
V’
2m<|Vx|>.
За время Δt о стенку ударятся половина молекул
из слоя ΔX= <|Vx|>Δt. Суммарный переданный
импульс составит:
ΔP = m<|Vx|>n<|Vx|>Δt S = nm<Vx2>ΔtS
Z
X
ΔX
где n[1/м3] - число молекул в единице объема,
S [м2] - площадь стенки.
Средняя сила действующая на единицу площади стенки называется
давлением газа:
Р = ΔP/ ΔtS = nm<V2> /3 = 2n<Ek>/3
Это и есть основное уравнение МКТ для идеального газа.
38.
Температура.Основное уравнение МКТ для идеального газа:
Р = 2/3n<Ek> = nΘ = nkT
Θ = 2/3<Ek> - абсолютная температура,
измеряемая в энергетических единицах [Дж]
Температура – мера средней кинетической энергии
движения молекул
T = Θ/k - абсолютная температура, измеряемая в градусах
Кельвина [K]
k = 1,38 х 10-23 Дж/К - коэффициент пропорциональности,
постоянная Больцмана.
Комнатная температура T ~ 300K ~ 4 • 10-21 Дж
<Ek> = 3kT / 2 = m<v2> / 2 => <v2> = 3kT / m
39.
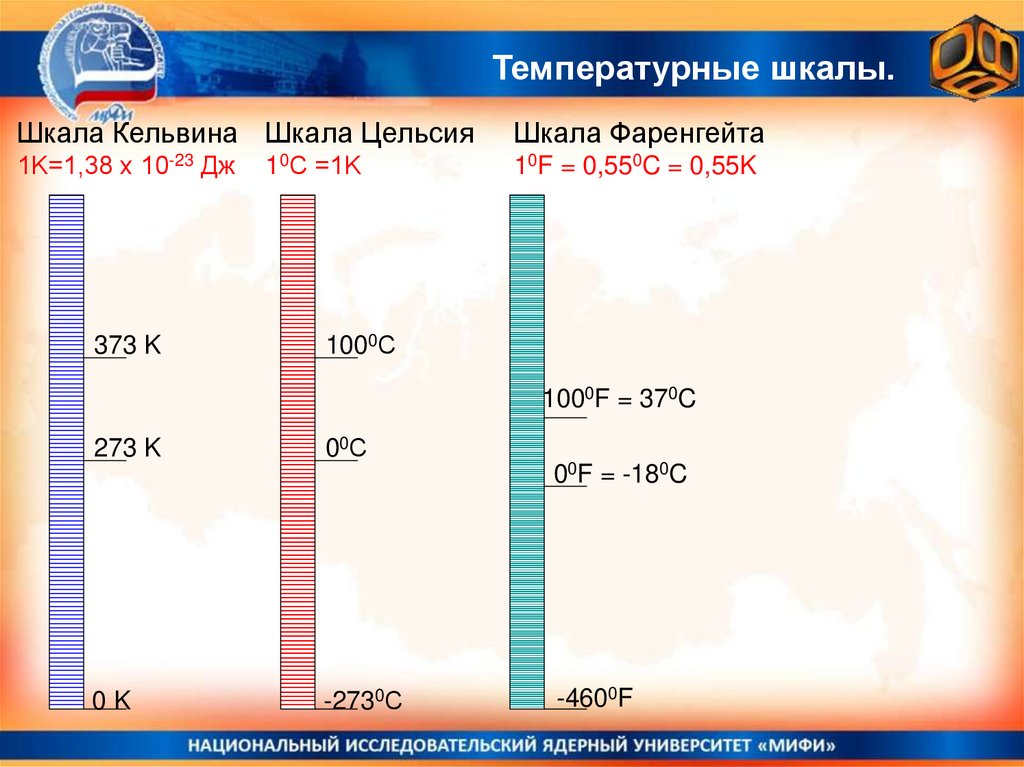
Температурные шкалы.Шкала Кельвина Шкала Цельсия
Шкала Фаренгейта
1K=1,38 х 10-23 Дж
10F = 0,550C = 0,55K
373 K
10С =1K
1000С
1000F = 370C
273 K
00С
00F = -180C
0K
-2730С
-4600F
40.
Основное уравнение идеального газа.Основное уравнение:
Р = nkT
Выразим n (число молекул в единице объема) через
макроскопические величины:
n = N/V = ν[моль]NA / V[м3] = (M/μ)(NA /V)
Основное макроскопическое уравнение состояния
идеального газа (уравнение Менделеева-Клапейрона):
РV = nkTV = νRT = (M/μ)RT
где R = kNA = 8,3 Дж/моль • К - универсальная газовая
постоянная
41.
Газовые законыРV = (M/μ)RT = νRT
Основное уравнение состояния идеального газа (уравнение
Менделеева(1874) – Клапейрона (1834))
PV = Const если Т = Const (изотермический процесс)
Для газа данной массы произведение давления газа на его объем постоянно,
если постоянна температура. (Р. Бойль,1662, Э. Мариотт,1677 )
P/T = Const если V = Const (изохорный процесс)
Для газа данной массы отношение давления газа к его температуре
постоянно, если объем не меняется. (Ж. Шарль,1787 )
V/T = Const если Р = Const (изобарный процесс)
Для газа данной массы отношение объема газа к его температуре
постоянно, если давление не меняется. (Ж. Гей-Люсак, 1802 )
42.
Дистанционный курс общей физики НИЯУ МИФИОсновы молекулярной и статистической
физики
Лекция 02
Идеальный газ
Спасибо за внимание!



































 physics
physics








