Similar presentations:
Культивирование клеток млекопитающих Розов Федор Николаевич
1. Культивирование клеток млекопитающих Розов Федор Николаевич
Большой практикум2. Когда нужно культивировать клетки?
• Исследование нормальной физиологии ибиохимии клеток
• Изучение свойств лекарств
• Получение рекомбинантных белков (в том
числе антител)
• Регенеративная медицина
3. План наших лекций
Оборудование
Среда культивирования клеток
Техники культивирования
Введение генетического материала в клетки
Контаминация в клеточных культурах
4. Оборудование
Часть1ОБОРУДОВАНИЕ
5. Что нужно для работы?
Соблюдение стерильностиПоддержание
оптимальных
условий
хранение
сбор материала
анализ
6. СO2 инкубаторы
Очень точноеподдержание
температуры
Контроль влажности
Создание газовой фазы с
заданными свойствами
(N2, O2, CO2)
Стерилизация
внутреннего пространства
7. Типы CO2 инкубаторов
Газовыйсостав
Только CO2
Мультигазовые
(контроль CO2, N2
и O2)
Содержание
воды в
атмосфере
Естественная
влажность
Повышенная
влажность
Стерилизация
внутреннего
пространства
Фильтрация
воздуха
Фильтрация и УФ
стерилизация
воздуха
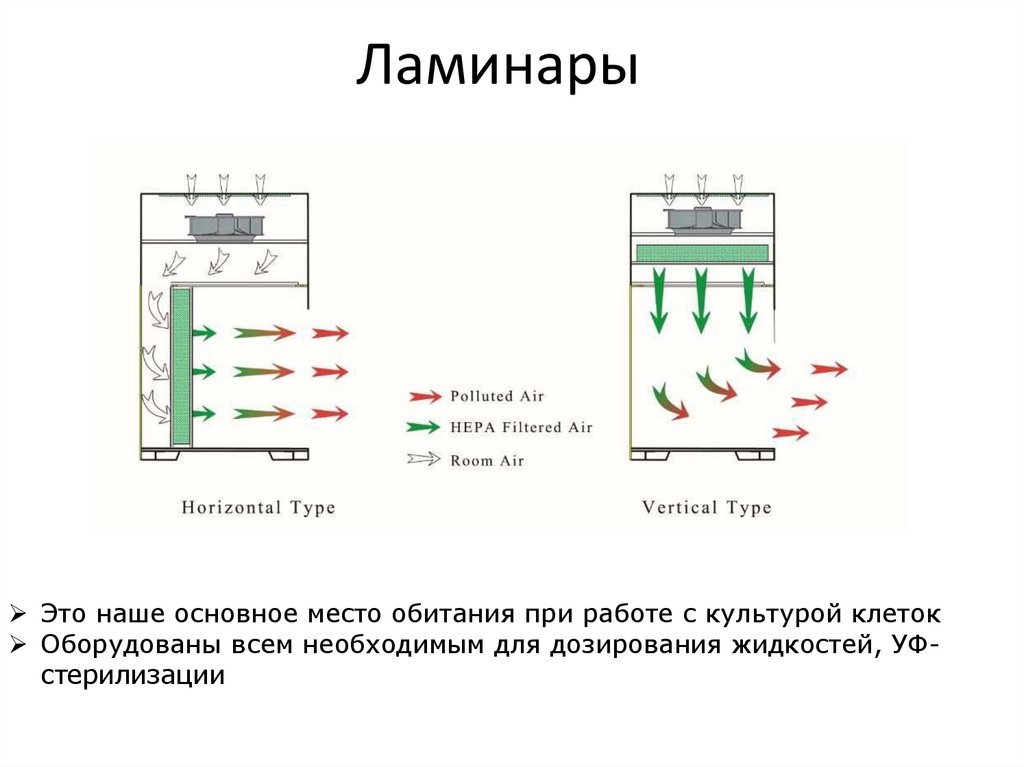
8. Ламинары
Это наше основное место обитания при работе с культурой клетокОборудованы всем необходимым для дозирования жидкостей, УФстерилизации
9. Правила работы в ламинаре
• В ламинаре должен быть минимумпредметов (часто это постоянный набор)
• Все необходимое для работы желательно
поместить в ламинар заранее
• До и после работы нужно провести УФ
стерилизацию ламинара
• Не оставляйте включенный газ
• Помните, каким типом ламинара вы
пользуетесь
• После себя оставляем порядок!
10.
11.
https://youtu.be/yJ_acpKglto12. Микроскопы
Инвертированные
Обязательно с фазовым контрастом
С цифровой камерой
Желательно иметь возможность работать с флуоресценцией
13. Сосуды Дьюара
Длительное хранение образцов (до десятков лет!)Транспортировка материала
Глубокая заморозка для последующей гомогенизации
!!!
Азот расширяется при испарении в 696 раз, поэтому
сосуды Дьюара НИКОГДА не закрывают герметично
Риск ожогов при попадании на одежду
Опасность удушья в закрытом помещении
https://youtu.be/bkiKKRGJbjc
14. Хранение в сосуде Дьюара
https://youtu.be/bkiKKRGJbjc15. Среда для культивирования клеток
Что входит в состав среды для культивирования
Физико-химические свойства сред
Сыворотки как источник ростовых факторов
«Семейство сред» Harry Eagle
Бессывороточные среды
16. Немного истории
• С.Рингер, 1882 – создание изотоничного раствора(поддерживал биение сердца лягушки)
• 30-40гг 20 века – создание более совершенных растворов
(Г. Кребс, М.Тирод, Г. Игл)
• Р.Г. Гаррисон, 1907 – впервые смог культивировать
нервные клетки лягушки с использованием
лимфатической жидкости
17. Немного истории
• M. T Burrows (1911) – выяснил, что для культуры тканитеплокровных лучше использовать плазму крови
(эксперименты на куриных эмбрионах)
• А. Carrel (1911-1913)-культивирование эмбрионов кур.
Добавление эмбрионального экстракта драматически
продлевает жизнь культуры.
• M. R. Reed(Lewis), W. H. Lewis (1911) –Показали, что сахара
и аминокислоты улучшают рост куриных эмбрионов
• W.L. Eagle (1940) – с помощью канцерогенеза создал
первую культуру иммортализованных фибробластов
мыши (L cells)
• G.O. Gey (1951) – культура клеток HeLa
18.
19. Подходы в создании сред культивирования
• Подход 1 (метод Фишера). Использованиедиализованной сыворотки, с последующим
добавлением в нее разных компонентов. С
применением этого подхода Г. Игл (1955)
определил необходимость в 13
аминокислотах и 8 витаминах- среда MEM
(minimum Eagle medium)
20.
• Подход 2 ( Philip R. White) – полный отказ от сыворотки и белков!Коктейль из глюкозы, солей, глутатиона. Вероятно, все же
требовалось до 10-20% сыворотки
• Лаборатория R. C. Parker – создание среды Medium 199
• Среда CMRL1066 – 58 низкомолекулярных компонентов
• W.R. Eagle (1956) – еще одна сложная по приготовлению среда
NCTC109
• C.Waymouth - упрощенная формула - среда MB 752/1
Все эти среды не позволяли клонировать клетки
• R.G. Ham (1963)- среда Ham F-10. Добавление фракций альбумина и
фетуина позволило клонировать клетки CHO (и пока только их)
• Ham F-12 – замена альбуминовой и фетуиновой фракции на
линолевую кислоту и путресцин. Каждый компонент также изменил
свою концентрацию. Среда позволяет клонировать фибробласты
мыши
21. Поиск заменителей сыворотки и разработка сред для отдельных линий (1970- наст время)
• Открыт инсулин как фактор, улучшающий рост культур• Последовательно открыты ростовые факторы: NGF, IGF,
FGF, PDGF, TGF
• Соли селена повышают ростовые характеристики
• L .J. Guilbert и N.N.Iscove (1976) – добавка инсулина,
трансферрина и альбумина улучшает рост
гемопоэтических клеток
• D. Barnes, G. Sato- разработана добавка ITS (инсулин,
трансферрин, селен)
• Комбинации базовых сред: (DMEM/F12, RPMI 1640/
DMEM/Ham's F‐12) позволяют компенсировать недостатки
друг друга
22. Что обычно входит в состав среды для культивирования более 50 химических соединений
Соли
Витамины
Аминокислоты
Глюкоза
Источники ростовых факторов
Индикатор pH
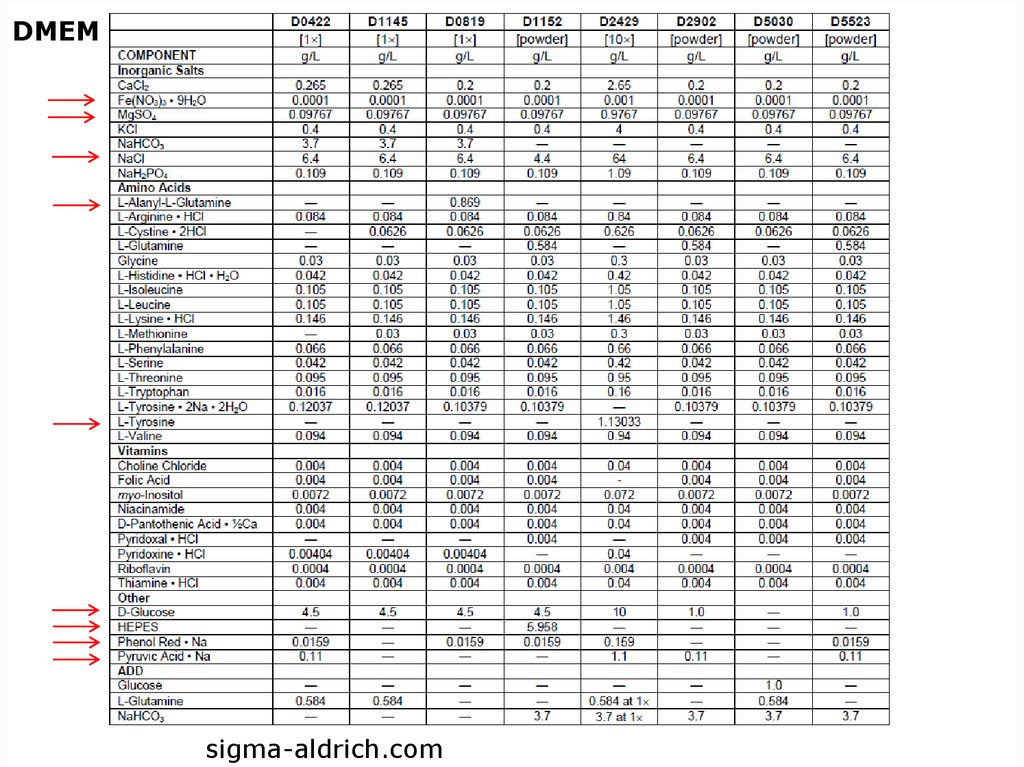
23.
DMEMsigma-aldrich.com
24. Производные сред Игла
Норман ИсковIMDM
(изменен состав
аминокислот
и витамиинов)
MEM
(4xкратная конц.
аминокислот)
BME
(Harry Eagle,
1955)
Фибробласты
HeLa
Glasgow
MEM
(добавлен
триптозофосфат)
Гарри Игл
1905-1992
DMEM
(4хкратная конц.
витаминов
и аминокислот)
Ренато Дульбекко
1914-2012. Нобелевская
премия (1975)
25. pH среды Контролируется индикаторами (феноловый красный)
A- pH 6.5
B- pH 7.0
C- pH 7.4
D - pH 7.6
E - pH 7.8
Большинство иммортализованных культур растут при pH 7.0-7.4.
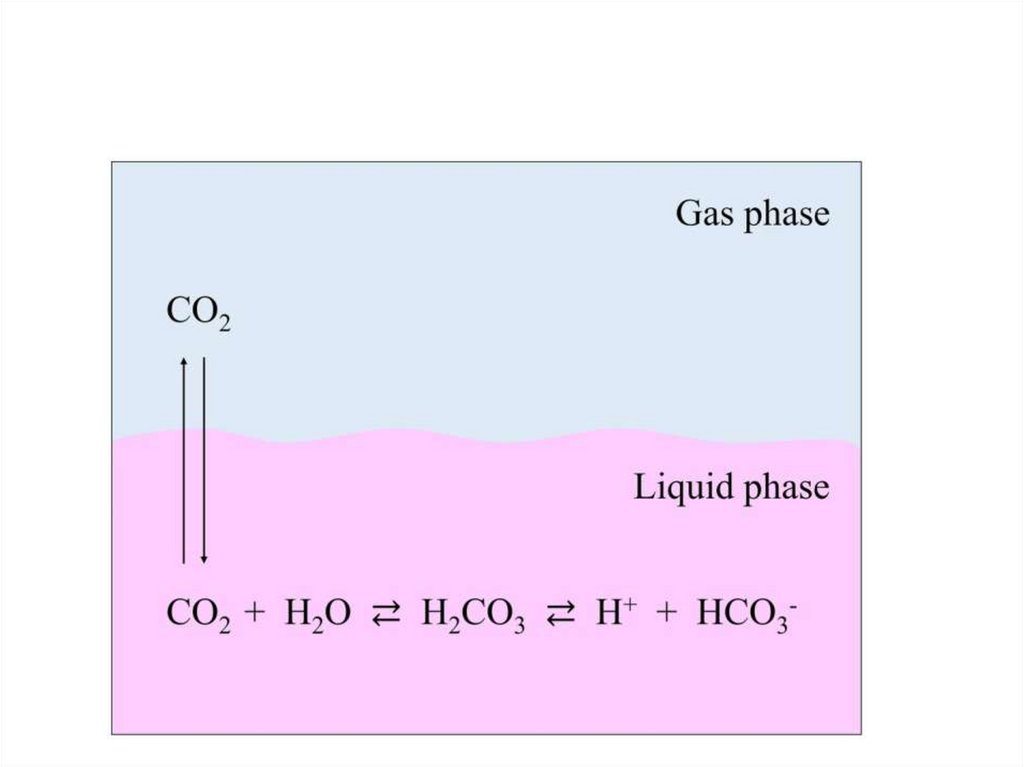
26. Поддержание рН среды: CO2 и бикарбонат натрия
Равновесие (1) и (2) достигается при pH 7.4Альтернативные буферные системы:
-HEPES (до 20мМ)- способен лишь частично снизить концентрацию
бикарбоната в среде и зависимость от CO2
-высокие (до 500мг/мл) концентрации пирувата натрия – за счет
стимуляции дыхания клеток (среда Leibovitz L15)
-очень высокое содержание аминокислот (среда для транспортировки
клеток)
27.
28. Кислород
• Требования к содержанию кислорода очень зависятот типа клеток
• Многие культуры (СКК, МСК) требуют сниженное по
сравнению с атмосферным содержание O2
• Трансформированные клетки отличаются
повышенным уровнем гликолиза и меньше зависят
от кислорода
• В состав многих сред входит меркаптоэтанол,
глутатион, DTT и другие гасители свободных
радикалов
29. Другие факторы
• ОсмолярностьПлазма человека – 290 mosmol/kg. Культура клеток – 260310 mosmol/kg
При длительном культивировании без смены среды осмолярность нужно слегка снизить!
• Температура
+370С.
При перегреве на 2 градуса клетки погибают за несколько
часов.
Проверяйте свой инкубатор регулярно. Не используйте холодные и перегретые среды!
• Поверхностное натяжение
Особенно важно для суспензионных культур
Не допускайте пены при пипетировании!
30. Сыворотка-это…
• Ростовые факторы• Жирорастворимые витамины
• Микроэлементы (селен, молибден,
рубидий)
• Ингибиторы (TGFb, белки системы
комплемента)
В зависимости от задачи используют сыворотки, полученные
от разных организмов (корова, лошадь, человек).
Важно: сыворотки разных лотов могут сильно различаться.
FBS (fetal bovine serum) – один из самых удобных видов
сыворотки
31. Ростовые факторы в сыворотке
• PDGF – тромбоцитарный фактор роста, основнойфактор роста фиброблатов
• TGFb- ингибитор роста эпителиальных клеток
• Семейство FGF – факторы роста фибробластов
• EGF – эпидермальный фактор роста
• Ang и Angptl - ангиопоэтины и ангиопоэтинподобные белки
• Il1, Il6 – факторы роста гемопоэтических
предшественников
32. Техника культивирования клеток
• Способы культивирования клеток• Пластик для культивирования
• Техника пересева клеток
33. Способы культивирования клеток
суспензионноестационарное
Способы культивирования клеток
Зависят от объема культуры и особенностей клеток
34.
35. Способы пересева клеток
• Суспензионные – просто посчитать и разбавитьсвежей средой
• Полуприкрепленные– механически отделяют от
субстрата серологической пипеткой
• Фибробласты и эпителий
- Отделяют от субстрата растворами хелаторов
(EDTA)
- ферментативно (трипсин, диспаза, коллагеназа)
- механически (скребки)
36. Способы подсчета клеток
Визуально
Подсчет в камере Горяева
Электронные счетчики
Центрифугирование-взвешивание
37. Подсчет в камере Горяева
• Суспензия клетокдолжна быть
тщательно
перемешана
• Камера должна быть
чистой
• Не допускать
переполнения камеры
• Не ошибаться в
подсчетах
38.
https://www.youtube.com/watch?v=pP0xERLUhyc
39. Подсчет с помощью автоматических счетчиков
Vi-Cell (Beckman Coulter)Быстрый подсчет десятков образцов
Определение размера клеток
Высокая точность
TC20 (Bio-Rad)
Определение клеточного титра и жизнеспособности
Небольшой размер
Возможность анализировать несколько типов клеток в одном
образце
40. Клетки HEK293
41. Преимущества HEK293 и их производных
• Неприхотливы, хорошо растут в простых средах, в т. ч.бессывороточных
• Легко переходят из прикрепленного в суспензионное
состояние
• Способны к секреции белков с «человеческим» типом
ПТМ: гликозилированием и фосфорилированием
• Хорошо поддаются трансфекции практически любым
способом
• Могут быть использованы как для стабильного, так и для
временного получения рекомбинантных белков
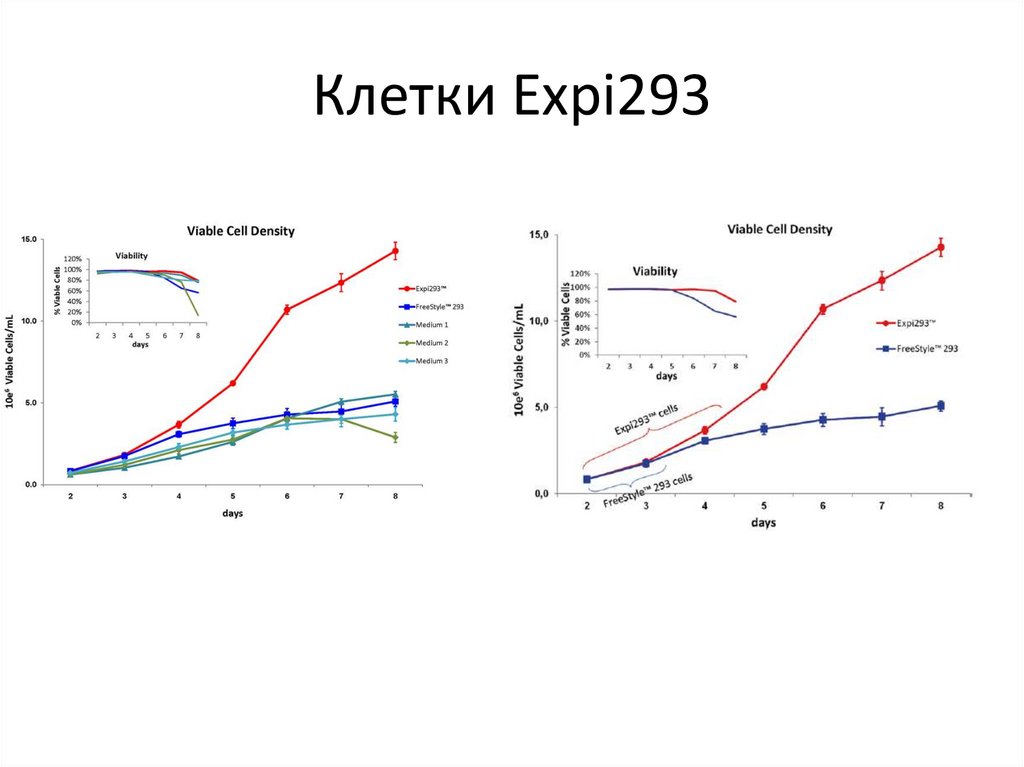
42. Expi293 Expression System kit
Богатая среда, универсальная и для роста и трансфекцииКлетки Expi293F, способные к быстрому росту в суспензии
Эффективный и нетоксичный реагент для трансфекции
Энхансеры трансфекции
Эффективный ДНК вектор
43. Клетки Expi293
44. Expifectamine 293
45. Состав наборов (китов) часто закрыт. Информация частично доступна из патентов
46. Высокоэффективный вектор
GOICMV- human cytomegalovirus
immediate-early enhancer and
promoter
WPRE- Woodchuck Hepatitis Virus
(WHP) Posttranscriptional Regulatory
Element. Base pairs 1093 to 1684 of the
Woodchuck hepatitis B virus (WHV8)
genome. When used in the 3′ UTR of a
mammalian expression cassette it can
significantly increase mRNA stability and
protein yield.
47. Введение генетического материала в клетки млекопитающих
ВВЕДЕНИЕ ГЕНЕТИЧЕСКОГОМАТЕРИАЛА В КЛЕТКИ
МЛЕКОПИТАЮЩИХ
48. Трансфекция клеток Трансфекция – введение плазмидного генетического материала в клетки эукариот
• Сравнение методов трансфекции клеток• Оценка эффективности трансфекции
49. Почему происходит трансфекция?
Свойство ДНКПроцесс
Отрицательный
заряд
Перемещение Электропорация
ДНК в
электрическом
поле
Наличие
фосфатных групп
Выпадение в
осадок в
растворе
хлорида
кальция
Способность
Образование
включаться в
ДНКлипидные мицеллы липидных
частиц
Метод трансфекции
Кальций-фосфатная
Липофекция
50. Кальций-фосфатная трансфекция
• В присутствии солейкальция ДНК выпадает
в осадок
• Эффективность
процесса зависит от pH
• Размер частиц осадка
зависит от
интенсивности
перемешивания
CaCl2
DNA в растворе
HEPES pH 7,05
51. Липосомный метод трансфекции
52. Электропорация
Зависит от…• Продолжительности
импульса
• Напряженности
электрического поля
• Формы кривой
импульса
• Числа импульсов
• Концентрации клеток
и плазмиды
53. Как выбрать метод трансфекции
МетодЦена
Эффективность
выживаемость
Особенности
Кальцийфосфатная
Крайне
низкая
Средняя
Отличная
Используется для трансфекции
препаративных количеств клеток. Очень
зависит от pH при формировании
комплексов.
Эффективность зависит от клеточной
линии
DEAEдекстран
Крайне
низкая
Средняя
Отличная
Редко используется для стабильной
интеграции плазмидной ДНК в геном
Электропор
ация
Высокая
Зависит от
множества
факторов
Обычно низкая
Обычно требует оптимизации
Проводится в специальных кюветах или
капиллярах
Поликатион
ные
полимеры
Низкая
Высокая
Зависит от
типа клеток
Используется для трансфекции
аналитических и препаративных
количеств клеток. Очень зависит от
клеточной линии
Липофекция
Высокая
Высокая
Обычно
высокая
Может быть сильно токсична для
отдельных культур. Ингибируется
антибиотиками
54. Оценка эффективности трансфекции
• E=n/N*100, где n-число ЖИВЫХ клеток,получивших плазмиду, N-общее число
ЖИВЫХ клеток
• Для оценки эффективности используются
флуоресцентные белки или ферменты
(галактозидаза, люцифераза,
хлорамфениколацетилтрансфераза)
• Выживаемость – важный параметр
успешности трансфекции (оценивается
разными способами, в том числе методом
исключения красителей)
55.
Примеры экспрессионных векторовhttp://www.exonbio.com/vector_construction.php
http://www.thermofisher.com
http://blog.addgene.org/topic/plasmids-101
56. Гены позитивной селекции
NameGene Conferring
Resistance
Cell Types*
Mode of
Action**
Working
Concentation***
Blasticidin
bsd
HeLa, NIH3T3,
CHO, COS-1,
293HEK
Inhibits
termination step
of translation
2-10 ug/mL
neo
HeLa, NIH3T3,
CHO, 293HEK,
Jurkat T cells
Blocks
polypeptide
synthesis at 80S;
inhibits chain
elongation
100-800 ug/mL
hygB
HeLa, NIH3T3,
CHO, Jurkat T
cells
Blocks
polypeptide
synthesis at 80S;
inhibits chain
elongation.
50-500 ug/mL
pac
HeLa, 293HEK,
Jurkat T cells
Inhibits protein
synthesis;
premature chain
termination
1-10 ug/mL
Sh bla
HeLa, NIH3T3,
CHO, COS-1,
293HEK, Jurkat T
cells
Complexes with
DNA; causes
strand scissions
100-400 ug/mL
G418/Geneticin
Hygromycin B
Puromycin
Zeocin
57. Контаминация в клеточных культурах
КОНТАМИНАЦИЯ В КЛЕТОЧНЫХКУЛЬТУРАХ
58. Контаминация клеточных культур
Типы контаминации
Источники
Методы предотвращения
«Лечение» клеточных культур
59. Типы контаминации
Контаминация«Химическая»
-детергенты
-следы металлов
-соли
«Биологическая»
-вирусы
-микоплазма
-бактерии
-грибы
-другие клеточные культуры
60. Почему опасна контаминация?
• «Отравление» клеточной культурыбактериальными токсинами
• Метаболиты аргинина и пуриновых
оснований токсичны для клеток
• Изменение pH среды
• Конкуренция за питательные вещества
61. Источники контаминации
ИсточникОсновной вид
Как избежать?
Увлажненный инкубатор
Грибы
Протирать резиновый
уплотнитель 70% спиртом.
Регулярно менять воду в
резервуаре на свежую
автоклавированную
Плохо простерилизованные
среды и посуда
Споры бактерий и грибов
Регулярно проверять
автоклав.
Тестировать приготовленные
среды перед использованием
Человек
Микоплазма
Грибы
Бактерии
Не работать больным
Надевать перчатки
Носить сменную обувь
Сыворотка
Микоплазма, вирусы
Использовать сыворотку
надежных производителей
Сами клеточные культуры
Микоплазма, вирусы,
грибы, бактерии
Не использовать клеточные
культуры из непроверенных
коллекций
62. Особенности разных видов контаминации
Типконтаминации
Особенности
pH среды
Способы устранения
Микоплазма
Сложно обнаружить и
лечить
Не меняется
Крайне сложно лечить
Бактерии
От момента инфекции до
полного «зароста»
культуры могут пройти
считанные часы
Обычно закисляется
Антибиотики
антибактериального
действия
(пенициллин+стрепто
мицин, гентамицин,
Грибы
Крайне сложно лечить.
Могут сосуществовать с
клетками
Обычно не меняется,
но может
защелачиваться
Антибиотики
(e.g.Fungizone)
Вирусы
Сложно детектировать и
лечить. Происхождение
вируса может быть очень
разнообразным
Не меняется
Вылечить практически
невозможно
63. Методы предотвращения контаминации
• Только сыворотка отнадежного
производителя!
• Регулярные
профилактические
работы: обработка
инкубатора и ламинара
• Периодически меняйте
протокол использования
антибиотиков
• Никаких клеток из
непроверенных
источников!
64. Микоплазма A conservative estimate states that between 15-35% of all continuous cell cultures are contaminated with mycoplasma,
some estimates are even higher (up to 80 % in some countries)Lonza
• Симптомы контаминации скрыты (часто
клетки просто медленно растут)
• Дорого и трудоемко детектировать
• Слабо чувствительна к антибиотикам
65. Проблемы, связанные с присутствием микоплазмы в клеточных культурах
Снижаетэффективность
трансфекции
Вызывает
хромосомные
аберрации
Изменяет
профиль
экспрессии
поверхностных
маркеров
Повышает
чувствительность
к апоптозу
Микоплазма
Снижает
титр
лентивирусов
в упаковочных
клетках
Меняет
профиль
экспрессии
генов
Ингибирует
рост
клеток
вносит
артефакты
в MTT assay
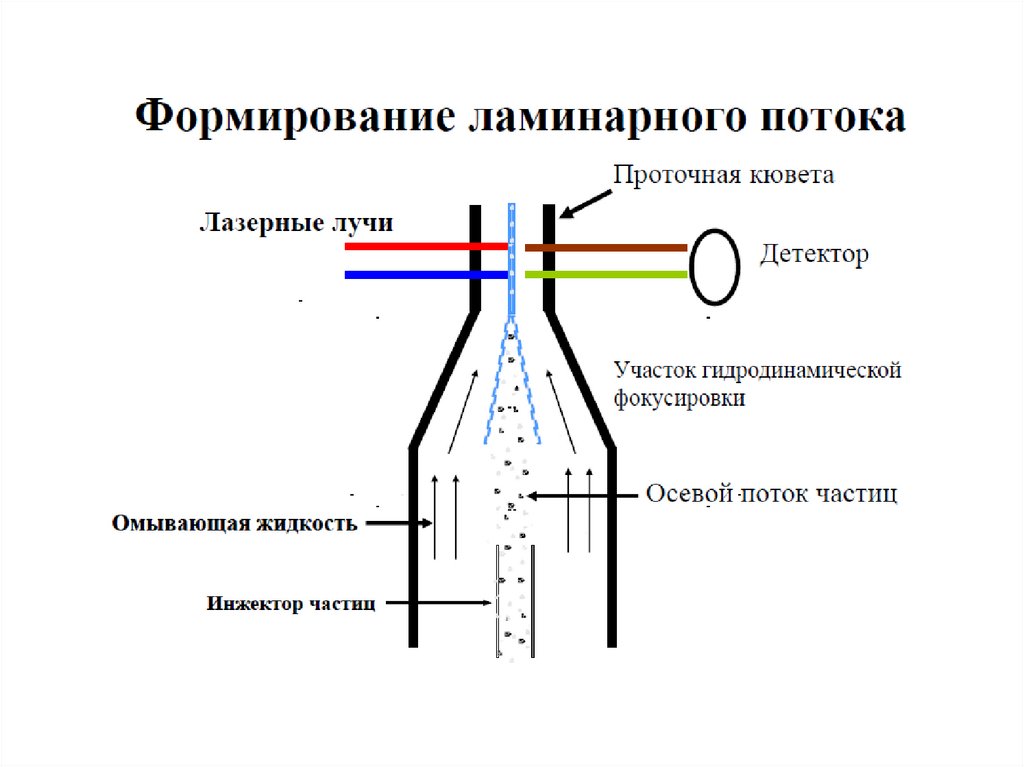
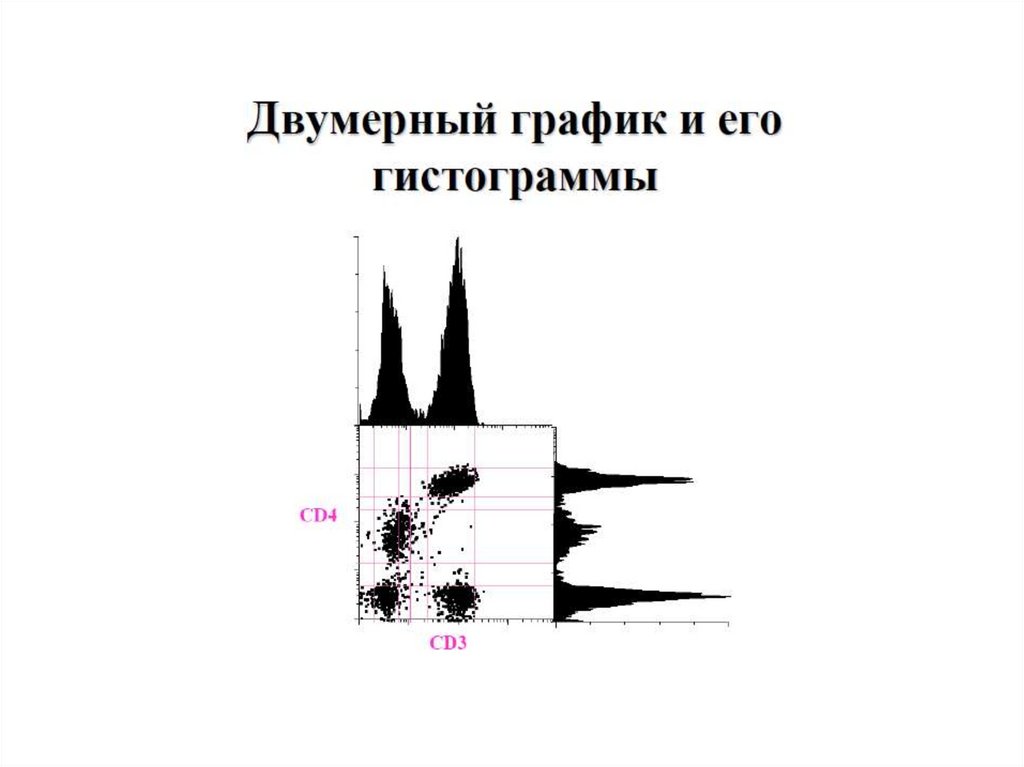
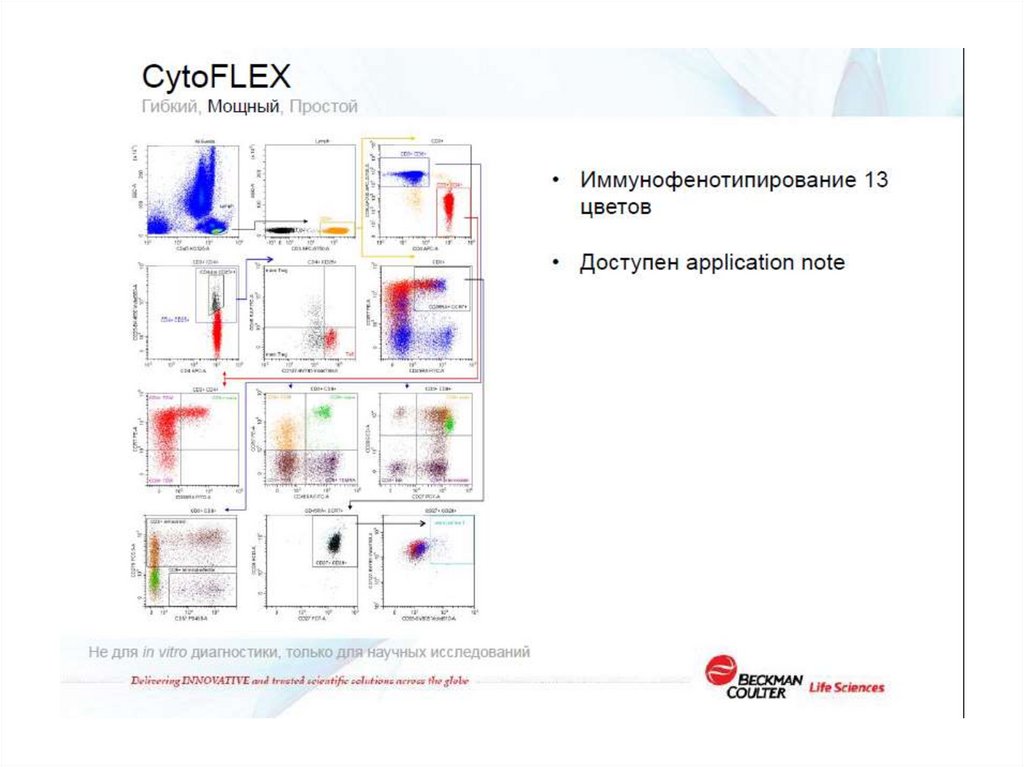
66. Основы проточной цитометрии
ОСНОВЫ ПРОТОЧНОЙЦИТОМЕТРИИ
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
https://www.youtube.com/watch?v=EQXPJ7eeesQ
79.
80.
81.
B2-R0-V4-Y482.
83.
84. Итак, что нужно уметь, чтобы культивировать клетки
• Освоить навыки стерильной работы• Уметь определять жизнеспособность и
плотность культуры
• Правильно культивировать клетки
• Читать методичку













































































 biology
biology








