Similar presentations:
Реакции замещения
1.
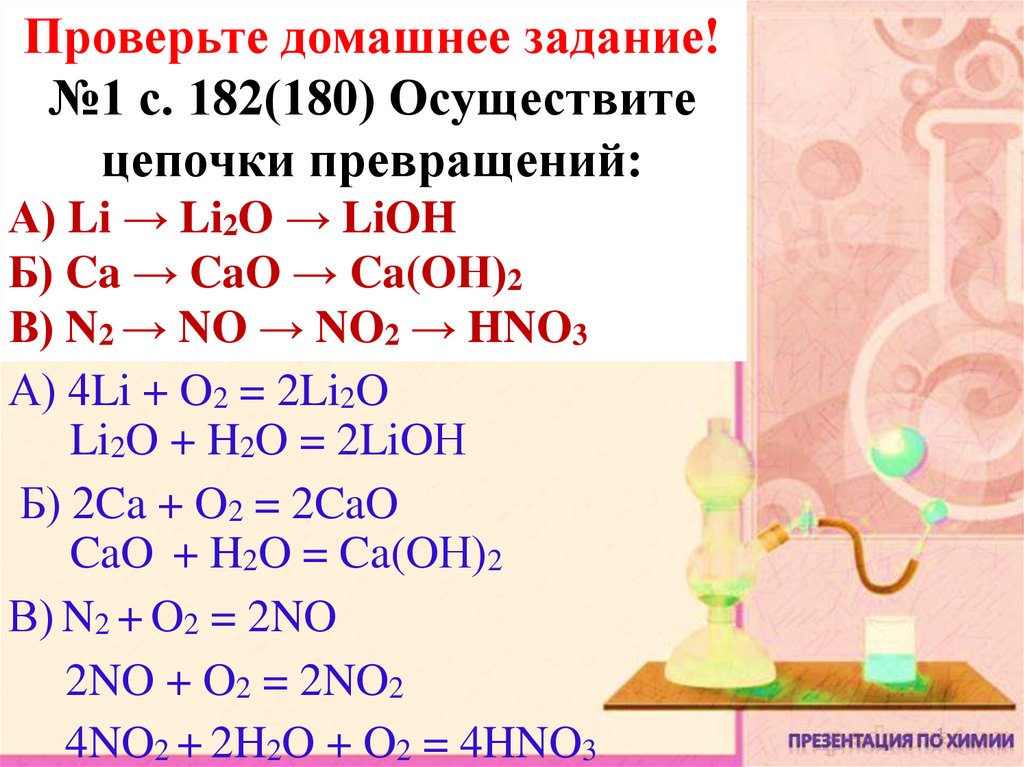
Проверьте домашнее задание!№1 с. 182(180) Осуществите
цепочки превращений:
А) Li → Li2O → LiOH
Б) Ca → CaO → Ca(OН)2
В) N2 → NO → NO2 → HNO3
А) 4Li + O2 = 2Li2O
Li2O + H2O = 2LiOН
Б) 2Ca + O2 = 2CaO
CaO + H2O = Ca(OН)2
В) N2 + O2 = 2NO
2NO + O2 = 2NO2
4NO2 + 2H2O + O2 = 4HNO3
1
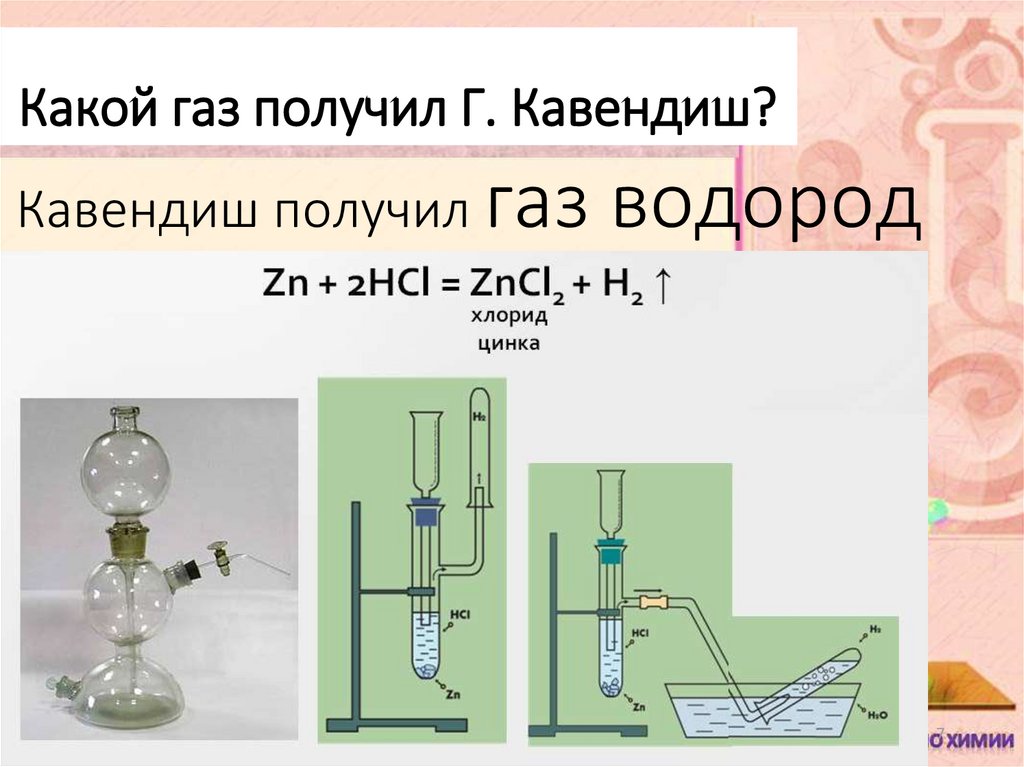
2. Лорд Генри Кавендиш – английский физик и химик, впервые получивший «гремучий газ» в 1766г, используя соляную кислоту и цинк.
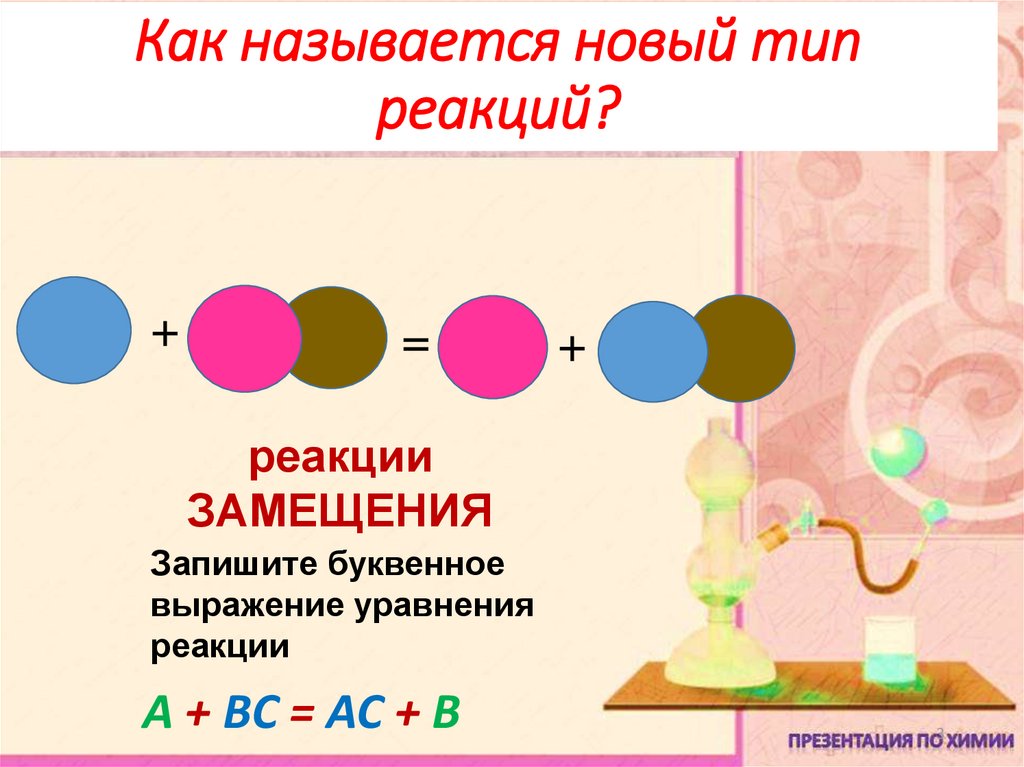
23. Как называется новый тип реакций?
+=
+
реакции
ЗАМЕЩЕНИЯ
Запишите буквенное
выражение уравнения
реакции
А + ВС = АС + В
3
4.
Тема урока:Реакции замещения
Цели урока:
1.Что происходит при реакциях замещения?
2.Как записываются уравнения реакций
замещения?
3.При каких условиях протекают данные
реакции?
4.Какой газ открыл (получил) Г. Кавендиш?
5.Какие правила техники безопасности нужно
выполнять при проведении опытов по
изучению реакций замещения?
8 класс4
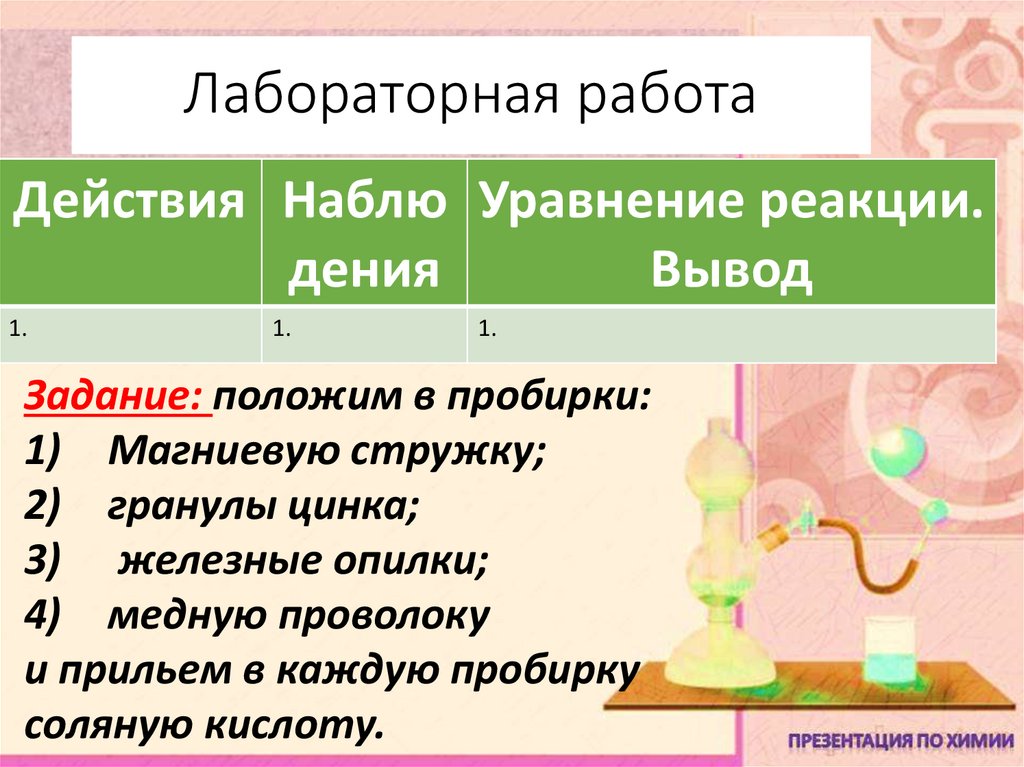
5. Лабораторная работа
Действия Наблю Уравнение реакции.дения
Вывод
1.
1.
1.
Задание: положим в пробирки:
1) Магниевую стружку;
2) гранулы цинка;
3) железные опилки;
4) медную проволоку
и прильем в каждую пробирку
соляную кислоту.
6. Правило 1. Ряд Н.Н. Бекетова
Металлы, стоящие до водорода,6
7. Кавендиш получил газ водород
Какой газ получил Г. Кавендиш?Кавендиш получил газ
водород
7
8. Mg + 2HCl = MgCl2 + H2↑ Zn + 2HCl = ZnCl2 + H2↑ Fe + 2HCl = FeCl2 + H2↑ Cu + 2HCl = реакция невозможна, т.к. медь стоит после
Записать уравнения химическихреакций
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Cu + 2HCl = реакция невозможна,
т.к. медь стоит после водорода
в ЭРНМ
8
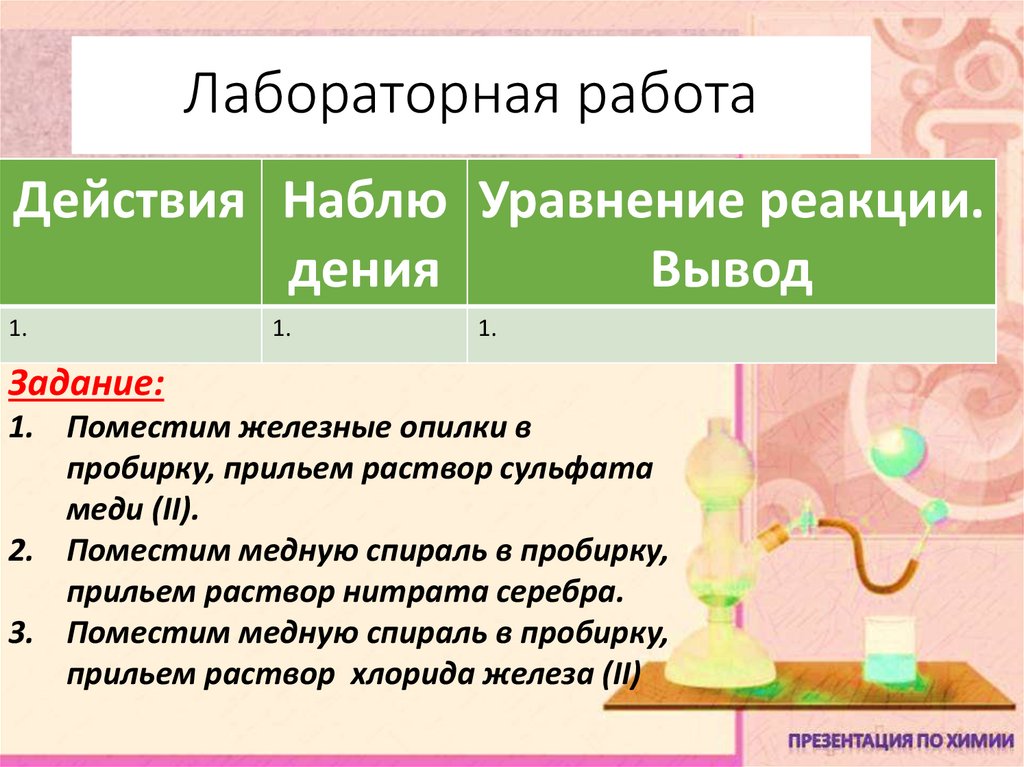
9. Лабораторная работа
Действия Наблю Уравнение реакции.дения
Вывод
1.
1.
1.
Задание:
1. Поместим железные опилки в
пробирку, прильем раствор сульфата
меди (II).
2. Поместим медную спираль в пробирку,
прильем раствор нитрата серебра.
3. Поместим медную спираль в пробирку,
прильем раствор хлорида железа (II)
10. Правило 2 Ряд Н.Н. Бекетова
В реакциях между металлами и солями:• Каждый металл вытесняет из солей (в водных
растворах) все те металлы, которые стоят
правее его в электрохимическом ряду.
• Все соли должны быть растворимы в воде.
Исключение из правил 1 и 2:
Металлы, расположенные до Mg, в водных
растворах кислот и солей взаимодействуют с
водой и вытесняют из неё водород:
2Na + 2H2O = 2NaOH + H2
10
11. Fe+ CuSO4 = FeSO4 + Cu↓ Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓ Cu + FeCl2 = реакция невозможна, т.к. медь стоит правее катиона железа в
Записать уравнения химическихреакций
Fe+ CuSO4 = FeSO4 + Cu↓
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Cu + FeCl2 = реакция невозможна,
т.к. медь стоит правее катиона
железа в ЭРНМ
11
12.
Реакции замещенияЭто такие реакции, в
результате которых атомы
простого вещества
замещают атомы одного из
элементов в сложном
веществе.
2
2
(А + ВС = АС + В)
12
13.
Домашнее задание§ 32,
Закончите уравнения возможных
реакций:
1) Аl + H2SO4 =
2) Cu + FeSO4 =
3) Mg + Zn(NO3)2 =
4) Ag + HCl =
Объясните возможность протекания
данных реакций.
выучить правила
.
13








 chemistry
chemistry








