Similar presentations:
Вещества
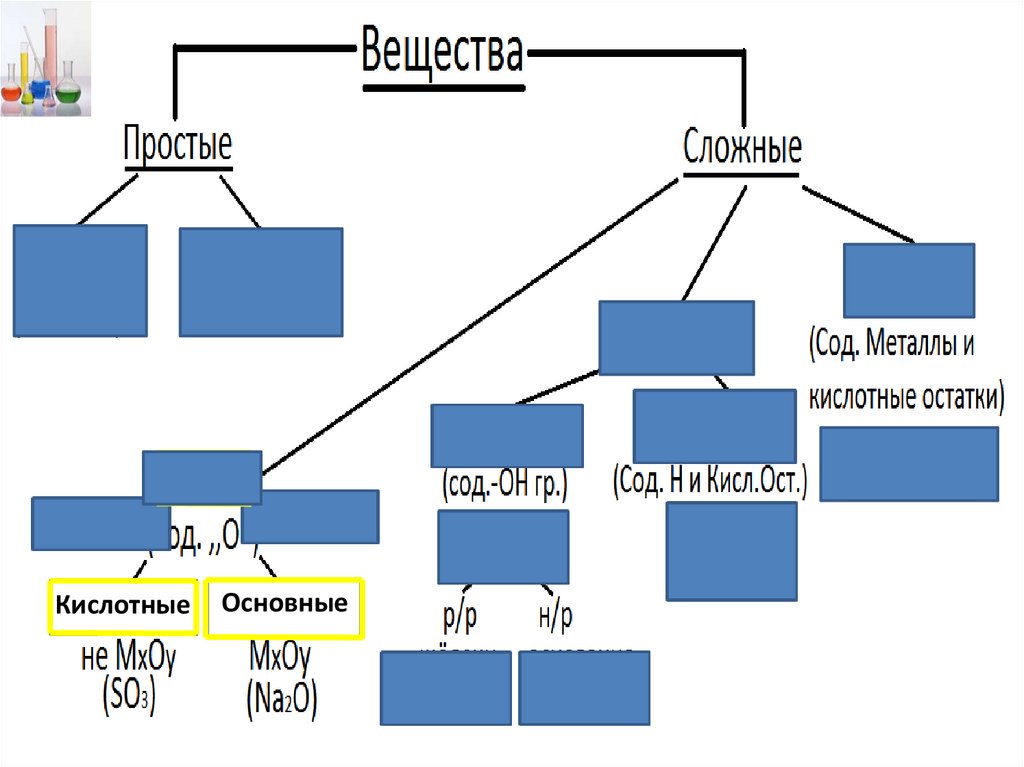
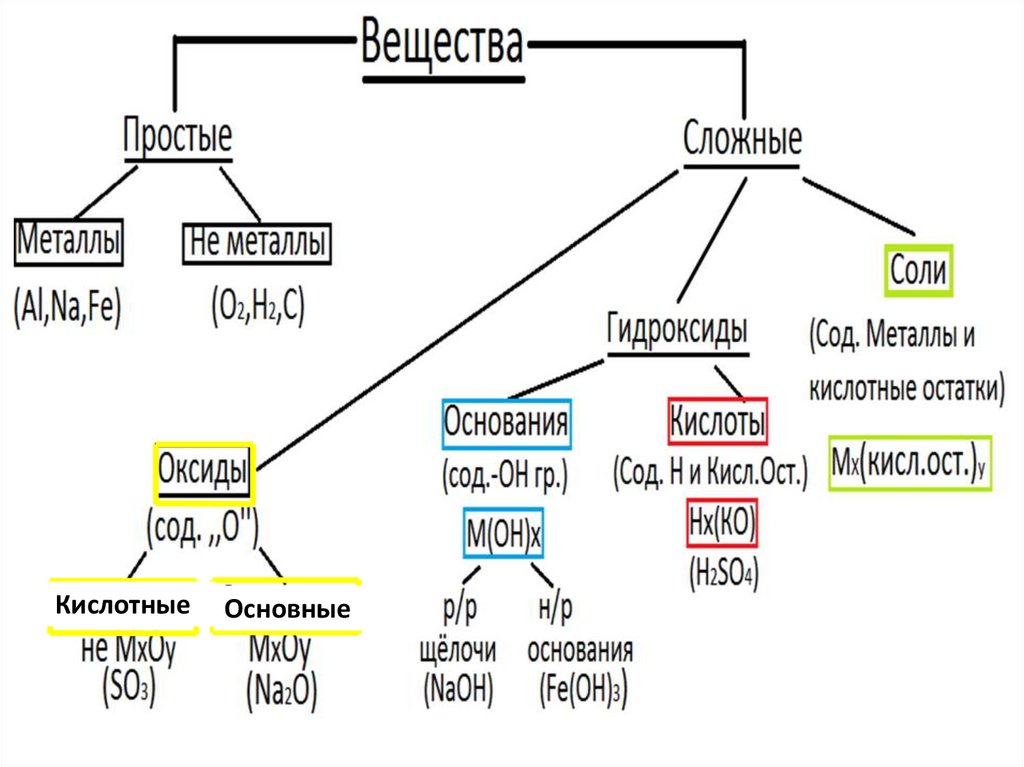
1. Вещества
2.
КислотныеОсновные
3.
КислотныеОсновные
4.
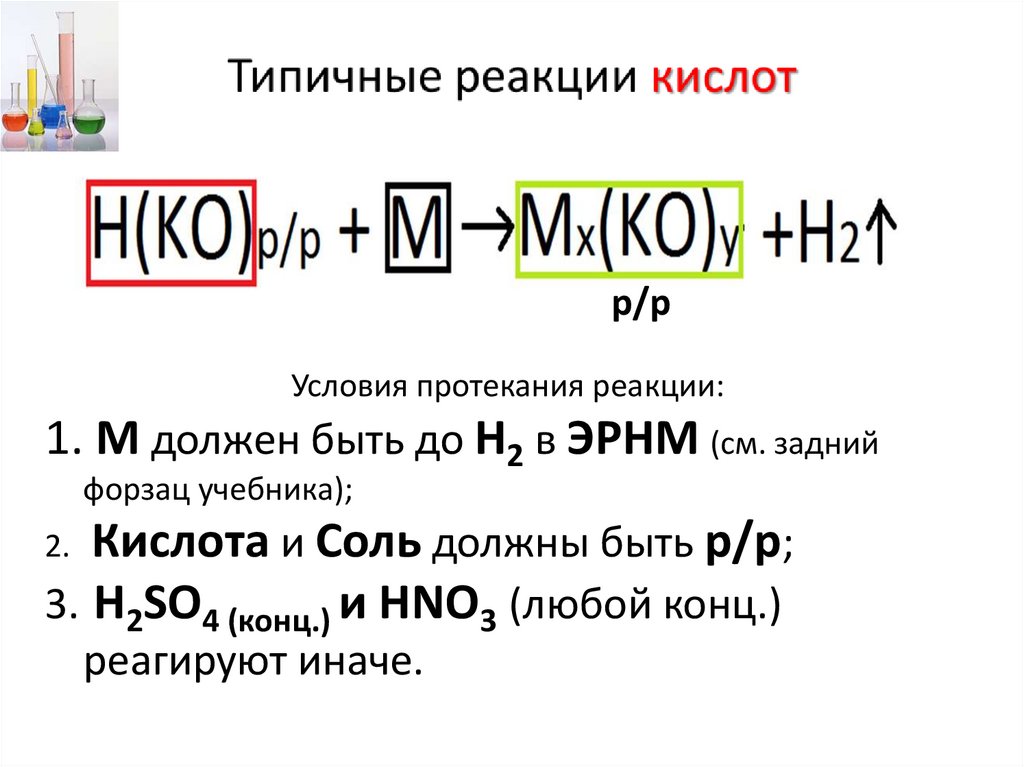
Типичные реакции кислот• Кислоты – это электролиты, которые при
диссоциации образуют катионы
водорода Н+ и анионы кислотного
остатка (Cl-, SO42-, PO43-)
5.
Сила кислот убывает в ряду:HCl > H2SO4 > HNO3 > H2SO3 >
>H3PO4 > HNO2 >H2CO3 > H2S >
>H2SiO3
Каждая предыдущая кислота может
вытеснить из соли последующую
6.
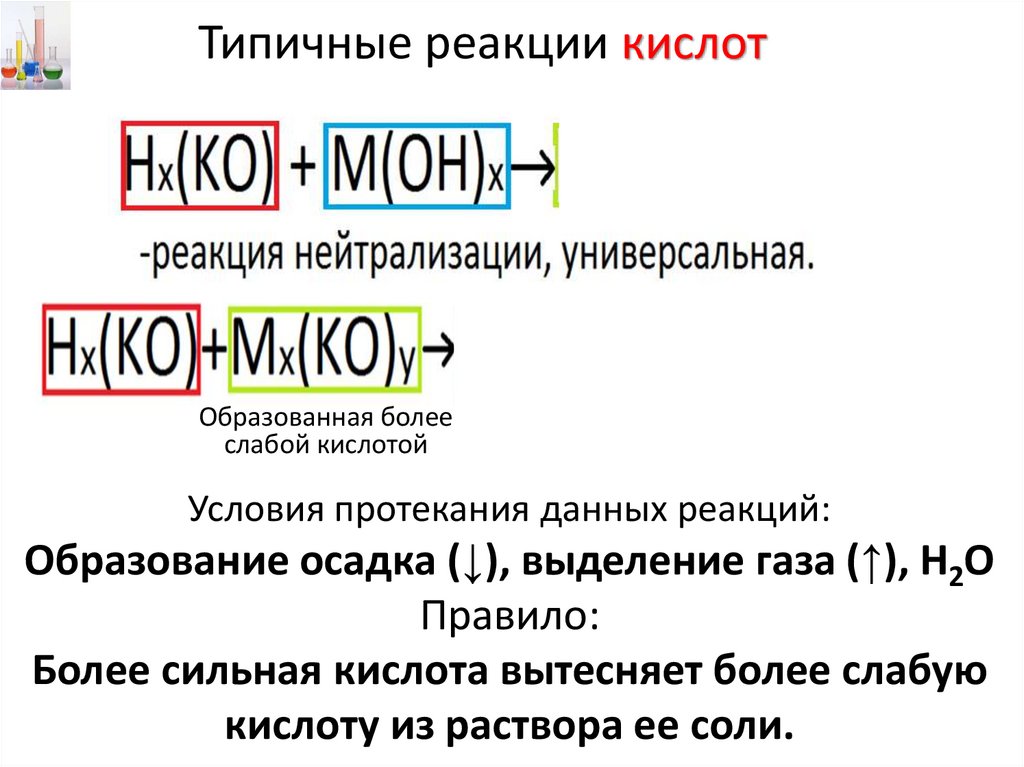
Типичные реакции кислотОбразованная более
слабой кислотой
Условия протекания данных реакций:
Образование осадка (↓), выделение газа (↑), Н2О
Правило:
Более сильная кислота вытесняет более слабую
кислоту из раствора ее соли.
7.
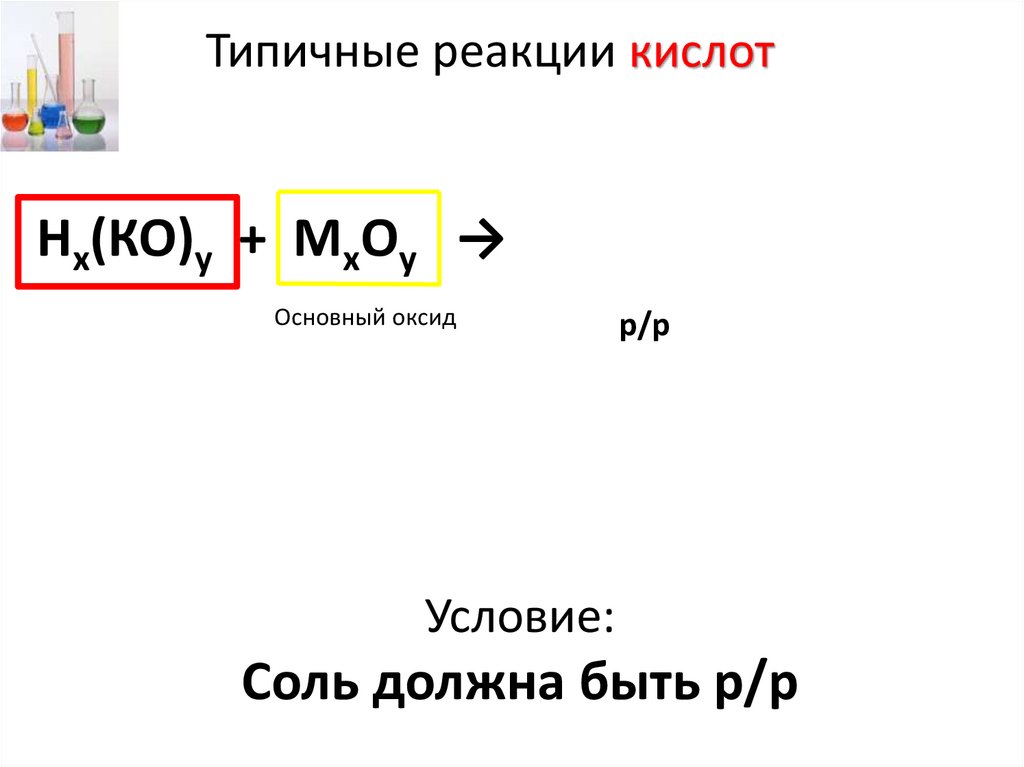
Типичные реакции кислотНх(КО)у + МхОу → Мх(КО)у + Н2О
Основный оксид
р/р
НCl + СаО → CaCl2 + Н2О
Условие:
Соль должна быть р/р
8.
р/рУсловия протекания реакции:
1. М должен быть до Н2 в ЭРНМ (см. задний
форзац учебника);
Кислота и Соль должны быть р/р;
3. H2SO4 (конц.) и HNO3 (любой конц.)
2.
реагируют иначе.
9.
Закончите уравнения возможных реакций:1.Cu + H2SO4 (разб.) →
2.HCl + CaS → CaCl2 + H2S↑
3.HNO3 + Ba(OH)2 → Ba(NO3)2
+ 2H2O
10. Закончите уравнения возможных реакций:
• 2Al(OH)3 + 6HCl → 2AlCl3 + 3H2OНапишите ионное уравнение, полное и сокращенное
2Al(OH)3 + 6H+ + 6Cl─ → 2Al+ + 6Cl ─ + 3H2O
2Al(OH)3 + 6H+ → 2Al+ + 3H2O
• Mg + H2S → т.к. MgS – нерастворимая соль
• H2SO4 + CaO → CaSO4 + H2O
2H+ + SO42- + CaO → Ca2+ + SO42- + H2O
2H+ + CaO → Ca2+ + H2O
11.
Д/З:§ 39 (все: 1,2 – у.,
3-6 – п.)
12.
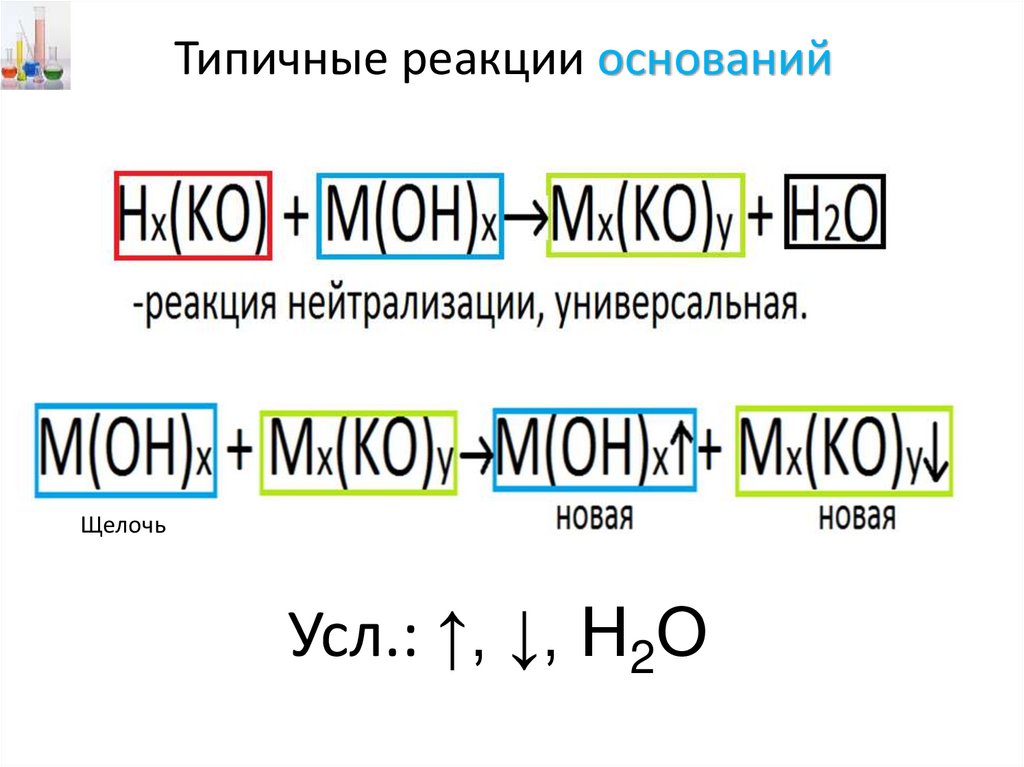
Типичные реакции оснований• Основания - это электролиты,
которые при диссоциации образуют
катионы металлов (Na+, Ca2+, Al3+) и
анионы гидроксогрупп ОН-.
13.
Типичные реакции основанийЩелочь
Усл.: ↑, ↓, Н2О
14.
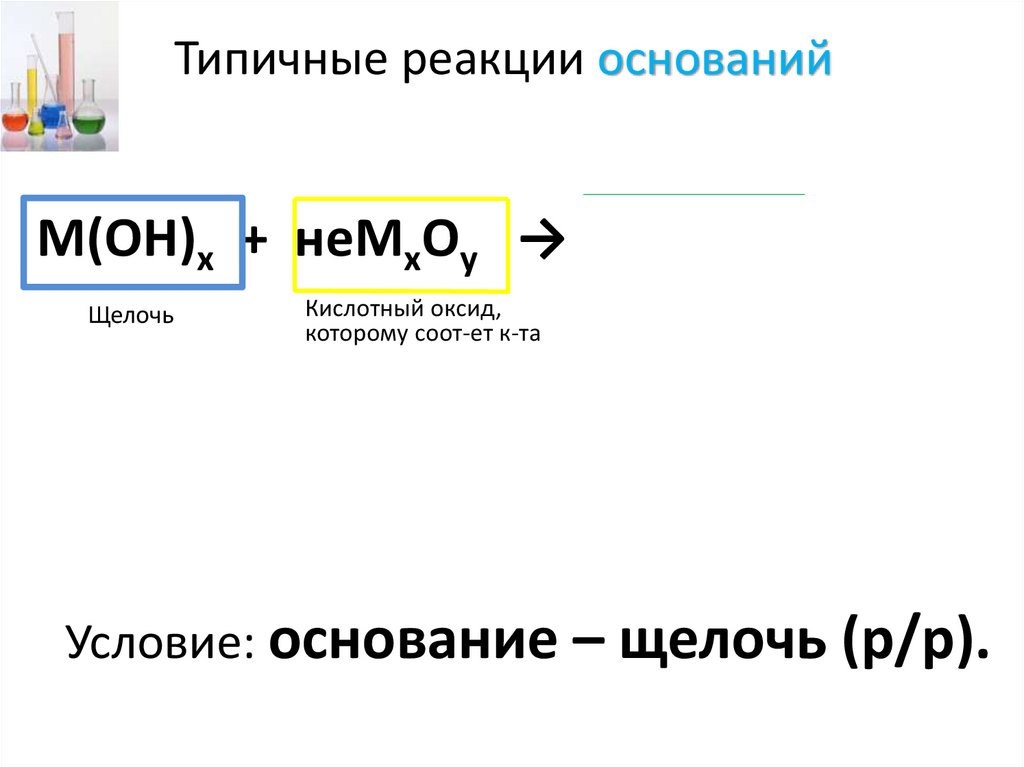
Типичные реакции основанийМ(ОН)х + неМхОу → Мх(КО)у + Н2О
Щелочь
Кислотный оксид,
которому соот-ет к-та
+4
+4
Ва(ОН)2 + СО2 → ВаСО3 + Н2О
+4
Н2СО3 – угольная кислота
Условие: основание – щелочь (р/р).
15.
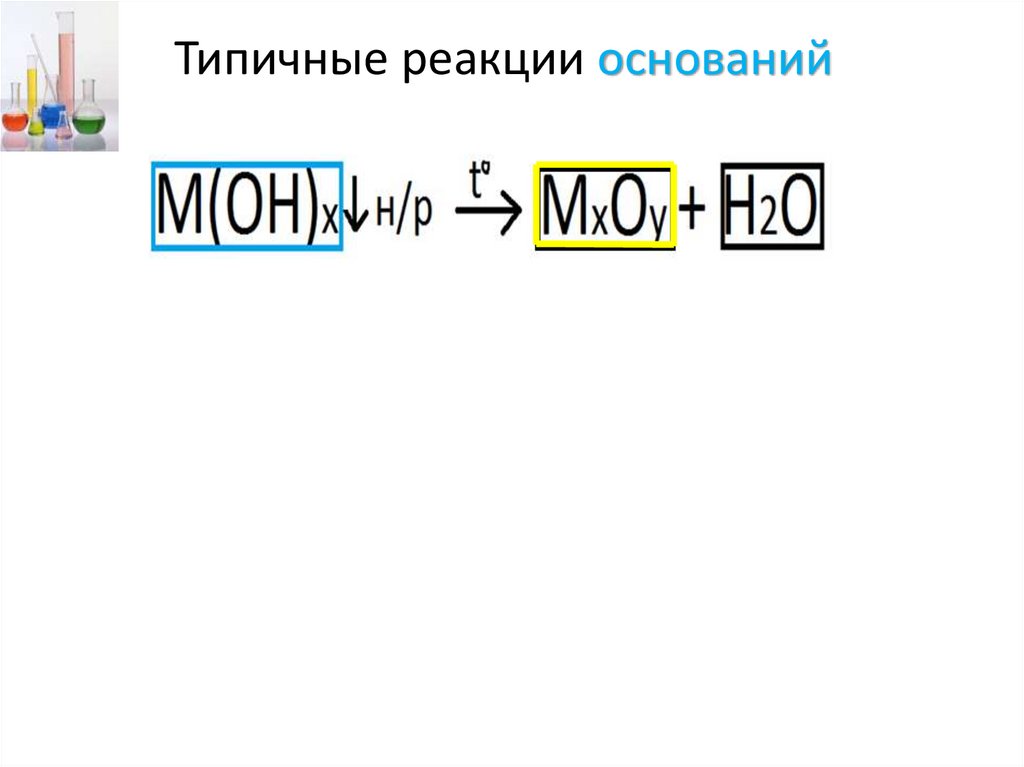
Типичные реакции оснований+3
t0
+3
+2
t0
+2
Fe(OH)3 → Fe2O3 + H2O
Fe(OH)2 → FeO + H2O
16.
Закончите уравнения возможных реакций:+5 -2
+5
Ва(ОН)2 + Р2О5 → Ва3(РО4)2 + Н2О
изб.
+5
Н3РО4 – фосфорная кислота
Al(OH)3 ↓ + CuO →
Al(OH)3 + HCl → AlCl3 + Н2О
17.
Д/З:§ 39 (1,2 – у.,
3-5 – п.)
18. Самостоятельная работа 8 класс Кислоты, основания
19. 1 вариант 2 вариант Нап. ур. возможных р-ций в молекул. и ионном виде Если реакция не идет, укажите причину.
1) HCl + Zn = …2) NaOH + SO2 = …
3) H2SO4 разб. + Cu =…
4) Ba(OH)2 + Na2CO3=…
*) Fe2+ + 2OH- = Fe(OH)2
20.
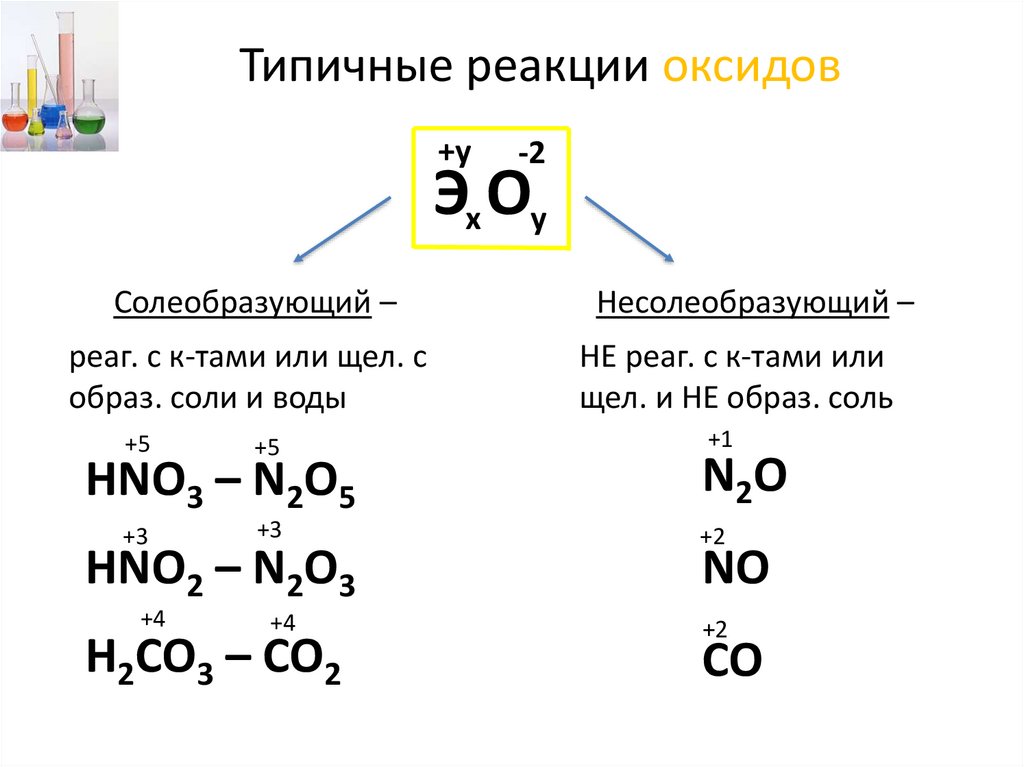
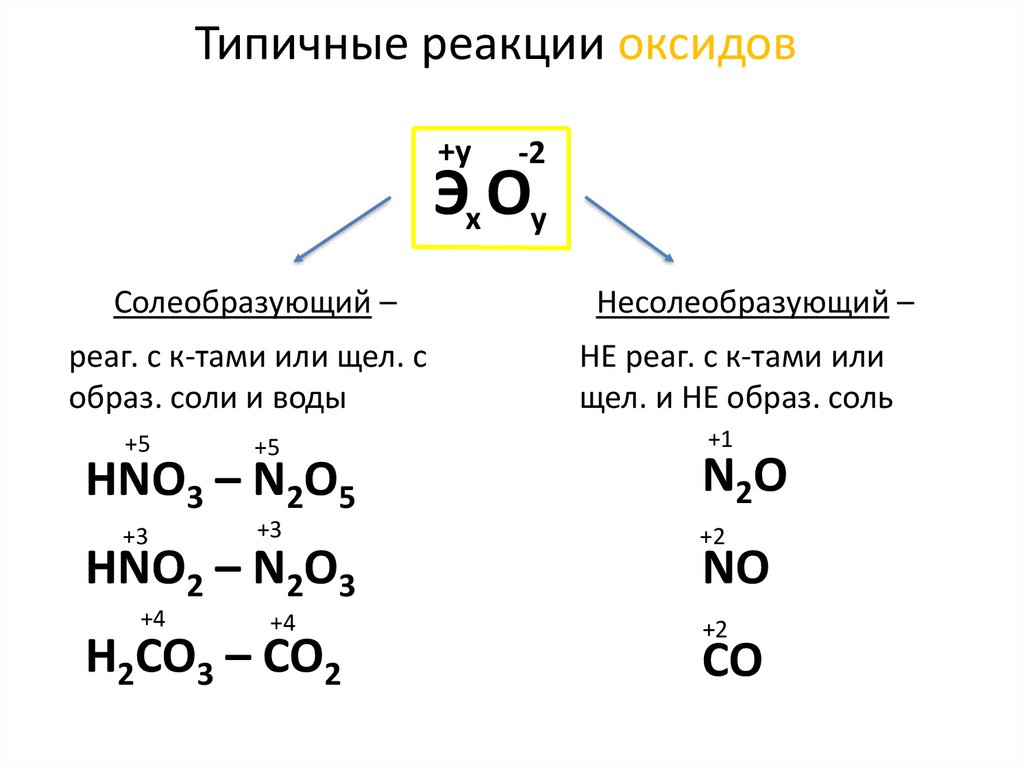
Типичные реакции оксидов+у
-2
Эх Оу
Солеобразующий –
реаг. с к-тами или щел. с
образ. соли и воды
+5
+5
+3
+3
HNO3 – N2O5
HNO2 – N2O3
+4
+4
H2CO3 – CO2
Несолеобразующий –
НЕ реаг. с к-тами или
щел. и НЕ образ. соль
+1
N2O
+2
NO
+2
CO
21.
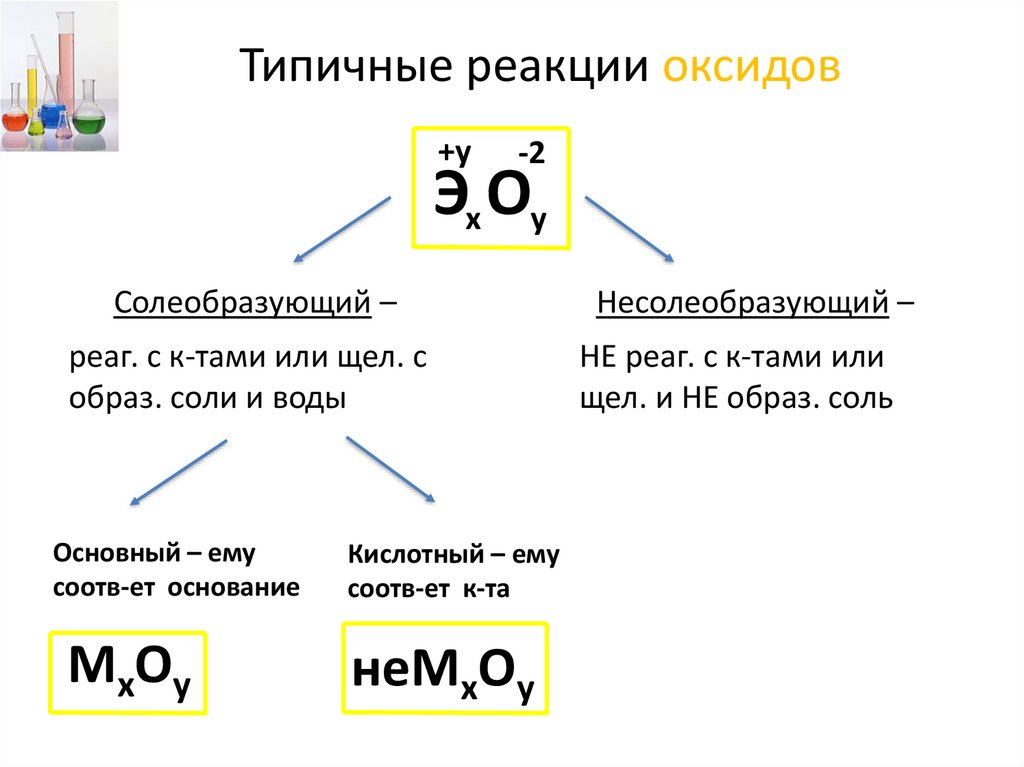
Типичные реакции оксидов+у
-2
Эх Оу
Солеобразующий –
реаг. с к-тами или щел. с
образ. соли и воды
Основный – ему
соотв-ет основание
МхОу
Кислотный – ему
соотв-ет к-та
неМхОу
Несолеобразующий –
НЕ реаг. с к-тами или
щел. и НЕ образ. соль
22.
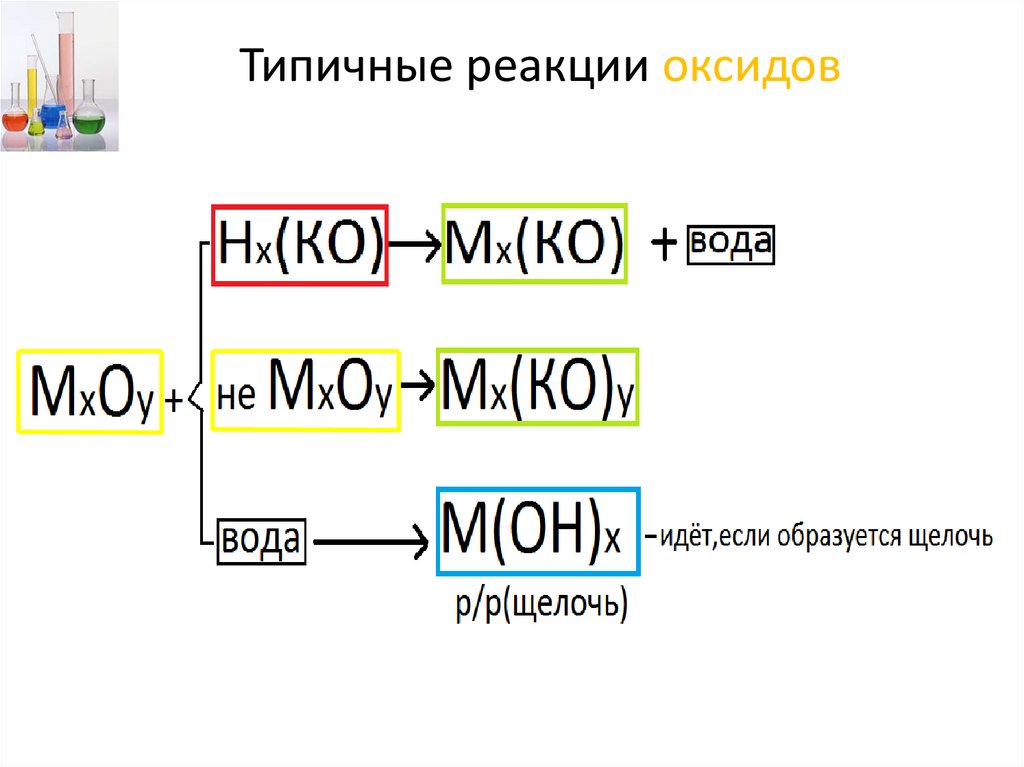
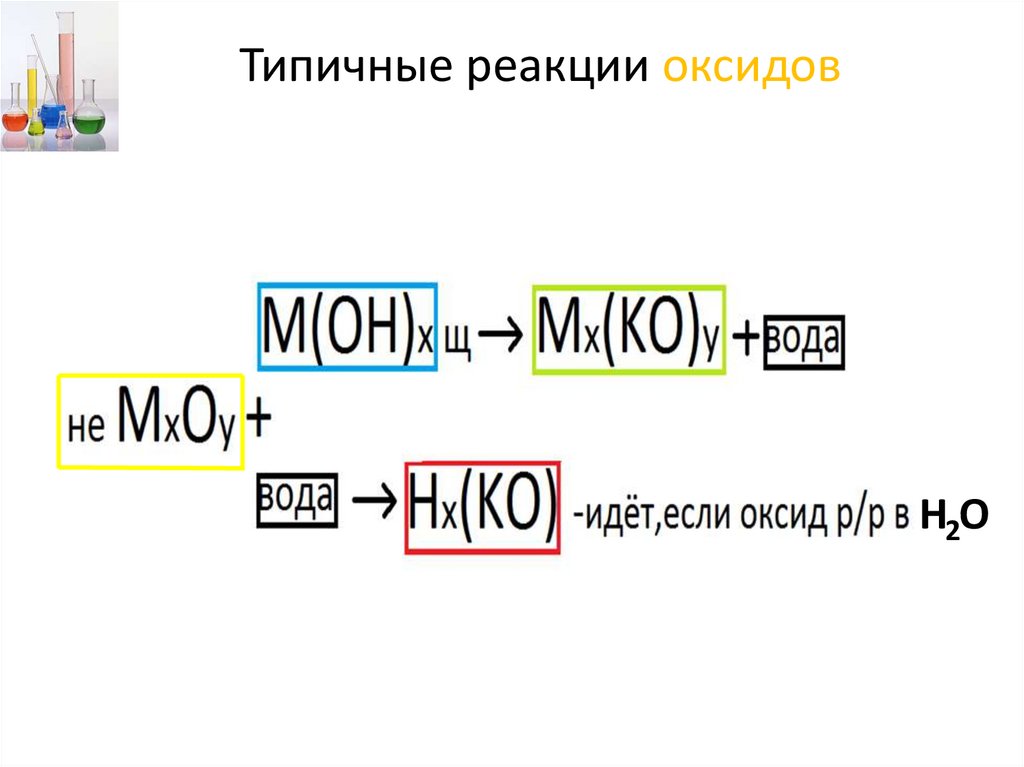
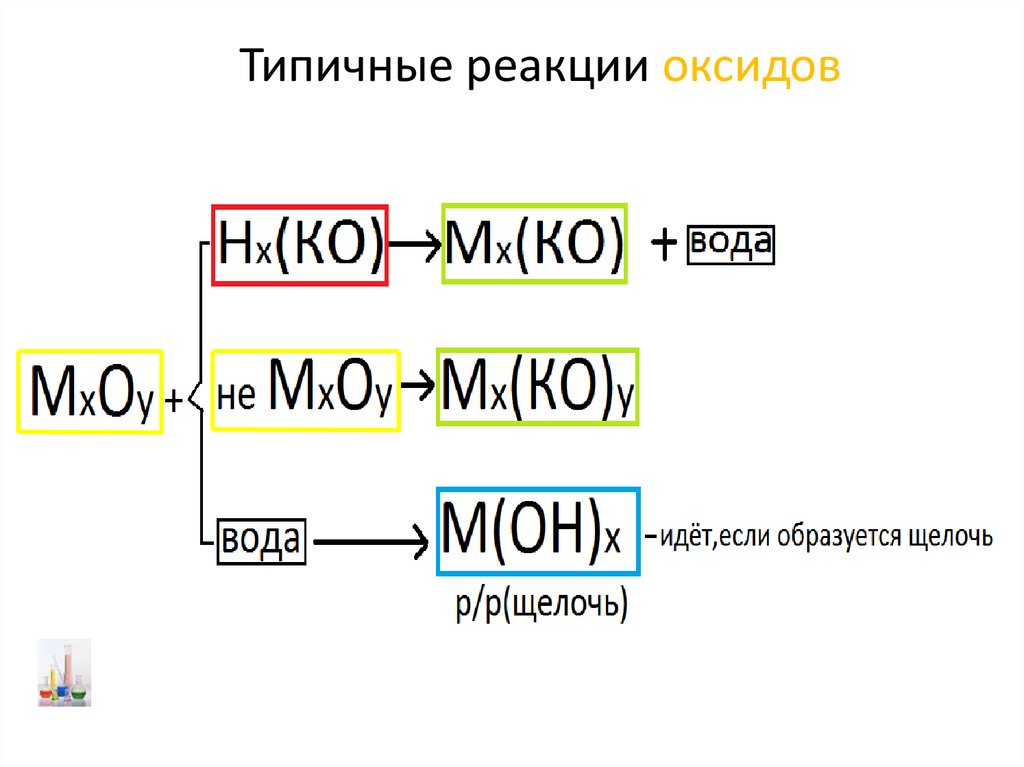
Типичные реакции оксидов23.
Типичные реакции оксидовН2О
24.
Закончите уравнения возможных реакций:+2
+2
FeO + H2O = Fe(OH)2↓
+2
NO + KOH =
Na2O + H2SO4 = Na2SO4 + H2O
+5
+5
N2O5 + Ba(OH)2 = Ba(NO3)2 + H2O
HNO3
25.
Типичные реакции оксидов+у
-2
Эх Оу
Солеобразующий –
реаг. с к-тами или щел. с
образ. соли и воды
+5
+5
+3
+3
HNO3 – N2O5
HNO2 – N2O3
+4
+4
H2CO3 – CO2
Несолеобразующий –
НЕ реаг. с к-тами или
щел. и НЕ образ. соль
+1
N2O
+2
NO
+2
CO
26.
Типичные реакции оксидов27.
Повторим:Закончите уравнения возможных реакций:
1.Cu + H2SO4 (разб.) →
2.HCl + CaS → CaCl2 + H2S↑
3.HNO3 + Ba(OH)2 → Ba(NO3)2
+ 2H2O
28. Закончите уравнения возможных реакций:
Повторим:Закончите уравнения возможных реакций:
• 2Al(OH)3 + 6HCl → 2AlCl3 + 3H2O
Напишите ионное уравнение, полное и сокращенное
2Al(OH)3 + 6H+ + 6Cl─ → 2Al+ + 6Cl ─ + 3H2O
2Al(OH)3 + 6H+ → 2Al+ + 3H2O
• Mg + H2S → т.к. MgS – нерастворимая соль
• H2SO4 + CaO → CaSO4 + H2O
2H+ + SO42- + CaO → Ca2+ + SO42- + H2O
2H+ + CaO → Ca2+ + H2O
29.
Закончите уравнения возможных реакций:+5 -2
+5
Ва(ОН)2 + Р2О5 → Ва3(РО4)2 + Н2О
изб.
+5
Н3РО4 – фосфорная кислота
Al(OH)3 ↓ + CuO →
Al(OH)3 + HCl → AlCl3 + Н2О
30.
Д/З:§ 41 (1, 3)
31.
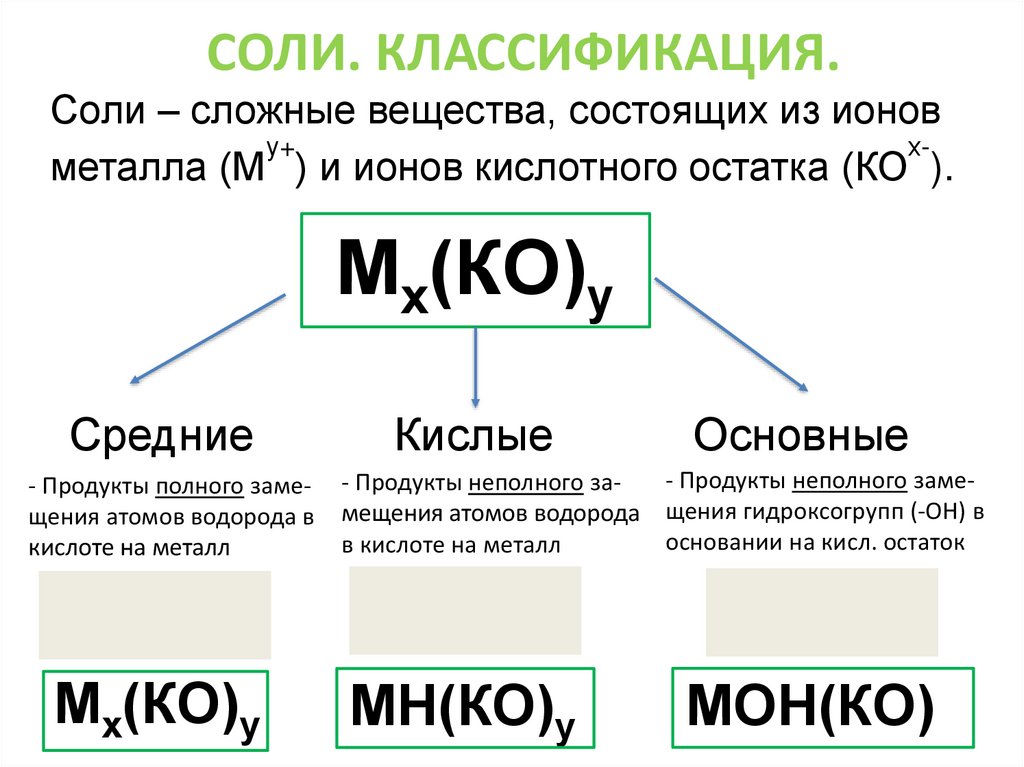
СОЛИ. КЛАССИФИКАЦИЯ.Соли – сложные вещества, состоящих из ионов
у+
хметалла (М ) и ионов кислотного остатка (КО ).
Мх(КО)у
Средние
- Продукты полного замещения атомов водорода в
кислоте на металл
Кислые
Основные
- Продукты неполного заме- Продукты неполного замещения атомов водорода щения гидроксогрупп (-ОН) в
основании на кисл. остаток
в кислоте на металл
Нх(КО)
Нх(КО)у
М(ОН)х
Мх(КО)у
МН(КО)у
МОН(КО)
32.
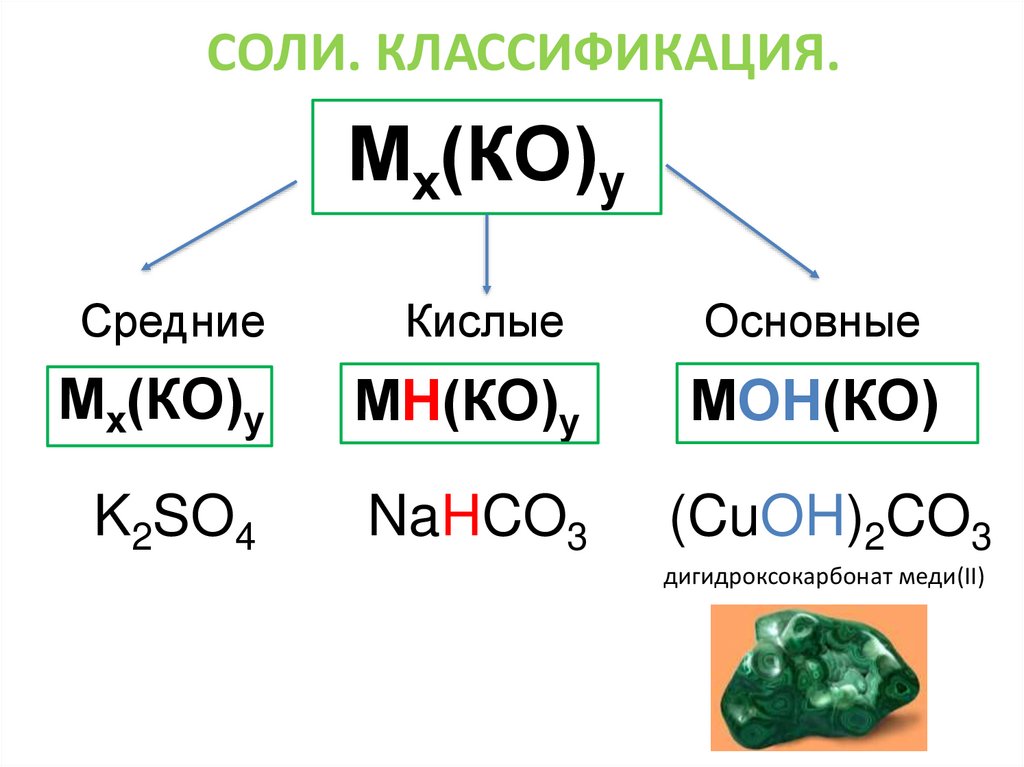
СОЛИ. КЛАССИФИКАЦИЯ.Мх(КО)у
Средние
Кислые
Основные
Мх(КО)у
МН(КО)у
МОН(КО)
K2SO4
NaHCO3
(CuOH)2CO3
дигидроксокарбонат меди(II)
33.
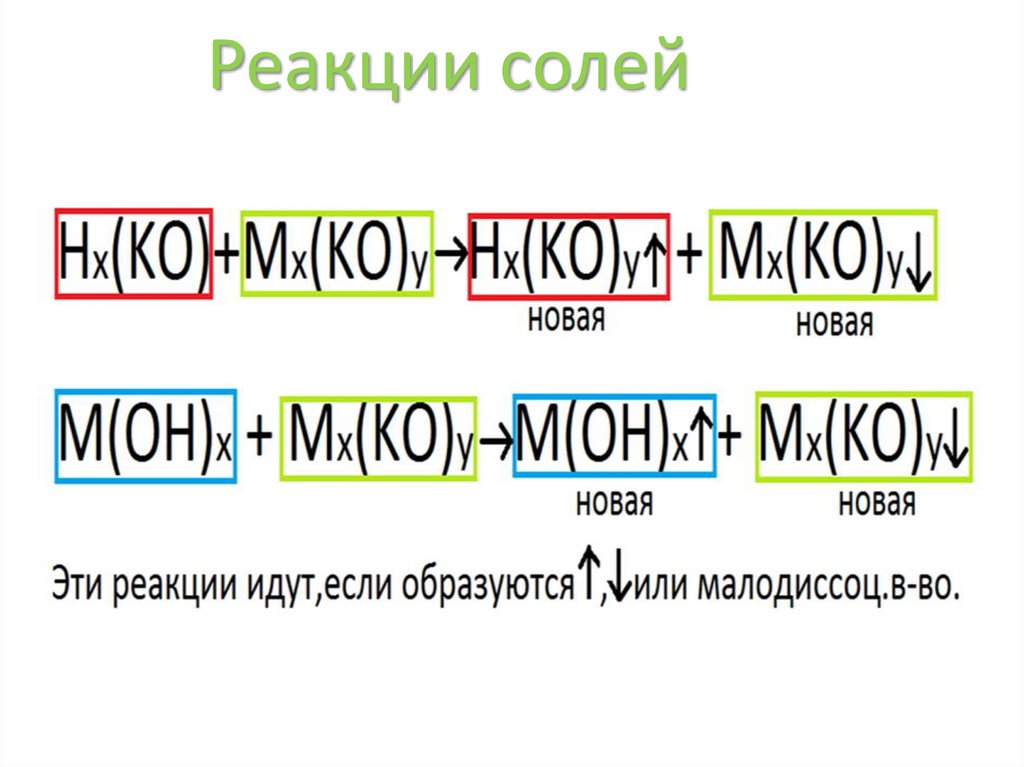
Реакции солей34.
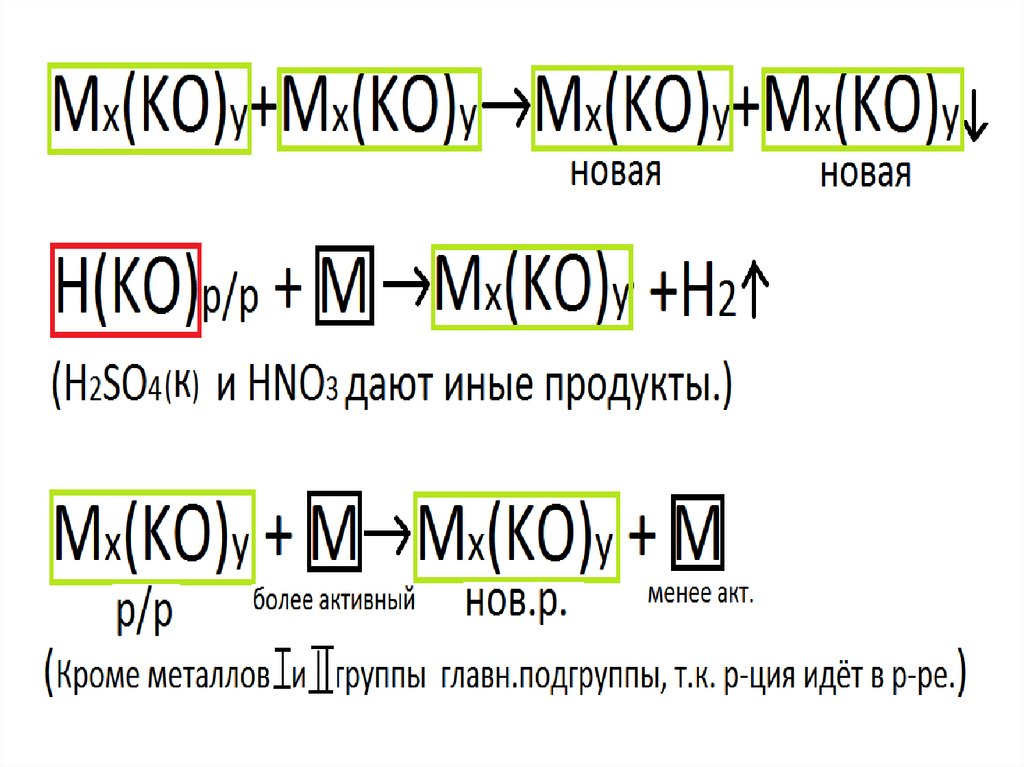
Реакции солейBaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
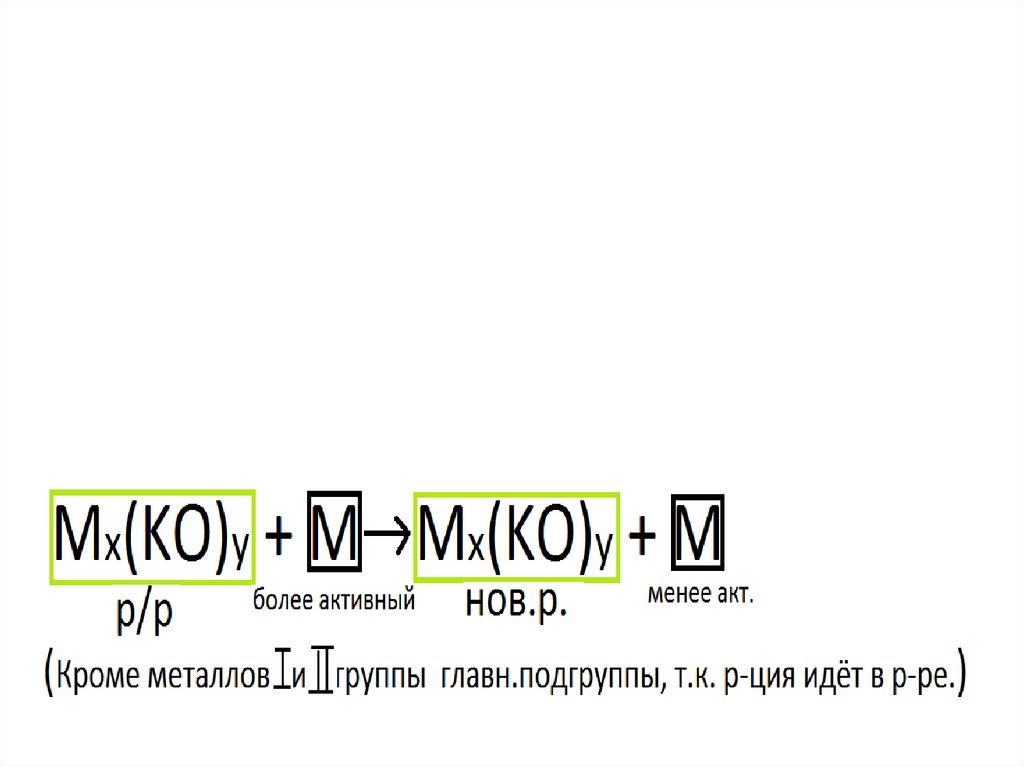
CuSO4 + Fe → FeSO4 + Cu
ZnSO4 + Fe
35. Игры – интерактивная доска
Состав и номенклатура кислотНоменклатура солей
Номенклатура солей 2
Формулы и названия кислот
Основные классы неорганических
соединений
• Характерные реакции
• Химия. классы веществ
• Химические уравнения
образования оксидов.
36.
Д/З:§ 42 (1,2)
37. Теперь вы знаете что такое вещества, а также их типичные реакции.
38.
Реакции солей39.
40.
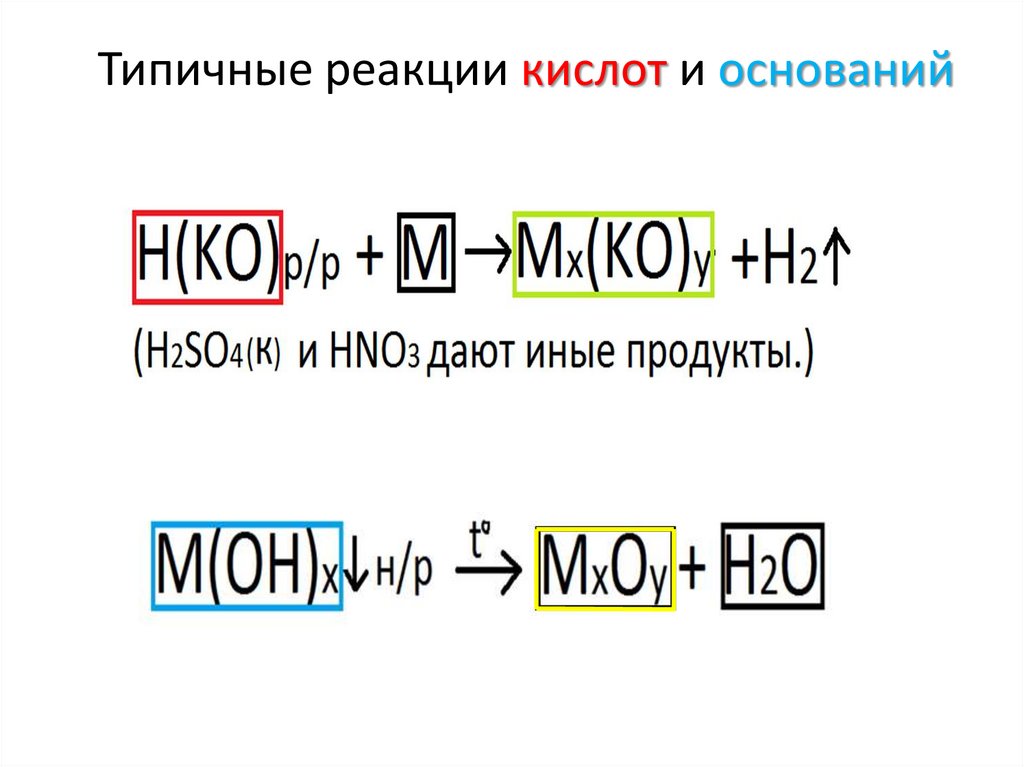
Типичные реакции кислот и оснований• Кислоты – это электролиты, которые при
диссоциации образуют катионы водорода Н+ и
анионы кислотного остатка (Cl-, SO42-, PO43-)
• Основания - это электролиты, которые при
диссоциации образуют катионы металлов (Na+, Ca2+,
Al3+) и анионы гидроксогрупп ОН-.
















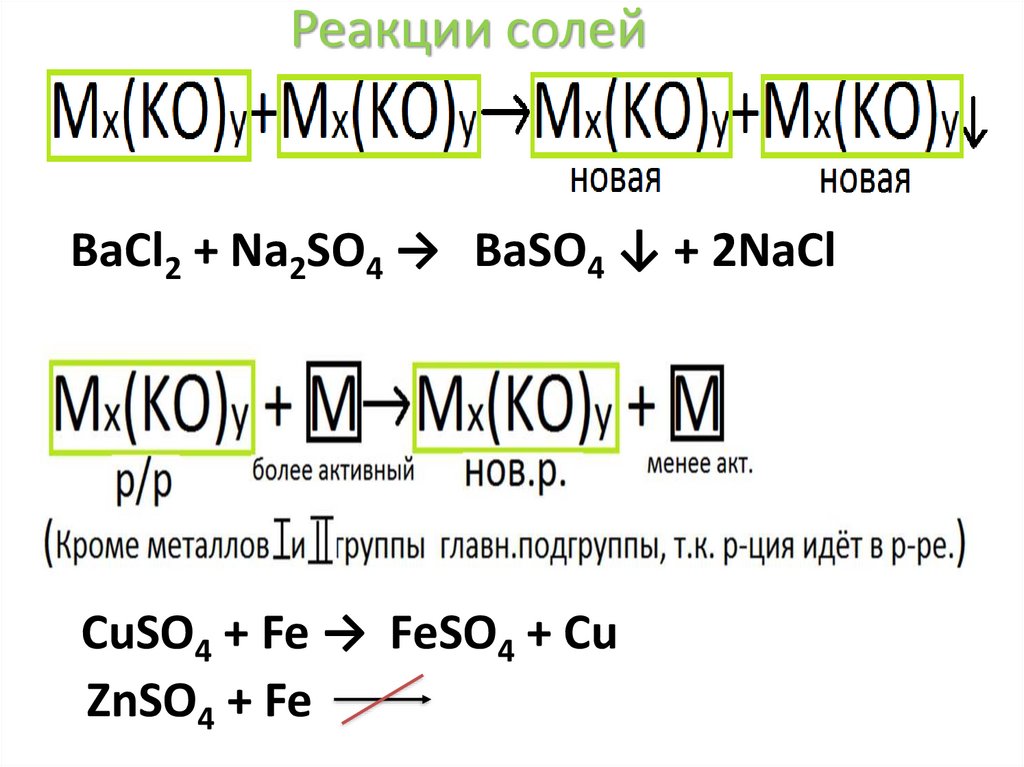





 chemistry
chemistry








