Similar presentations:
Иммунитет. Антигены (лекция 1)
1. Лекция 1
Иммунитет.Антигены.
2. Иммунитет – защита организма от генетически чужеродных веществ (антигенов) экзогенного или эндогенного происхождения с целью
сохранения иподдержания гомеостаза, структурной и
функциональной целостности организма,
а также биологической (антигенной)
индивидуальности и видовых различий.
3.
4.
Иммунитет бывает:1) Врожденный (неспецифический,
естественный, видовой).
Является первичной воспалительной
защитной неспецифической реакцией
организма на антиген.
Генетически закрепленная способность
противостоять инфекции.
5.
2) Приобретенный (специфический–защищает от строго определенного антигена;
адаптивный).
Это невосприимчивость организма к
антигену, приобретаемая в процессе
онтогенеза. Формируется при специфическом
взаимодействии клеток иммунной системы с
антигеном, в результате чего появляются
антитела и лимфоциты, распознающие и
нейтрализующие данный антиген.
6.
Приобретенный иммунитет бывает:1. Активный. Обусловлен активной реакцией
иммунной системы при встрече с
определенным антигеном.
Выделяют:
а) естественный, формирующийся после
перенесенной инфекции;
б) искусственный, формирующийся после
вакцинации.
7.
2. Пассивный. Формируется за счет введенияв организм уже готовых иммунореагентов,
способных защищать от антигена.
Выделяют:
а) естественный, сформированный у
новорожденных в результате внутриутробной
передачи антител через плаценту от матери;
б) искусственный, формирующийся при
введении иммунных сывороток и
иммуноглобулинов (антител).
8.
Приобретенный иммунитет бывает:1. Стерильный: после инфекционного
заболевания иммунитет поддерживается
при отсутствии антигенов возбудителя в
организме. Например: ветряная оспа.
2. Нестерильный – иммунитет
поддерживается только при присутствии
антигенов возбудителя в организме.
Например: туберкулез.
9.
По основным иммунореагентам различаютиммунитет:
1. Клеточный (фагоциты, цитотоксические Тлимфоциты);
2. Гуморальный (антитела, лизоцим и др.).
Также выделяют иммунитет:
1. Общий (системный, генерализованный);
2. Местный. Например: слизистых оболочек.
10.
Факторы и механизмы врожденногоиммунитета
Врожденный иммунитет – наиболее ранний
защитный механизм, развивающийся в
первые часы и дни после проникновения
чужеродного материала во внутреннюю
среду. Инактивирует значительную часть
патогенов. Если врожденный иммунитет не
может своевременно уничтожить какой-либо
патоген или его дозу, то в борьбу вступает
приобретенный иммунитет.
11.
Факторы и механизмы врожденногоиммунитета
• Кожа, слизистые оболочки, нормальная
микрофлора – барьер для патогенов;
• Сальные и потовые железы, мерцательный
эпителий слизистых оболочек, слизь,
слюна, слезы, кислая среда желудка,
пищеварительные ферменты; температура
тела, гормональный баланс, чихание,
кашель, выделение токсинов с мочой и
калом – физиологическая защита, удаление
патогенов и токсинов;
12.
• Фагоциты (макрофаги, гранулоциты) –фагоцитоз, продукция цитокинов
воспаления;
• Натуральные киллеры (NК-клетки) –
уничтожение измененных клеток;
противовирусное, противоопухолевое
действие;
• В1-лимфоциты брюшной и плевральной
полостей – продукция полиспецифичных
антибактериальных антител;
• Тγδ-лимфоциты с неспецифической
активностью – уничтожение микробов;
13.
• Антимикробные пептиды: кателицидины,дефензины – уничтожение микробов;
• Лизоцим (мурамидаза) – разрушение
пептидогликана клеточной стенки бактерий;
• Бета-лизин – антибактериальный белок
тромбоцитов;
• Фибронектин, белки острой фазы –
нейтрализация патогенов, опсонизация;
• Комплемент – разрушение клеток,
опсонизация, анафилотоксин,
хемоаттрактант.
14.
Факторы и механизмы приобретенногоиммунитета
CD4 – Т-хелперы;
В-лимфоциты;
CD8 – Цитотоксические Т-лимфоциты (ЦТЛ);
Активированные макрофаги (иммунный
фагоцитоз);
• Антитела.
15.
Формы иммунного реагированияАнтителообразование;
Иммунный фагоцитоз;
Киллерная функция лимфоцитов;
Аллергия; ГНТ и ГЗТ;
Иммунологическая память;
Иммунологическая толерантность.
16.
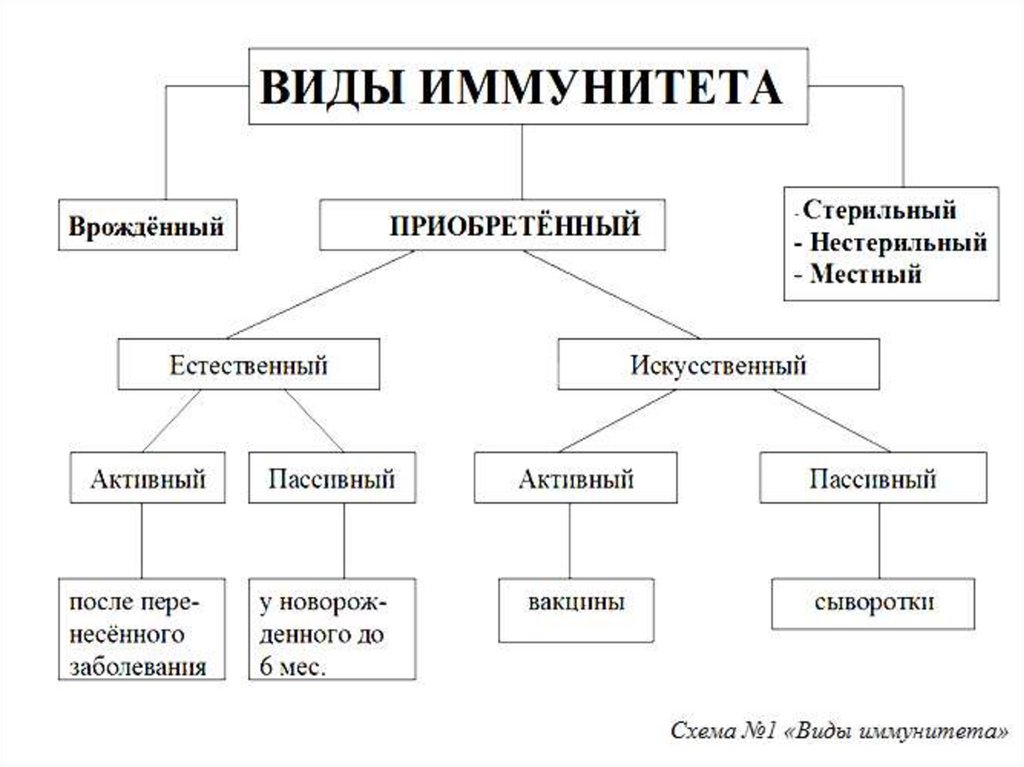
Органы иммунной системыЦентральные: красный костный мозг (ККМ) и тимус
(вилочковая железа).
В ККМ из плюрипотентных стволовых клеток
образуются эритроциты, гранулоциты, моноциты,
дендритные клетки, NК-клетки, В-лимфоциты и
предшественники Т-лимфоцитов.
В ККМ происходит лимфопоэз – рождение,
размножение (пролиферация) и дифференцировка
лимфоцитов до стадии предшественников. В нем же
предшественники В-лимфоцитов дифференцируются
до зрелых неимунных (наивных) В-лимфоцитов
(антигеннезависимая дифференциация).
17.
Предшественники Т-лимфоцитов из ККМ поступают втимус, где происходит их дифференциация на Тхелперы (CD4) и цитотоксические Т-лимфоциты (ЦТЛ)
(CD8). Здесь они проходят «обучение», включающее
позитивную и негативную селекцию. При позитивной
селекции поддерживается жизнедеятельность только
тех лимфоцитов, рецепторы которых эффективно
связались с МНС антигенами на эпителиальных
клетках тимуса. В ходе негативной селекции
отбраковываются аутореактивные клоны лимфоцитов,
т.е. тем лимфоцитам, рецепторы которых связались
(высокая авидность) с собственными антигенами
организма, представленными МНС на дендритных
клетках, передается сигнал к апоптозу.
18.
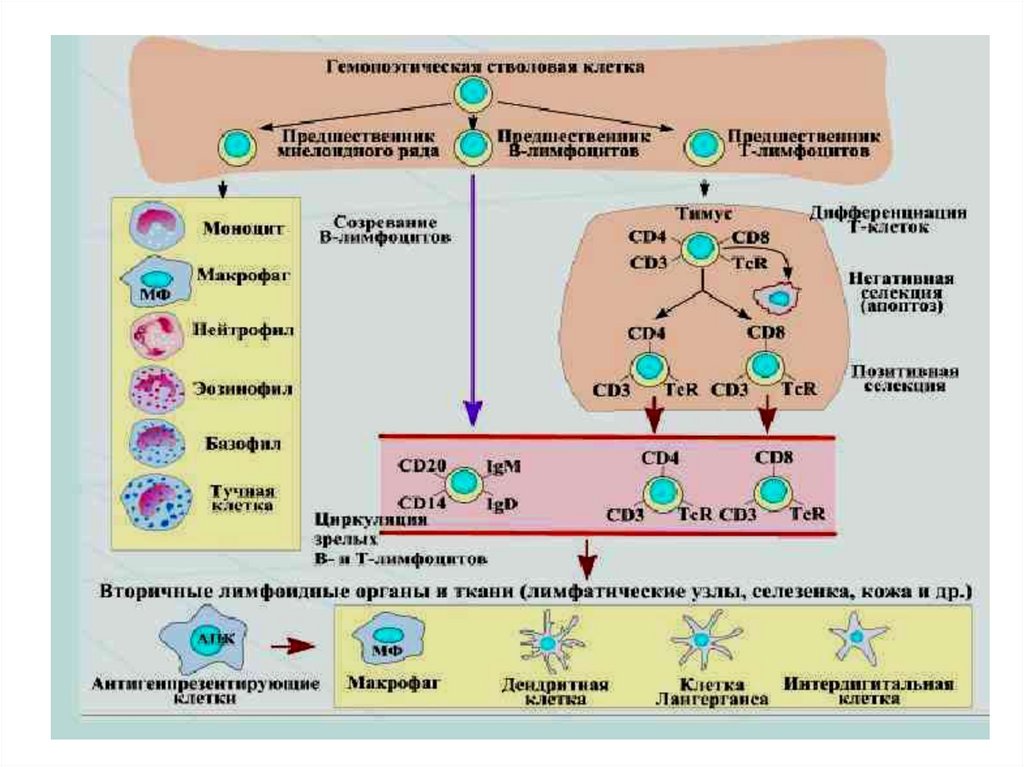
Таким образом, из центральных органов иммуннойсистемы выходят зрелые, но не иммунные (наивные)
Т- и В-лимфоциты. Они мигрируют в периферические
органы иммунной системы, где заселяют соответствующие им зоны. В периферических органах
происходит взаимодействие наивных лимфоцитов с
антигенами, которые им представляют антигенпрезентирующие клетки (АПК). Получив такую
антигенную, а также цитокиновую стимуляцию,
наивные лимфоциты активируются и дифференцируются (иммуногенез) в зрелые иммунные
лимфоциты, способные осуществлять иммунный
ответ против конкретного антигена (антигензависимая дифференциация).
19.
20.
21.
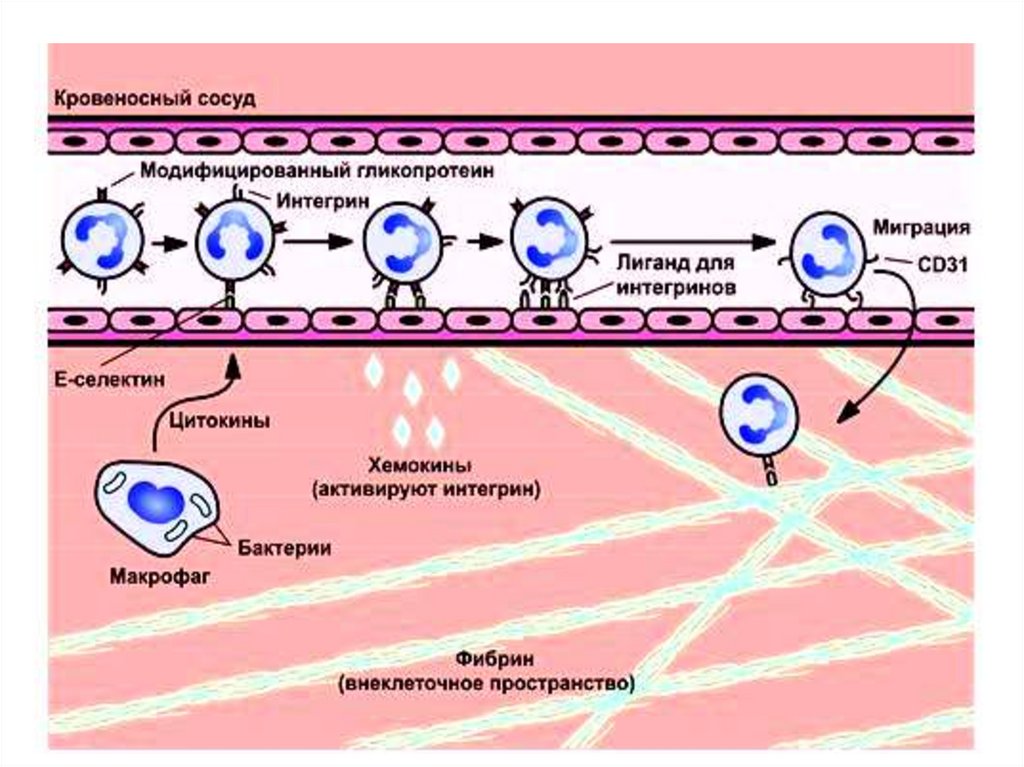
Взаимодействие клетокВ процессе развития
иммунного ответа
происходят взаимодействия разных клеток друг с
другом: лимфоцитов с эндотелием сосудов, Тлимфоцита с антигенпредставляющей клеткой, Тлимфоцита с В-лимфоцитоми др.
Выделяют 2 вида взаимодействия:
1)Адгезия клеток. Непосредственное взаимодействие на уровне мембранных рецепторов.
К молекулам межклеточной адгезии относят
селектины, интегрины, адрессины и др.
22.
2)Взаимодействие при помощи медиаторов(дистантное). Клетка синтезирует и секретирует
вещества (цитокины), взаимодействующие с
рецепторами других клеток, что обеспечивает
передачу сигнала.
Цитокины – белки, образуемые активированными
клетками иммунной системы (реже другими
клетками), обеспечивающие межклеточные
взаимодействия, рост и пролиферацию многих
клеток, иммунорегуляцию. К цитокинам относят
интерфероны, интерлейкины (обеспечивают
межклеточные взаимодействия между
лейкоцитами), ФНО, факторы роста, хемокины и
др.
23.
24.
Клетки иммунной системыВыделяют антигенпрезентирующие,
регуляторные клетки и эффекторы.
• Антигенпрезентирующие клетки (АПК).
К профессиональным АПК относятся: макрофаги,
дендритные клетки, клетки Лангерганса, Влимфоциты и др. АПК захватывают (фагоцитируют)
антиген, осуществляют процессинг (неполное
расщепление до низкомолекулярных пептидов) и
выставляют антиген на своей поверхности в
комплексе с МНС II. Таким образом антиген
представляется (презентируется)
иммунокомпетентным клеткам – Т-хелперам.
25.
• Т-лимфоциты: Т-хелперы и цитотоксические Тлимфоциты (ЦТЛ).Т-хелперы (CD4 лимфоциты) – субпопуляция
лимфоцитов, выполняющих регуляторную функцию.
Наивные Т-хелперы взаимодействуют с антигеном,
который представляют им АПК, после чего
активируются (становятся иммунными) и
дифференцируются либо в Т-хелперы 1-го типа (Th1),
активирующие клеточный иммунитет, либо Тхелперы 2-го типа (Th2), активирующие гуморальный
иммунитет.
26.
Цитотоксические Т-лимфоциты (CD8 лимфоциты)(ЦТЛ) – субпопуляция эффекторных лимфоцитов.
Отвечают за клеточный иммунитет. После
«знакомства» с антигеном и Т-хелперной стимуляции
наивные ЦТЛ активируются и дифференцируются в
иммунные ЦТЛ, которые при помощи своих
рецепторов находят клетки организма, несущие
чужеродные антигены (инфицированные клетки) или
свои измененные антигены (опухолевые). Затем ЦТЛ
лизирует (разрушает) такую клетку-мишень, выделяя
перфорин, гранзимы и гранулизин (перфорин
образует поры в мембране, через которые в клетку
проникают гранзимы и гранулизин, вызывающие
апоптоз).
27.
• В-лимфоциты – эффекторные иммунокомпетентные клетки. Отвечают за гуморальныйиммунитет. После взаимодействия с антигеном и Тхелперной стимуляции наивные В-лимфоциты активируются и дифференцируются в иммунные В-лимфоциты, продуцирующие антитела против данного
антигена. Конечной стадией их дифференциации
являются плазматические клетки и клетки памяти.
• Естественные киллеры (NК-клетки). Играют роль
в механизмах доиммунной защиты. Распознают и
уничтожают инфицированные, опухолевые клетки и
др. Уничтожают клетки, с которыми связались
антитела – антителозависимая клеточная
цитотоксичность.
28.
АнтигеныАнтиген (АГ) – это любая молекула (пептид, углевод,
полифосфат и др.), которая потенциально может
быть распознана иммунной системой как
чужеродная, что вызывает иммунные реакции,
направленные на ее устранение.
Свойства антигенов: антигенность, специфичность,
иммуногенность.
Антигенность - потенциальная способность АГ
активировать и специфически взаимодействовать с
факторами иммунитета (антитела, лимфоциты).
29.
При этом взаимодействие происходит не со всеймолекулой АГ, а с небольшим участком – антигенной
детерминантой, или эпитопом.
Антигенность зависит от наличия и числа эпитопов в
структуре молекулы АГ. Обязательное условие
антигенности – чужеродность. В норме иммунная
система не восприимчива к собственным АГ.
Чужеродность находится в прямой зависимости от
«эволюционного расстояния » между организмами.
Иммуногенность – потенциальная способность АГ
вызывать по отношению к себе специфическую
защитную реакцию.
30.
Она зависит от:1) Молекулярных особенностей АГ. В зависимости от:
• природы АГ: наиболее иммуногенны белки и полисахариды, менее – липиды и нуклеиновые кислоты;
• Химического состава: более иммуногенны белки с
разнобразными аминокилотами, а также с
ароматическими аминокислотами;
• Оптической изомерии: высокоиммуногенны
пептиды из L-аминокислот, низко – из Dаминокислот;
• Размера и молекулярной массы: чем больше масса
белков и полисахаридов, тем выше
иммуногенность;
31.
• Пространственной структуры: большейиммуногенностью обладают белки с α-спиралями и
разветвленными боковыми цепями, а также
агрегаты молекул и корпускулярные АГ;
• Растворимости: нерастворимые белки (кератин,
натуральный шелк) не вызывают иммунного ответа
(используют в качестве шовного материала).
2) Динамики поступления и выведения АГ из
организма. Чем больше АГ поступает в организм, тем
более выражен иммунный ответ, но в то же время
слишком высокая доза вызывает иммунологическую
толерантность.
32.
3) Состояния организма. Играют важную роль:• генетическая предрасположенность;
• функциональное состояние организма:
эмоциональный и гормональный фон,
интенсивность обменный процессов, возраст и др.
Специфичность – способность АГ вызывать
иммунный ответ к строго определенному эпитопу.
Молекулы большинства АГ достаточно большие, в их
структуре выделяют множество эпитопов, которые
распознаются разными антителами и лимфоцитами.
Поэтому на один АГ активируется множество
лимфоцитов и вырабатываются различные антитела.
33.
Классификация антигенов:1) По происхождению:
• Экзогенные
• Эндогенные:
аутоантигены (антигены собственного
организма), неоантигены (возникают в
результате мутаций), забарьерные (в норме
ограниченно доступны для иммунных
факторов);
34.
2) По степени иммуногенности:• Полноценные – иммунная система реагирует на них
выработкой факторов иммунитета
• Неполноценные (гаптены) – не способны вызывать
иммунный ответ (чаще всего это
низкомолекулярные соединения)
3) По степени чужеродности:
• Ксеноантигены – АГ общие для организмов разных
биологических видов;
• Аллоантигены – АГ общие для неродственных
организмов, относящихся к одному виду;
• Изоантигены – АГ общие для генетически
идентичных организмов (однояйцевые близнецы)
35.
4) По направленности активации и обеспеченностииммунного реагирования:
• Иммуноген – способен вызывать продуктивную
реакцию иммунной системы с выработкой
факторов иммунитета;
• Толероген – при взаимодействии с иммунной
системой вызывает иммунологическую
толерантность;
• Аллерген – вызывает гиперчувствительность
немедленного или замедленного типа;
36.
Перекрестно реагирующие АГ (атигеннаямимикрия) – АГ, эпитопы которых сходны у
представителей разных видов.
Например, АГ стрептококка сходны с АГ миокарда и
клубочков почек человека.
Суперантигены – АГ, вызывающие ложную реакцию
распознания АГ и активацию большого количества
лимфоцтов – антигеннеспецифическую
поликлональную активацию.
37.
Антигены организма человекаАнтигенные маркеры клеток человека – СDантигены
В зависимости от морфофункционального состояния
или стадии развития клетки на ее поверхности могут
появляться определенные молекулы гликопротеидов
(выполняют необходимые клетке функции).
Обнаружение этих молекул может использоваться для
определения вида клеток или стадии их развития. Эти
маркерные молекулы получили название кластеры
дифференцировки - CD-антигены ( с англ. clusters of
differentiation). Обнаружение этих маркерных молекул
на клетках проводится в серологических реакциях с
помощью моноклональных антител к ним.
38.
Выделяют свыше 300 таких маркеров.Примеры:
СD3-антиген – маркер Т-лимфоцитов. Является частью
их антигенраспознающего рецептора.
СD4-антиген – маркер Т-хелперов. Служит
костимулирующей молекулой их рецептора:
распознает МНС II на АПК.
CD8-антиген – маркер цитотоксических Т-лимфоцитов.
Служит костимулирующей молекулой его рецептора:
распознает МНС I на клетках-мишенях и АПК.
39.
Антигены главного комплексагистосовместимости
С англ. major hystocompatibility complex – МНС.
Находятся на ЦПМ почти всех клеток макроорганизма.
У человека МНС был описан на лейкоцитах и его
обозначили как HLA (human leukocyte antigen). По
химической природе это гликопротеид, прочно
связанный с ЦПМ, отдельные фрагменты похожи на
иммуноглобулины. Различают МНС I и МНС II. МНС
состоят из 2-х цепей, имеющих доменное строение.
Межу доменами имеется антигенсвязывающая
полость, которую называют щель Бьоркмана.
40.
Формирование МНС I протекает внутри клетокнепрерывно. Он экспрессируется на поверхности
почти всех клеток, кроме эритроцитов и клеток
ворсинчатого трофобласта (профилактика отторжения
плода). При наличии внутри клетки чужеродных
(измененных) антигенов, например вирусных и др.,
МНС I соединяется с ними и образует комплекс
антигенный пептид-МНС. Так МНС I презентируют
внутриклеточно образующиеся пептидные антигены
Т-лимфоцитам.
Благодаря множеству аллельных вариантов генов
МНС I (HLA) в сублокусах 6-й хромосомы (A,B,C), в
популяции формируется множество неповторяющихся комбинаций. В результате человек строго уникален
по МНС.
41.
При своем формировании МНСII также образуеткомплекс с пептидом-антигеном, но включает в себя
антиген, захваченный клеткой из внеклеточной среды
путем эндоцитоза. Этот комплекс появляется на
поверхности ограниченного числа клеток:
дендритных, макрофагах, В-лимфоцитах
(активированных эпителиальных и эндотелиальных
клетках и др.). Включенный в состав МНС II антиген
презентируется Т-хелперам.
В состав МНС II (HLA) входят продукты трех основных
локусов хромосомы (DR,DQ,DP).
42.
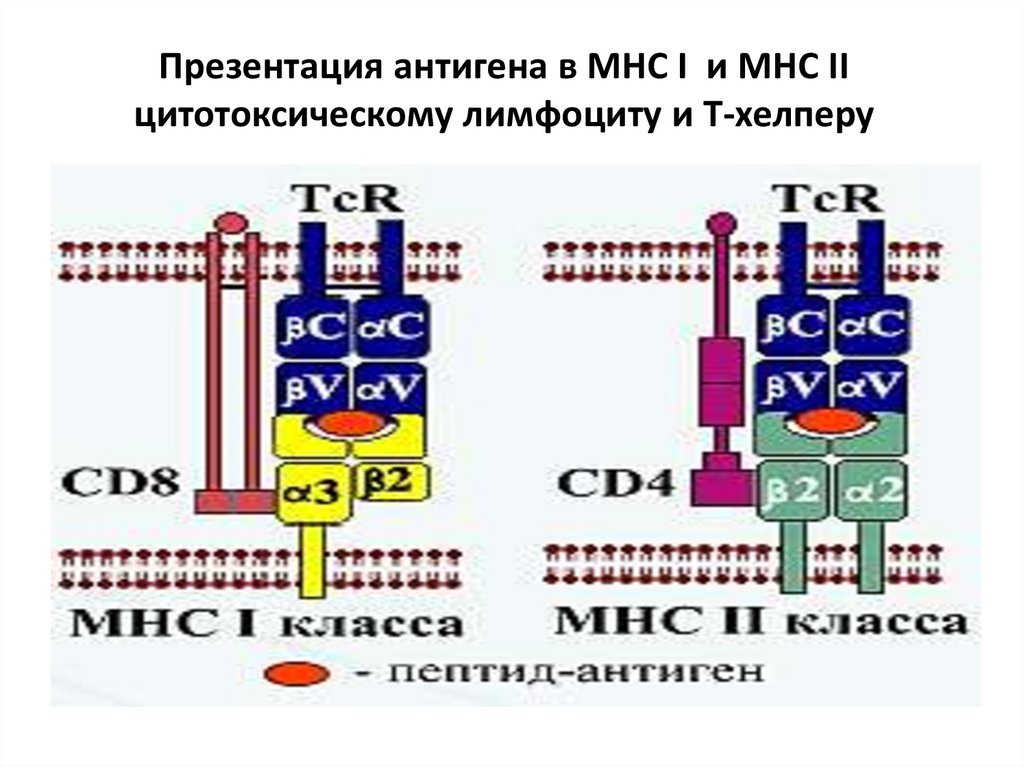
Презентация антигена в MHC I и MHC IIцитотоксическому лимфоциту и Т-хелперу
43.
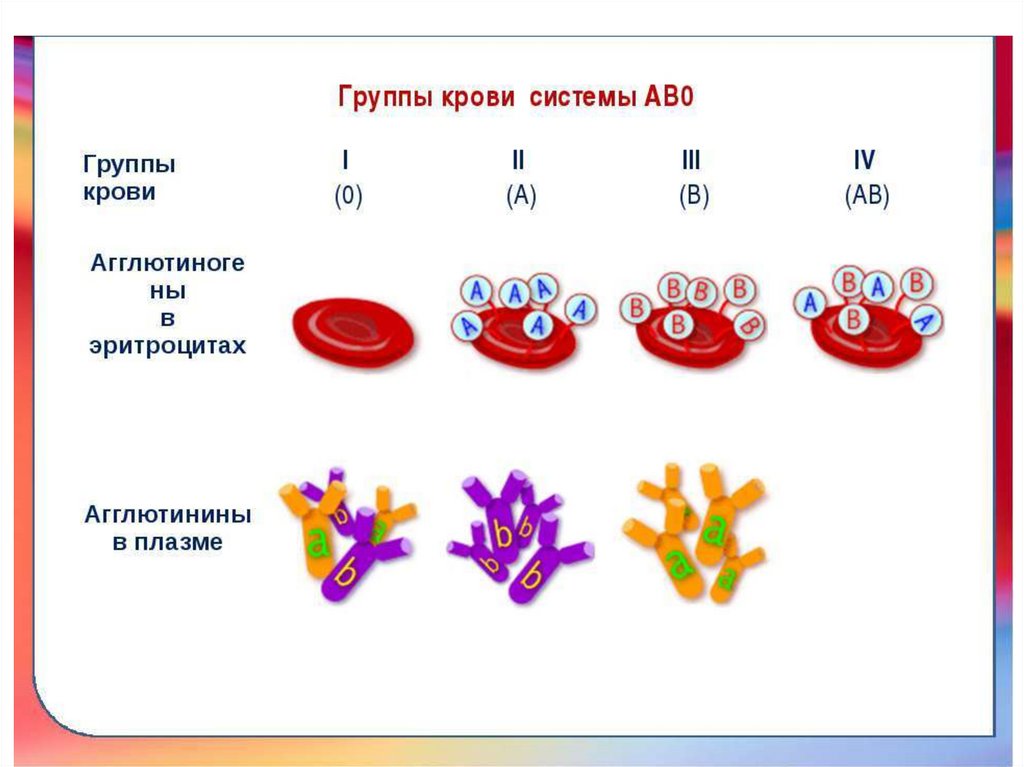
Антигены групп крови.АГ системы АВ0 находятся на мембране всех клеток
крови и тканей человека, но наиболее выражены на
эритроцитах. Это высокогликозилированные пептиды.
Углеводная часть определяет иммуногенность и
существует 3 ее варианта: Н, А и В. АГ системы АВ0
имеют независимое аллельное наследование, что
определяет наличие в популяции 4 групп крови: 0(I),
А(II), В(III), АВ(IV). Также выделяются антитела α и β
(агглютинины), вызывающие склеивание
(агглютинацию) эритроцитов при взаимодействии с
одноименными антигенами (агглютиногенами) А и В.
Например, при переливании крови.
44.
45.
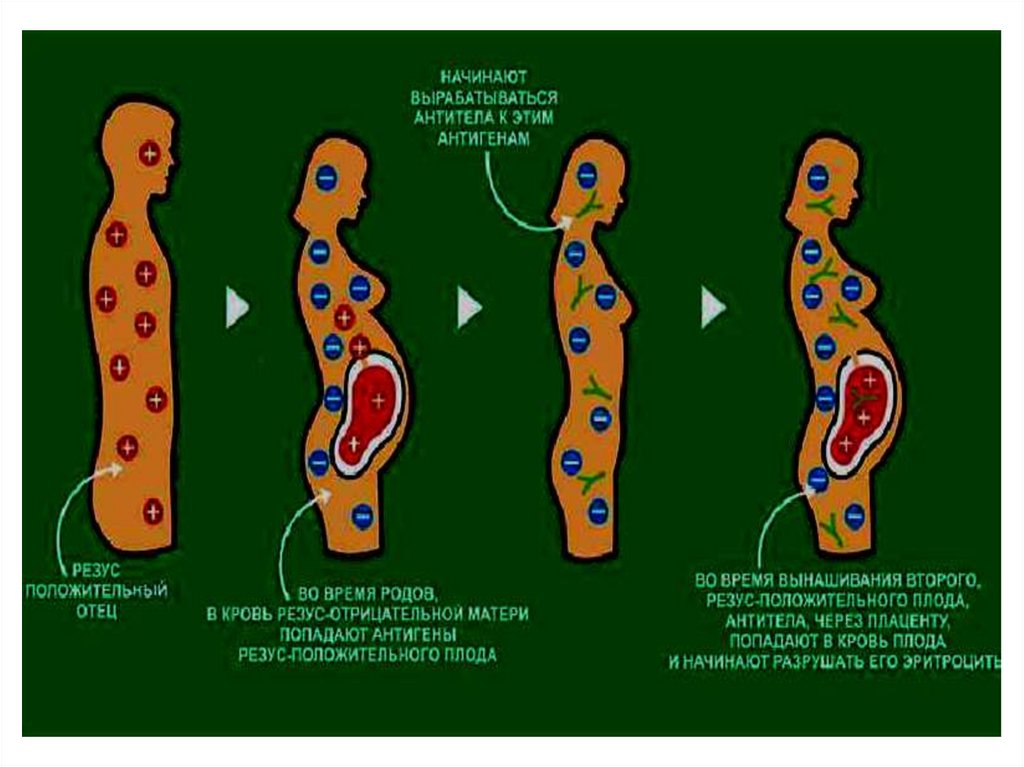
Резус АГ обнаруживают на эритроцитах. Этолипопротеид. Выделяют 6 разновидностей. В
зависимости от его наличия или отсутствия
различают резус-положительных и резусотрицательных людей. При беременности резусотрицательной матери резус-положительным плодом
может развиться резус-конфликт. Так как новые для
матери резус-АГ плода вызывают у нее образование
антител, которые проходят через плаценту и
вызывают разрушение эритроцитов.
АГ групп крови необходимо учитывать при
переливании крови, пересадке органов и тканей,
предупреждении и лечении иммуноконфликтных
осложнений беременности и др.
46.
47.
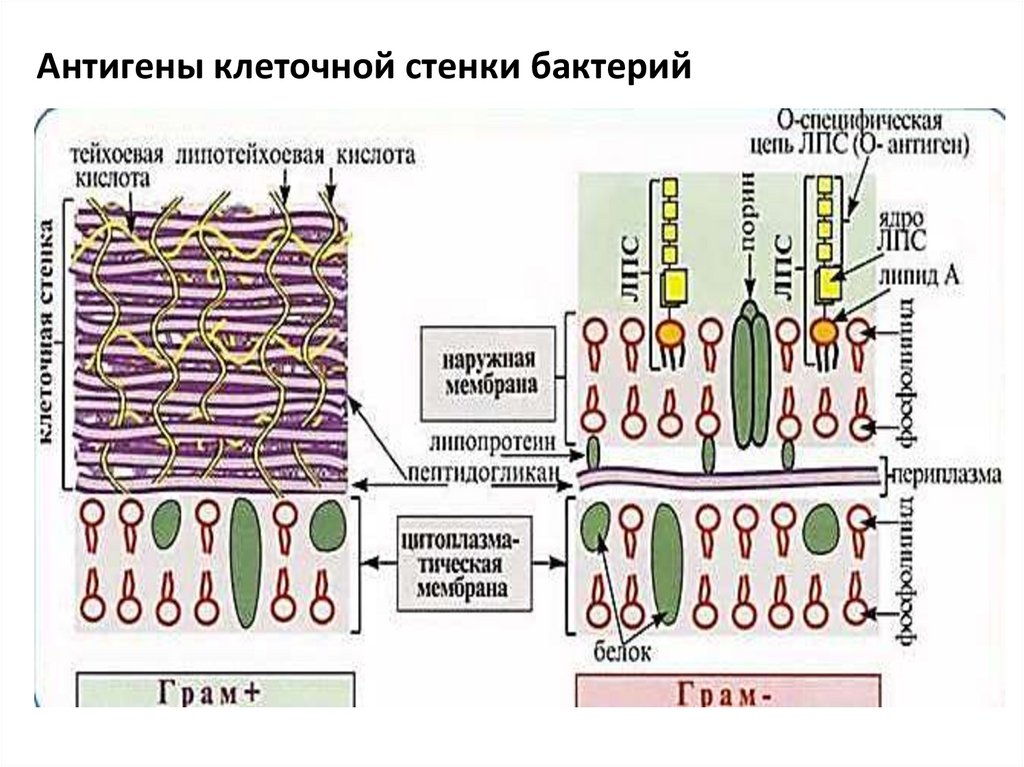
Антигены микроорганизмовАГ бактерий
• жгутиковый Н-антиген – это белок флагеллин,
который разрушается при нагревании
• соматический О-антиген – липополисахарид (ЛПС)
клеточной стенки грамотрицательных бактерий,
термостабилен. Состоит из 3 фрагментов: липид
А(консервативная структура, является
эндотоксином, способна усиливать иммунный
ответ), ядро (олигосахаридная стержневая
структура), высоковариабельная О-специфическая
цепь полисахарида. В больших дозах может
вызывать эндотоксический шок.
48.
• капсульный – К-антиген, представленполисахаридами, является антифагоцитарным
фактором.
• пептидогликан муреин
• белковые токсины, ферменты, продукты
жизнедеятельности бактерий.
АГ вирусов
Выделяют:
• ядерные (коровые)
• капсидные
• суперкапсидные (гемагглютинины)
49.
Антигены клеточной стенки бактерий50.
Факторы и механизмы врожденного иммунитетаПонятие доиммунной защиты включает
неспецифическое защитное действие покровных
тканей, физиологических реакций, гуморальных и
клеточных факторов защиты организма (см. выше).
Лизоцим. Это гидролитический фермент
мурамидаза, синтезируется макрофагами,
нейтрофилами и другими фагоцитами и
постоянно поступает в жидкости и ткани
организма. Лизоцим есть везде, кроме спинномозговой жидкости и передней камеры глаза. Он
разрушает клеточную стенку бактерий и
способствует фагоцитозу поврежденных клеток.
51.
Интерферон. Это защитный белок иммуннойсистемы, обладающий противовирусным
свойством, синтезируется клетками иммунной
системы и соединительной ткани. Альфа- ИФ
вырабатывается лейкоцитами, Бета-ИФ –
фибробластами, Гамма-ИФ – активированными Тлимфоцитами, макрофагами, ЕК.
Индукторы ИФ: вирусы, РНК, ДНК, сложные
полимеры.
Защитные белки сыворотки крови.
• белок острой фазы – С-реактивный белок,
вырабатывается в печени в ответ на повреждение
тканей и клеток.
52.
• Маннозо-связывающий белок – связывается состатками маннозы на мембране микробных
клеток и активирует комплемент по лектиновому
пути и способствует фагоцитозу.
• Пропердин - нормальный глобулин сыворотки
крови. Активирует комплемент по
альтернативному пути.
• бета-лизины- синтезируются тромбоцитами и
повреждают ЦПМ бактерий.
• фибронектин- белок плазмы и тканевых
жидкостей. Обеспечивает опсонизацию АГ,
препятствует тромбообразованию.
53.
КомплементКомплемент – это система сывороточных белков
(более 20 компонентов), которые находятся в крови
в неактивном состоянии и могут каскадно
(последовательно друг за другом; активация одного
компонента вызывает активацию последующего)
активироваться при наличии в организме
чужеродного антигена.
Функции: 1) Участвует в лизисе микробных и других
клеток (цитотоксическое действие); 2) участвует в
анафилаксии; 3) обладает хемотаксической
активностью (хемоаттрактант); 4) участвует в
фагоцитозе (опсонин) и др.
54.
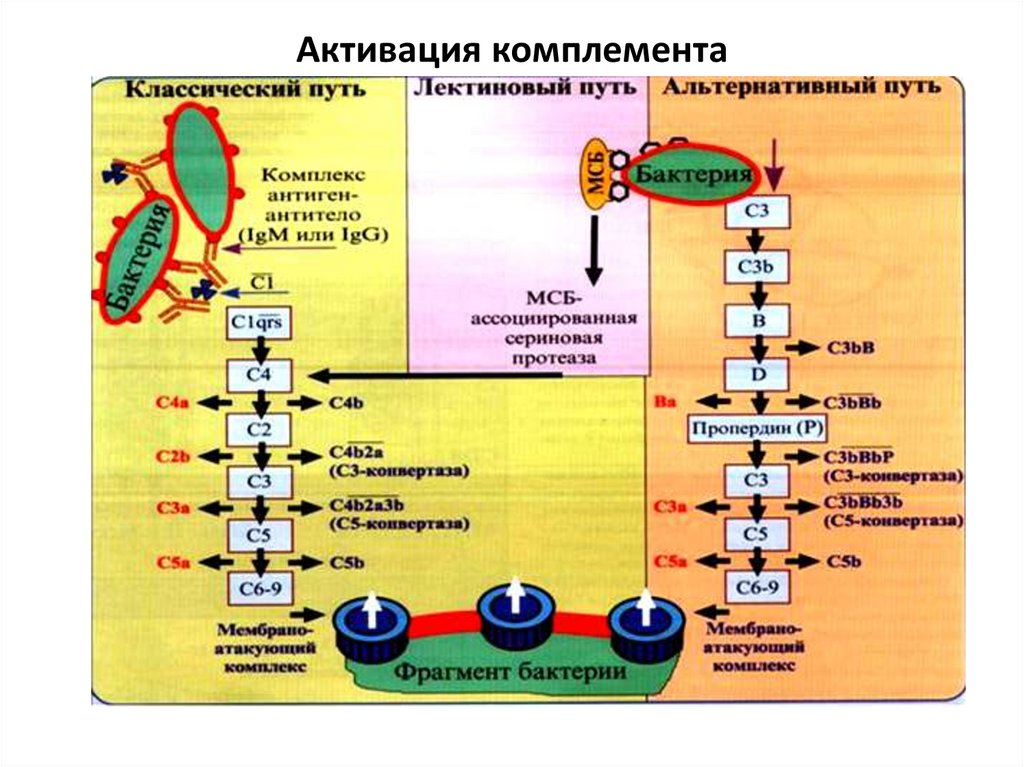
Выделяют 3 пути активации комплемента:1) Классический (антителозависимый).
При образовании комплекса антиген-антитело (2
молекулы IgG или 1 IgM) к ним присоединяется
первый компонент комплемента С1 (C1q, C1r, C1s).
Этот активированный компонент вызывает
протеолиз (отщепление ингибирующей части
молекулы) С4 на C4a и С4b. Далее С4b связывается с
мембраной клетки и с участием С1s расщепляет C2
на С2а и С2b. С2а и C4b расщепляют С3 на С3a и C3b
и совместно с C3b вызывают протеолиз С5 на С5а и
C5b. При связывании С5b с мембраной к нему
последовательно присоединяются С6, С7, С8 и С9.
55.
Последние компоненты (С6-9) образуютмембраноатакующий компекс (МАК) – деффект
(пору) в мембране клетки. В результате
многочисленных МАК клетка погибает от
осмотического лизиса.
Образовавшиеся в результате активации фрагменты
С3а и С5а вызывают сокращение гладких мышц,
выброс гистамина тучными клетками и базофилами
(анафилатоксины), индуцируют хемотаксис
(хемоаттрактанты) и активацию гранулоцитов.
56.
2) ЛектиновыйИнициируется маннозосвязывающим белком –
лектином крови (аналог С1q). Он связывается с
маннозой поверхности бактериальной клетки и
запускает каскад реакций, начиная с расщепления
С4 на С4а и С4b (см. выше).
3) Альтернативный.
Активаторами являются антигены
грамотрицательных бактерий и агрегаты белков.
Проходит при участии дополнительных факторов: B,
D, Р и Н. Начинается с С3 (см. выше).
57.
Активация комплемента58.
ФагоцитозПроцесс поглощения клеткой корпускулярных
частиц и крупных комплексов.
К «профессиональным» фагоцитам относятся
нейтрофилы и макрофаги (Купферовские клетки –
печени; микроглия – мозга и др.)
Функции фагоцитов:
1) удаление из организма отмирающих клеток и их
структур;
2) удаление неметаболизируемых неорганических
веществ, попадающих во внутреннюю среду
организма (частички угля, минеральная пыль);
59.
3) поглощение и инактивирование микробов;4) синтез БАВ;
5) участие в регуляции работы иммунной системы;
6) Представление АГ Т-хелперам (АПК поглощает АГ
и после процессинга включает его в состав
молекулы МНС II класса, затем выставляет на
поверхность (экспрессирует) для ознакомления с
ним Т-хелперам).
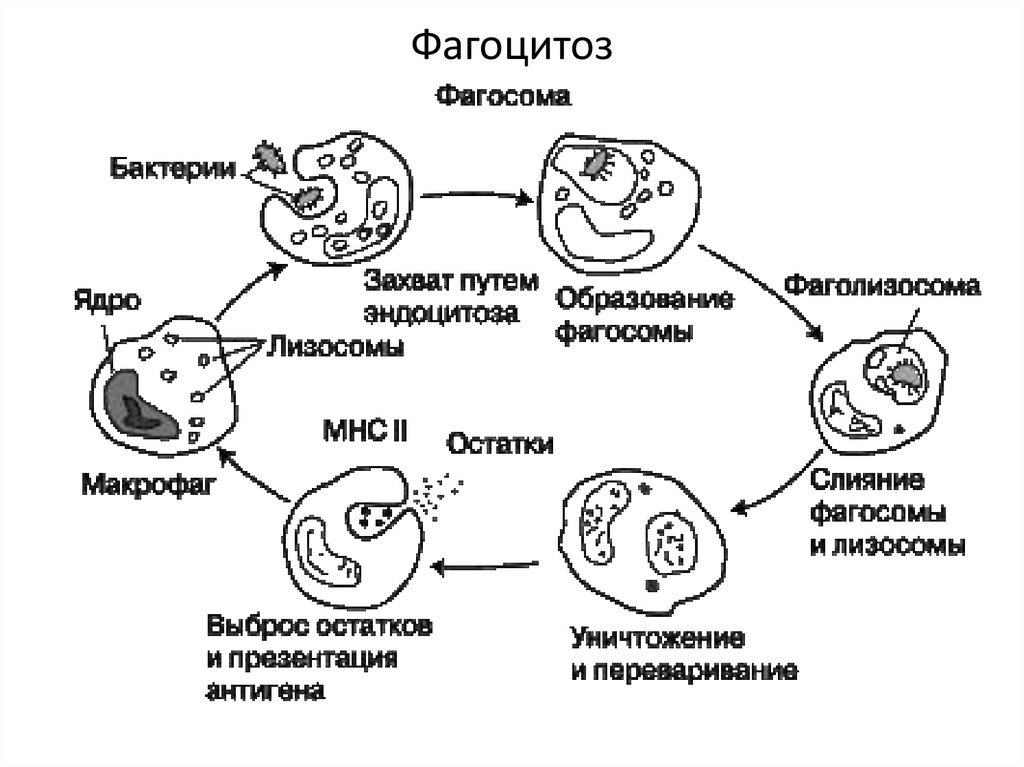
Стадии фагоцитоза: приближение фагоцита к
объекту поглощения (хемотаксис) → адсорбция АГ
на поверхности фагоцита → поглощение АГ путем
инвагинации клеточной мембраны и образование
фагосомы (эндоцитоз) → слияние фагосомы с
лизосомой и образование фаголизосомы
60.
→ переваривание АГ при помощи активированныхферментов (завершенный фагоцитоз).
Незавершенный фагоцитоз – микробы не погибают
и сохраняют способность к размножению.
Причины:
• Подавление слияния фагосомы с лизосомами
• Устойчивость к лизосомальным ферментам
• Выход микробов из фагосом
61. Фагоцитоз
62.
Выделяют:• килороднезависимый механизм переваривания
АГ : литические ферменты (более 100 видов)
• кислородзависимый механизм: перекись
водорода, супероксиданион, гидроксильный
радикал, синглетный кислород и NO- ионрадикалы (поражают мембрану клетки)
Хемотаксис (движение к объекту фагоцитоза)
осуществляется по градиенту хемоаттрактантов –
веществ, привлекающих фагоцитов.
К ним относятся: компоненты комплемента,
цитокины, продукты распада клеток, продукты
жизнедеятельности бактерий и др.
63.
Опсонины – вещества, обволакивающие антигены иусиливающие их фагоцитоз. Роль опсонинов
выполняют иммуноглобулины, белки острой фазы,
фибронектин, ЛПС-связывающий белок,
компоненты комплемента, сурфактантные
протеины легких и др.
64.
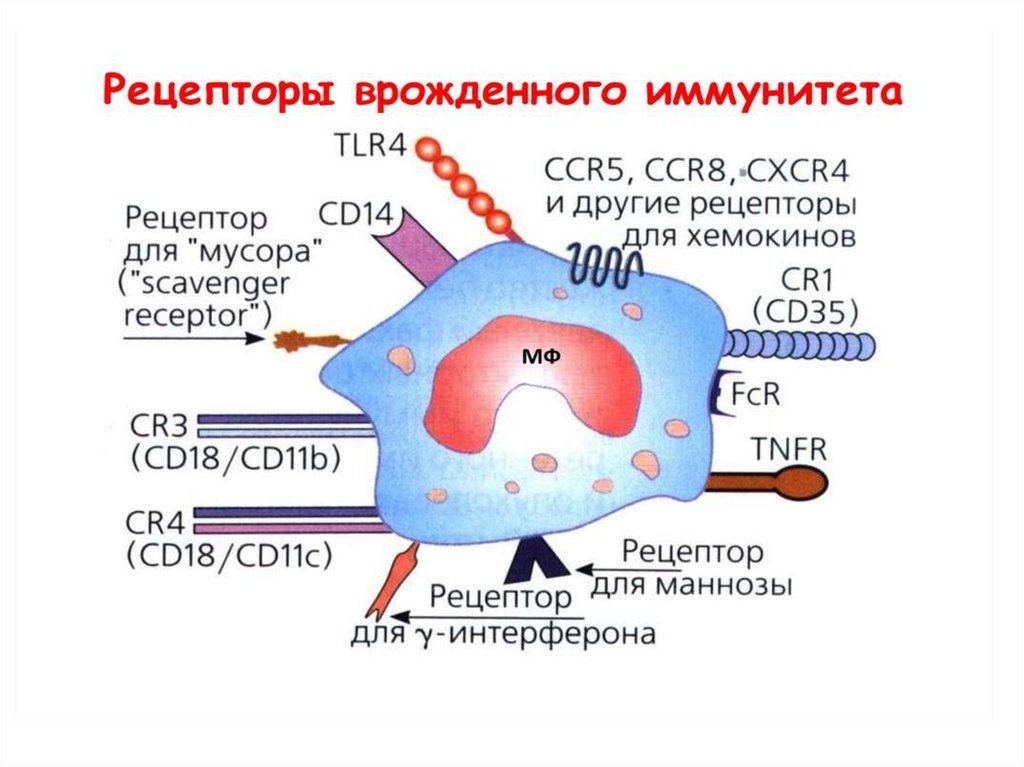
Рецепторы макрофагов:1) Рецепторы для «хвостов» антител – FcR
2) Рецепторы для компонентов комплемента
3) Рецепторы для цитокинов, гормонов и
медиаторов
4) Рецепторы распознавания «чужого» (PRR, TLR
– Toll-Like Receptor).
5) Рецепторы – «мусорщики». Рецепторы для
фрагментов фосфолипидных мембран и
других компонентов собственных
поврежденных и умирающих клеток
6) др.
65.
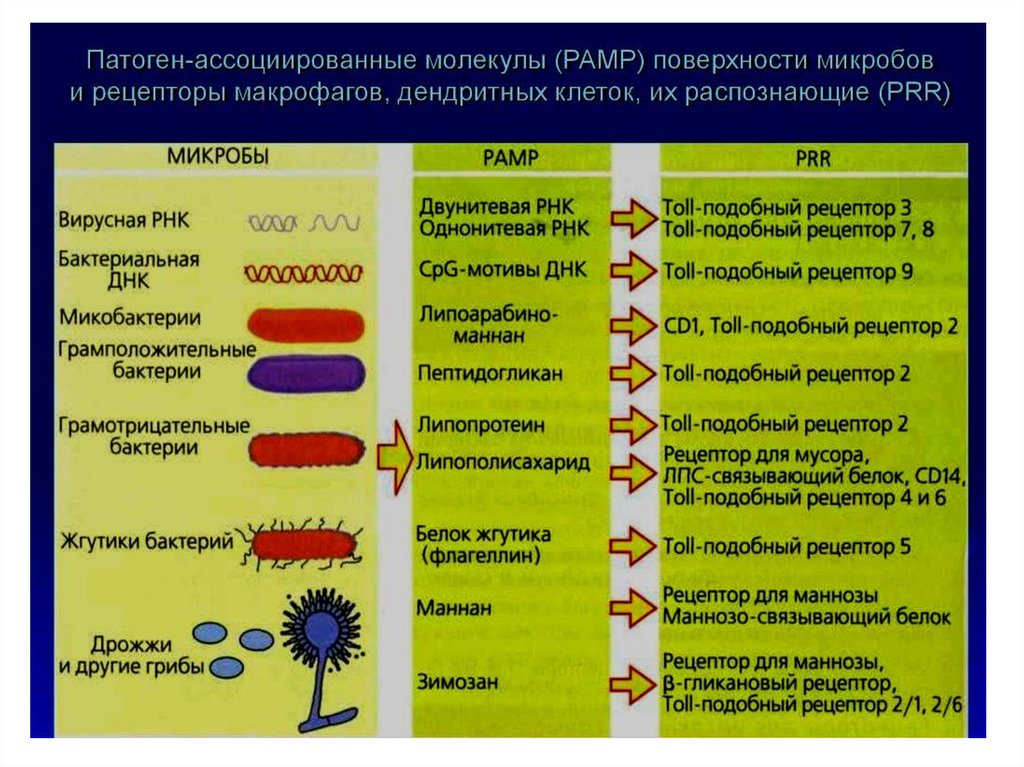
Рецепторы распознавания «чужого»Ключевое понятие иммунитета – способность
иммунной системы распознавать «чужое» и
применять к нему механизмы нейтрализации и
уничтожения.
На поверхности микроорганизмов присутствуют
повторяющиеся молекулярные углеводные и
липидные структуры («узоры»), которых в
большинстве случаев нет на клетках организма
человека. Рецепторы, распознающие этот «узор»
на поверхности патогена – PRR
(паттернраспознающие рецепторы). Они
позволяют клеткам врожденного иммунитета
обнаруживать патогены.
66.
В зависимости от локализации выделяютрастворимые и мембранные формы PRR.
• Растворимые рецепторы для патогенов – белки
сыворотки крови, синтезируемы печенью: ЛПСсвязывающий белок, компонент комплемента С1,
белки острой фазы МСЛ и С-реактивный белок.
Они связываются с микробными продуктами и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами, либо могут
активировать систему комплемента.
67.
• Мембранные рецепторы. У млекопитающих ониполучили название Toll-подобных рецепторов (TollLike Receptor). У человека описано 10 различных
вариантов TLR. Одни из них непосредственно
связывают продукты патогенов, другие работают
совместно с другими рецепторами.
При взаимодействии рецептора с патогеном
запускается цепь последовательных
взаимодействий определенных молекул,
приводящая к передаче сигнала в ядро клетки и
транскрипции генов провоспалительных
цитокинов, хемокинов и костимуляторных
молекул, создавая условия для активации
специфического иммунитета.

























































 medicine
medicine