Similar presentations:
Периодическая система. Закономерности изменения свойств
1.
2.
Периодическая системаЗакономерности изменения свойств
3.
4.
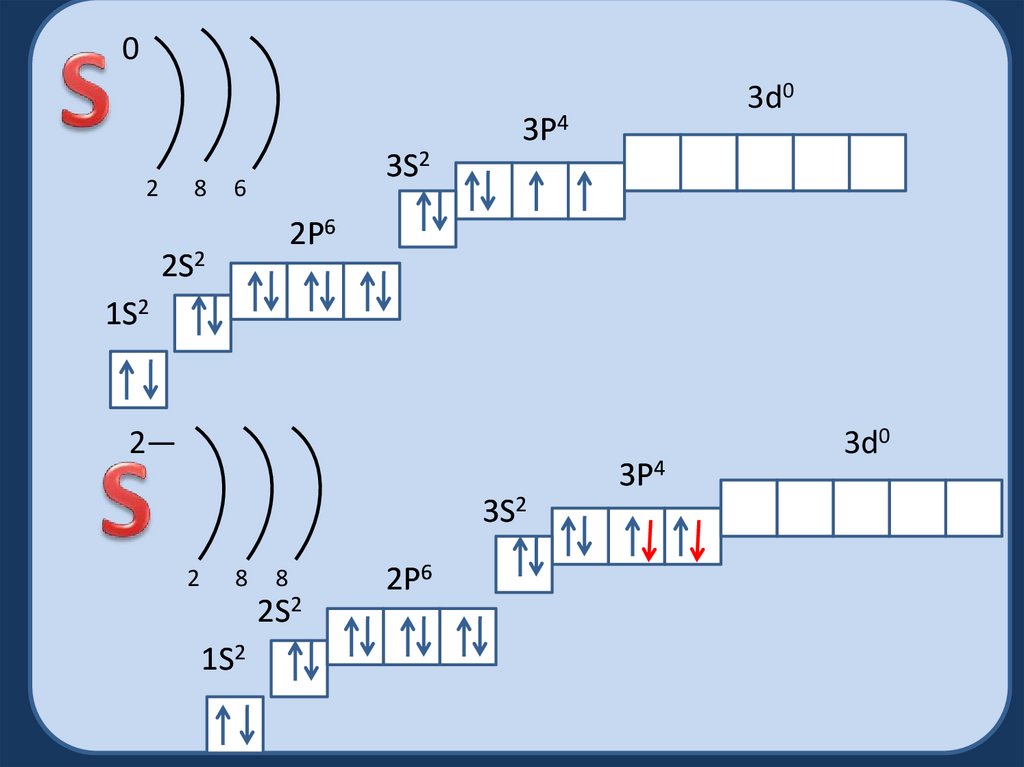
03d0
3P4
2
8
3S2
6
2P6
2S2
1S2
2—
3P4
3S2
2
8
8
2S2
1S2
2P6
3d0
5.
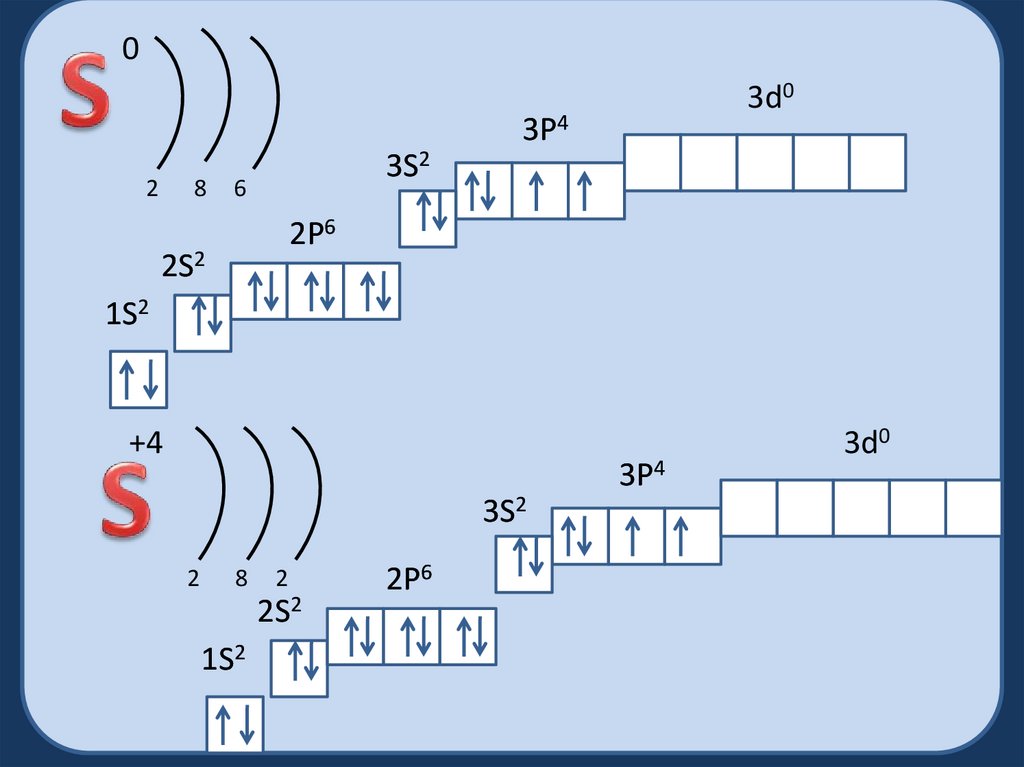
03d0
3P4
2
8
3S2
6
2P6
2S2
1S2
+4
3P4
3S2
2
8
2
2S2
1S2
2P6
3d0
6.
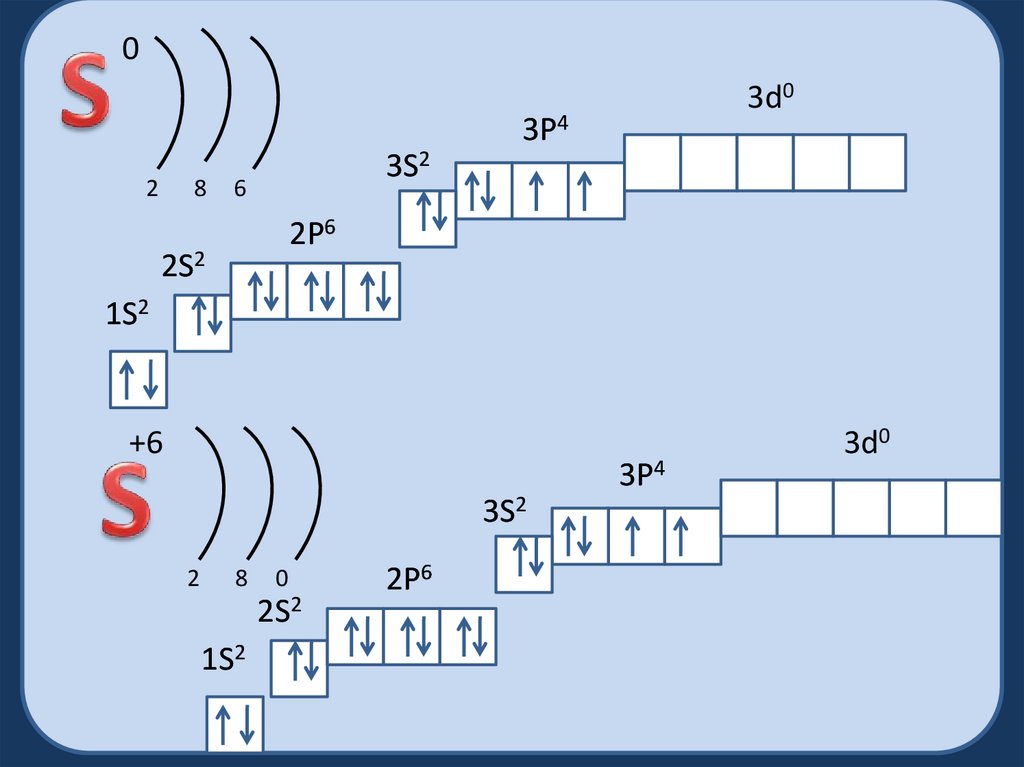
03d0
3P4
2
8
3S2
6
2P6
2S2
1S2
+6
3P4
3S2
2
8
0
2S2
1S2
2P6
3d0
7.
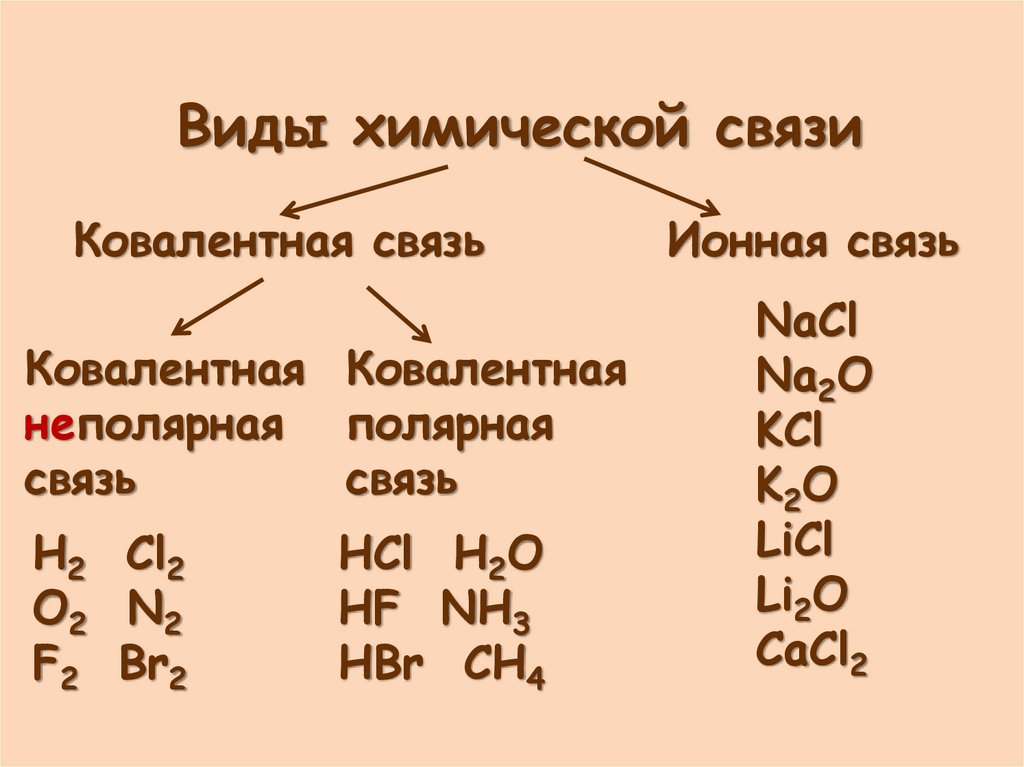
Виды химической связиКовалентная связь
Ковалентная Ковалентная
неполярная полярная
связь
связь
H2 Cl2
O2 N2
F2 Br2
HCl H2O
HF NH3
HBr CH4
Ионная связь
NaCl
Na2O
KCl
K2O
LiCl
Li2O
CaCl2
8.
Ковалентная неполярная связь9.
10.
Степень окисленияNH3
+
NH4
OF2
NaH
(NH4)2SO4 , CuNO3 , Cu(NO3)2 , Ca3(PO4)2
11.
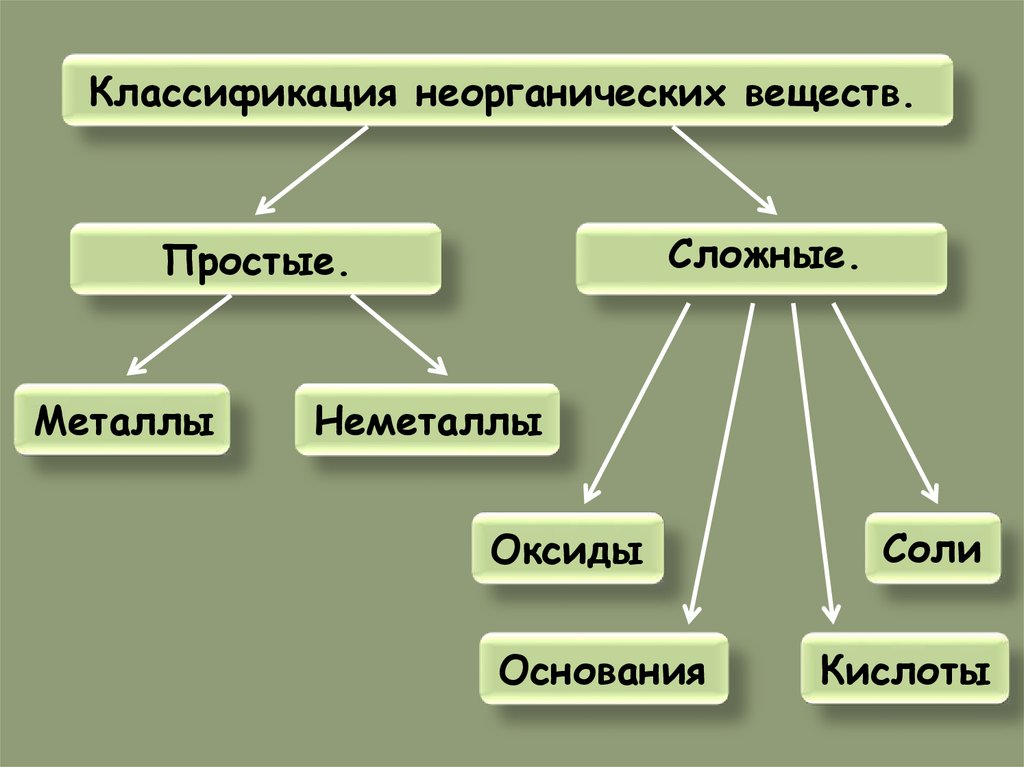
Классификация неорганических веществ.Сложные.
Простые.
Металлы
Неметаллы
Оксиды
Основания
Соли
Кислоты
12.
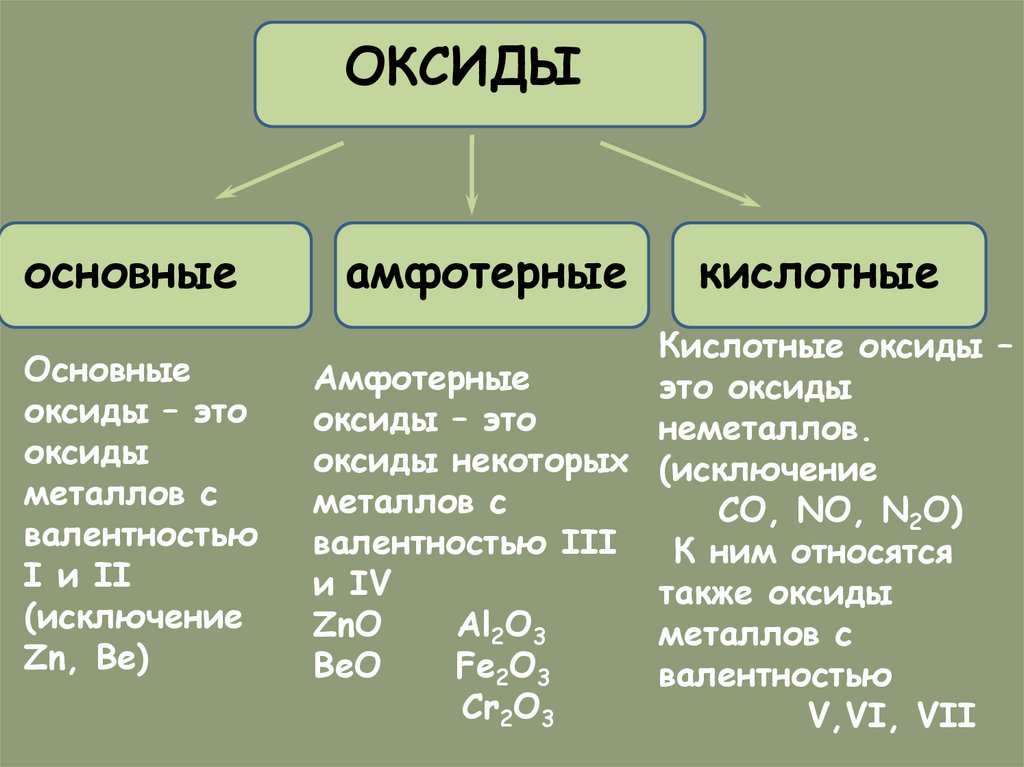
ОКСИДЫосновные
Основные
оксиды – это
оксиды
металлов с
валентностью
I и II
(исключение
Zn, Be)
амфотерные
кислотные
Кислотные оксиды –
Амфотерные
это оксиды
оксиды – это
неметаллов.
оксиды некоторых (исключение
металлов с
CO, NO, N2O)
валентностью III
К ним относятся
и IV
также оксиды
ZnO
Al2O3
металлов с
BeO
Fe2O3
валентностью
Cr2O3
V,VI, VII
13.
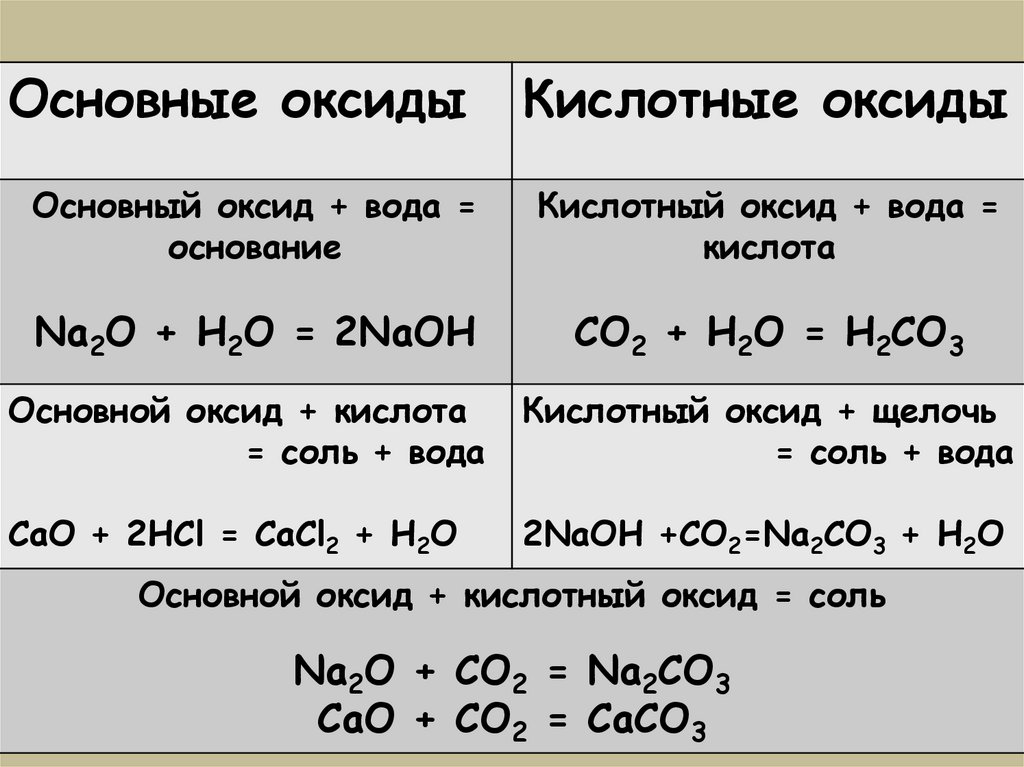
Основные оксидыКислотные оксиды
Основный оксид + вода =
основание
Кислотный оксид + вода =
кислота
Na2O + H2O = 2NaOH
CO2 + H2O = H2CO3
Основной оксид + кислота
= соль + вода
Кислотный оксид + щелочь
= соль + вода
CaO + 2HCl = CaCl2 + H2O
2NaOH +CO2=Na2CO3 + H2O
Основной оксид + кислотный оксид = соль
Na2O + CO2 = Na2CO3
CaO + CO2 = CaCO3
14.
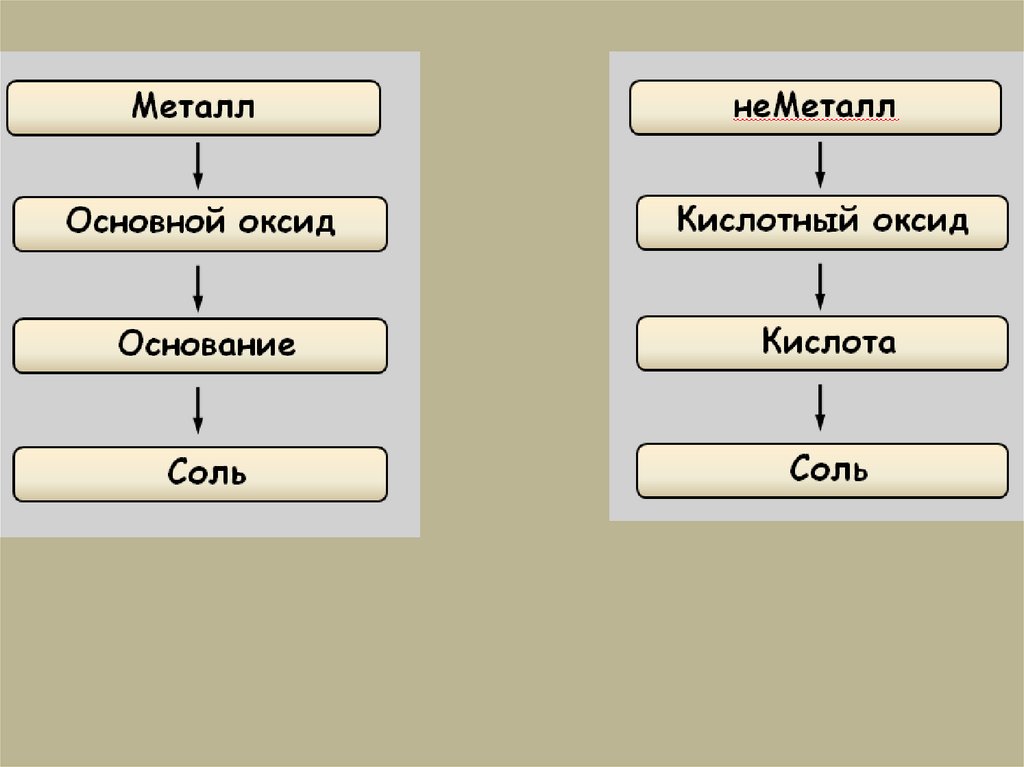
Генетический ряд металлов.Металл
Основной оксид
Основание
Соль
15.
Генетический ряд неметаллов.неМеталл
Кислотный оксид
Кислота
Соль
16.
17.
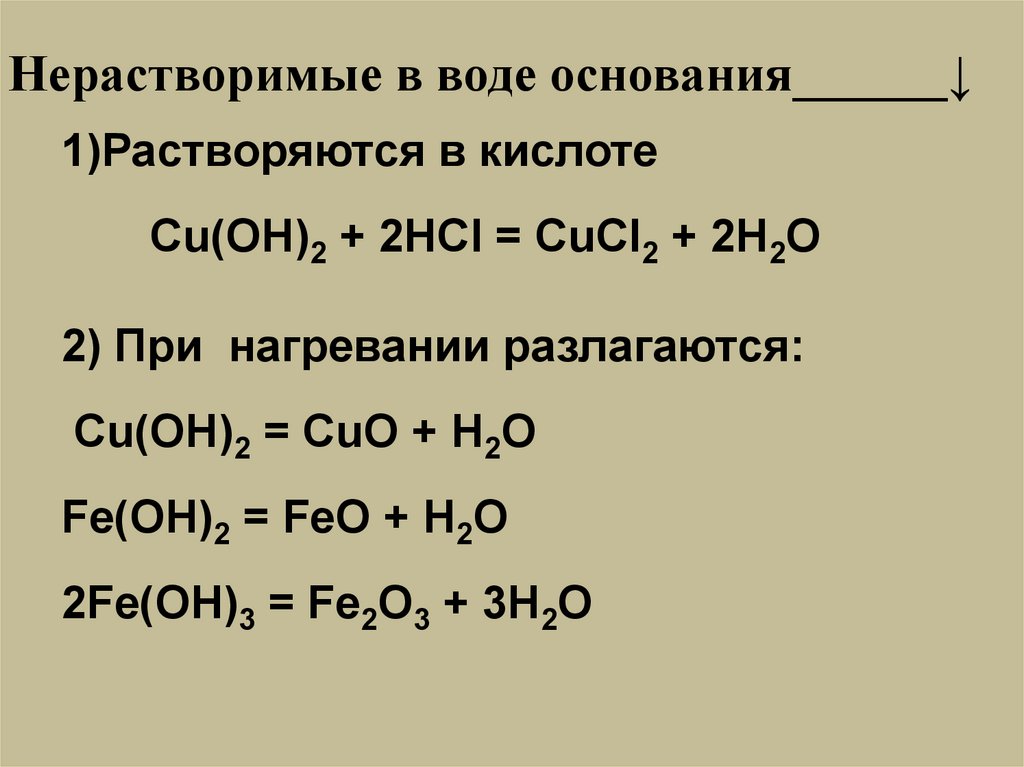
Нерастворимые в воде основания______↓1)Растворяются в кислоте
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
2) При нагревании разлагаются:
Cu(OH)2 = CuO + H2O
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
18.
СОЛИ1) Взаимодействие с металлами
2) Взаимодействие с растворимыми в
воде основаниями
3) Взаимодействие с растворимыми в
воде кислотами
4) Взаимодействие с растворимыми в
воде солями
19. Галогены
20.
1. Взаимодействие с металлами.При взаимодействии галогенов с металлами
образуются соли – галогениды.
Zn + F2 = ZnF2
фторид цинка
2Fe
2FeCl
хлорид
цинка
Fe + 3Cl
Cl2 2−−FeCl
цинка
3 3 хлорид
2Al
2AlBr
бромид
цинка
Al + 3Br
Br2 2−−AlBr
цинка
3 3 бромид
2Al
2AlI
бромид
цинка
Al + 3I
I2 2−−AlI
цинка
3 3 бромид
21.
2. Взаимодействие с водородом.При взаимодействии галогенов с водородом
образуются галогеноводороды (при растворении в
воде галогеноводороды образуют кислоты)
H
H22 +
+ FF22 −
− 2HF
HF
фтороводород
фтороводород (со
(со взрывом)
взрывом)
хлороводород
(со
взрывом
при
хлороводород
(со
взрывом
при
H
H22 +
+ Cl
Cl22 −
− 2HCl
HCl
ярком солнечном освещении)
ярком солнечном освещении)
H
H22 +
+ Br
Br22 −2HBr
− HBr бромоводород
бромоводород (при
(при нагревании)
нагревании)
H
H22 +
+ II22 −
− 2HI
HI
иодоводород
иодоводород (при
(при нагревании,
нагревании,
медленно)
медленно)
22.
3. Взаимодействие с водой.Cl2, Br2, I2 взаимодействуют по схеме:
Гal2 + H2O = HГalО + НГal
Cl2 + H2O = HClO + HCl
(хлороводородная кислота)
(хлорноватистая кислота)
Вода горит во фторе:
F2 2++H2H
2F
− HF
= 4HF
+ O+
2O2O
2 O2
23.
4. Взаимодействие со сложными веществами.Более активный галоген вытесняет менее активный из
растворов солей.
F2 > Cl2 > Br2 > I2
активность уменьшается
КBr
2КBr+ +ClCl
− −KCl
2KCl
+ Br
+ 2Br2
2 2
Почему для этой реакции не используют фтор?
24.
Окислительныесвойства
Восстановительные
свойства
1. Сера взаимодействует
практически со всеми металлами.
1. Сера взаимодействует с
кислородом (горит)
2. Со щелочными металлами сера
взаимодействует без нагревания.
2. Сера взаимодействует со
фтором.
2Al + 3S = Al2S3
2Na + S = Na2S
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S = H2S
S + O2 = SO2
S + 3F2 = SF6
25.
Оксид серы (IV)SO2
Оксид серы (VI)
SO3
1. Взаимодействие с
водой.
1. Взаимодействие с
водой.
2. Взаимодействие со
щелочами.
2. Взаимодействие со
щелочами.
3. Взаимодействие с
основными оксидами.
3. Взаимодействие с
основными оксидами.
26.
Химические свойства.учебник, стр.89 – 91
1. Серная кислота диссоциирует ступенчато.
2. Разбавленная серная кислота взаимодействует с
металлами
(стоящими в электрохимическом ряду до водорода)
3. Серная кислота взаимодействует с основными
оксидами.
4. Серная кислота взаимодействует с основаниями
( и растворимыми и нерастворимыми)
5. Серная кислота взаимодействует с растворимыми
солями.
27.
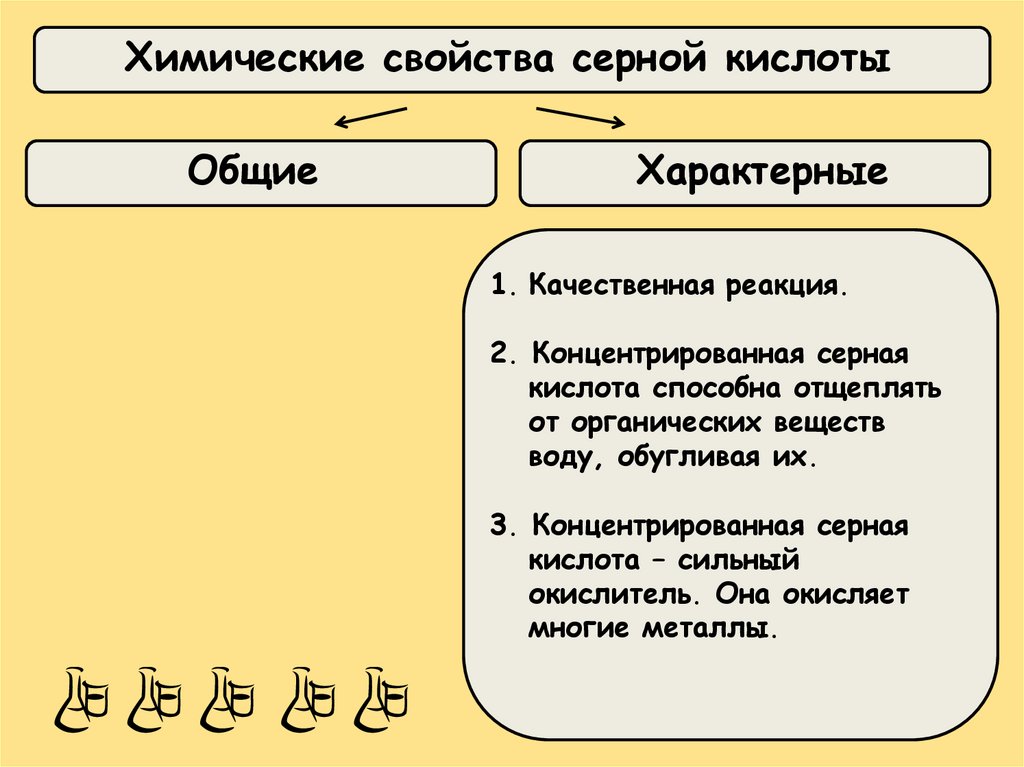
Химические свойства серной кислотыОбщие
Характерные
1. Качественная реакция.
2. Концентрированная серная
кислота способна отщеплять
от органических веществ
воду, обугливая их.
3. Концентрированная серная
кислота – сильный
окислитель. Она окисляет
многие металлы.
28.
29.
Химические свойства азота30.
Химические свойства азота1. Взаимодействие с металлами:
6 Li + N2 = 2 Li3N
2. Взаимодействие с водородом :
N2 + 3 H2 = 2NH3
3. Взаимодействие с кислородом :
N2 + O2 = 2 NO
31.
Химические свойства аммиака1. Взаимодействие с водой:
2. Взаимодействие с кислотами:
32.
Химические свойства аммиака1. Взаимодействие с водой:
2. Взаимодействие с кислотами:
33.
Химические свойства аммиака1. Взаимодействие с водой:
2. Взаимодействие с кислотами:
34.
Химические свойства аммиака3. Горение аммиака:
4. Каталитическое окисление аммиака:
35.
Химические свойства аммиака3. Горение аммиака:
4. Каталитическое окисление аммиака:
36.
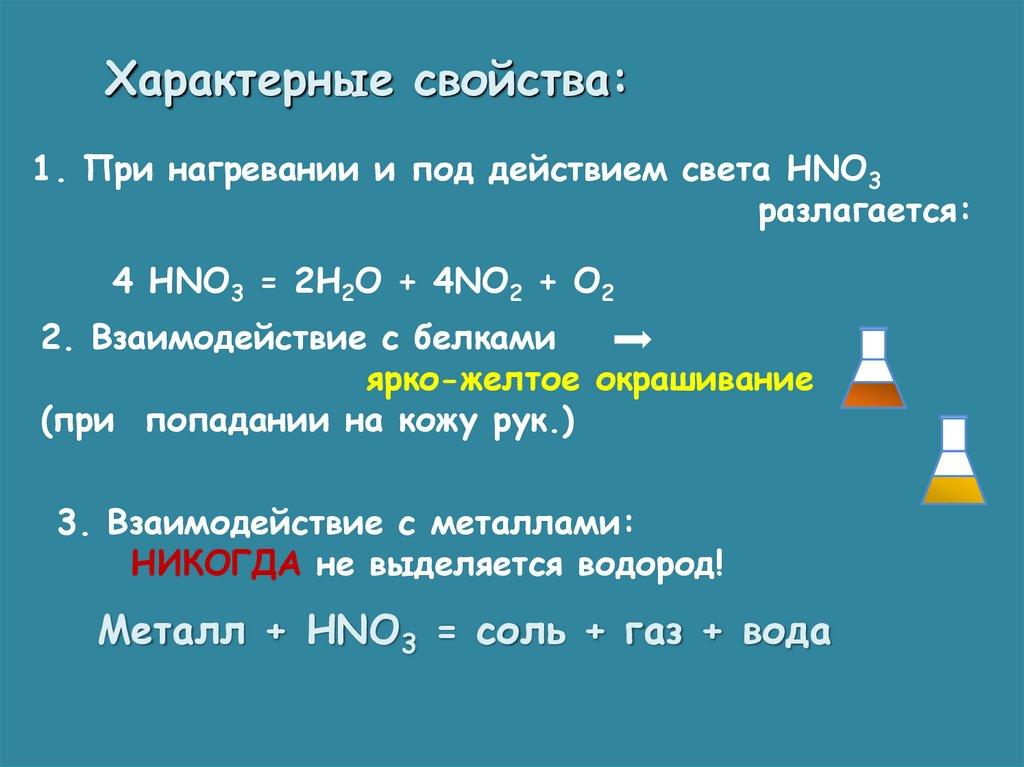
Характерные свойства:1. При нагревании и под действием света HNO3
разлагается:
4 HNO3 = 2H2O + 4NO2 + O2
2. Взаимодействие с белками
ярко-желтое окрашивание
(при попадании на кожу рук.)
3. Взаимодействие с металлами:
НИКОГДА не выделяется водород!
Металл + HNO3 = соль + газ + вода
37.
38.
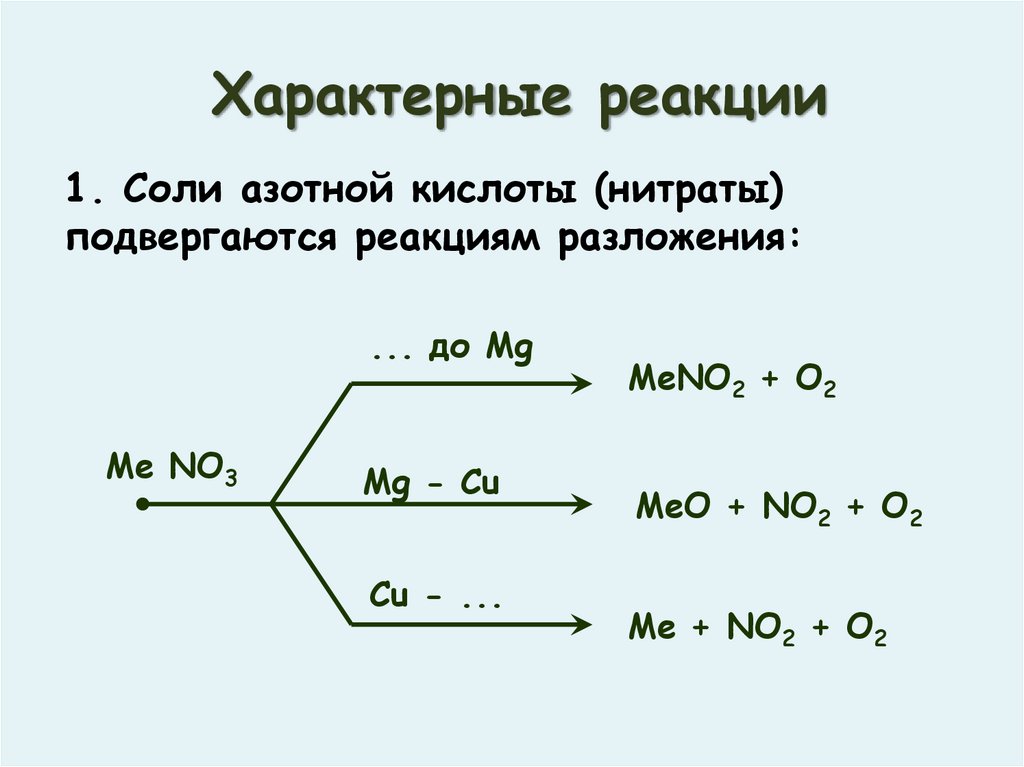
Характерные реакции1. Соли азотной кислоты (нитраты)
подвергаются реакциям разложения:
... до Mg
Me NO3
Mg - Cu
Cu - ...
MeNO2 + O2
MeO + NO2 + O2
Me + NO2 + O2
39.
Химические свойства углерода:Восстановительные свойства
Окислительные свойства
1. Горение угля:
С + О2 = СО2
2. Неполное сгорание
1. Вз-ие с водородом:
С + 2Н2 = СН4 (метан)
2. Вз-ие с металлами
углерода:
2С + О2 = 2СО (угарный газ)
3. Восстановление
металлов из оксидов:
С + 2CuO = 2Cu + CO2
4. Взаимодействие с
оксидом углерода (IV):
С + СО2 = 2СО
(образуются карбиды)
3С + 4Al = Al4C3
Са + 2С = СаС2
3. Взаимодействие с
кремнием:
С + Si = Si+4C−4
40.
41.
I. Взаимодействие с простыми веществами.42.
I. Взаимодействие с простыми веществами.43.
I. Взаимодействие с простыми веществами.44.
II. Взаимодействие со сложными веществами.45.
II. Взаимодействие со сложными веществами.46.
47.
К раствору карбоната калия массой 27, 6 г имассовой долей 10% прилили избыток
раствора нитрата кальция. Вычислите массу
образовавшегося осадка.
170 г нитрата серебра смешали с избытком
раствора хлорида натрия. Выпал осадок
массой 8, 61 г. Вычислите массовую долю соли
в растворе нитрата серебра.




































 chemistry
chemistry








