Similar presentations:
Монреальский протокол
1. Самостоятельная работа
Вопрос 1.На каких фактах основывается современное научное
представление о возникновении
Вселенной?
Вопрос 2.
Какие данные послужили основой для принятия
Монреальского протокола?
2. Продолжение лекции 2 МОНРЕАЛЬСКИЙ ПРОТОКОЛ
Монреа́льскийпротоко́л
по
вещества́м,
разруша́ющим озо́новый слой (англ. The Montreal
Protocol on Substances That Deplete the Ozone
Layer) — международный протокол к Венской
конвенции об охране озонового слоя 1985 года,
разработанный с целью защиты озонового слоя с
помощью снятия с производства некоторых
химических веществ, которые разрушают озоновый
слой.
3. МОНРЕАЛЬСКИЙ ПРОТОКОЛ
Протокол был подготовлен к подписанию 16 сентября1987 года и вступил в силу 1 января 1989 года.
После этого последовала первая встреча в Хельсинки
в мае 1989 года.
С тех пор протокол подвергался пересмотру семь
раз: в 1990 (Лондон), 1991 (Найроби),
1992 (Копенгаген), 1993 (Бангкок), 1995 (Вена),
1997 (Монреаль) и 1999 (Пекин).
4.
Монреальский протокол предусматриваетдля каждой группы галогенированных
углеводородов определённый срок, в
течение которого она должна быть снята
с производства и исключена из
использования.
5.
По состоянию на декабрь 2009 года 196государств-членов ООН ратифицировали
первоначальную версию Монреальского
протокола.
Генеральный секретарь ООН (1997—2006)
- Кофи Аннан сказал, что «возможно,
единственным очень успешным
международным соглашением можно считать
Монреальский протокол».
6.
ВООН
16
сентября
отмечается
Международный день охраны озонового
слоя. Он был установлен в 1994 году в
память
о
подписании
Монреальского
протокола по веществам, разрушающим
озоновый слой.
7. Влияние вулканов на озоновый слой
ВАнтарктиде
находится
постояннодействующий
вулкан Эребус (77,5° ю.ш., 167,2° в.д.; высота – 3794 м.),
входящий в список самых активных вулканов на
Земле.
В его главном кратере находится лавовое озеро, не
застывающее
из-за
непрерывных
конвективных
процессов подъема и перемешивания магмы, которая
циркулирует от камеры, расположенной глубоко в
вулкане.
8.
Эребус–
один
из
немногих
вулканов,
представляющий собой систему открытого жерла,
объясняющую
активности
устойчивость
вулкана:
частую
и
разнообразие
смену
между
пассивной и активной дегазацией и взрывными
извержениями.
Рядом с лавовым озером, в главном кратере
находится жерло активной дегазации (пепловое
жерло), из которого периодически выбрасывается
столб вулканических газов.
9.
Весной над Антарктидой одновременно с сильнымпонижением стратосферного озона наблюдается рост
концентрации монооксида хлора ClO.
По максимальным значениям концентрации ClO в
стратосфере над станцией McMurdo в сентябре 1992 г.
с учетом площади озоновой дыры рассчитана масса
хлороводорода HCl, необходимого для ее образования.
Масса HCl составила 9,3 кт.
10.
Лондонскаяпожарная
служба
неоднократно
сообщала, что 90% пожаров с летальным исходом
связано именно с взрывами холодильников и
вдыханием
черного
токсичного
дыма,
образующегося при горении теплоизоляционных
материалов
холодильников.
Таких
пожаров
в
Лондоне происходит приблизительно 300 в год, то
есть практически почти каждый день происходит
пожар из-за возгорания холодильника.
Подробности: https://regnum.ru/news/polit/2302128.html
Любое использование материалов допускается только при наличии гиперссылки на ИА REGNUM.
11.
Последняякрупная
катастрофа,
причины
которой
подготовлены Монреальским и Киотским протоколами, —
пожар 24-этажного жилого дома Grenfell Tower постройки 1970-х
годов в Лондоне, случившийся 14 июня 2017 года. В результате
трагедии
погибло
не
менее
100
человек
12.
Монреальский протокол (МП), подписанный всемигосударствами
использование
мира,
и
регулирует
оборот
более
100
производство,
химических
веществ, подозреваемых в разрушении озонового
слоя. Большая часть из них изъята из использования.
Таким образом, совершен технологический переворот
в
мировой
химической
промышленности,
отбросивший многие ее отрасли на годы назад.
Подробности:
https://regnum.ru/news/polit/2302128.html
Любое использование материалов допускается только при наличии гиперссылки на ИА REGNUM.
13.
Существенноесокращение
антарктической
стратосферной озоновой дыры в 2010 году и в
течение ряда предыдущих лет — результат
чрезвычайного метеорологического явления,
иногда свойственного полярной зиме.
Учёные
называют
стратосферным
это
потеплением
stratospheric warming, SSW).
внезапным
(sudden
14. Лекция 3
Физико-химические процессы втропосфере
15. Тропосфера
Тропосфера–
нижний,
непосредственно
соприкасающийся с земной поверхностью,
слой
атмосферы.
Именно
воздухом
тропосферы дышат живые организмы, влага,
конденсирующаяся
в
тропосфере
и
выпадающая с атмосферными осадками,
обеспечивает человека питьевой водой.
16. Процессы окисления примесей в тропосфере
Протекают по различным направлениям:1) Окисление непосредственно в газовой фазе;
2)
Окислению
предшествует
абсорбция
частицами воды, и в дальнейшем процесс
окисления протекает в растворе;
3)
Окислению
предшествует
адсорбция
примесей на поверхности твердых частиц,
взвешенных в воздухе.
17. Концентрация примесей в тропосфере
18. Образование гидроксильного радикала в тропосфере
O(1D)+Н2О = 2ОНO(1D)+СН4 = СН3+ОН
O(1D) + Н2 = Н+ОН
НNO2 —→NO+ОН , λ<340 нм
НNO3—→NO2+ОН, λ<335 нм
Н2O2—→2ОН, λ<300 нм
19. Главные пути стока ОН - радикала
СО + ОН → СО2 + НСН4 + ОН → СН3 + Н2О
NO + OH + M → НNO2 + М*
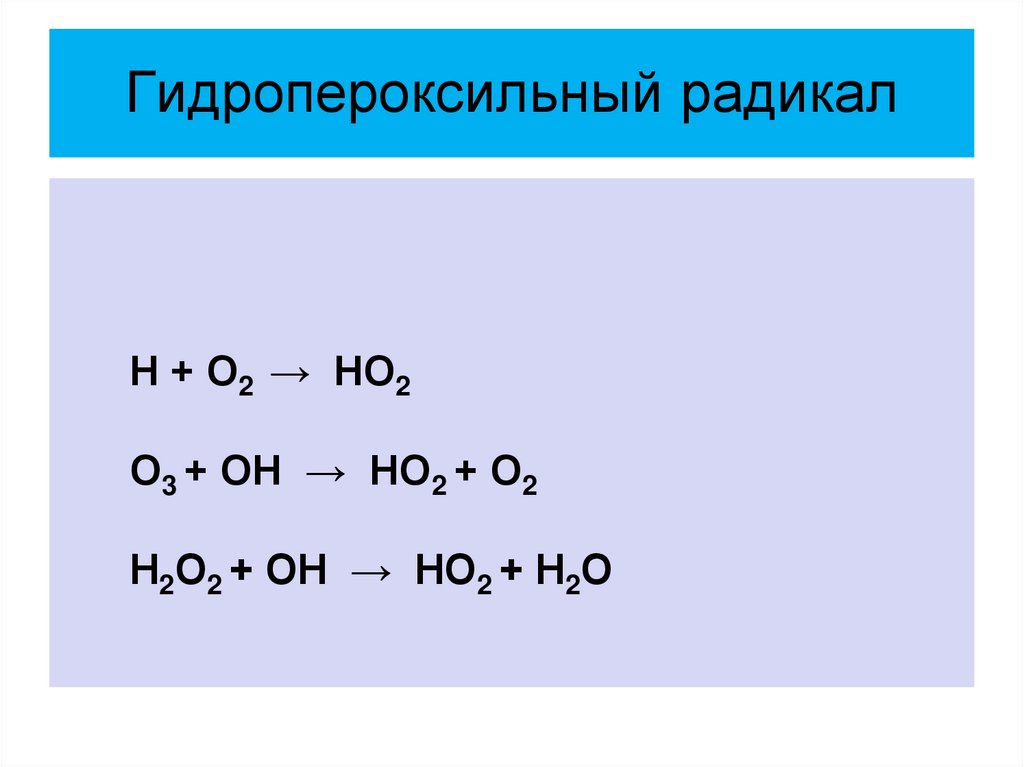
20. Гидропероксильный радикал
Н + О2 → НО2О3 + ОН → НО2 + О2
Н2О2 + ОН → НО2 + Н2О
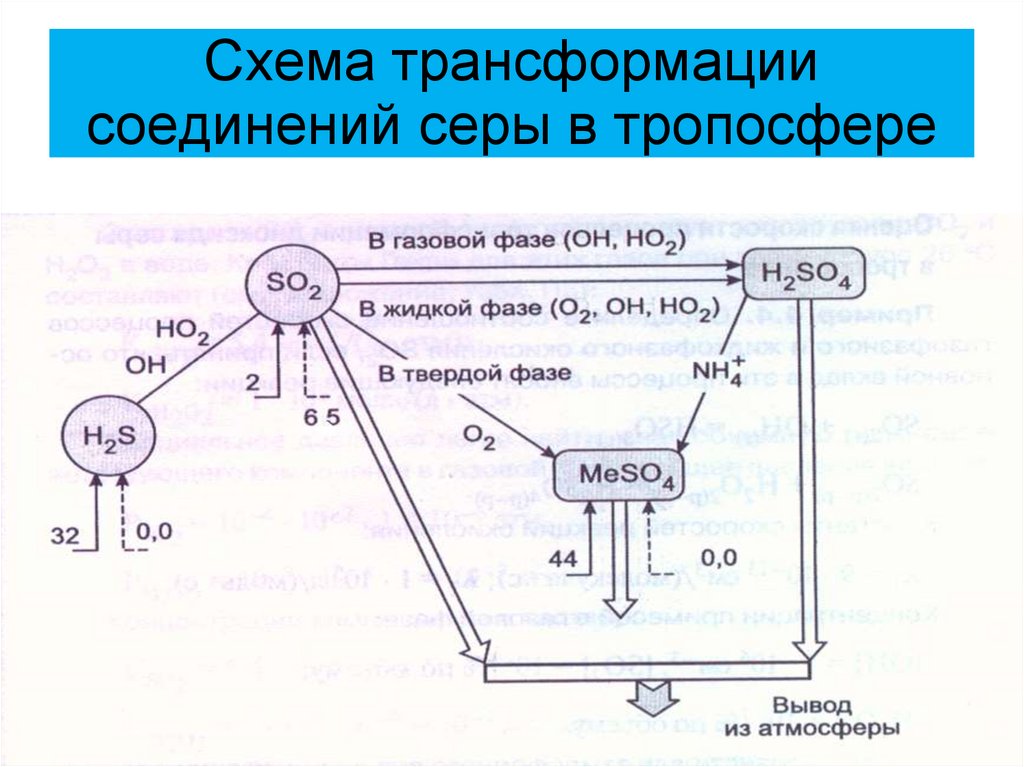
21. Схема трансформации соединений серы в тропосфере
22.
Основные поступления неорганическихсоединений серы в тропосферу связаны с
антропогенными источниками.
На их долю приходится примерно 65% от
всех поступлений неорганических
соединений серы в атмосферу. Около 95%
из этого количества составляет диоксид
серы.
23.
Изприродных
неорганических
источников
соединений
поступлений
серы
следует
выделить волновую деятельность в океанах,
приводящую к образованию аэрозолей.
Общее
количество
серы,
содержащейся
в
аэрозолях в виде сульфатов магния и кальция,
оценивается в 44 млн. т. в год, что составляет
примерно 30% от ее поступления в атмосферу в
виде неорганических соединений.
24.
Биологическиесоединений
источники
серы
выделяют
неорганических
преимущественно
сероводород, с которым в атмосферу поступает, по
различным оценкам, от 23 до 49% от всех
неорганических соединений серы.
Масштабы поступления сероводорода в атмосферу
и
процессы
его
трансформации
изучены еще недостаточно подробно.
в
атмосфере
25.
Имеющиеся в литературе сведения позволяютлишь грубо оценить его содержание в тропосфере.
Так над океанами концентрация H2S колебалась от
0.0076 до 0.076 мкг*м-3, а над континентами от 0,05
до 0.1 мкг*м-3.
Сероводород последовательно, в ряде стадий
окисляется до SO2.
26.
Принимая во внимание скоростьпоступления сероводорода в атмосферу и
его содержание в тропосфере, время его
жизни в атмосфере можно оценить в
несколько часов.
27.
Полученныйв
результате
диоксид
серы, как и SO2, поступающий из
других источников, окисляется далее.
Механизм этого процесса изучен более
подробно.
28.
Реакция окисления SO2 атомарным кислородомне играет существенной роли для процессов
трансформации соединений серы в тропосфере.
Ведущую роль в этих процессах играют свободные
радикалы. Протекающие при этом процессы можно
представить следующими уравнениями реакций:
SO2 + ОН + М = HSO3 + M*
HSO3 + HO2 = SO3 + 2OH
SO2 + HO2 = SO3 + OH
SO2 + CH3O2 = SO3 + CH3O
29.
Триоксид серы - серный ангидридлегко взаимодействует с частицами
атмосферной
влаги
и
растворы серной кислоты
образует
30.
Реагируяс
аммиаком
или
ионами
металлов,
присутствующими в частицах атмосферной влаги,
SO3
частично
переходят
в
соответствующие
сульфаты.
В
основном
это
сульфаты
аммония,
натрия,
кальция.
Образование сульфатов происходит и в процессе
окисления
сульфитов
на
поверхности
частиц, присутствующих в воздухе.
твердых
31.
Оксиды железа, алюминия, хрома и другихметаллов,
которые
также
могут
присутствовать в воздухе, резко ускоряют
процесс окисления диоксида серы. Как
показали лабораторные эксперименты, в
присутствии,
скорость
например,
процесса
частиц
трансформации
составляет примерно 100%•ч-1 .
Fe2O3,
SO2
32.
Необходимо отметить, однако, что данное значениеполучено
для
воздуха, в
котором
содержание
оксидов железа в 100 - 200 раз превышало фоновые
концентрации.
Поэтому
данный
процесс
трансформации диоксида серы играет основную
роль
лишь
содержащем
металлов.
в
сильно
значительные
запыленном
воздухе,
количества
оксидов
33.
Третий путь окисления диоксида серы втропосфере
связан
с
предварительной
абсорбцией SO2 каплями атмосферной влаги.
В
дождливую
погоду
и
при
высокой
влажности атмосферы этот путь окисления
может
стать
основным
трансформации диоксида серы.
в
процессе
34.
В качестве окислителя в природных условияхчасто
выступает
пероксид
водорода.
При
высоких значениях рН, когда в растворе в основном
находятся ионы SO3- скорость окисления заметно
возрастает.
Конечным продуктом окисления, как и в
случае окисления в газовой фазе, является
серная кислота, которая в дальнейшем может
перейти в сульфаты.
35.
Помимо процессов химической трансформациидиоксида серы в серную кислоту и сульфаты,
сток - вывод из атмосферы этих соединений
происходит в результате процессов:
- мокрого осаждения, с атмосферными
осадками;
- сухого осаждения - при контакте с
поверхностью
почвы,
поверхностного
водоема или растительностью.
36.
37.
В первый момент после выброса диоксидасеры в атмосфере отсутствуют серная кислота
и
сульфаты.
Со
временем
уменьшается,
доля
увеличивается,
проходит
доля
SO2
серной
кислоты
через
максимум
спустя 10 –15 часов после выброса, количество
сульфатов
в
атмосфере
будет
постепенно
увеличиваться в течение 40 –50 часов, затем
медленно начнет уменьшаться.
38.
Полученныерезультаты
наглядно
демонстрируют
опасность загрязнения атмосферы соединениями серы,
связанную с возможностью трансграничного переноса
примесей (перенос примесей на большие расстояния,
свыше 100 км).
Так, предположим, что над источником выбросов
соединений серы дует ветер, имеющий скорость
порядка 30 км/ч. В этом случае, спустя 10 часов с
момента выброса примеси будут удалены на расстояние
300 км от источника выброса.
В этом воздухе доля диоксида серы уменьшится
примерно в 5 раз, и основное количество соединений
серы будет представлено серной кислотой.
39.
В случае выпадения дождевых осадков надэтой территорией практически все соединения
серы будут выведены из атмосферы в виде
кислотного дождя. Необходимо отметить, что,
несмотря на наметившееся в последние годы
сокращение общего количества диоксида серы,
выбрасываемого в атмосферу,
серная кислота остается основным
компонентом, приводящим к закислению
атмосферных осадков.





































 ecology
ecology








