Similar presentations:
Строение атома
1.
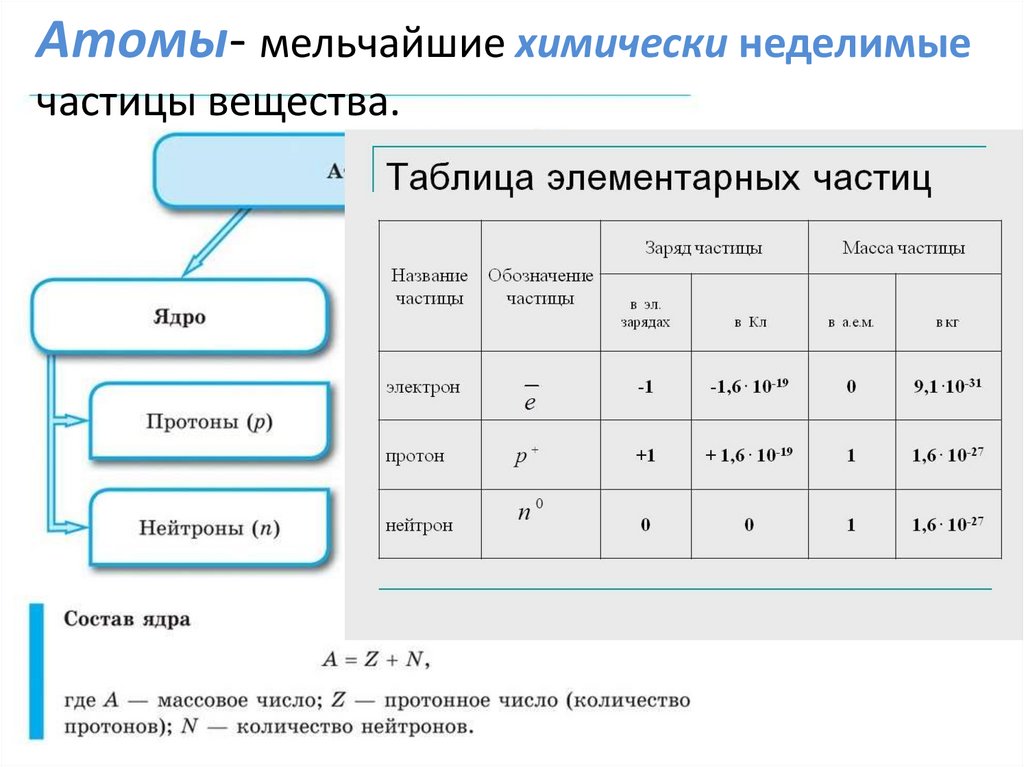
п.д.о. Маркина Н.Н.2. Атомы- мельчайшие химически неделимые частицы вещества.
3.
4.
5.
6. Изотопы водорода
Изотопуглерода
С14
7. Радиоуглеродный анализ
8. Ошибки метода
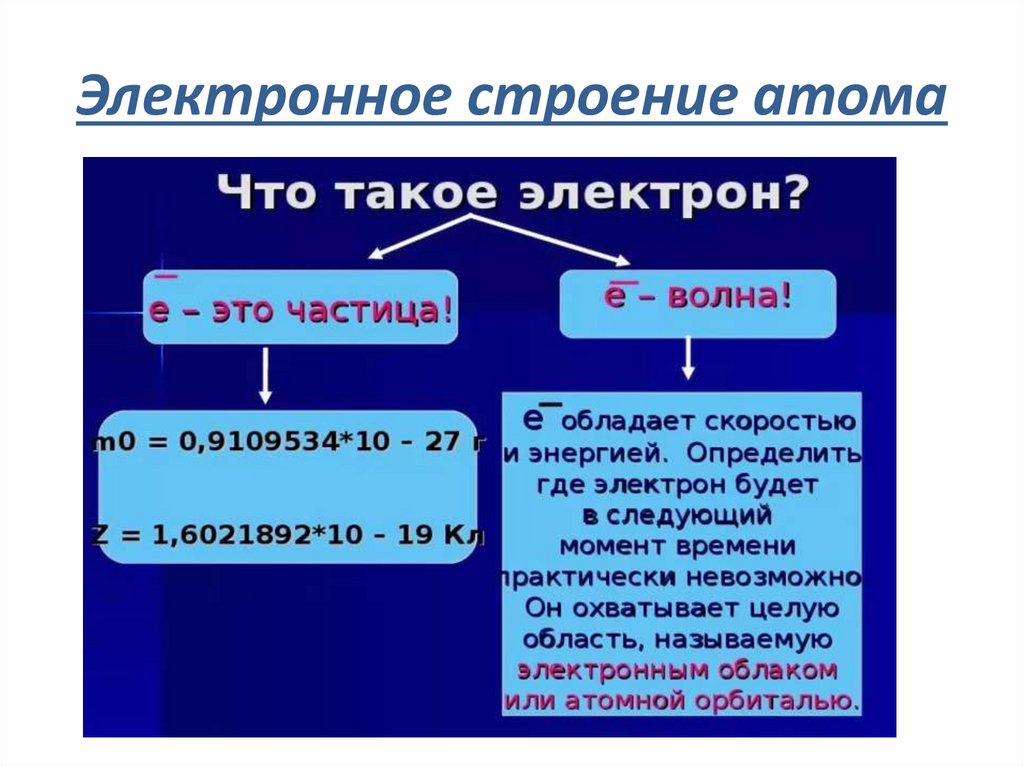
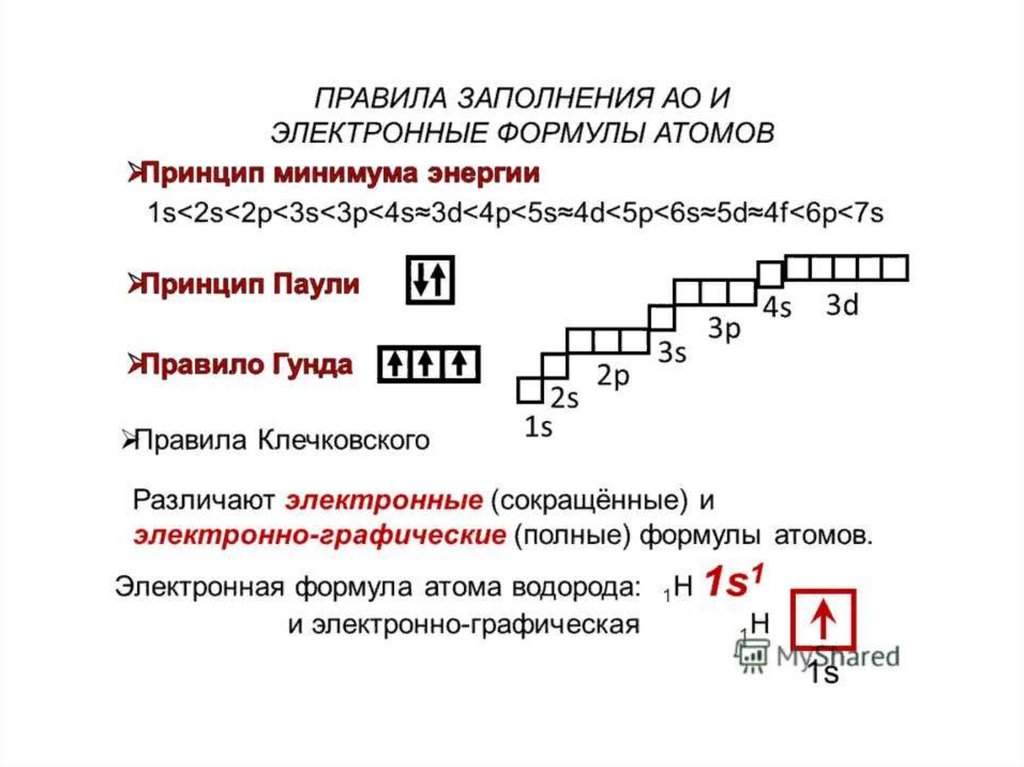
9. Электронное строение атома
10.
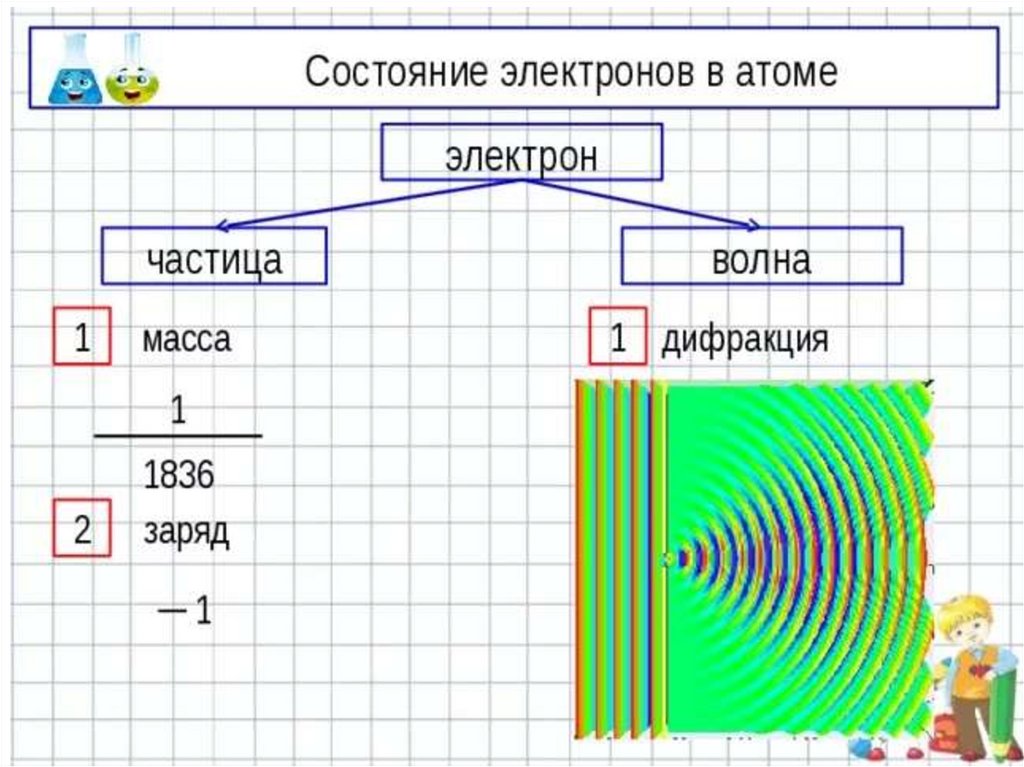
11. Волновая природа электрона
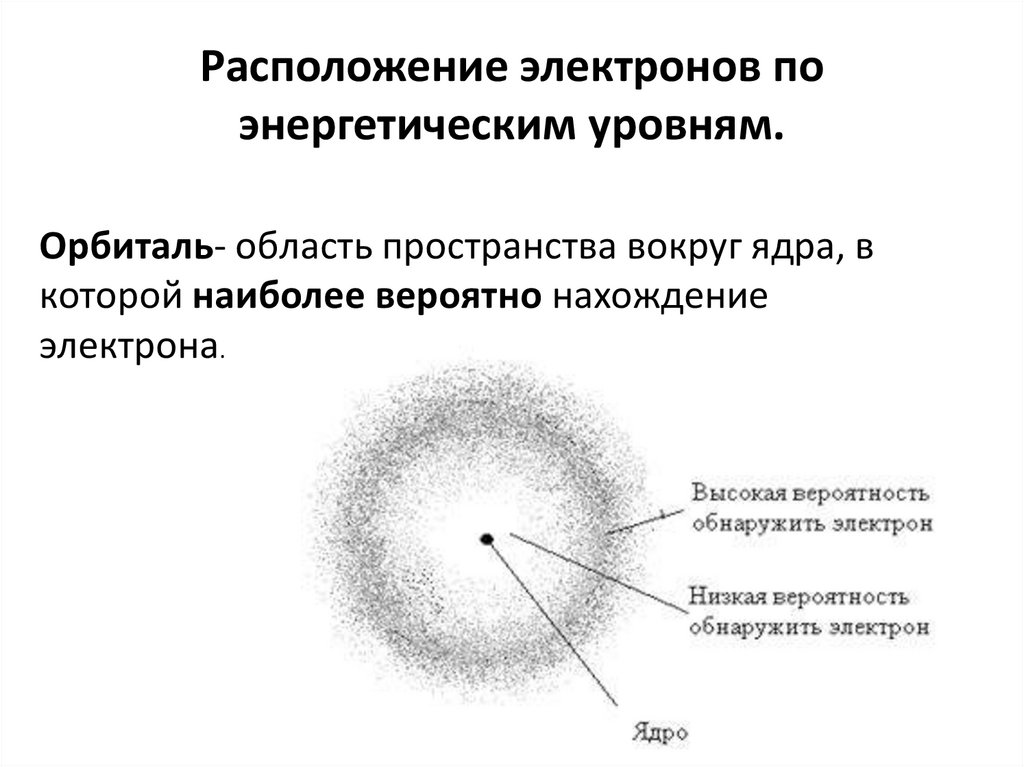
12. Расположение электронов по энергетическим уровням.
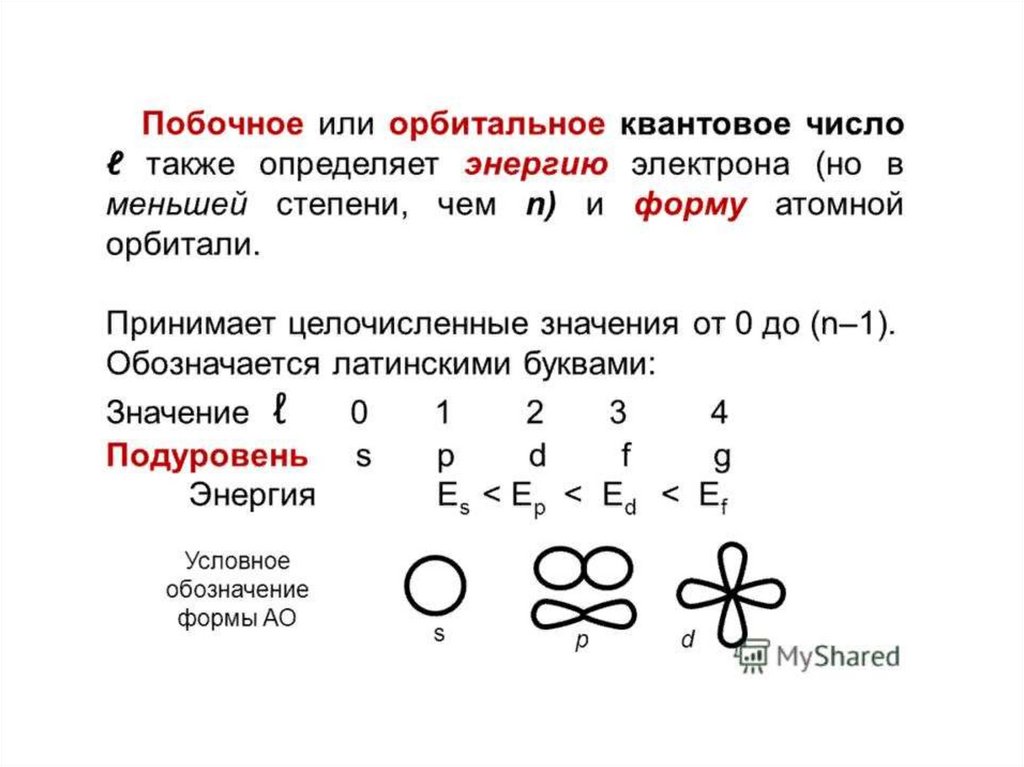
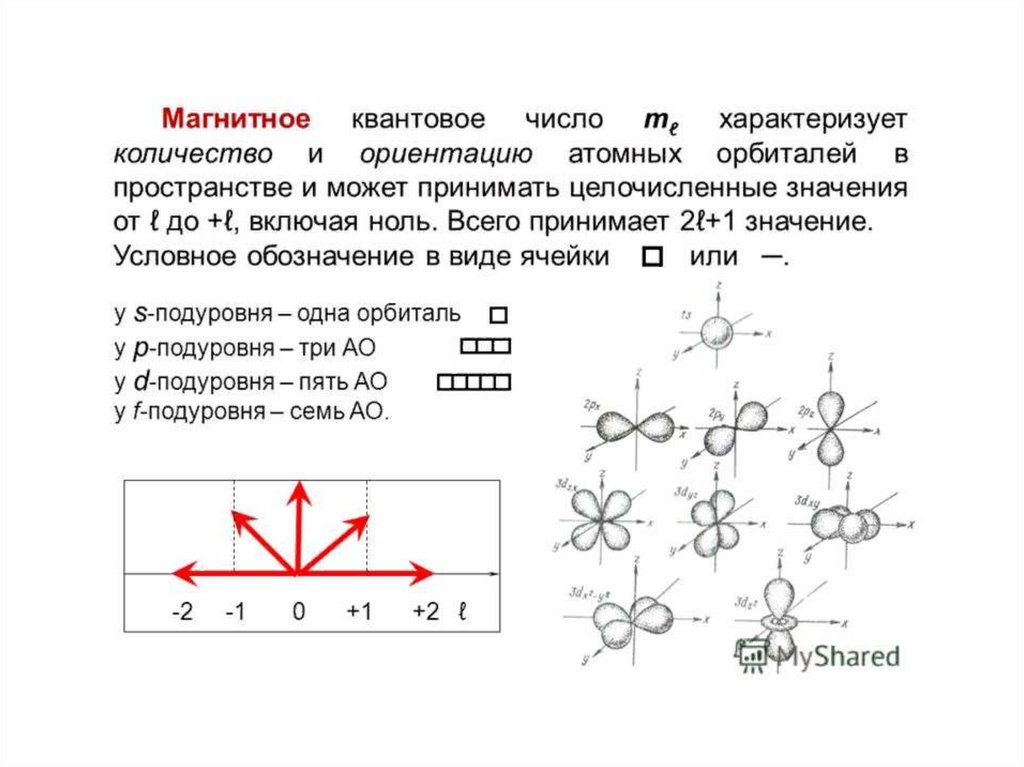
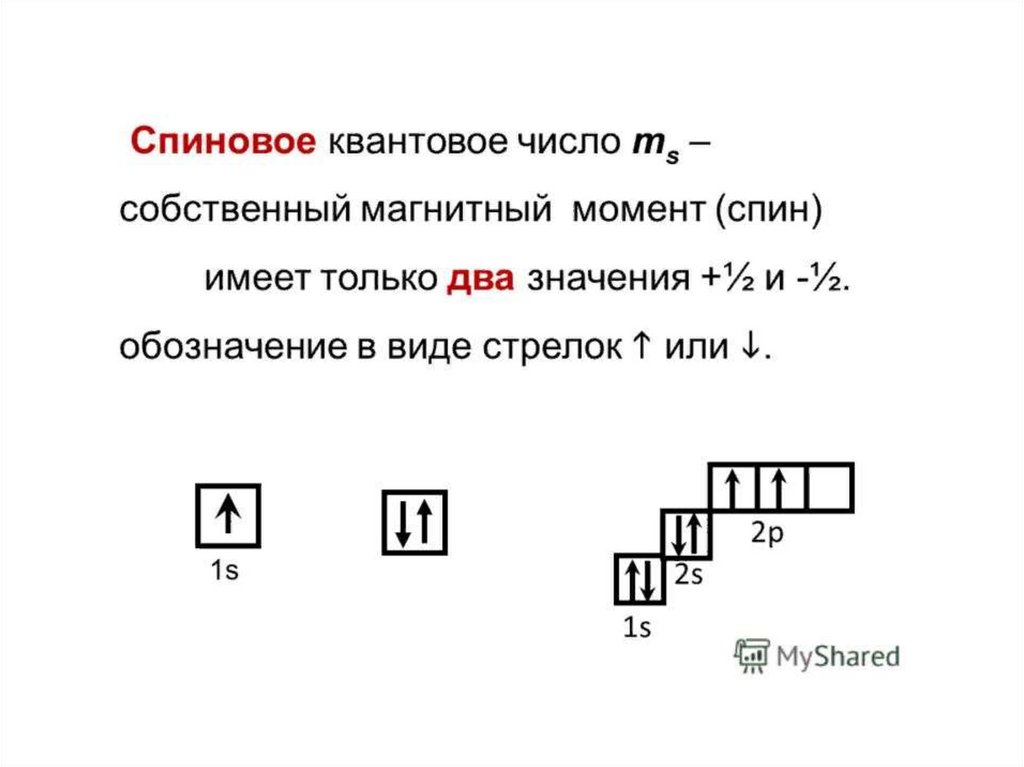
Орбиталь- область пространства вокруг ядра, вкоторой наиболее вероятно нахождение
электрона.
13. Состояние электрона в атоме описывает квантовая механика
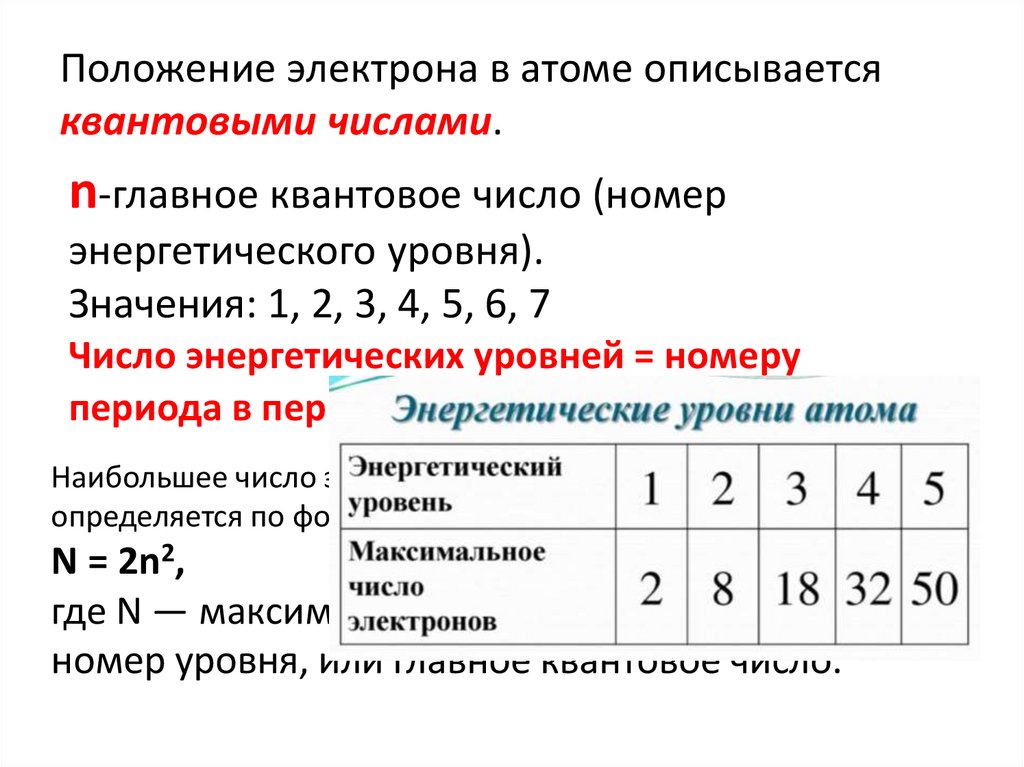
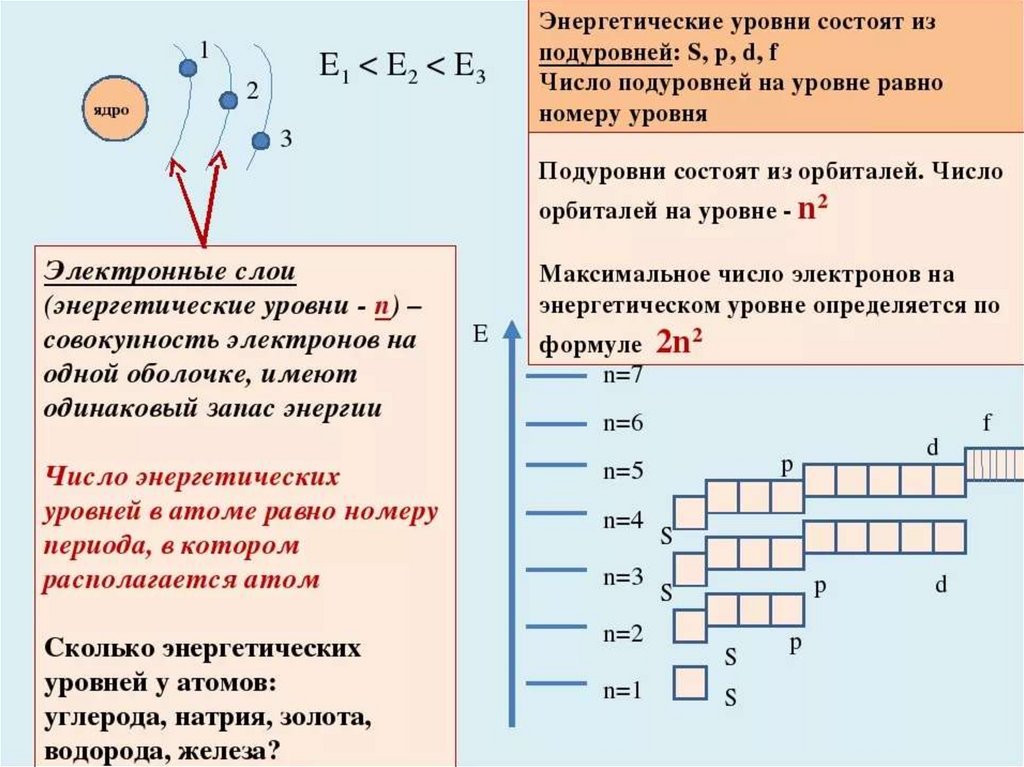
14. Положение электрона в атоме описывается квантовыми числами.
n-главное квантовое число (номерэнергетического уровня).
Значения: 1, 2, 3, 4, 5, 6, 7
Число энергетических уровней = номеру
периода в периодической системе.
Наибольшее число электронов на энергетическом уровне
определяется по формуле:
N = 2n2,
где N — максимальное число электронов; n —
номер уровня, или главное квантовое число.
15.
16.
17.
18.
19.
20.
21. «Нарушение» этой последовательности
22. ПРИЧИНА «ПРОСКОКА» ЭЛЕКТРОНА Считается, что энергетически более выгодно, когда в атоме имеется наполовину или полностью
заполненныйподуровень (d5; d10; f7; f14).
23. У каких элементов «проскок» электрона
Атомная валентная зонаЭлемент
теоретическая
практическая
Cu
3d9 4s2
3d10 4s1
Ag
4d9 5s2
4d10 5s1
Au
5d9 6s2
5d10 6s1
Cr
3d4 4s2
3d5 4s1
Mo
4d45s2
4d5 5s1
24.
25. Д/З 1) Составить электронные формулы атомов элементов в основном состоянии:
2) Выполнить тестовые задания потеме «Строение атома» по ссылке:
https://chemege.ru/testy-stroenie-atoma/
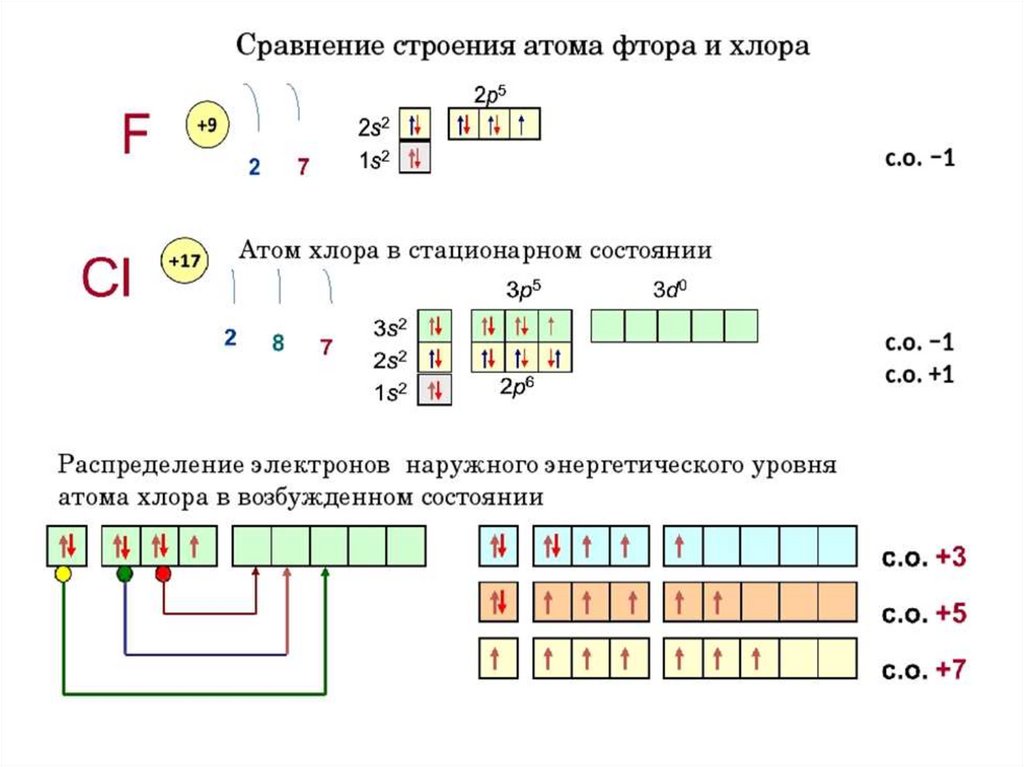
26. Возбуждённое состояние атома и валентные возможности химического элемента
Валентность- число индивидуальных химическихсвязей, которые может образовать один
атом.
- число общих электронный пар.
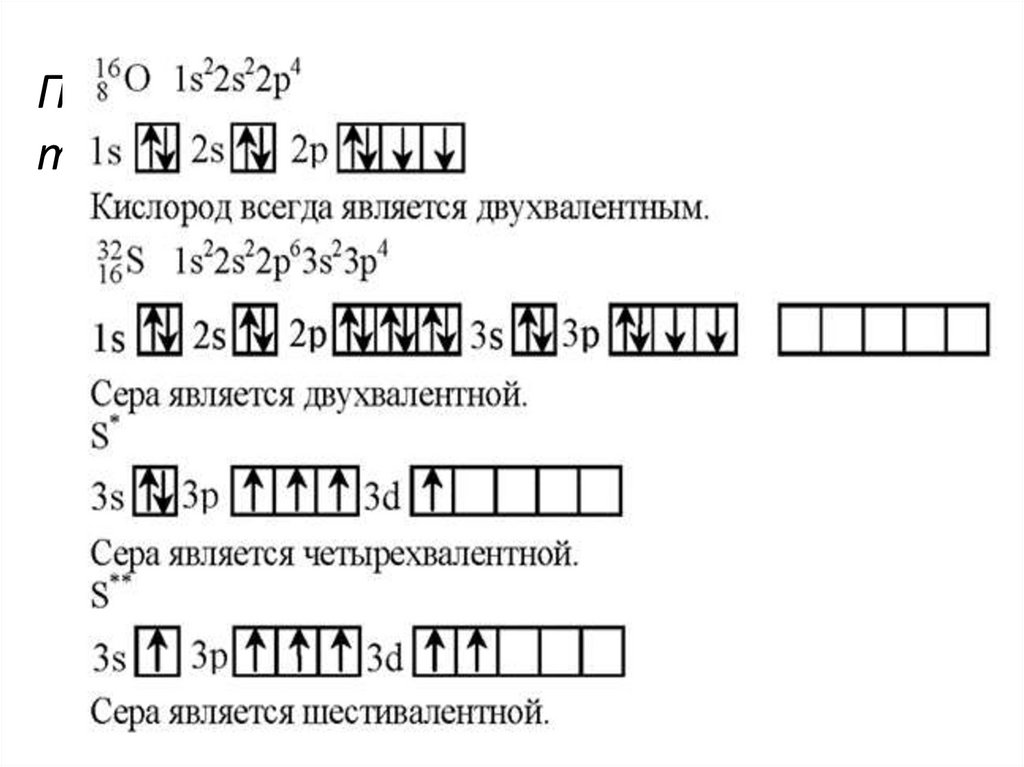
27. Почему кислород может проявлять только валентность II, а сера II, IV, VI ?
28.
29.
30.
31.
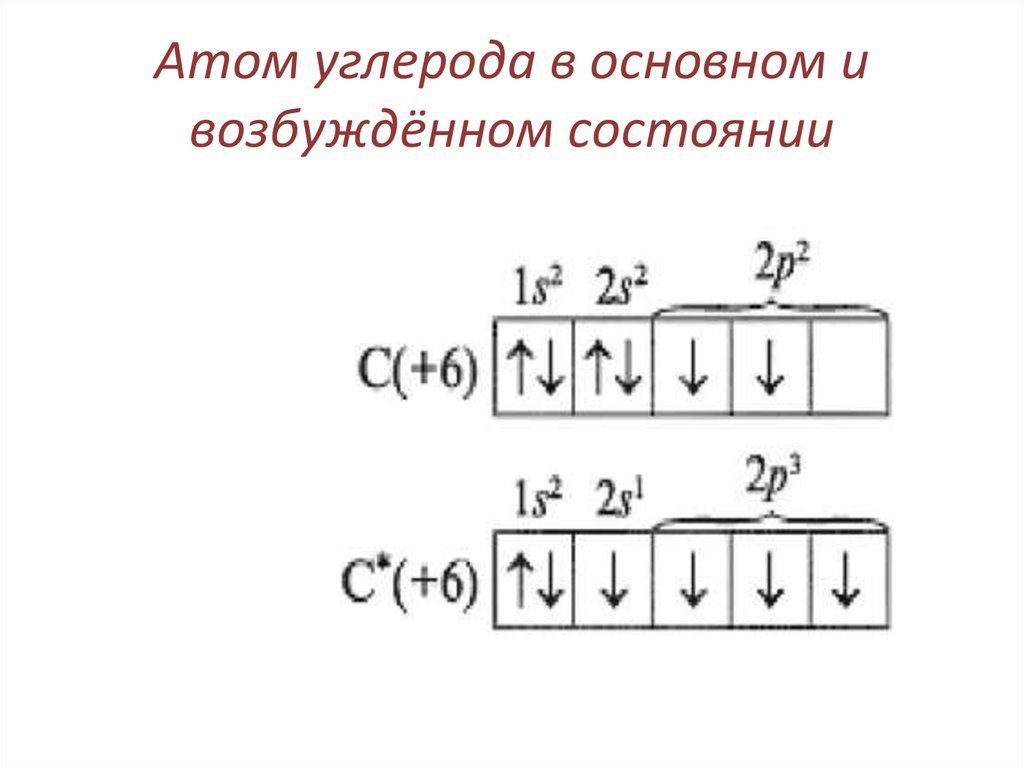
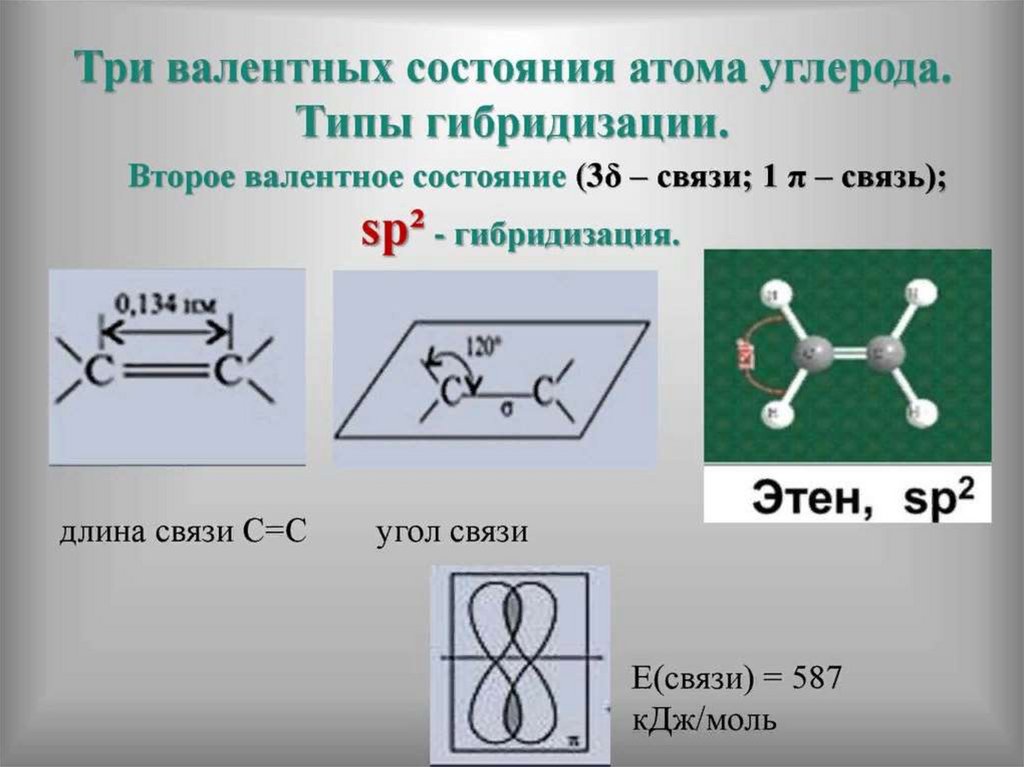
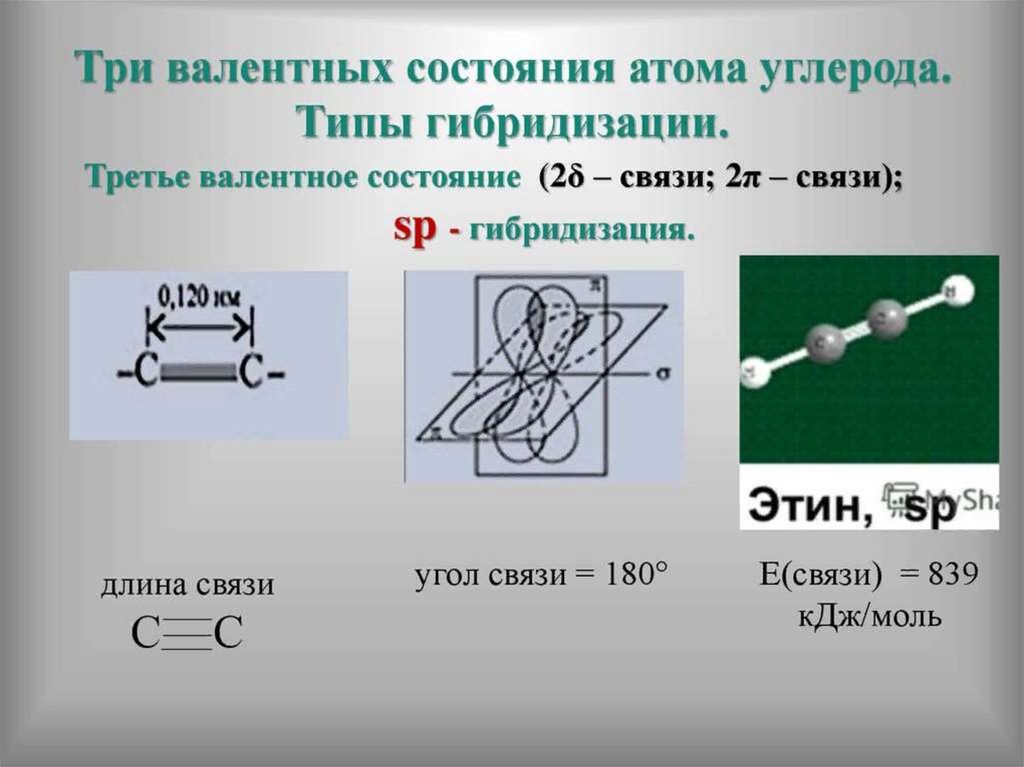
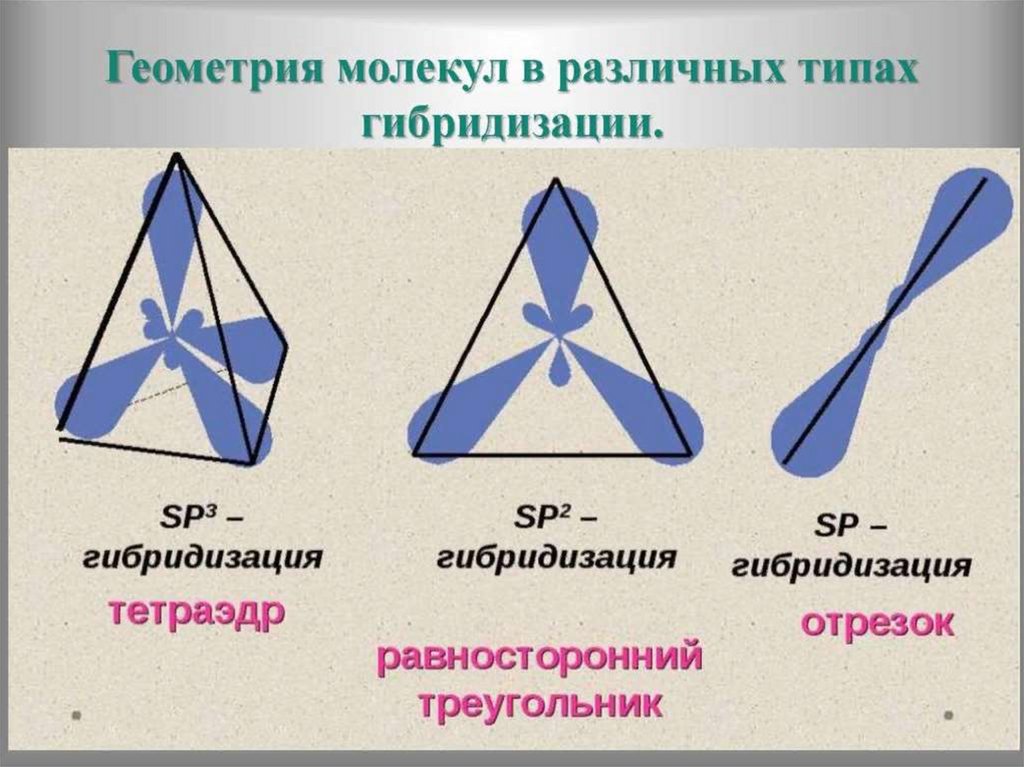
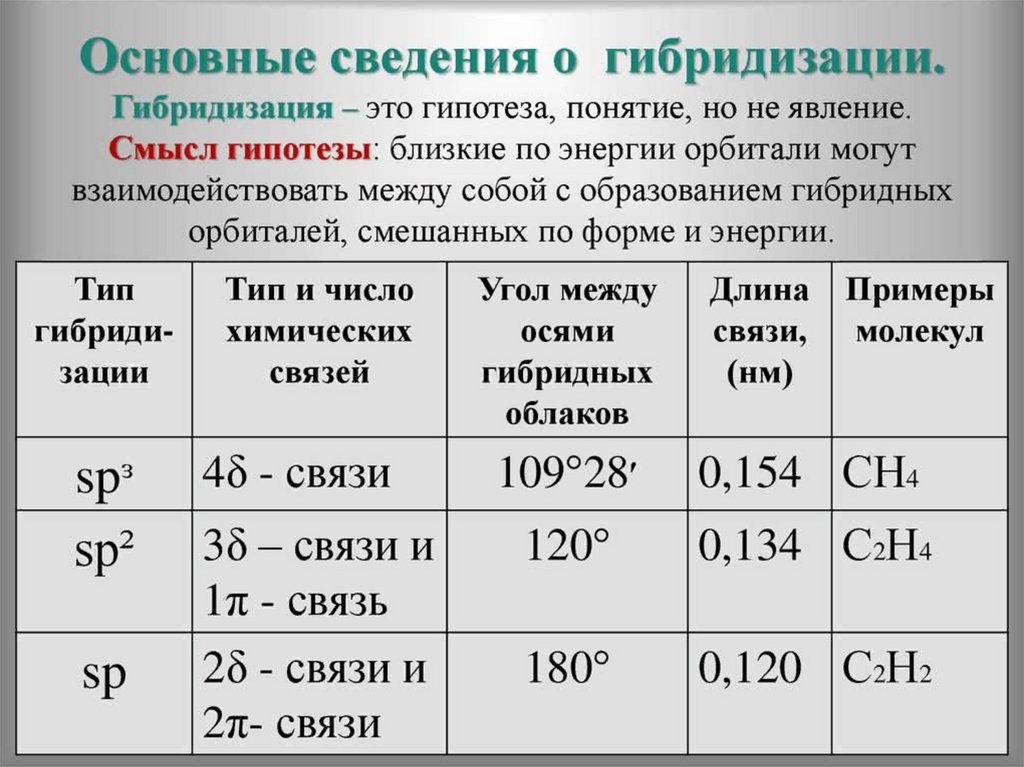
32. Атом углерода в основном и возбуждённом состоянии
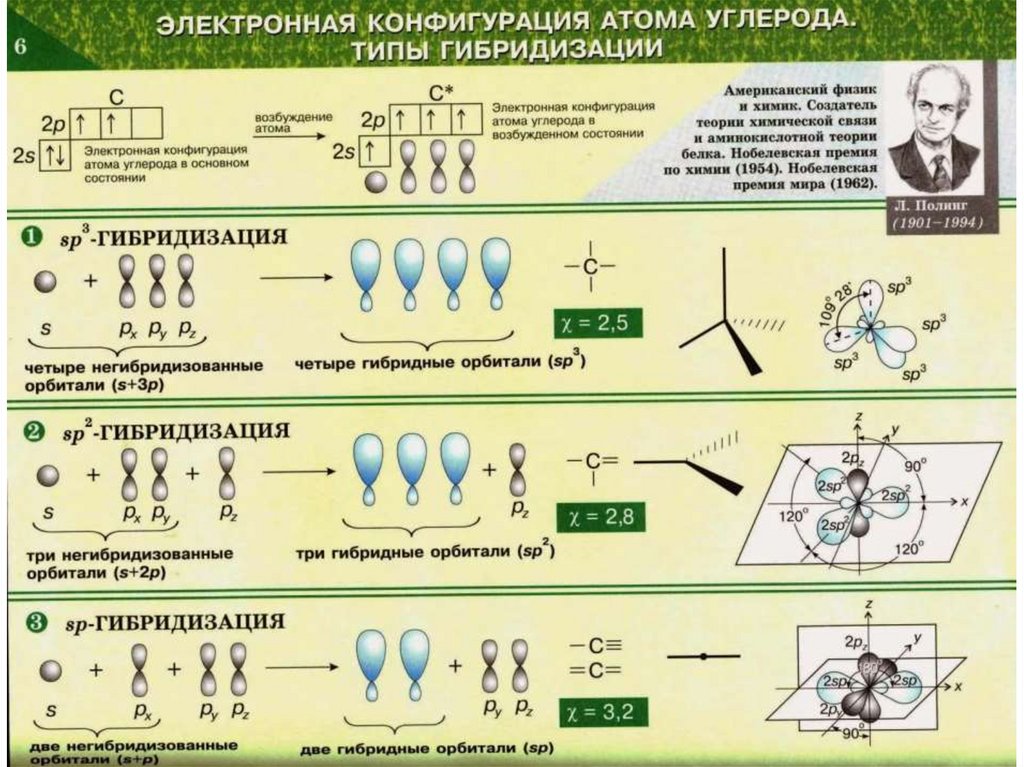
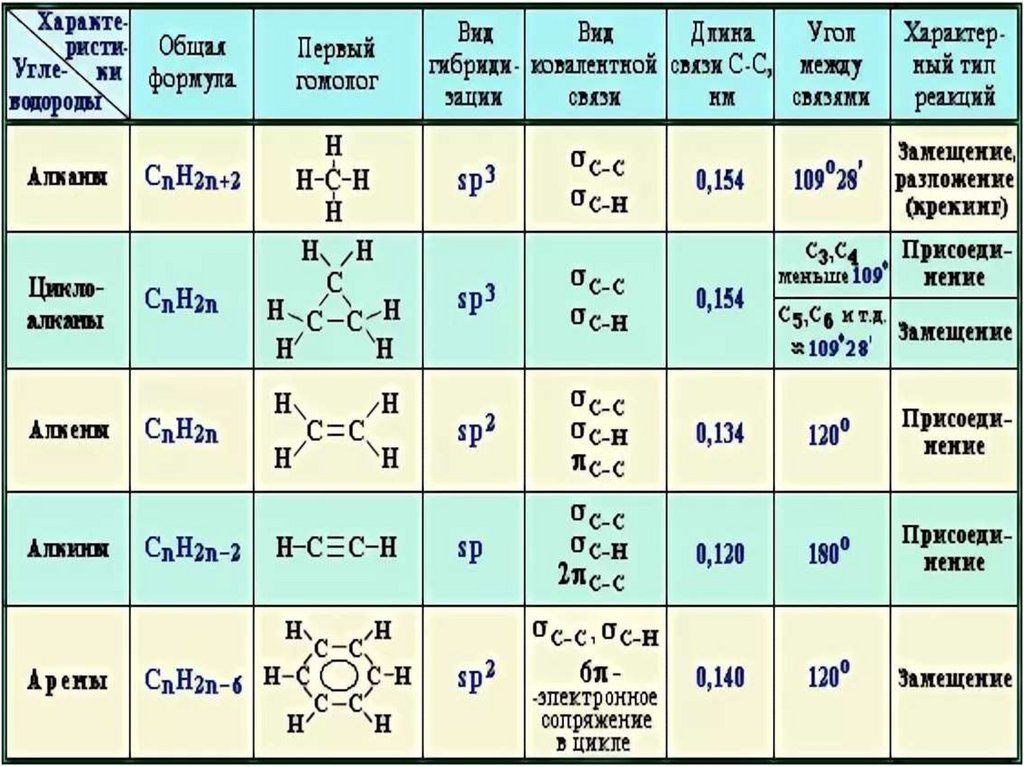
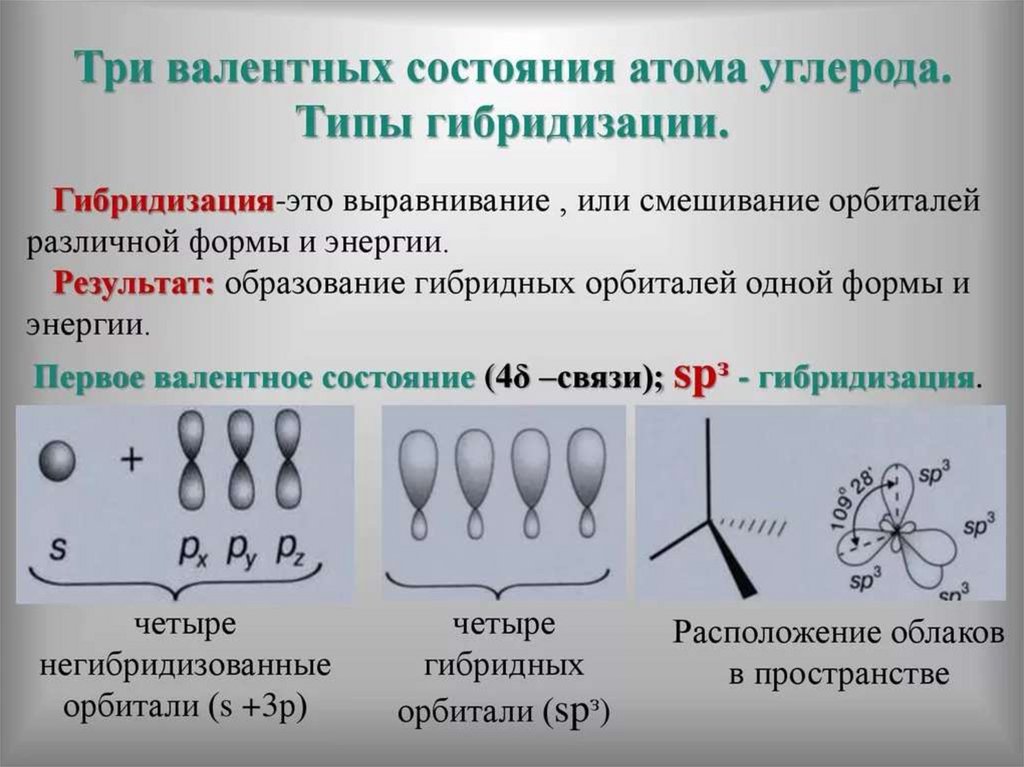
33. Теория гибридизации
Лайнус Карл Полингв 1954 году
34.
35.
36.
37.
38.
39.
40.
41.
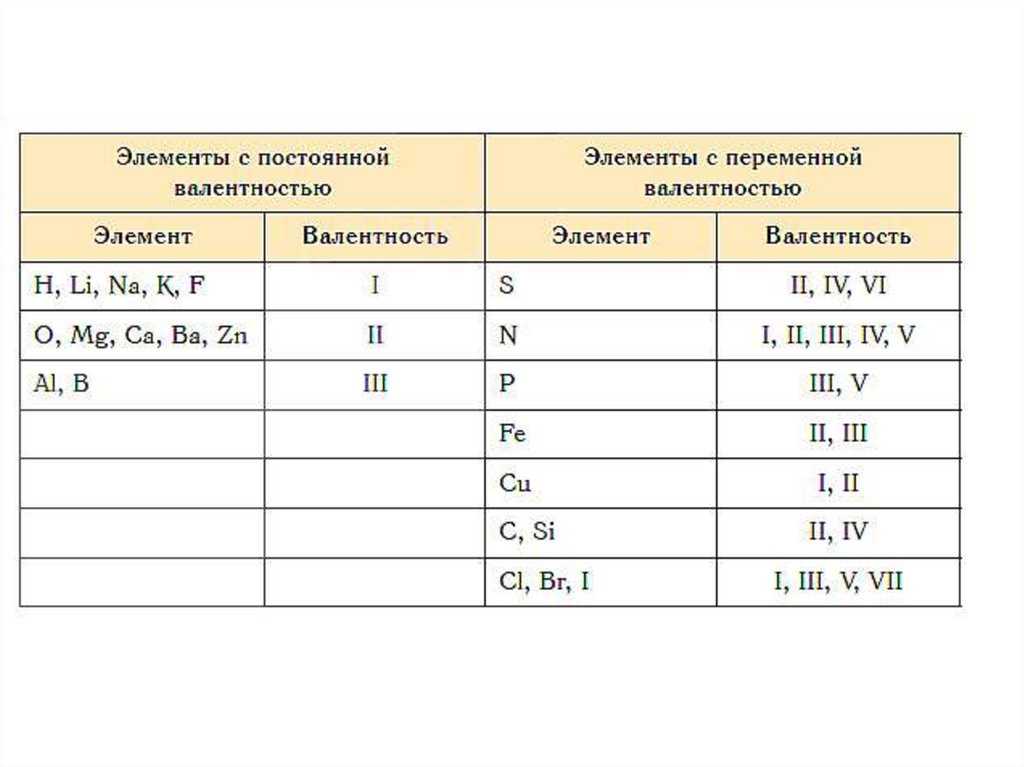
42. ТАБЛИЦА ВАЛЕНТНОСТИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ЭлементыВалентность
Примеры
соединений
C, Si
II, IV
CO, CO2, CH4, SiO2,
SiCl4
Cu
I, II
Cu2O, CuO
Fe
II, III
FeCl2, FeCl3
Cr
II, III, VI
CrCl2, CrCl3, CrO3
S
II, IV, VI
H2S, SO2, SO3
N
III, IV
NH3, NH4Cl, HNO3
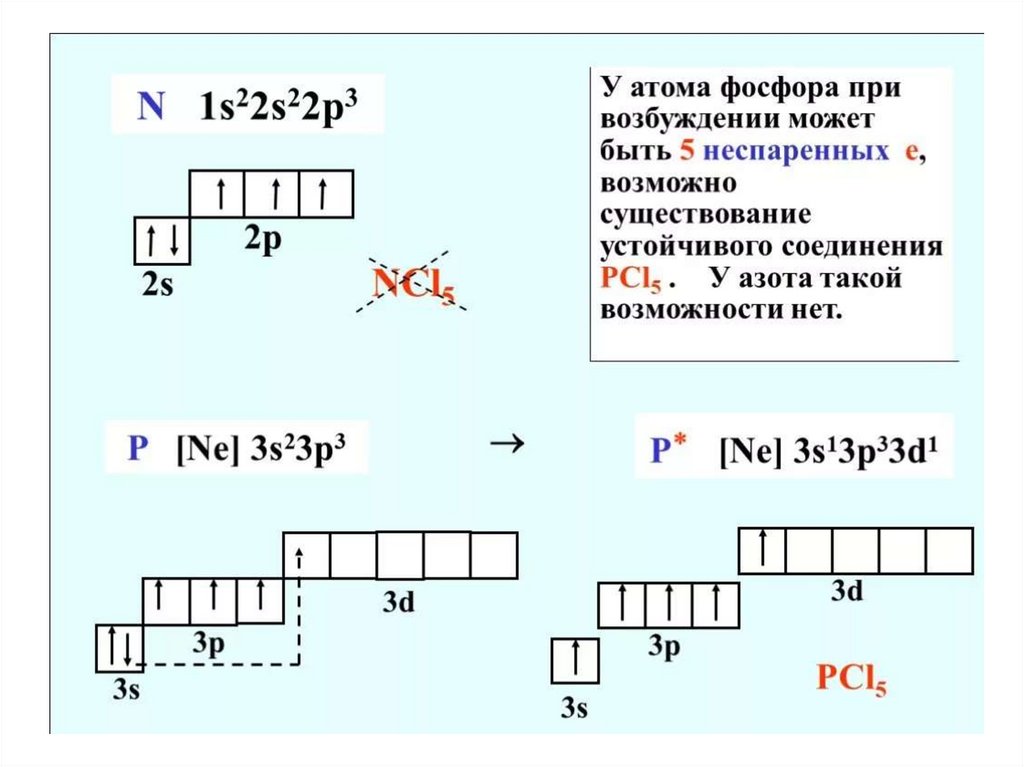
P
III, V
PH3, P2O5, H3PO4
Sn, Pb
II, IV
SnCl2, SnCl4, PbO,
PbO2
Cl, Br, I
I, III, V, VII
HCl, ClF3, BrF5, IF7
43. ЭЛЕМЕНТЫ с ПОСТЯННОЙ ВАЛЕТНОСТЬЮ
ВалентностиЭлементы
I
H, Na, Li, K, Rb, Cs
II
O, Be, Mg, Ca, Sr, Ba, Ra, Zn,
Cd
III
B, Al, Ga, In























 chemistry
chemistry








