Similar presentations:
Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов
1.
Неравновесные явления в растворах электролитовЭлектрическая проводимость растворов электролитов
Проводники электрического тока делятся на две основные группы: проводники первого
рода, электрическая проводимость которых осуществляется за счет направленного движения
электронов (металлы, сплавы, графит), и проводники второго рода, обладающие ионной
проводимостью (растворы и расплавы электролитов, твердые ионопроводящие системы).
При пропускании электричества через растворы электролитов, являющихся проводниками II
рода, в отличие от металлов – проводников I рода – происходит перенос вещества (явление
электролиза). В связи с этим в схеме измерения электрической проводимости электролитов
используют переменный ток, чтобы исключить потерю электричества, связанное с явлением
электролиза.
Мерой способности веществ проводить электрический ток является электрическая
проводимость(L) – величина обратная электрическому сопротивлению (R) проводника:
L
Так как:
l
R
S
(2)
то:
1
R
(1)
1 S
S
L
l
l
где ρ – удельное сопротивление, Ом-1 м-1(Ом-1 cм-1).
S – поперечное сечение, м2(см2)
L - длина проводника, м(см)
-удельная электрическая проводимость, Ом-1 м-1(Ом-1 cм-1).
(3)
2.
Удельная электрическая проводимость раствора – это электрическаяпроводимость объёма раствора, заключенного между двумя параллельными
электродами, имеющими площадь по 1м2(см2) и расположенными на расстоянии 1м
(см) друг от друга.
Сопротивление раствора связано с удельной электрической проводимостью соотношением:
1
l
R
S
где
(4)
l
K - постоянная измерительной ячейки.
S
С учетом введенного понятия:
R
1
K
(5)
3.
Удельная электрическая проводимость зависит от концентрации раствора электролита, причемзависимости æ=ƒ(С) для слабых и сильных электролитов имеют идентичный характер: электрическая
проводимость вначале возрастает, затем достигает максимума и уменьшается (рис.1). Однако сильные
электролиты обладают значительно большими величинами электрической проводимости, чем слабые.
Экстремальная
форма
зависимости
объясняется тем, что при малых концентрациях, как
для растворов сильных, так и слабых электролитов,
происходит
увеличение
электрической
проводимости из-за роста числа носителей заряда
(ионов) в 1 см3 раствора. Причины снижения
удельной электрической проводимости после точки
максимума для слабых и сильных электролитов
различны. Для слабых электролитов это связано с
уменьшением
степени
диссоциации
при
дальнейшем
увеличении
концентрации.
Для
сильных
с
увеличением
межионного
взаимодействия.
Достоинством
удельной
электрической
проводимости является то, что она может быть
непосредственно
измерена.
Однако
для
характеристики раствора электролита и для
понимания его свойств удобнее пользоваться
эквивалентной электрической проводимостью λ .
4.
Эквивалентная (мольная) электрическая проводимость численно равна электрическойпроводимости такого объёма V (м3, л, см3) раствора данной концентрации, в котором
содержится 1г-экв (1 моль) растворённого вещества.
Условно, это электрическая проводимость объёма V раствора, заключенного между двумя
параллельными электродами, с межэлектродным расстоянием 1м (см), причем каждый электрод имеет
такую площадь, чтобы в этом объёме содержался 1г-экв (1моль) электролита.
Эквивалентная (мольная) электрическая проводимость и удельная электрическая проводимость
связаны соотношением:
v
C
(6)
Если концентрация выражена в моль/л, а удельная электрическая проводимость в Ом-1см-1, то:
1000
C
v
(7)
Значение
эквивалентной
электрической
проводимости было бы постоянным для каждого
электролита, если бы степень диссоциации слабых
электролитов была постоянной и отсутствовало бы
межионное взаимодействие в растворах сильных
электролитов. Но так как межионное взаимодействие
существует и степень диссоциации меняется, то
зависимости эквивалентной электрической проводимости
от концентрации имеют вид, представленный на рис.2.
5.
Зависимости λV = f(С) однозначны, так как для нихкаждому значению λV соответствует только одно значение
концентрации.
С
увеличением
разведения
V
эквивалентная
электрическая проводимость возрастает и при некотором
достаточно
большом
разведении
она
достигает
постоянного предельного значения (рис. 3).
Разведение,
при
котором
эквивалентная
электрическая проводимость достигает предельного
значения,
условно
называется
бесконечным,
а
эквивалентная
электрическая
проводимость,
соответствующая
этому
разведению,
называется
эквивалентной электрической проводимостью при
бесконечном разведении аи обозначается
Для сильных электролитов эквивалентная электрическая проводимость при бесконечном
разведении а может быть экспериментально измерена. Для слабых электролитов она не
достигается при всех доступных исследованию разведениях и не может быть экспериментально
определена путем непосредственного измерения электрической проводимости. Эквивалентная
электрическая проводимость при бесконечном разведении как для сильных, так и для слабых
электролитов, может быть вычислена с помощью закона независимого движения ионов, который
называется законом Кольрауша.
6.
Зависимость электрической проводимости от скоростей движения ионовСкорости направленного движения ионов зависят от многих факторов: природы
ионов, их размеров, степени сольватации, природы растворителя, его вязкости,
концентрации раствора, температуры и градиента потенциала поля (градиента падения
напряжения). При прочих равных условиях ионы различной природы движутся с разными
скоростями и поэтому переносят неодинаковое количество электричества.
Сравнение скоростей движения различных видов ионов производится при градиенте
потенциала поля, равном 1 В/см. В этих условиях скорость движения ионов называют
абсолютной скоростью и обозначают через Vко и Vао соответственно для катиона и аниона
(она имеет размерность см2·В-1·с-1 или м2·В-1·с-1).
В водном растворе электролита происходит гидратация ионов (в общем случае
сольватация) - образование довольно прочных соединений между ионами и молекулами
растворителя. Размеры образовавшихся частиц определяются размерами ионов и
степенью их гидратации. При наложении на раствор электрического поля ионы движутся
вместе с гидратными оболочками.
В ряду Li+, Na+, K+, Rb+, Cs+, ионы с малым истинным (кристаллографическим)
радиусом (Li+, Na+) имеют более высокую степень гидратации и обладают меньшей
подвижностью, чем слабо гидратированные ионы: Rb+, Cs+, (табл.1).
7.
Таблица 1Предельные подвижности катионов щелочных металлов
в воде при 25 оС в зависимости от кристаллографических радиусов
Вид иона
Li+
Na+
K+
Rb+
Cs+
Кристаллографич
еский радиус, Å
0,68
0,98
1,33
1,48
1,67
Подвижность
ионов
Ом-1 ·см2 ·г-экв-1
38,6
50,1
73,5
77,2
77,8
8.
В водных растворах особенно велики предельные подвижности ионов гидроксонияОм-1 ∙см2 ∙г-экв-1) и гидроксида OH- (198,0). Это объясняется тем, что в отличие
от других ионов перемещение ионов Н3О+ и ОН- в растворе происходит по особому, так
называемому, эстафетному механизму, который состоит в том, что между ионами
гидроксония Н3О+ и молекулами воды, а также между молекулами воды и ионами ОНнепрерывно происходит обмен протонами по уравнениям:
H3O+ (349,8
причем эти процессы происходят с такой быстротой, что средняя
продолжительность существоания иона Н3О+ равна 10-11с. Следовательно, механизм
переноса электричества ионами Н3О+ и ОН- отличаются от механизма переноса
электричества другими ионами.
9.
Числа переносаДоля электричества, переносимая ионами данного вида, называется числами переноса.
Доля
количества
электричества,
переносимого
характеризуется числами переноса n+ и n-.
Их можно рассчитать по следующим формулам:
q
n
q
q
n
q
0
0
0
V
V
n
V
V
V
V
v
n
ионами
данного
знака,
(8)
0
V
V
n
0 0 (9)
V
V
V
V
v
n
(10)
где q+ и q- - количество электричества переносимого катионами и анионами,
соответственно;
q - общее количество электричества переносимого ионами (Кл).
Сумма чисел переноса для электролита:
n n 1
(11)
10.
Электрическая проводимость раствора электролита определяется суммарным количествомэлектричества, перенесенного катионами и анионами.
Согласно закону Фарадея 1 г-экв вещества переносит F кулонов электричества. Поэтому
количество электричества q, переносимое катионами и анионами через сечение 1 см2 при градиенте
падения напряжения 1 В/см за время 1 секунду равно:
С
0F
C
0
q
V
V
F
к
a
1000
1000
По физическому смыслу, это выражение есть удельная электрическая проводимость, тогда:
=
С
V
0
0
F
V
F
к
a
1000
11.
Получаем:0
0
V
V
V
кF
aF
Произведение абсолютной скорости движения ионов на число Фарадея
подвижностью ионов. Подвижность катионов обозначают λk, а аниона λa. Тогда:
k Vk0F
называется
a Va0F
( k а)
V
При бесконечном разведении степень диссоциации α стремится к единице, эквивалентная
электрическая проводимость λV стремится к эквивалентной электрической проводимости электролита
при бесконечном разведении λ∞, а λk → λk∞, λa → λa∞:
λ∞ = λk ∞ + λa ∞
(12)
Как показывает опыт, при разведении эквивалентная электрическая проводимость для любого
электролита приближается к сумме подвижностей ионов при бесконечном разведении. Последнее
соотношение называется законом аддитивности или законом независимого движения ионов. Он
установлен Кольраушем и заключается в том, что в растворе как сильного, так и слабого электролита
катионы и анионы переносят электричество независимо друг от друга и их электрические
проводимости при бесконечном разведении имеют предельные значения.
Сумма подвижностей ионов при данном разведении (λk∞ + λa∞) всегда меньше, чем сумма
подвижностей тех же ионов при бесконечном разведении (λk∞ + λa∞). Отношение этих сумм называется
коэффициентом электропроводности f :
к а
f
к а
12.
Он характеризует межионное взаимодействие в растворе. По мере разведения взаимодействиемежду ионами уменьшается, а коэффициент электрической проводимости f возрастает, и при
бесконечно большом разведении, когда межионное взаимодействие исчезает, он становится равным
единице.
к а , получаем:
Преобразовав уравнение
f
к
a
к
а
к а
(
) f(
)
Подставим полученное выражение в полученную ранее формулу для λV , получаем:
f
V
к
а
В растворах слабых электролитов коэффициент электрической проводимости f = 1, а степень
диссоциации α < 1. Для них:
V
к
а
и можно определить степень диссоциации :
V
(13)
В разбавленных растворах сильных электролитов степень диссоциации, α = 1, а коэффициент
электрической проводимости f < 1. Из последнего выражения для λV следует , что :
V f
к
а
V
f
(14)
Последние
три
соотношения
позволяют
экспериментально определить степень диссоциации слабого
электролита и коэффициент электрической проводимости
для сильного электролита. Значение λV определяют
экспериментально, а λ∞ вычисляют по соотношению (12).
13.
Особенности электрической проводимости растворов сильных электролитовРассмотрим более подробно поведение сильных электролитов в электрическом поле.
Кольраушем была установлена экспериментальная зависимость электрической
проводимости сильных электролитов от концентрации (уравнение Кольрауша):
АС
V
(15)
Из уравнения следует, что при переходе от
бесконечно разбавленного раствора к растворам
конечных концентраций, происходит снижение
эквивалентной электрической проводимости. Это
объясняется тем, что при повышении концентрации
электролита
увеличивается
межионное
взаимодействие в растворе, что снижает скорость
движения ионов, т.е. происходит торможение их
движения,
и,
соответственно,
уменьшение
подвижности ионов.Уравнение (15) в координатах
λV - С является уравнением прямой с тангенсом
угла наклона α равным А (рис.4). А−эмпирическая
константа, зависящая от природы растворителя.
Зависимость λV = f С позволяет экспериментально
определить
эквивален-тную
электрическую
проводимость растворов сильных электролитов при
бесконечном разведении λ∞ путем графической
экстраполяции прямой до нулевой концентрации.
С
С
14.
В связи с тем, что центральный ион окружен ионной атмосферой, при его движении возникаютдва эффекта торможения (рис.5 а, б).
«-»
«+»
«+»
«-»
++
а
−
+
б
Рис. 5 Схемы электрофоретического(а) и релаксационного(б) эффектов
1. Электрофоретический эффект связан с тем, что в электрическом поле центральный ион
движется в одну сторону, а ионная атмосфера заряженная противоположно, - в другую. В целом
получается, что ион движется в среде, которая также движется, но в другую сторону. Это
обстоятельство эквивалентно повышению вязкости среды и оказывает тормозящее влияние на
движение ионов. Установлено, что электрофоретический эффект снижает эквивалентную
электрическую проводимость пропорционально корню квадратному из концентрации электролита.
2. Релаксационный эффект обусловлен асимметрией ионной атмосферы, которая возникает
при движении иона в электрическом поле. Для разрушения ионной атмосферы и образования новой
необходимо время, которое называется временем релаксации. В отсутствии электрического поля
ионная атмосфера симметрична. В электрическом поле эта симметрия нарушается, так как при
движении иона плотность ионной атмосферы впереди и позади иона неодинакова. Взаимодействие
центрального иона с основной частью ионной атмосферы позади него оказывает тормозящее
воздействие на движение иона. Данный эффект приводит к снижению эквивалентной электрической
проводимости также пропорционально корню квадратному из концентрации.
15.
Основываясь на теории Дебая-Гюккеля теоретическим путем Онзагером быловыведено уравнение:
с
а
b
V
(16)
в котором присутствуют два числа, отвечающие электрофоретическому торможению (a)
и релаксационному (b∙λ∞). Коэффициенты a и b зависят от диэлектрической
проницаемости среды , вязкости растворителя Ƞ и температуры Т:
4
8,24
10
a
1
Т 2
b
8,2 105
Т
3
2
Расчеты показывают, что электрофоретический эффект дает примерно 2/3 общего
понижения электрической проводимости, тогда как на долю релаксационного эффекта
приходится около 1/3. Таким образом в уравнении Онзагера получило свое
теоретическое обоснование эмпирическое уравнение Кольрауша. Сравнивая уравнения
(16) и (15) можно получить расшифровку постоянной А в эмпирическом уравнении
Кольрауша.
Необходимо отметить, что уравнение (16) было выведено фактически на основе тех
же предпосылок, что и уравнение первого приближения теории Дебая-Гюккеля для
коэффициента активности. Поэтому следует ожидать, что оно применимо к
разбавленным растворам.
16.
Поведение сильных электролитов в полях высокой напряженности и высокойчастоты
Эффекты торможения, связанные с существованием ионной атмосферы должны исчезнуть,
если исчезнет сама ионная атмосфера. Такое явление можно наблюдать при помещении раствора
сильного электролита в поле высокой напряженности. Если измерять электрическую проводимость
такого раствора при возрастающей напряженности электрического поля Е, то можно наблюдать
увеличение эквивалентной электрической проводимости и достижение ее постоянного значения,
равного предельному значению λ∞. Это наблюдается при достаточно большой напряженности поля
Е, равной ~2∙105 В/см (рис. 6). Наблюдаемый эффект называется эффектом Вина и объясняется
тем, что в полях высокой напряженности ионы движутся с такой большой скоростью, что ионная
атмосфера практически не успевает образоваться вокруг них. Это приводит к исчезновению обоих
эффектов торможения. В результате этого оба члена в уравнении Онзагера исчезают и электрическая
проводимость возрастает до предельного значения λV = λ∞.
17.
Если электролит помещают в поле высокой частоты, то электрическая проводимость такжебудет возрастать до некоторого постоянного значения при определенных частотах электрического
поля f (~108Гц), но при этом она не будет достигать предельного значения λ∞ (рис.7). Данный эффект
называется эффектом Дебая-Фалькенгагена и объясняется тем, что в таких условиях в уравнении
Онзагера исчезает только один член, связанный с релаксацией, а электрофоретическое торможение
остается.
Таким образом, эффект Дебая-Фалькенгагена позволяет разделить релаксационный и
электрофоретический эффекты и изучать их отдельно. В то же время эффекты Вина и ДебаяФалькенгагена
служат
экспериментальным
доказательством
реального
существования
электрофоретического и релаксационного эффектов торможения.
18.
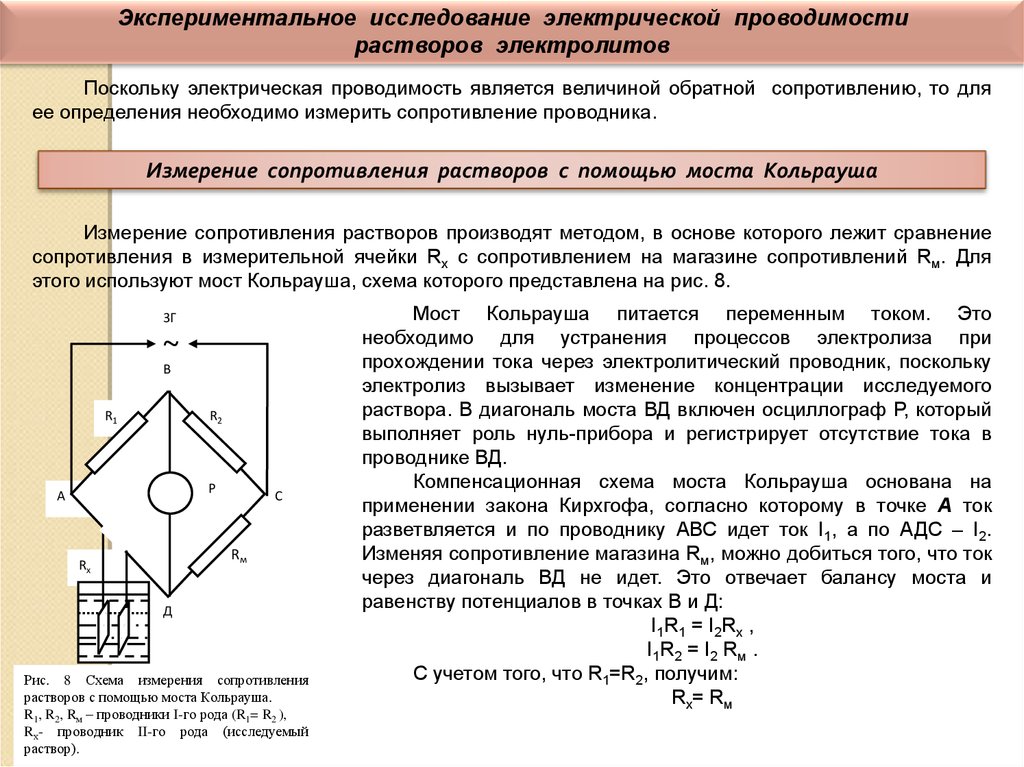
Экспериментальное исследование электрической проводимостирастворов электролитов
Поскольку электрическая проводимость является величиной обратной сопротивлению, то для
ее определения необходимо измерить сопротивление проводника.
Измерение сопротивления растворов с помощью моста Кольрауша
Измерение сопротивления растворов производят методом, в основе которого лежит сравнение
сопротивления в измерительной ячейки Rх с сопротивлением на магазине сопротивлений Rм. Для
этого используют мост Кольрауша, схема которого представлена на рис. 8.
3Г
~
В
R1
R2
Р
А
С
Rм
Rx
Д
Рис. 8 Схема измерения сопротивления
растворов с помощью моста Кольрауша.
R1, R2, Rм – проводники I-го рода (R1= R2 ),
Rх- проводник II-го рода (исследуемый
раствор).
Мост Кольрауша питается переменным током. Это
необходимо для устранения процессов электролиза при
прохождении тока через электролитический проводник, поскольку
электролиз вызывает изменение концентрации исследуемого
раствора. В диагональ моста ВД включен осциллограф Р, который
выполняет роль нуль-прибора и регистрирует отсутствие тока в
проводнике ВД.
Компенсационная схема моста Кольрауша основана на
применении закона Кирхгофа, согласно которому в точке А ток
разветвляется и по проводнику АВС идет ток I1, а по АДС – I2.
Изменяя сопротивление магазина Rм, можно добиться того, что ток
через диагональ ВД не идет. Это отвечает балансу моста и
равенству потенциалов в точках В и Д:
I1R1 = I2Rx ,
I1R2 = I2 Rм .
C учетом того, что R1=R2, получим:
Rx= Rм
19.
С помощью такой схемы можно непосредственно определить удельную электрическуюпроводимость раствора электролита, но для этого необходимо иметь электрохимическую ячейку с
электродами, каждый из которых имеет площадь S=1см2 и отстоящими друг от друга на расстоянии
l=1 см. В этом случае измеренное сопротивление Rх является удельным сопротивлением ρ раствора
электролита и тогда удельная электрическая проводимость æ=1/Rх. Такой метод измерения
называется абсолютным.
Абсолютный метод технически трудно осуществим из-за сложности конструирования ячейки со
строго заданными геометрическими размерами. Кольраушем этим методом с большой точностью
были получены данные по электрической проводимости растворов КСl, NaCl, CsCl различных
концентраций при различных температурах. Эти значения послужили справочным материалом для
применения более простого – относительного метода.
Ранее было показано, что величина сопротивления раствора, находящегося между
электродами, определяется уравнением:
Отношение расстояния между электродами к площади электродов для данной
электрохимической ячейки является величиной постоянной, обозначается буквой К и называется
постоянной ячейки:
K l/S
Тогда
R= К/æ .
Относительный метод состоит в следующем:
1.
Определение постоянной ячейки К. Для этого измеряют сопротивление стандартного раствора
Rст с известной электрической проводимостью æст:
Rст= К/ æст ,
откуда
К = æст∙ Rст .
2.
Измерение сопротивления Rx исследуемого раствора электролита. Из соотношения
R= К/æ следует, что зная К и определив Rх, можно рассчитать электрическую проводимость
исследуемого раствора æх:
æх=K/Rх
20.
Электролиз. Законы ФарадеяЭлектролизом
называется
совокупность
электрохимических
окислительно
–
восстановительных реакций, протекающих на электродах при прохождении постоянного тока
через раствор электролита или его расплав. При этом на катоде происходит процесс
восстановления, а на аноде – окисления. Катионы восстанавливаются в ионы более низкой
степени окисления или в атомы, например:
3
2
Fe
e
Fe
2
Cu
2
e
Cu
Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно
или взаимодействовать с продуктами катодного процесса, которые рассматриваются в этом
случае как промежуточные вещества. Например, восстановление воды:
2
H
O
2
e
H
2
OH
2
2
На аноде окисляются ионы или молекулы, поступающие из объёма электролита,
например:
4
OH
4
e
2
H
O
H
2
2
2
Cl
2
e
Cl
2
или принадлежащие материалу анода, в последнем случае анод растворяется:
2
Cu
2
e
Cu
(растворение анода).
Скорость электродных реакций зависит от состава и концентрации электролита,
материала электродов, электродного потенциала, температуры, гидродинамических условий.
21.
Процессы электролиза описываются законами Фарадея, которые в объединенной формечитаются следующим образом: массы веществ, испытавших электрохимические превращения на
электродах, прямо пропорционально количеству протекшего через электролит электричества и
электрохимическим эквивалентам этих веществ:
m
Э
q
F
m
Э
J
F
(17)
где m - масса вещества, превратившегося на электроде, г;
J - сила тока, А;
- продолжительность электролиза, с;
q - количество электричества, Кл;
Э - эквивалентная масса вещества, г/моль;
F=96485 Кл/г-экв – число Фарадея – количество электричества, которое необходимо пропустить
через электролит для химического превращения 1г-экв электролита.
Величина Э/F называется электрохимическим эквивалентом. Она характеризует массу
продуктов электролиза, выделившихся на электродах при прохождении через электролит 1Кл
электричества.
При электрохимических процессах часто наблюдаются отклонения от законов Фарадея: масса
действительно полученного или разложившегося продукта не соответствует теоретической. Эти
отклонения – кажущиеся и возникают за счет одновременного протекания побочных
электрохимических процессов и химических реакций, в которые вступает продукт, и его потерь.
Эффективность электрохимического процесса оценивается выходом по току Ƞ:
mпрактич
..
mтеор
.
m
практич
..
100
%
m
теор
.
(18)
22.
Электродный потенциал возникает в биосистемах, как и влюбых системах, имеющих контакт двух фаз. Это относится к
растворам белков, нервным и мышечным волокнам, растительным
и живым клеткам, биосырью и т.д.
1) Ox-Red системы часто встречаются в биохимических
процессах и характеризуются ЕOX/Red, т.к. в них присутствуют
окисленные и восстановленные формы различных соединений.
Если в процессе OX-Red принимают участие не только электроны,
но и ионы Н+, φ зависит от рН раствора. В пищевых технологиях
биохимические превращения сырья происходят в присутствии
ферментов, которые проявляют свою активность при строго
определенном значении рН (пепсин – рН=2; трипсин рН=8)
(контроль рН осуществляют с помощью стеклянных,
ионоселективных, ферментных, мембранных электродов).





















 physics
physics








