Similar presentations:
Свойства белков, определяемые третичной и четвертичной структурами. Белковые кристаллы. Моделирование структуры белков
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ«БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ НАЦИОНАЛЬНЫЙ
ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ»
(НИУ «БелГУ»)
Презентация
Студента очной формы обучения
направления подготовки 19.03.01 Биотехнология
2 курса группы 11002017
Прилуцкого Леонида Юрьевича
На тему:
СВОЙСТВА БЕЛКОВ, ОПРЕДЕЛЯЕМЫЕ ТРЕТИЧНОЙ И
ЧЕТВЕРТИЧНОЙ СТРУКТУРАМИ. БЕЛКОВЫЕ
КРИСТАЛЛЫ. МОДЕЛИРОВАНИЕ СТРУКТУРЫ БЕЛКОВ.
ПРЕПОДАВАТЕЛЬ: АСС. СЕНЧЕНКОВ В.Ю.
2.
Содержание3.
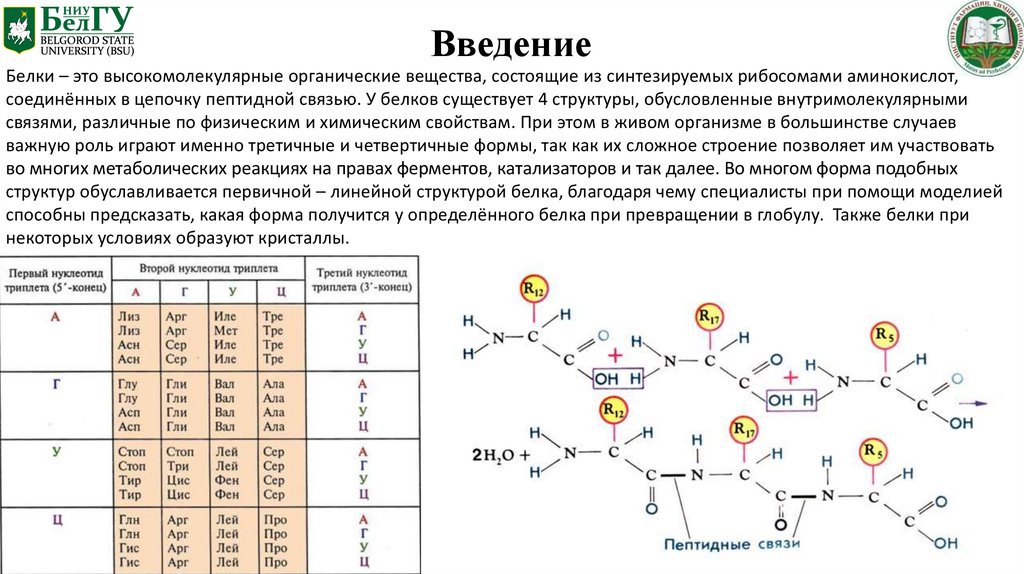
ВведениеБелки – это высокомолекулярные органические вещества, состоящие из синтезируемых рибосомами аминокислот,
соединённых в цепочку пептидной связью. У белков существует 4 структуры, обусловленные внутримолекулярными
связями, различные по физическим и химическим свойствам. При этом в живом организме в большинстве случаев
важную роль играют именно третичные и четвертичные формы, так как их сложное строение позволяет им участвовать
во многих метаболических реакциях на правах ферментов, катализаторов и так далее. Во многом форма подобных
структур обуславливается первичной – линейной структурой белка, благодаря чему специалисты при помощи моделией
способны предсказать, какая форма получится у определённого белка при превращении в глобулу. Также белки при
некоторых условиях образуют кристаллы.
4.
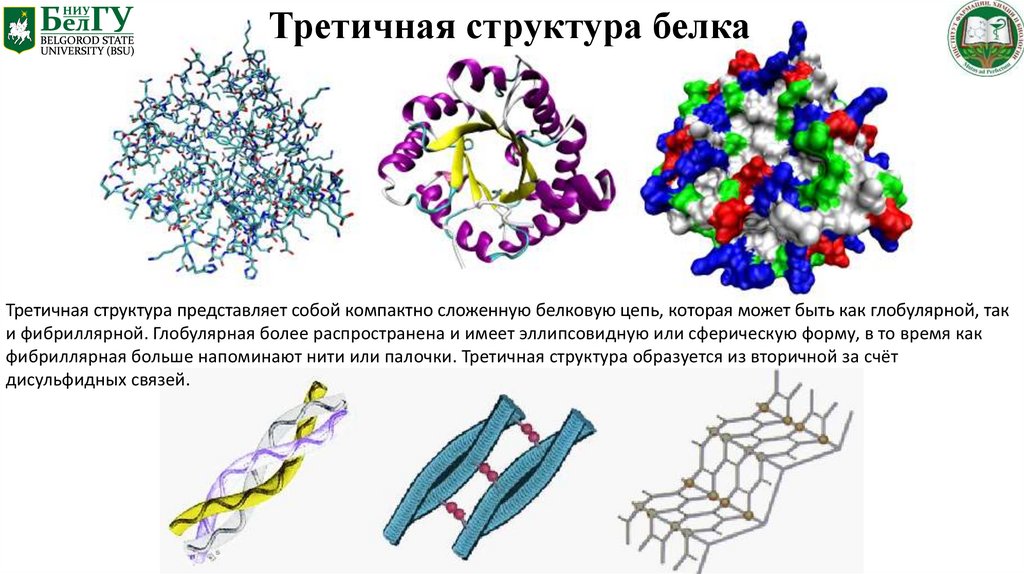
Третичная структура белкаТретичная структура представляет собой компактно сложенную белковую цепь, которая может быть как глобулярной, так
и фибриллярной. Глобулярная более распространена и имеет эллипсовидную или сферическую форму, в то время как
фибриллярная больше напоминают нити или палочки. Третичная структура образуется из вторичной за счёт
дисульфидных связей.
5.
Свойства третичной структурыДля поддержания третичной структуры
особенно важны гидрофобные
взаимодействия (объединения неполярных
молекул или отдельных частей молекул),
позволяющие исключить молекулы воды,
что очень существенно, например, для
мембран, учитывая водное окружение
клетки. Для определения третичной
структуры белков можно использовать
метод рентгеновского анализа.
6.
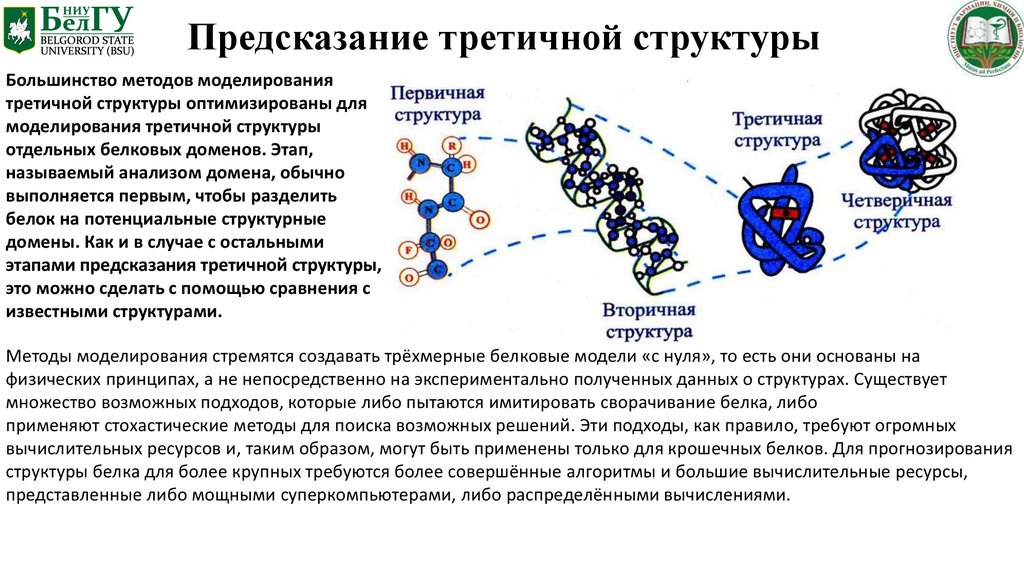
Предсказание третичной структурыБольшинство методов моделирования
третичной структуры оптимизированы для
моделирования третичной структуры
отдельных белковых доменов. Этап,
называемый анализом домена, обычно
выполняется первым, чтобы разделить
белок на потенциальные структурные
домены. Как и в случае с остальными
этапами предсказания третичной структуры,
это можно сделать с помощью сравнения с
известными структурами.
Методы моделирования стремятся создавать трёхмерные белковые модели «с нуля», то есть они основаны на
физических принципах, а не непосредственно на экспериментально полученных данных о структурах. Существует
множество возможных подходов, которые либо пытаются имитировать сворачивание белка, либо
применяют стохастические методы для поиска возможных решений. Эти подходы, как правило, требуют огромных
вычислительных ресурсов и, таким образом, могут быть применены только для крошечных белков. Для прогнозирования
структуры белка для более крупных требуются более совершённые алгоритмы и большие вычислительные ресурсы,
представленные либо мощными суперкомпьютерами, либо распределёнными вычислениями.
7.
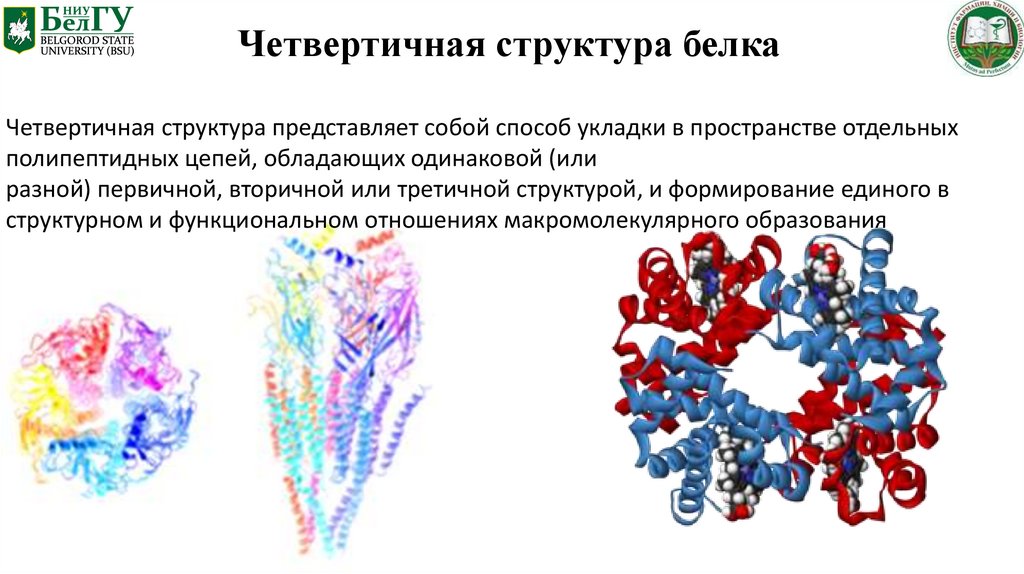
Четвертичная структура белкаЧетвертичная структура представляет собой способ укладки в пространстве отдельных
полипептидных цепей, обладающих одинаковой (или
разной) первичной, вторичной или третичной структурой, и формирование единого в
структурном и функциональном отношениях макромолекулярного образования
8.
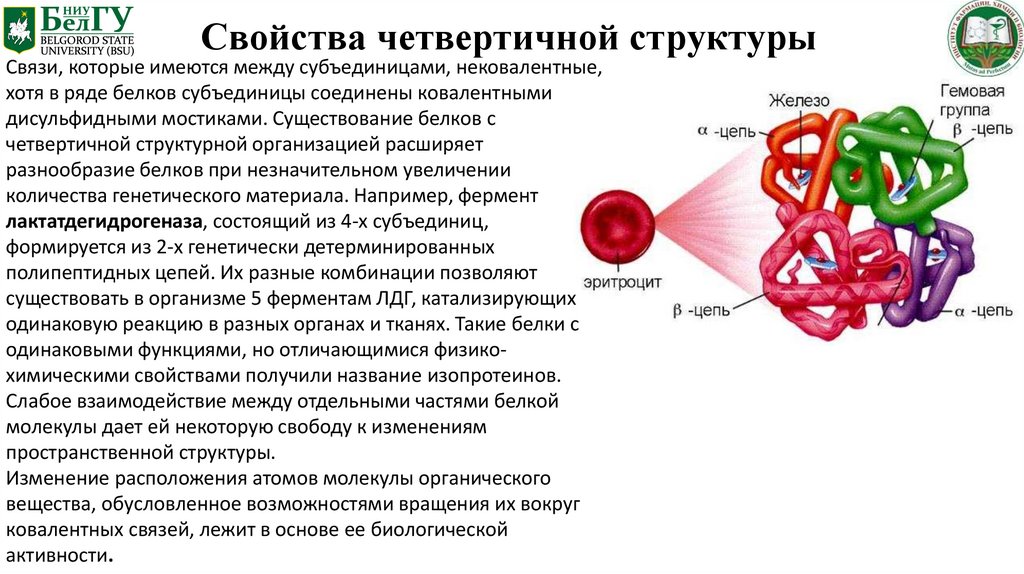
Свойства четвертичной структурыСвязи, которые имеются между субъединицами, нековалентные,
хотя в ряде белков субъединицы соединены ковалентными
дисульфидными мостиками. Существование белков с
четвертичной структурной организацией расширяет
разнообразие белков при незначительном увеличении
количества генетического материала. Например, фермент
лактатдегидрогеназа, состоящий из 4-х субъединиц,
формируется из 2-х генетически детерминированных
полипептидных цепей. Их разные комбинации позволяют
существовать в организме 5 ферментам ЛДГ, катализирующих
одинаковую реакцию в разных органах и тканях. Такие белки с
одинаковыми функциями, но отличающимися физикохимическими свойствами получили название изопротеинов.
Слабое взаимодействие между отдельными частями белкой
молекулы дает ей некоторую свободу к изменениям
пространственной структуры.
Изменение расположения атомов молекулы органического
вещества, обусловленное возможностями вращения их вокруг
ковалентных связей, лежит в основе ее биологической
активности.
9.
Кристаллизация белковКристаллизация белка - это процесс образования
регулярного массива отдельных молекул белка,
стабилизированных кристаллическими контактами. Если
кристалл достаточно упорядочен, он
будет дифракционировать. Некоторые белки естественным
образом образуют кристаллические массивы, такие
как аквапорин в хрусталике глаза.
Образование кристаллов требует двух стадий: зародышеобразования и
роста. Зародышеобразование является стадией инициации
кристаллизации. На стадии зародышеобразования молекулы белка в
растворе собираются вместе в виде агрегатов, образуя стабильное твердое
ядро. По мере образования ядра кристалл становится все больше и больше
за счет прикрепления молекул к этому стабильному ядру. Стадия
зародышеобразования имеет решающее значение для образования
кристалла при переходе образцов от высокой степени свободы к
упорядоченному состоянию (от водного к твердому). Для успеха стадии
зародышеобразования необходимо манипулировать параметрами
кристаллизации. Подход к кристаллизации белка заключается в том, чтобы
обеспечить более низкую растворимость целевого белка в растворе.
Как только предел растворимости будет превышен и появятся
кристаллы, кристаллизация будет завершена.
10.
ЗаключениеМы рассмотрели самые важные
структуры белков, моделирование
превращений по первичной
форме, а также такой интересный
процесс, как кристаллизация.
Третичная структура обусловлена
дисульфидными связями, но её
образование сильно зависит от
гидрофобных процессов.
Четвертичная структура может
состоять не только из глобул, но и
из других структур, при этом она
может включать в себя
посторонние вещества, как,
например, атом железа в
гемоглобине.
Структуру глобулы или
фибриллярного белка можно
предсказать, если знать его
первичную структуру. Для этого
используют доменную систему,
которую определяют при помощи
суперкомпьютеров или систем
разделённых вычислений.
Кристаллизация белков возможна
благодаря образованию контактов
между молекулами белка,
некоторые из них способны
образовываться в естественных
условиях.
11.
Источники и используемая литература1. Куранова И. П. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ РАСТВОРИМЫХ БЕЛКОВ // Биохимия. - 1990. - №11. - С. 1924-1945.
2. Третичная структура белка // XuMuK URL: https://xumuk.ru/biologhim/022.html (дата обращения: 13.05.2022).
3. Структура и модификации белков. Классификация ферментов // Pulsar URL: Biology-Genetics-M11-Rebrikov130429.02.pdf (дата обращения: 13.05.2022).
4. РАЗДЕЛ 1. БЕЛКИ. ФЕРМЕНТЫ // ГОУ ВПО "ИВАНОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ" URL:
https://ivgma.ru/attachments/16523 (дата обращения: 13.05.2022).
5. Лекция 11 Моделирование структуры белков // МГУ имМ.В. Ломоносова, Факультет Биоинженерии и
Биоинформатики URL: https://kodomo.fbb.msu.ru (дата обращения: 13.05.2022).
6. Четвертичная структура белков // Студопедия URL: https://studopedia.ru/3_159392_chetvertichnaya-strukturabelkov.html (дата обращения: 13.05.2022).
7. Торжество компьютерных методов: предсказание строения белков // Биомолекула URL:
https://biomolecula.ru/articles/torzhestvo-kompiuternykh-metodov-predskazanie-stroeniia-belkov (дата обращения:
13.05.2022).







 biology
biology








