Similar presentations:
Алканы
1. АЛКАНЫ
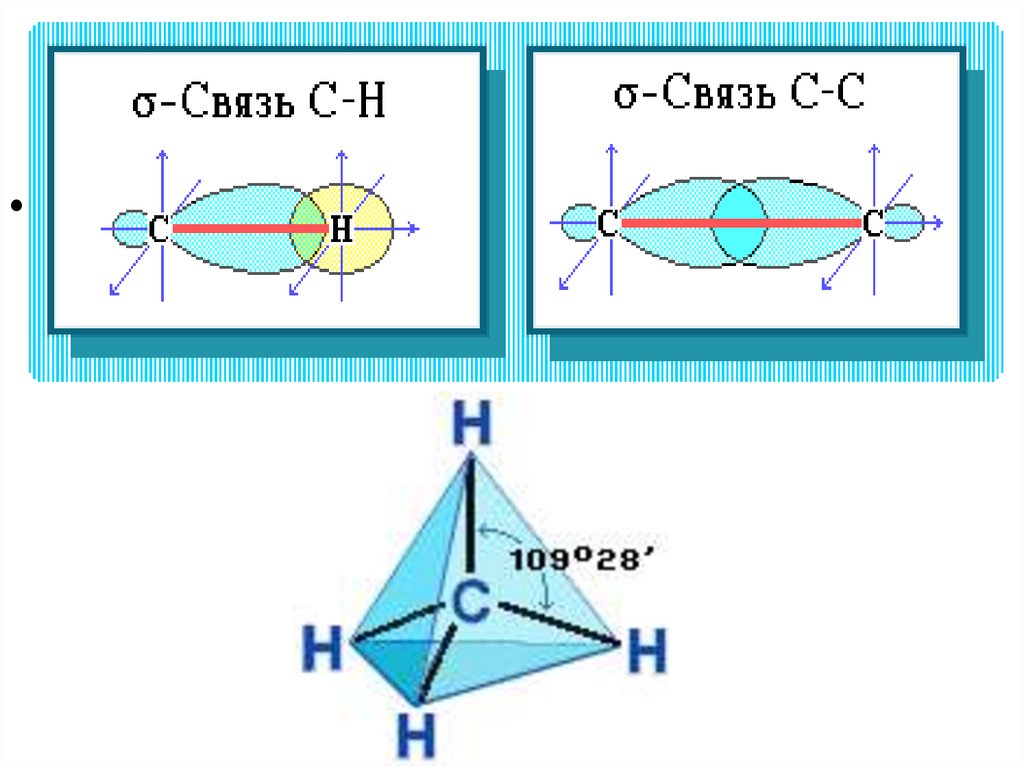
2. Общая формула: СnH2n+2 УВ в молекулах которых атомы связаны одинарными связями.
3.
4. Физические свойства
1.С1-С4
С5-С15
- газы
- жидкости
С16 ….. - твердые вещества
2. С увеличением Мr увеличиваются
температуры плавления и кипения алканов.
3. Плохо растворяются в воде. Жидкие УВ –
растворители.
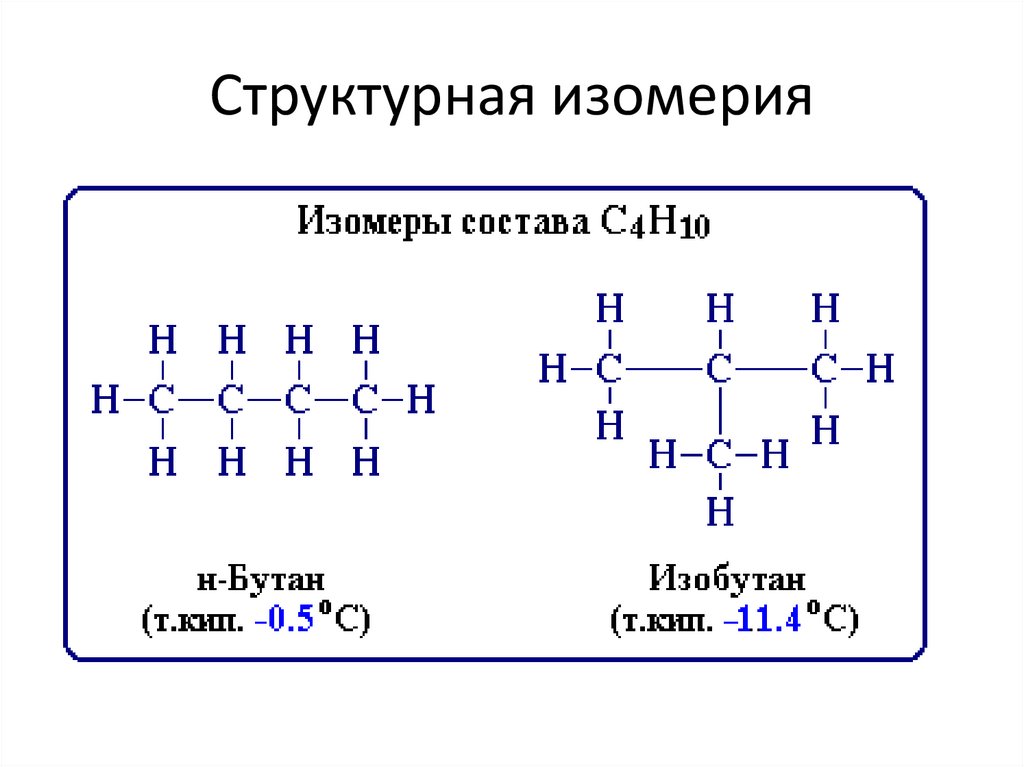
5. Изомерия алканов
1. Структурная (углеродного скелета),начиная с бутана;
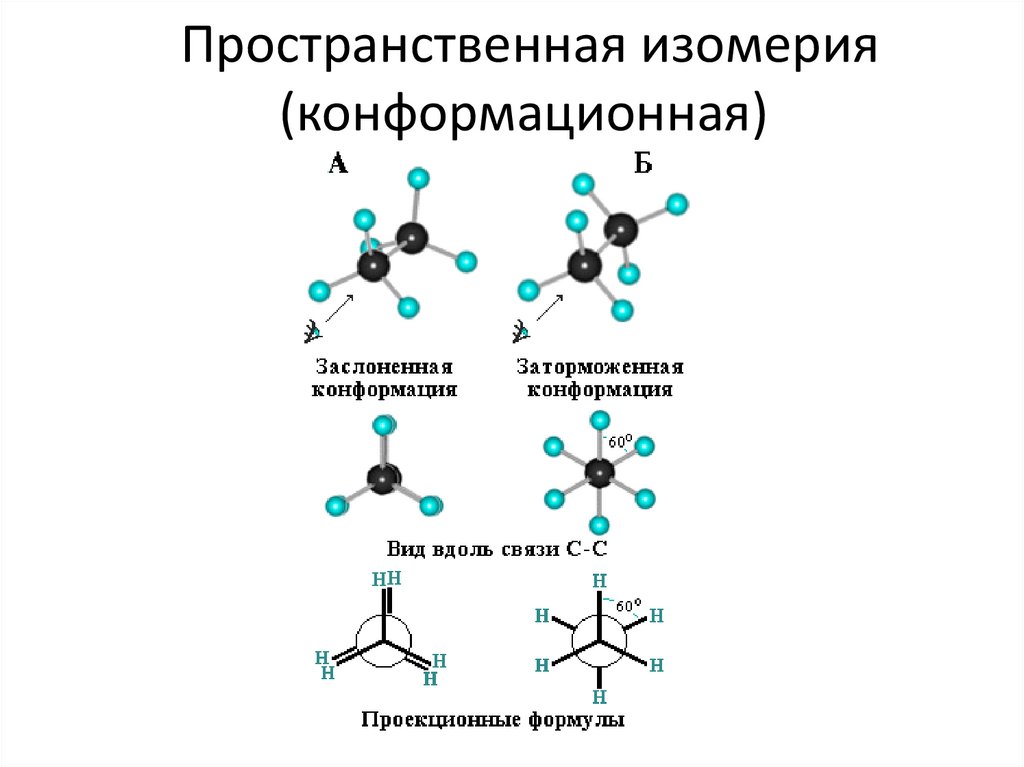
2. Пространственная (конформационная);
3. Оптическая (зеркальная), при наличии в
молекуле 7-ми и более углеродных атомов.
6. Структурная изомерия
7. Пространственная изомерия (конформационная)
8. Оптическая изомерия (зеркальная)
при наличии в молекуле 7-ми и болееуглеродных атомов
9. Химические свойства алканов
1. предельная насыщенность алканов не допускаетреакций присоединения, но не препятствует
реакциям разложения, изомеризации и
замещения;
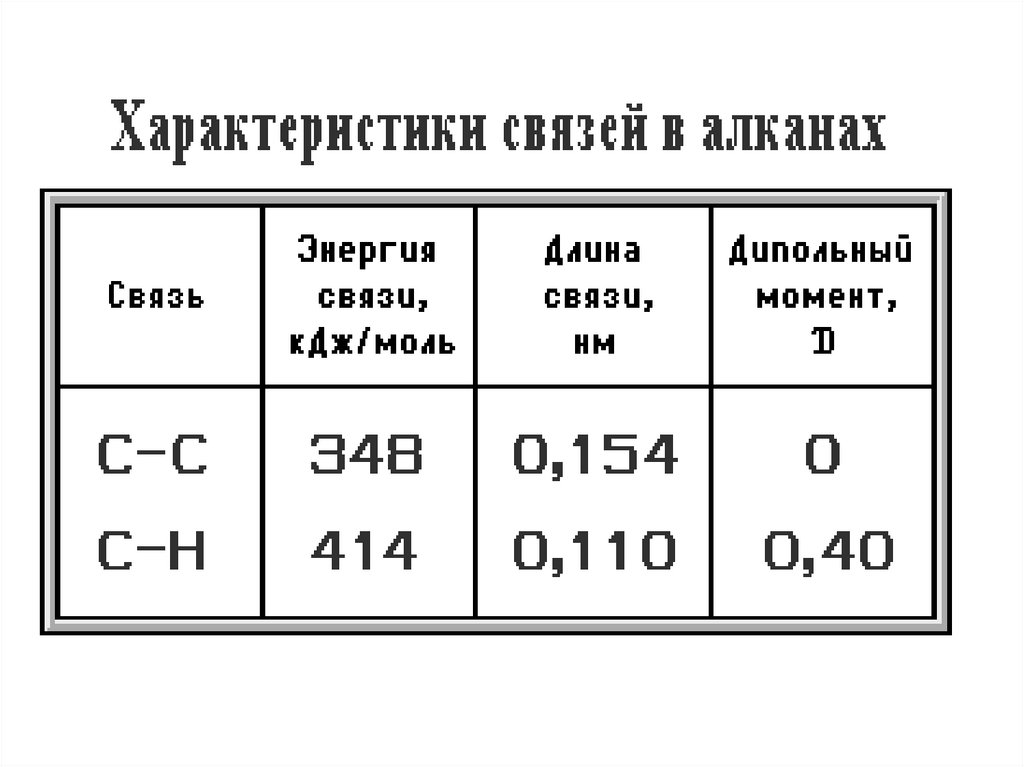
2. симметричность неполярных С–С и
слабополярных С–Н ковалентных связей
предполагает их гомолитический
(симметричный) разрыв на свободные радикалы
(радикальный механизм реакций);
3. устойчивы к действию полярных реагентов
(кислот, щелочей, окислителей ионного типа:
КMnO4, К2Сr2O7 и т.п.)
10.
11. реакции алканов подразделяются на следующие типы.
1. По связям С–Н возможны реакции замещенияатома водорода или его отщепления
(дегидрирование алканов).
2. С разрывом связей С–С происходят реакции
разложения (крекинг алканов) и изомеризации
углеродного скелета.
3. В присутствии окислителей в определенных
условиях будут происходить реакции окисления
алканов с участием связей
С–С и С–Н.
12. Реакции замещения
13. 1. Галогенирование
Механизм радикального замещения (SR):1 стадия – зарождение цепи - появление в зоне
реакции свободных радикалов.
2 стадия – рост (развитие) цепи.
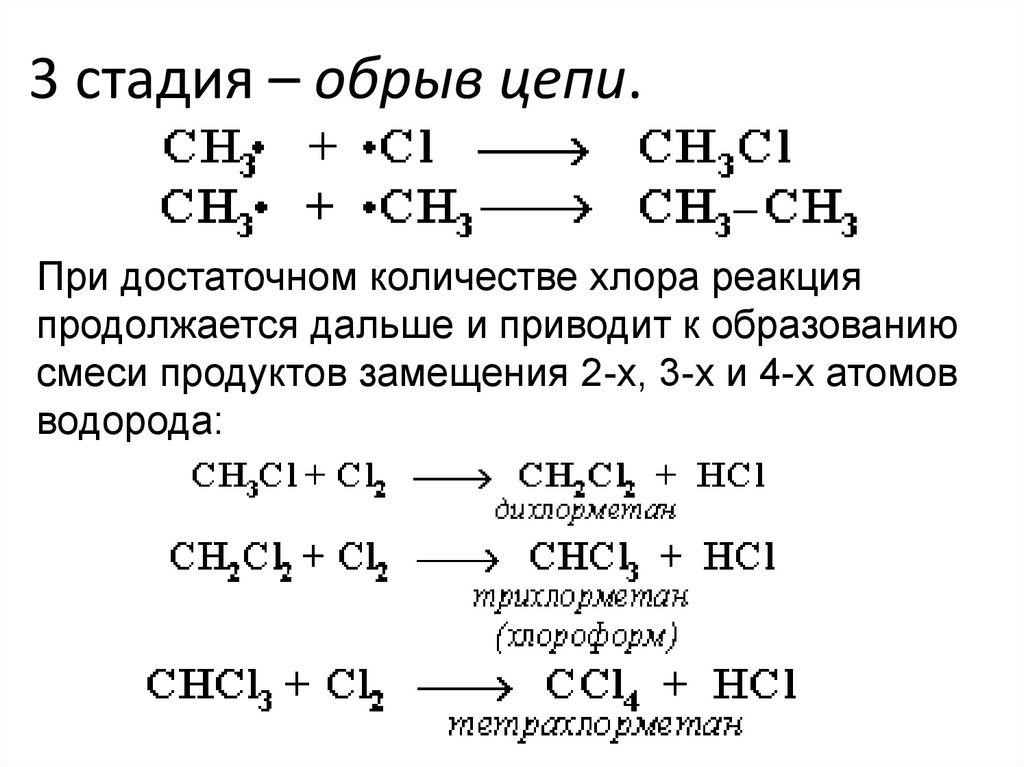
14. 3 стадия – обрыв цепи.
При достаточном количестве хлора реакцияпродолжается дальше и приводит к образованию
смеси продуктов замещения 2-х, 3-х и 4-х атомов
водорода:
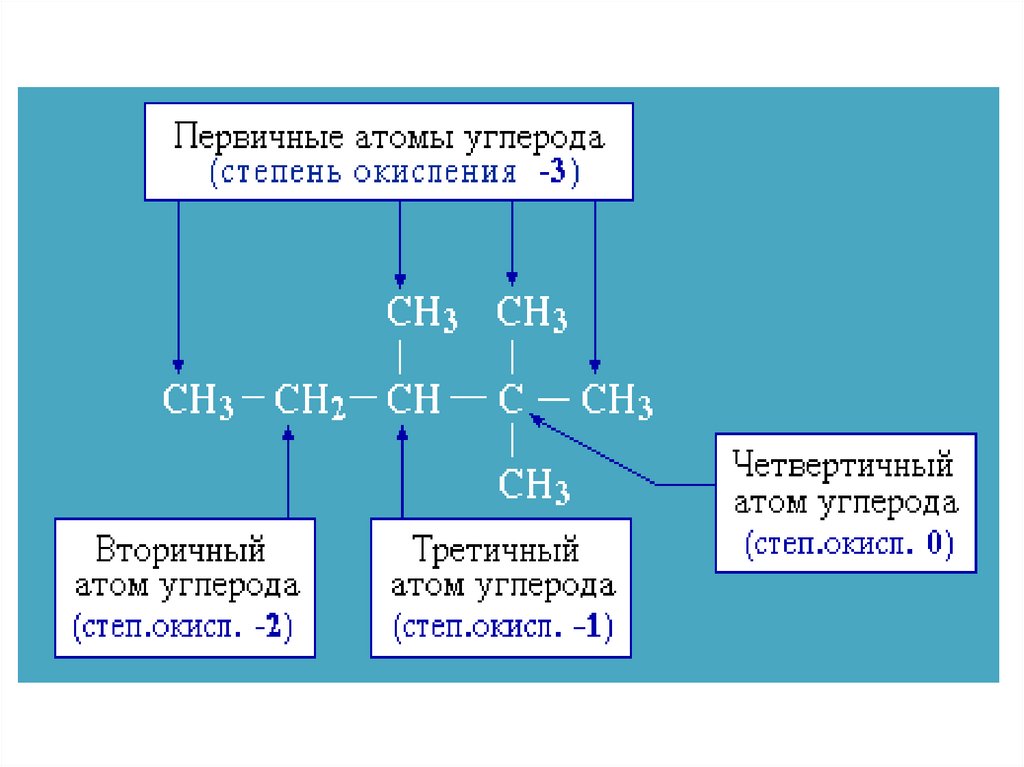
15. При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у
третичного атома,труднее у вторичного и еще труднее у
первичного.
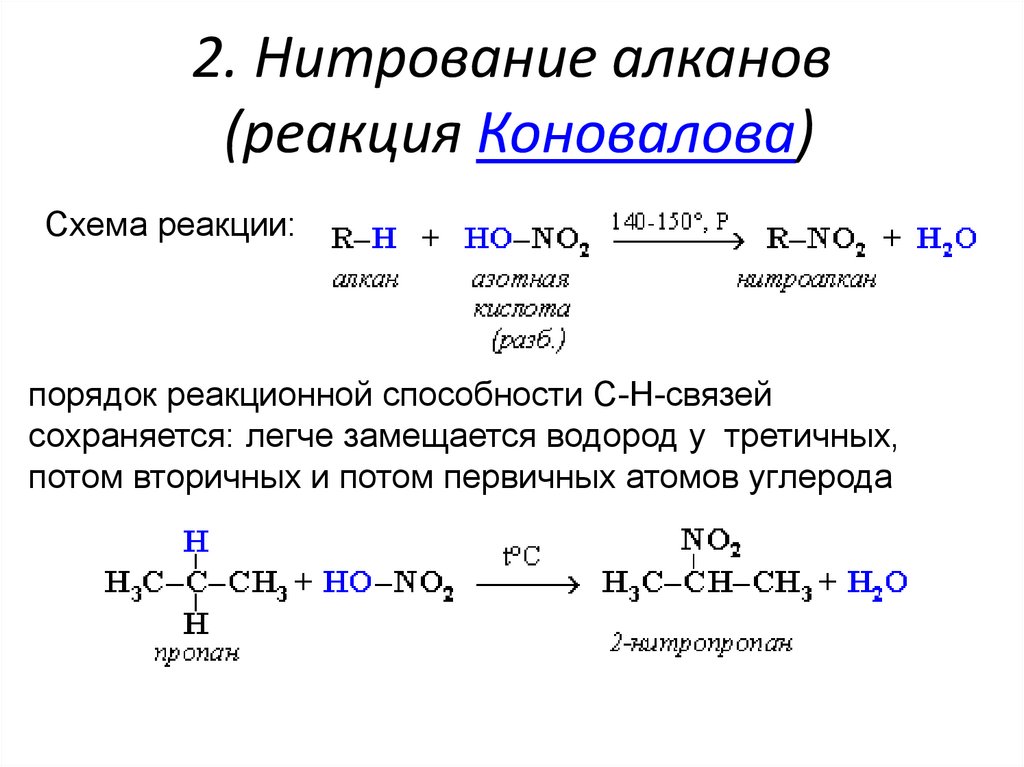
16. 2. Нитрование алканов (реакция Коновалова)
Схема реакции:порядок реакционной способности С-Н-связей
сохраняется: легче замещается водород у третичных,
потом вторичных и потом первичных атомов углерода
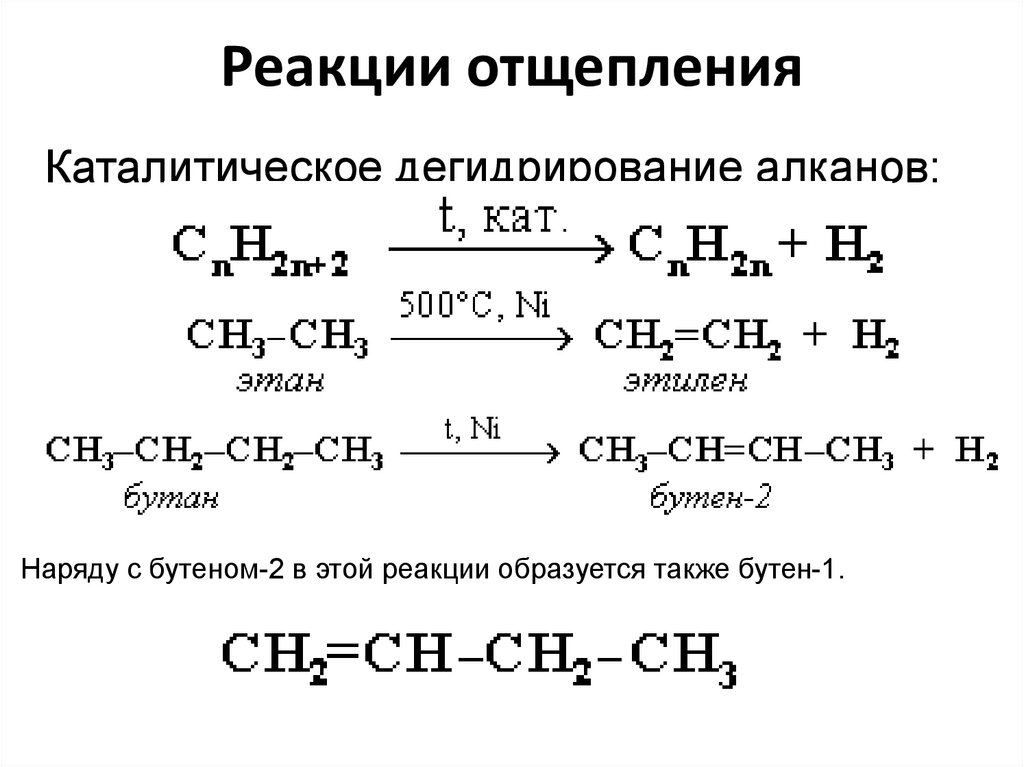
17. Реакции отщепления
Каталитическое дегидрирование алканов:Наряду с бутеном-2 в этой реакции образуется также бутен-1.
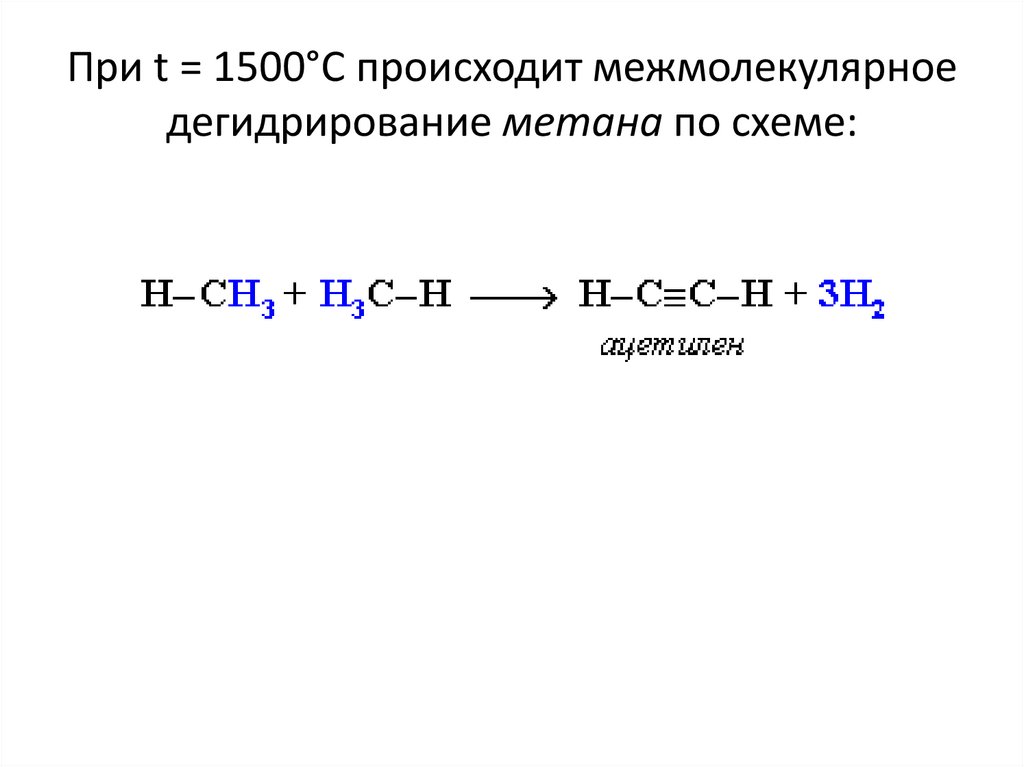
18. При t = 1500°С происходит межмолекулярное дегидрирование метана по схеме:
19. Реакции окисления алканов
В органической химии реакции окисления ивосстановления рассматриваются как реакции, связанные
с потерей и приобретением органическим соединением
атомов водорода и кислорода. Эти процессы
сопровождаются изменением степеней окисления атомов.
Окисление органического вещества – введение в его
состав кислорода и (или) отщепление водорода.
Восстановление – обратный процесс (введение
водорода и отщепление кислорода). Учитывая состав
алканов (СnH2n+2), можно сделать вывод о их
неспособности вступать в реакции восстановления, но
возможности участвовать в реакциях окисления.
20.
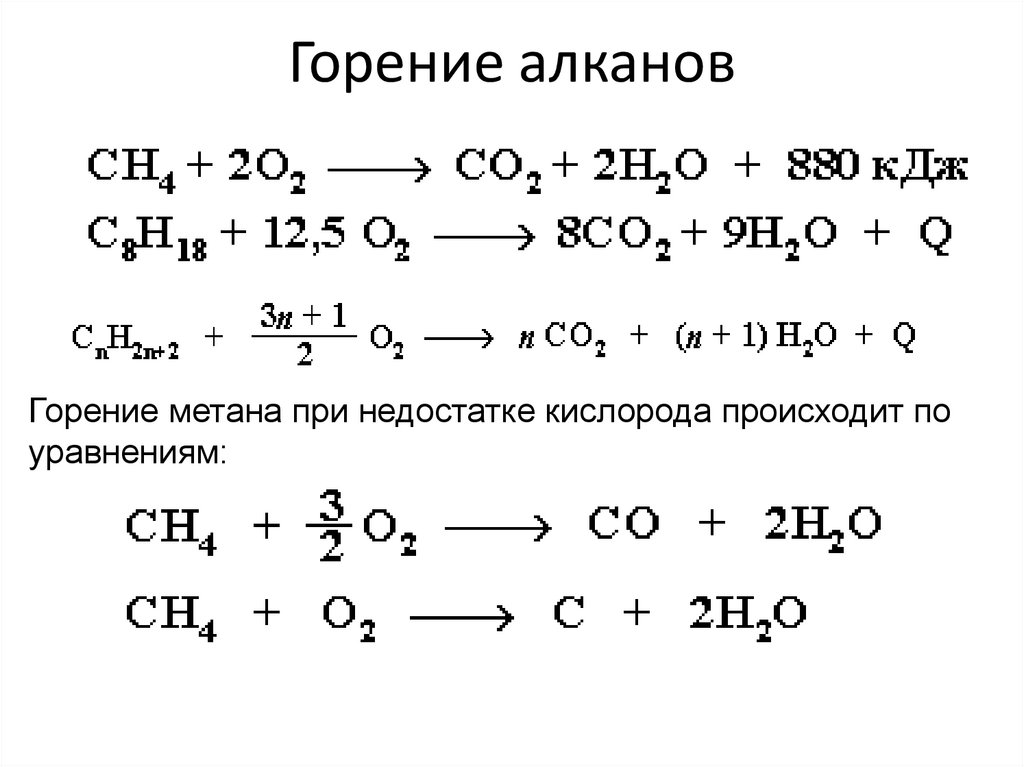
21. Горение алканов
Горение метана при недостатке кислорода происходит поуравнениям:
22. Каталитическое окисление алканов
при неполном окислении бутана (разрыв связиС2–С3) в присутствии катализатора и при
нагревании получают уксусную кислоту:
взаимодействия метана с водяным паром, в результате
которой образуется смесь оксида углерода (II) с
водородом – "синтез-газ":
23. Крекинг алканов
Крекинг - реакции расщепления углеродного скелетакрупных молекул при нагревании и в присутствии
катализаторов .
Разрыв С–С связи возможен в любом случайном месте
молекулы. Поэтому образуется смесь алканов и алкенов с
меньшей, чем у исходного алкана, молекулярной массой.
24. Пиролиз алканов
При нагревании до 1000 С без доступавоздуха:
С2Н6 2С + 3Н2
25. Изомеризация алканов
26. Получение алканов
Получение в промышленности1. Алканы выделяют из природных источников
(природный и попутный газы, нефть,
каменный уголь).
2. Крекинг нефти:
С18Н38 С9Н20 + С9Н18
3. Гидpиpование непpедельных углеводоpодов:
27. Получение алканов
4. Газификация твердого топлива (приповышенной температуре (400-500 С) и
давлении, катализатор Ni):
5. Из синтез-газа (СО + Н2) получают смесь
алканов (катализатор Со, Fe, Ni;
t =170 -330 C):
28. Получение алканов
В лаборатории:1. Реакция Вюpца (синтез более сложных
алканов из галогенопpоизводных с меньшим
числом атомов углеpода):
29. Получение алканов
2. Из солей карбоновых кислот:а) сплавление со щелочью (реакция Дюма)
б) электролиз по Кольбе




















 chemistry
chemistry








