Similar presentations:
Химия элементов VIIA-группы
1.
Химия элементовVIIА-группы
1
2.
Галогены (солероды)F, Cl, Br, I, At
р-элементы
F
2s2
2p5
ns2np5
2p ↑↓ ↑↓ ↑
2s ↑↓
Основное состояние
ЭО (F) = 4 (Л. Полинг)
В=1
C.O. –1
O+2F2–
2
3.
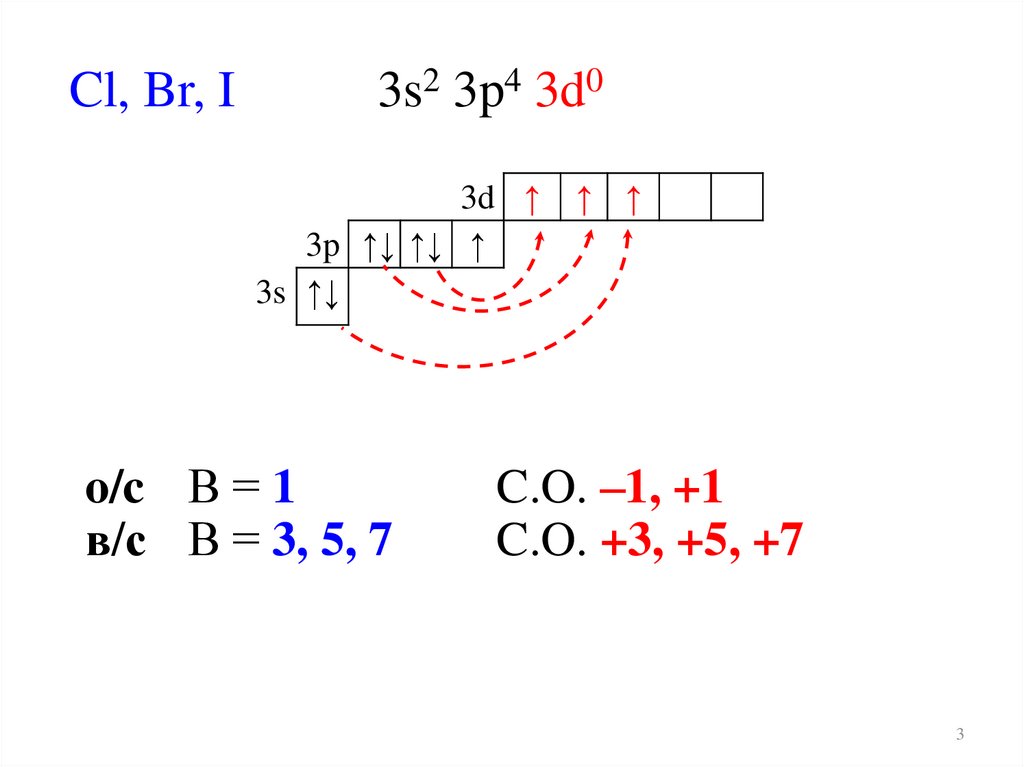
Cl, Br, I3s2 3p4 3d0
3d ↑
3p ↑↓ ↑↓ ↑
3s ↑↓
o/c В = 1
в/с В = 3, 5, 7
↑ ↑
C.O. –1, +1
C.O. +3, +5, +7
3
4.
В природе:фтор – CaF2 флюорит (плавиковый шпат)
3Ca3(PO4)2·CaF2 фторапатит
Na3[AlF6] – криолит
хлор –
бром –
NaCl каменная соль (галит)
KCl сильвин
NaСl∙KCl сильвинит
KCl·MgCl2·6H2O карналлит
KBr∙KCl бромсильвинит
KBr·MgBr2·6H2O бромкарналлит
йод – морские водоросли, NaIO3 иодат натрия
Промышленный источник брома и йода –
воды соленых озер и нефтеносных скважин
4
5.
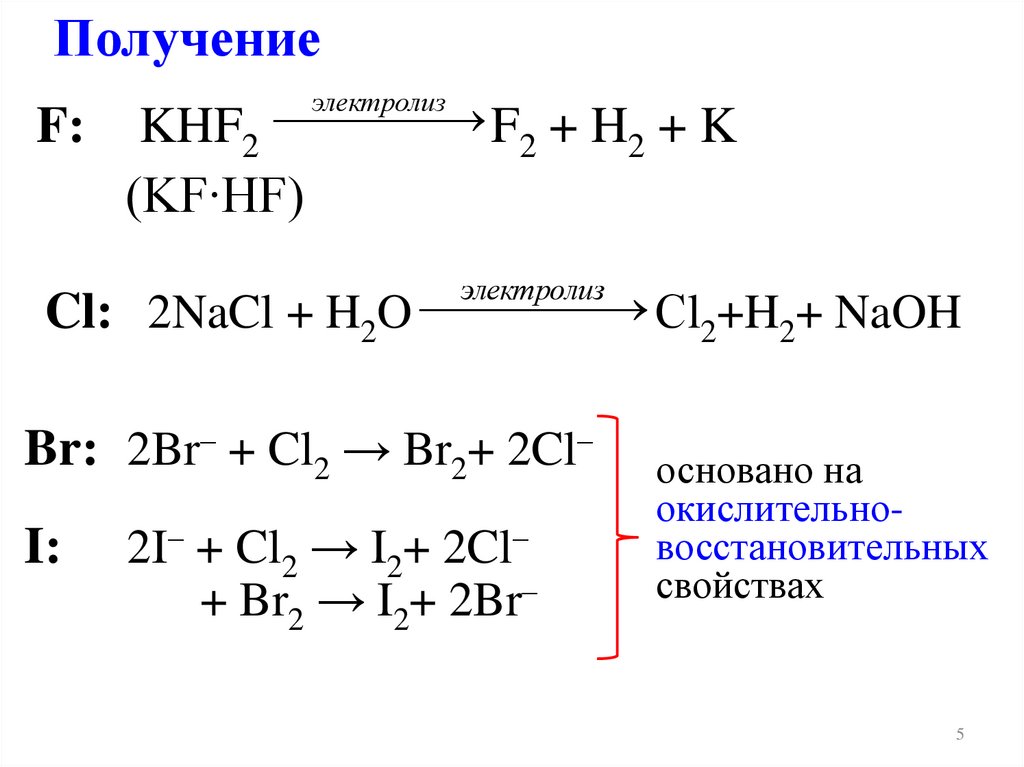
ПолучениеF:
электролиз
KHF2 F2 + H2 + K
(KF∙HF)
электролиз
Cl: 2NaCl + H2O Сl2+H2+ NaOH
Br: 2Br– + Cl2 → Br2+ 2Cl–
I:
2I– + Cl2 → I2+ 2Cl–
+ Br2 → I2+ 2Br–
основано на
окислительновосстановительных
свойствах
5
6.
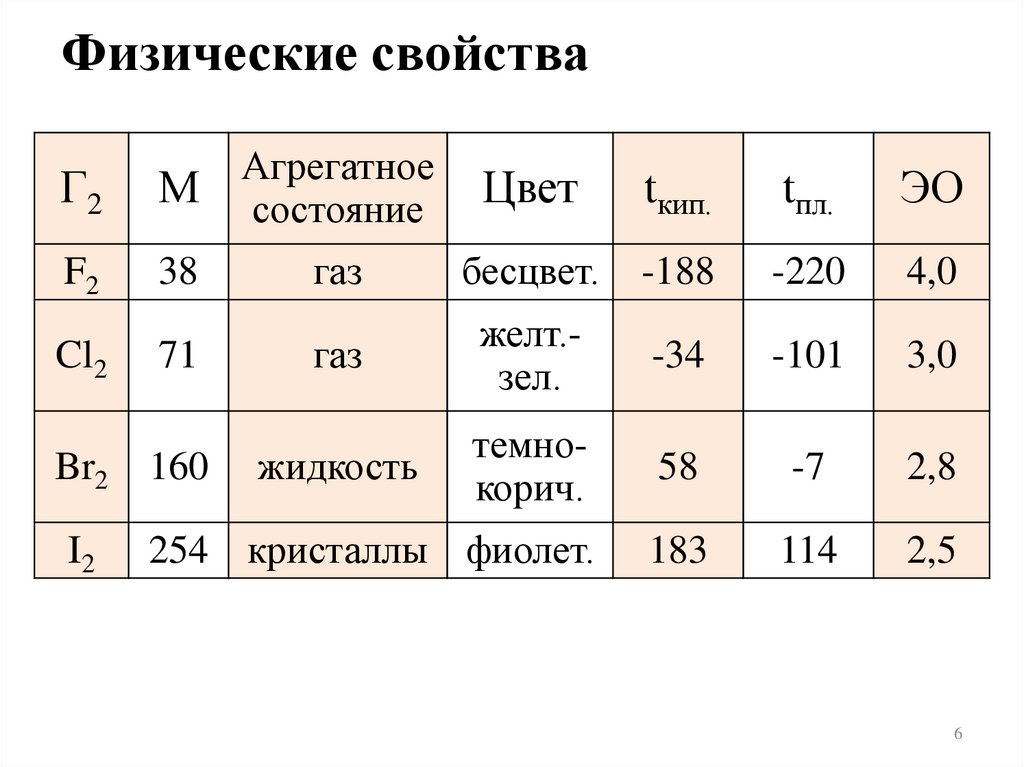
Физические свойстваГ2
М
Агрегатное
состояние
F2
38
газ
бесцвет.
-188
-220
4,0
газ
желт.зел.
-34
-101
3,0
жидкость
темнокорич.
58
-7
2,8
254 кристаллы фиолет.
183
114
2,5
Cl2
Br2
I2
71
160
Цвет
tкип.
tпл.
ЭО
6
7.
Химические свойства простыхвеществ
Следствие из закона Авогадро −
состав двухатомный Г2 – F2, Cl2, Br2, I2
Молекулы образуются
ММО:
за счет перехода ēē с
АО на МО
Еобр. связи
кДж/моль
F2
-158
МВС:
за счет образования
ОЭП по обменному
механизму
Cl2
-239
Br2
-188,5
I2
-149
наиболее прочная
7
8.
Несмотря на значительную прочность –возможна диссоциация
Г2 ⇄ 2Г0 (атомы)
α ↑ в ряду Cl→Br→I
Г2(газ) ⇄ Г2(раствор)
особенно энергично:
F2+ Н2О ⇄ (HF)2+[O]
Г2 в Н2О
растворяются плохо,
т.к. растворитель
полярный
Cl2+ Н2О ⇄ HCl– + HCl+1O
хлорная вода
8
9.
Наиболее характерно восстановлениеГ2+ 2ē → 2Г– окислитель
ns2 np6 устойчивая 8-электронная конфигурация
Г2 + 2Me = 2MeГ (щел. металлы)
Cl2 + P4 (белый) → PCl3 (PCl5)
Cl2 + S → SCl4 (SCl6)
Г2 + Н2 = 2HГ (цепной механизм)
+ N2, O2, C ≠
9
10.
F2 → I2↓ ЭО, ↓ окислительная активность
1/2F2 + ē ⇄ F–
1/2Cl2 + ē ⇄ Cl–
1/2Br2 + ē ⇄ Br–
1/2I2 + ē ⇄ I–
φ° = +2,85 B
φ° = +1,36 B
φ° = +1,065 B
φ° = +0,54 B
F2 + 2Г– → 2F– + Г20
Cl2 + 2Br– → 2Cl– + Br20
2I– → 2Cl– + I20
Br2 + 2I– → 2Br– + I20
F2 + SiO2 → SiF4 + O
10
11.
Соединения галогеновС.О. −1
галогеноводороды HГ
δ+Н−Гδ−
молекулы полярны
растворы в воде – сильные кислоты
(кроме HF)
HF → HCl → HBr → НI ↑ сила кислот
возможна реакция
2HI + Ag → [AgI2]-+ H2↑
соли – галогениды
11
12.
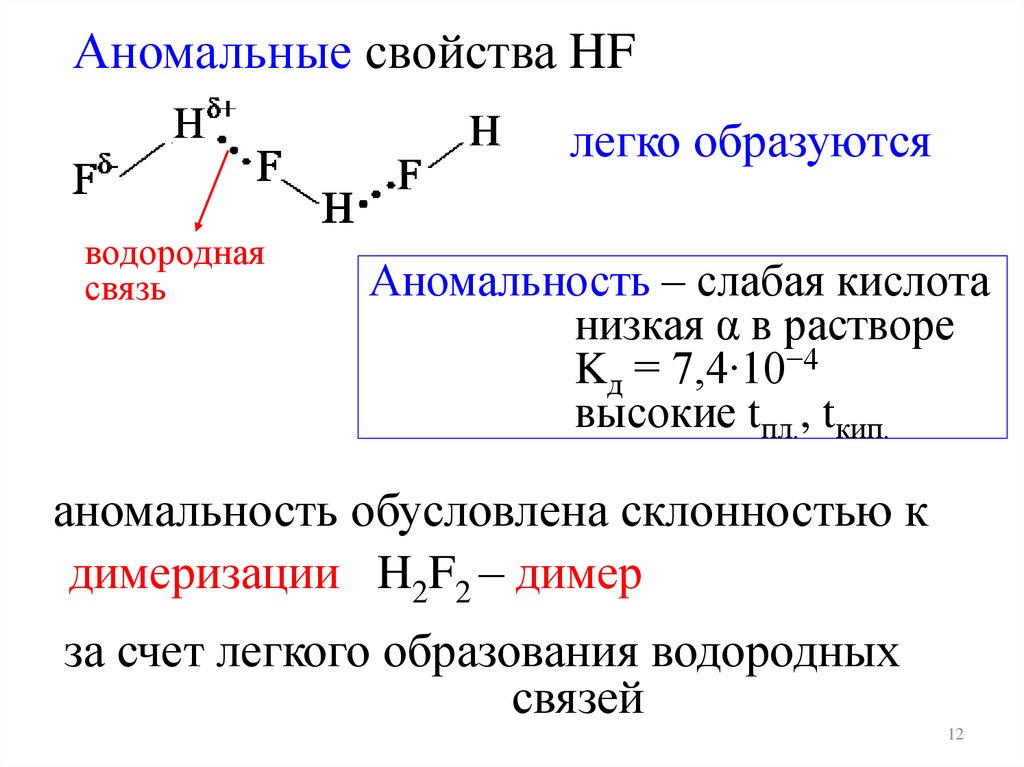
Аномальные свойства HFлегко образуются
водородная
связь
Аномальность – слабая кислота
низкая α в растворе
Kд = 7,4‧10−4
высокие tпл., tкип.
аномальность обусловлена склонностью к
димеризации H2F2 – димер
за счет легкого образования водородных
связей
12
13.
H2F2 – двухосновная, слабаядва типа солей
H2F2 + KOH ⇄ H2O + KHF2
кислая
H2F2 + 2KOH ⇄ H2O + 2KF
средняя
особенность
6HF + SiO2 → H2[SiF6] + 2H2O
13
14.
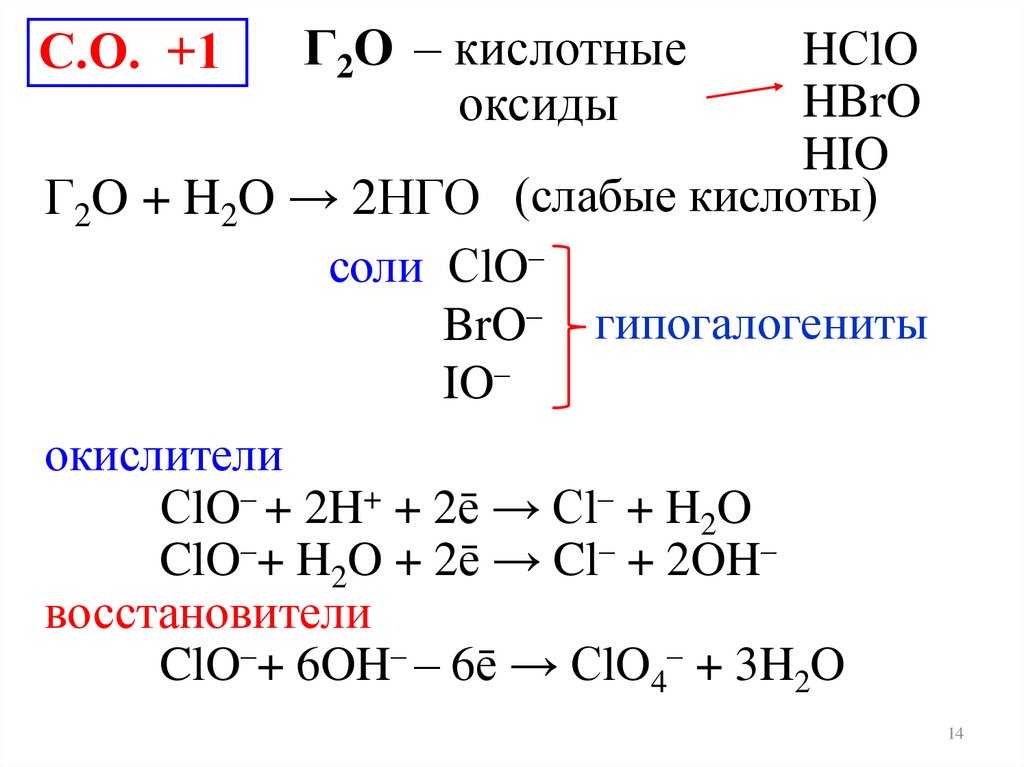
С.О. +1Г2O – кислотные
оксиды
HСlO
HBrO
HIO
Г2O + H2O → 2НГО (слабые кислоты)
соли СlO–
BrO– гипогалогениты
IO–
окислители
СlO– + 2H+ + 2ē → Сl– + H2O
ClO–+ H2O + 2ē → Cl– + 2OH–
восстановители
ClO–+ 6OH– – 6ē → СlO4– + 3H2O
14
15.
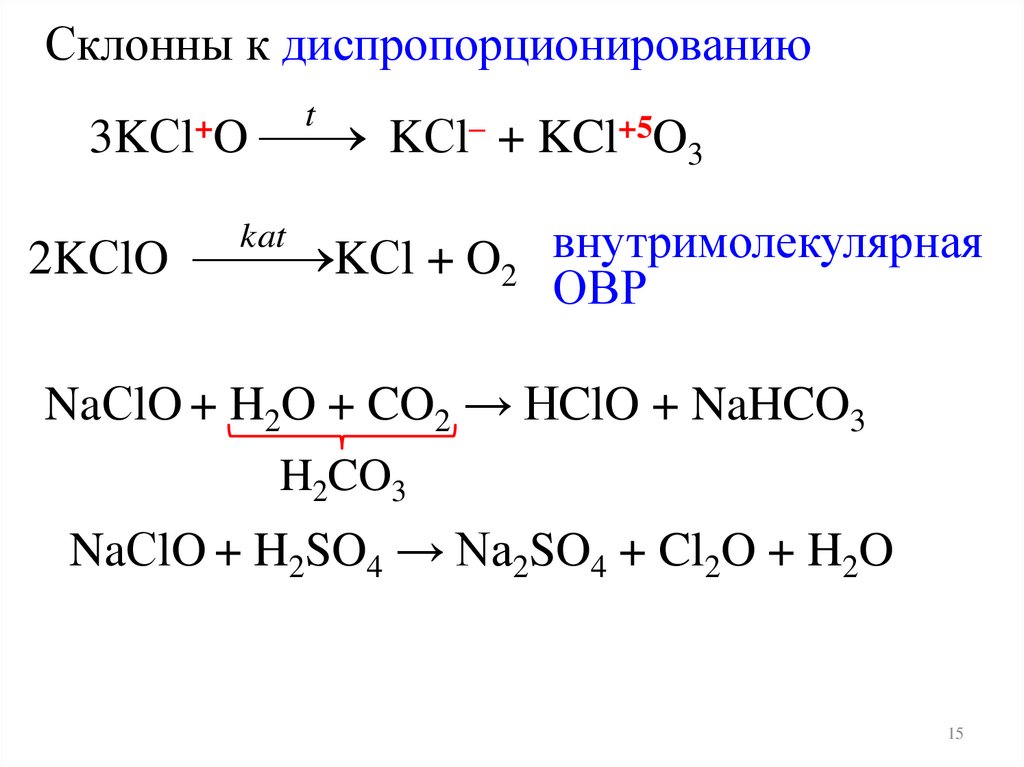
Склонны к диспропорционированию3KСl+O
t
KСl– + KCl+5O3
KСl + O2 внутримолекулярная
2KСlO
ОВР
kat
NaСlO + H2O + CO2 → HClO + NaHCO3
H2CO3
NaСlO + H2SO4 → Na2SO4 + Cl2O + H2O
15
16.
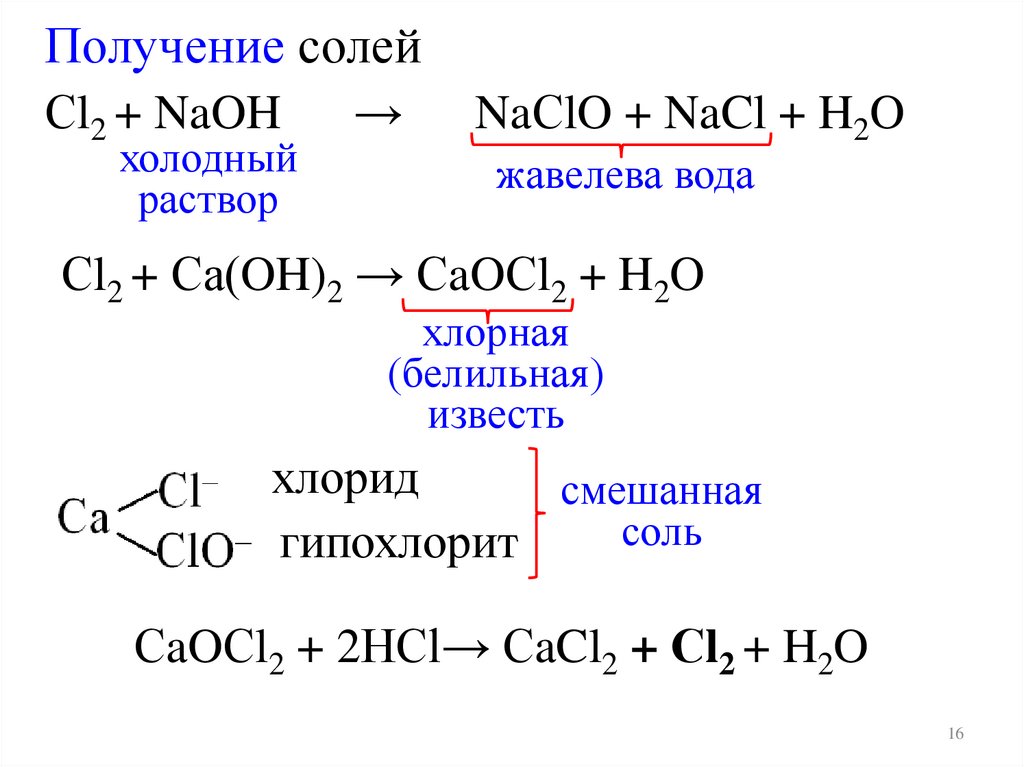
Получение солейСl2 + NaOH
холодный
раствор
→
NaСlO + NaCl + H2O
жавелева вода
Сl2 + Са(OH)2 → СaOСl2 + H2O
хлорная
(белильная)
известь
хлорид
смешанная
соль
гипохлорит
СaOСl2 + 2HCl→ СaCl2 + Сl2 + H2O
16
17.
С.О. +3характерна для хлора – Сl2O3
НСlО2 – хлористая
BrО2–
IО2–
СlО2– – хлорит
неустойчивы
легко диспропорционируют
Ba(СlО2)2 + Н2SO4 → 2НСlО2 + BaSO4↓
17
18.
окислительСlO2– + 4H+ + 4ē → Сl– + 2H2O
восстановитель
ClO2– + 4OH–– 4ē → СlО4– + 2H2O
диспропорционирование
2HСlО2 ⇄ НCl– + НСl+7О4
разложение
NaСlО2 → NaCl + О2↑
18
19.
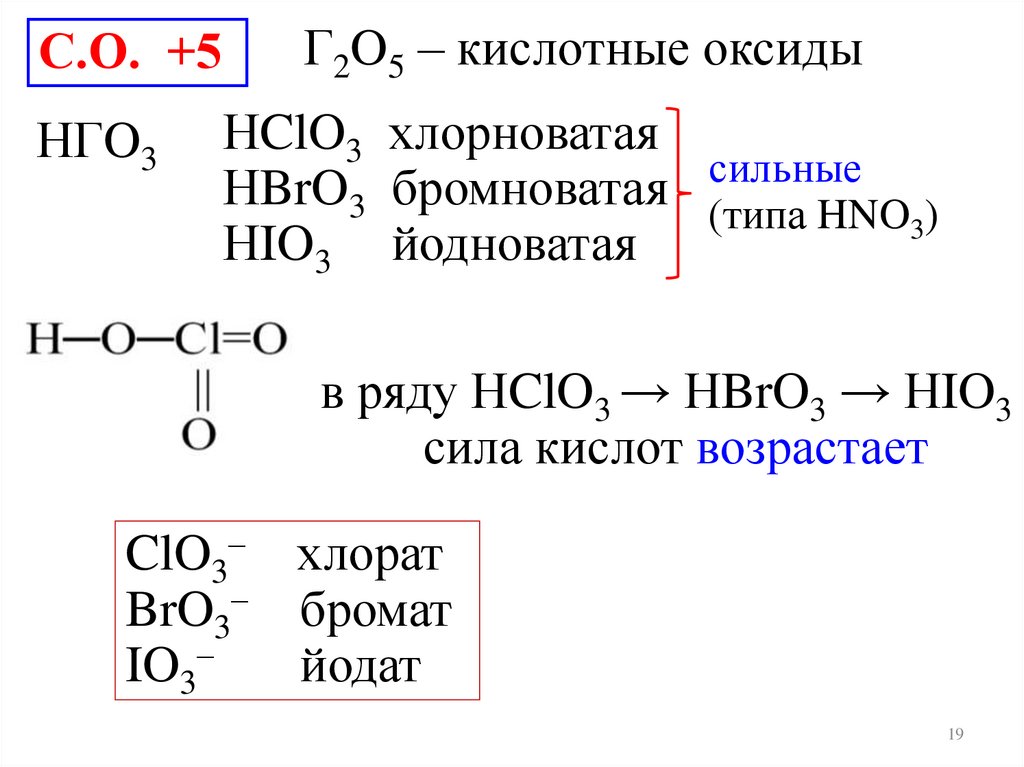
С.О. +5НГO3
Г2O5 – кислотные оксиды
НClO3 хлорноватая
сильные
НBrO3 бромноватая (типа HNO )
3
НIO3 йодноватая
в ряду НClO3 → НBrO3 → НIO3
сила кислот возрастает
ClO3– хлорат
BrO3– бромат
IO3–
йодат
19
20.
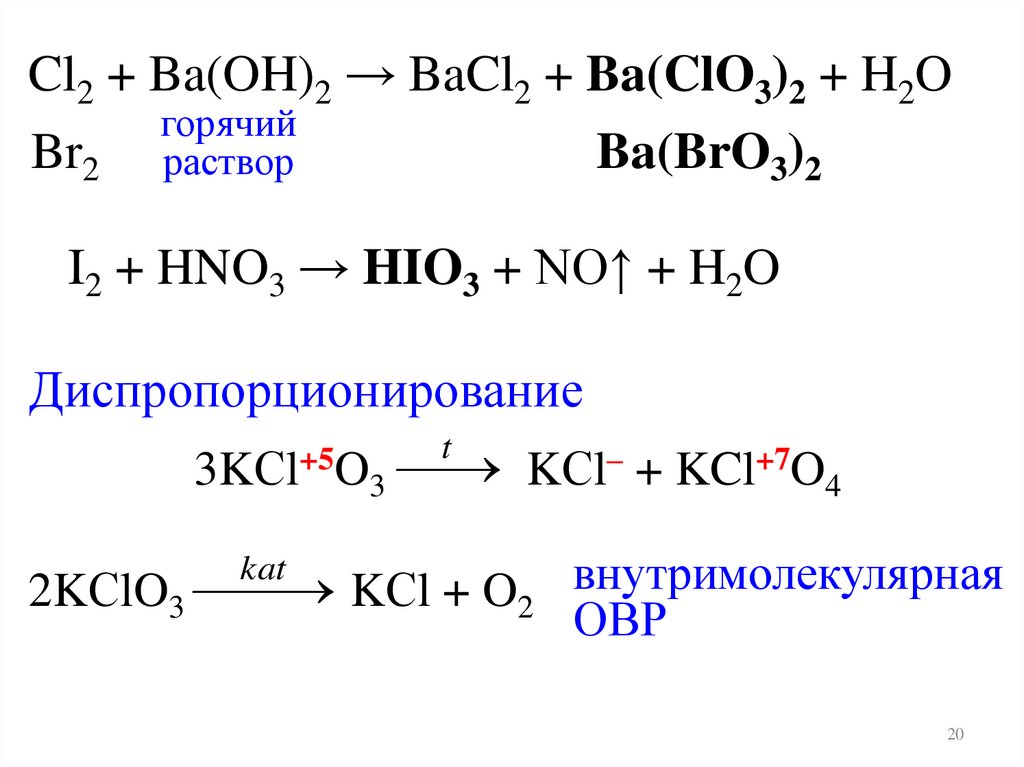
Cl2 + Ba(OH)2 → BaCl2 + Ba(ClO3)2 + H2Oгорячий
Br2 раствор
Ba(BrO3)2
I2 + HNO3 → HIO3 + NO↑ + H2O
Диспропорционирование
3KСl+5O3
t
KСl– + KCl+7O4
KСl + O2 внутримолекулярная
2KСlO3
ОВР
kat
20
21.
окислителиСlO3– + 6H+ + 6ē → Сl– + 3H2O
2СlO3– + 12H+ + 10ē → Сl2 + 6H2O
восстановители
ClO3– + 2OH–– 2ē → СlO4– + H2O
ClO3– + 2H2O – 2ē → СlO4– + 4H+
t
KCl + CО2↑
KСlО3 + C
окисление органических соединений
8KClO3+C12H22O11+4H2SO4 =
= 4KHSO4 + 4KCl + 4HCl + 12CO2 + 11H2O
21
22.
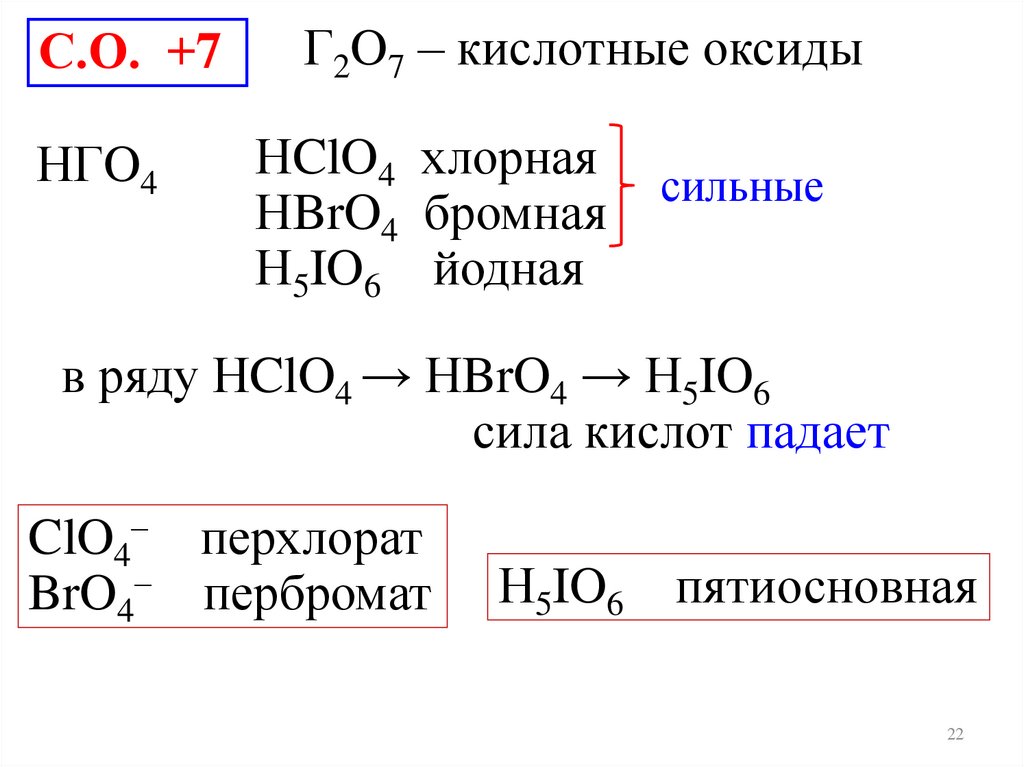
С.О. +7НГO4
Г2O7 – кислотные оксиды
НClO4 хлорная
НBrO4 бромная
Н5IO6 йодная
сильные
в ряду НClO4 → НBrO4 → Н5IO6
сила кислот падает
ClO4– перхлорат
BrO4– пербромат
Н5IO6 пятиосновная
22
23.
НClO4 – наиболее устойчива100 %-ная взрывоопасна
товарная не > 72%
Сила кислоты объясняется
особенностями связей Сl−O в молекуле
Получение в лаборатории
KСlО4 + H2SO4 → НClO4 + KНSO4
t
KСl + KClO4
KСlO3
23
24.
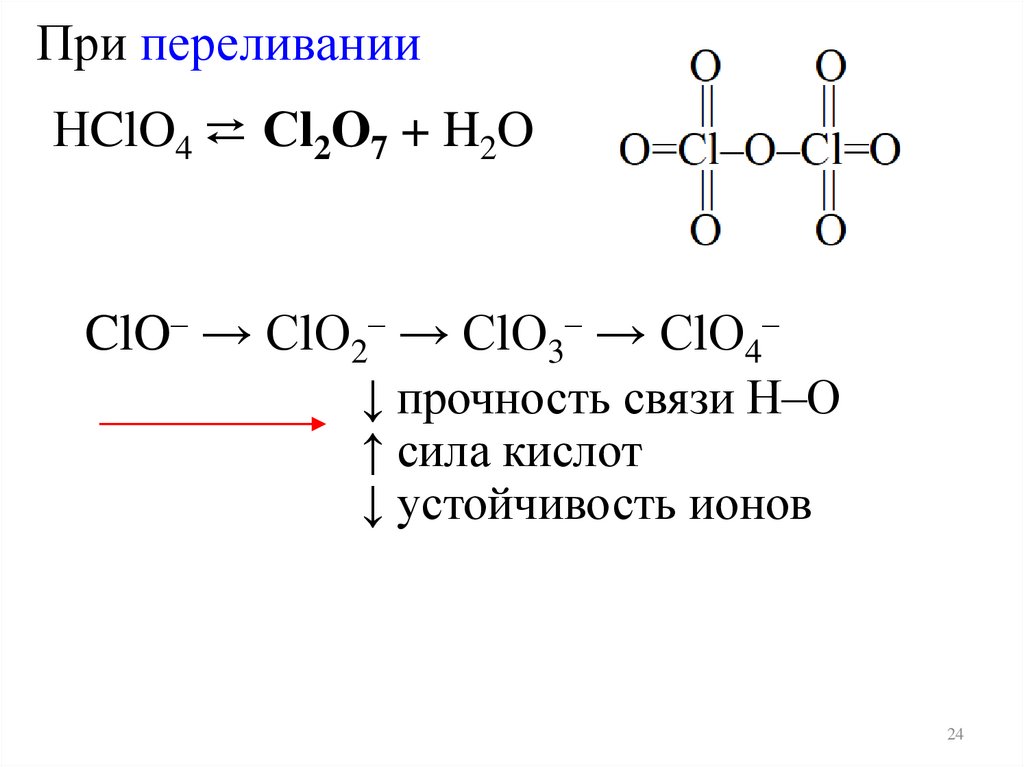
При переливанииНClO4 ⇄ Сl2O7 + H2O
ClO– → СlО2– → СlО3– → СlО4–
↓ прочность связи Н–О
↑ сила кислот
↓ устойчивость ионов
24
25.
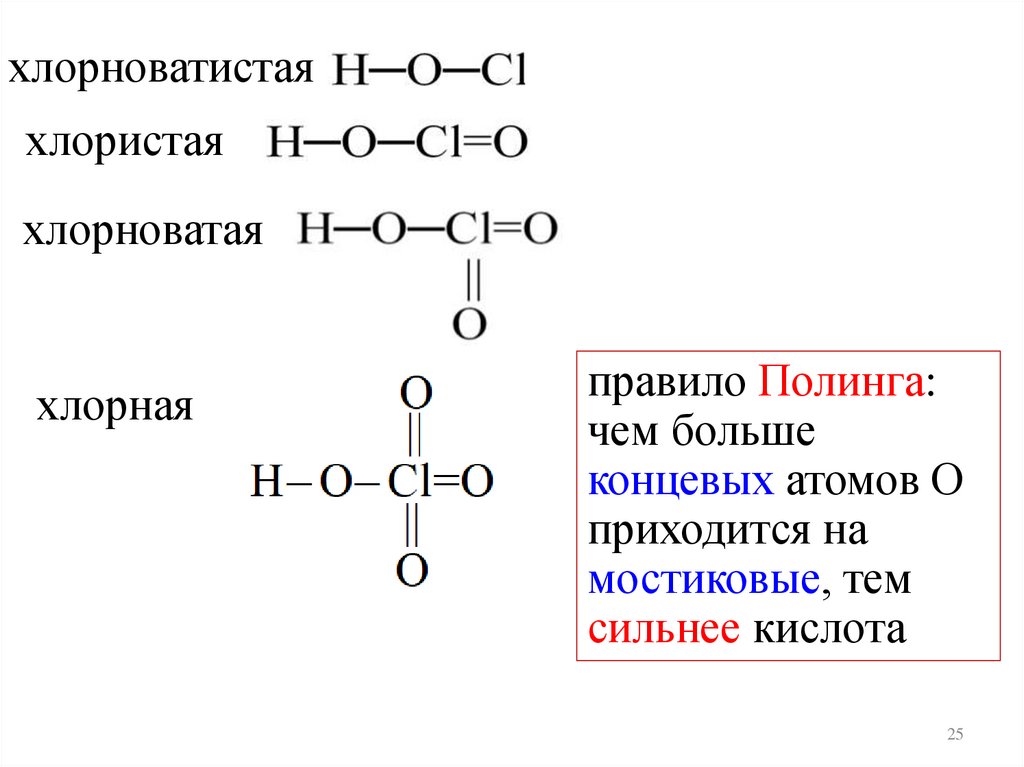
хлорноватистаяхлористая
хлорноватая
хлорная
правило Полинга:
чем больше
концевых атомов О
приходится на
мостиковые, тем
сильнее кислота
25
26.
Интергалогенидыбинарные соединения XYn
Y – более легкий Г
n – нечетное
+1
ClF
BrF
BrCl
ICl
IBr
+3
ClF3
BrF3
+5
ClF5
BrF5
+7
ICl3
IF5
IF7
26
27.
Свойства –диамагнитны
молекулы полярны
очень сильные окислители
В водном растворе – гидролиз
BrCl + NaOH (вод. р-р) → NaCl + NaBrO
BrCl + H2O ⇄ HCl + HBrO
I+5F5– + H2O ⇄ HF– + HI+5O3
IF7 + H2O ⇄ HF + H5IO6
27















 chemistry
chemistry








