Similar presentations:
Физические основы методов анализа вещества
1.
ФИЗИЧЕСКИЕОСНОВЫ
МЕТОДОВ
АНАЛИЗА
ВЕЩЕСТВА
2.
Предмет дисциплиныФундаментальные свойства и основные физические и физикохимические закономерности, лежащие в основе инструментальных
методов анализа состава и структуры вещества.
Цель изучения дисциплины
Освоение теоретических знаний об основных физических и физикохимических процессах, на основе которых разработаны и созданы методы
анализа вещества.
Знакомство со сравнительными возможностями, характеристиками и
ограничениями методов анализа вещества.
Знакомство с современной аналитической аппаратурой и
приобретение практических навыков работы с ней.
Овладение методами и средствами физического эксперимента, анализа
и обработки данных экспериментов и наблюдений.
Формирование научного мировоззрения и современного физического
мышления.
3.
Рекомендуемая литератураОсновная
1. Физические основы инструментальных методов анализа вещества.
Физико-химические методы: учебное пособие / М.В. Дубков,
А.Е. Малютин, М.А. Буробин. – Москва: Курс, 2022 – 152 с.
Дополнительная
1. Юинг Г. Инструментальные методы химического анализа: Пер. с
англ. – М.: Мир, 1989. – 608 с.
2. Методы анализа и контроля веществ: учебное пособие / А.П.
Родзевич, Е.Г Газенаур; Юргинский технологический институт. –
Томск: Изд-во Томского политехнического университета, 2013. –
312 с.
3. Лебедев А.Т. Масс-спектрометрия для анализа объектов окружающей
среды / А.Т. Лебедев. — Электрон. текстовые данные. — М.:
Техносфера, 2013. — 632 c.
4. Физические методы исследования и их практическое применение в
химическом анализе : издание второе, переработанное и дополненное.
Учебное пособие / Н.Г. Ярышев и др. — М.: Прометей, 2015. — 196 c.
4.
ВВЕДЕНИЕАнализ – это способ научного познания сущности целого путем его
разложения на составные части.
Анализ вещества состоит в выявлении того, из каких компонентов
(атомов, ионов, молекул) состоит вещество, каково их количественное
содержание, как пространственно распределены они внутри тела.
Метод анализа вещества – совокупность принципов, положенных в
основу анализа вещества.
Методика анализа вещества – описание последовательности действий
по проведению анализа вещества.
5.
1. КЛАССИФИКАЦИЯ И ХАРАКТЕРИСТИКИМЕТОДОВ АНАЛИЗА ВЕЩЕСТВА
1.1. Классификация методов анализа вещества
по природе аналитического сигнала
Аналитический сигнал – любое проявление физико-химических свойств
вещества, несущее информацию о его составе, количестве или структуре.
Появление аналитического сигнала должно надежно фиксироваться, а
его величина поддаваться измерению.
6.
Химическиеметоды
Физико-химические
методы
Физические
методы
Основаны на химических
реакциях между
определяемым веществом и
веществом реагентом:
• кислотно-основные;
• окислительновосстановительные;
• комплексообразование;
• осаждение – растворение;
• экстракция.
Основаны на измерении
аналитического сигнала,
возникающего с участием
внешних (валентных)
электронов.
Аналитический сигнал
связан с природой и
концентрацией вещества,
его фазовым состоянием.
Основаны на измерении
аналитического сигнала,
возникающего с участием
внутренних электронов и
ядер атомов.
Агрегатное состояние
вещества и его химическая
форма в большинстве
случаев роли не играют.
Виды
индикаторные методы;
гравиметрия;
титриметрия
Виды
электрохимические
методы;
оптическая
спектроскопия;
хроматография
Виды
масс-спектрометрия;
радиоспектроскопия;
рентгеноскопия;
микроскопические
методы;
ядерно-физические
методы
7.
1.2. Классификация методов анализа веществапо назначению анализа
Качественный анализ устанавливает из каких компонентов состоит
анализируемый объект.
Качественный анализ устанавливает количественное содержание этих
компонентов либо одного из них.
Аналитический сигнал, не зависящий от количества устанавливаемого
компонента называется интенсивным, а зависящий – экстенсивным.
Для проведения количественного анализа требуется знать зависимость
экстенсивного аналитического сигнала A от количества (концентрации)
анализируемого компонента C:
A f (C ).
8.
Метод градуировочного графика1. Берут серию стандартных образцов
с
известными
концентрациями
определяемого компонента Ci.
2. Получают аналитический сигнал от
стандартных образцов Ai
3. Строят градуировочный график
Наиболее удобен линейный график
N Ci Ai Ci Ai
,
k
2
2
N Ci Ci
Ai k Ci
.
a
N
Тогда
Cx
Ax a
.
k
Нелинейный график стараются
привести к линейному виду:
A kC n
после логарифмирования
ln A ln k n ln C
9.
Метод сравненияИспользуется стандартный образец с близкой концентрацией
определяемого компонента. Считая зависимость аналитического сигнала
от концентрации прямой пропорциональностью получим
Cx Cст
Ax
.
Aст
Метод ограничивающих образцов
Используются два стандартных образца с известными концентрациями
С1 и С2, такими что аналитический сигнал от исследуемого образца Ах
попадает в диапазон между аналитическими сигналами от стандартных
образцов А1 и А2.Тогда
A1 kC1 a;
A2 kC2 a;
A kC a;
x
x
C x C1 C2 C1
Ax A1
A2 A1
10.
Метод добавок1. Исследуемый образец делят на две части.
2. В одну из них добавляют известное количество определяемого
компонента, в результате чего его концентрация увеличивается на С0.
3. Определяют аналитический сигнал от образца без добавки Ах .
4. Определяют аналитический сигнал от образца с добавкой А0.
5. Находят концентрацию
Ax kCx
Ax
C
C
.
x
0
A0 Ax
A0 k (Cx C0 ) Ax kC0
11.
Назначение анализапо типу определяемых компонентов
Качественный
количественный
Количественный
анализ
элементный
функциональный
Определение из каких
химических элементов
состоит образец. В какие
вещества входят найденные
элементы в этом виде
анализа не определяется.
Определение присутствия в
исследуемом образце
определенных структурных
элементов молекул –
функциональных групп
(карбоксильной,
гидроксильной и др.). То
есть определяется наличие
в исследуемом образце
соединений определенного
класса – фенолов,
альдегидов и т.п.
Разновидность – изотопный
анализ, в котором
определяется в каком
соотношении находятся
изотопы данного элемента в
образце.
молекулярный
Определение из каких
химических соединений
состоит образец
12.
Структурный анализ1. Анализ молекулярной структуры, в том числе пространственной
конфигурации молекулы.
2. Кристаллографический анализ, в котором устанавливается взаимное
расположение атомов, ионов или молекул.
4. Фазовый анализ, в котором устанавливается распределение фаз.
5. Анализ структуры поверхности твердого тела, как профиля
поверхности, так и распределения по поверхности определенных
компонентов (химических элементов или соединений)
Имиджинг – методы визуализации результатов структурного анализа
13.
1.3. Основные характеристикиметодов анализа вещества
1. Чувствительность
(предел обнаружения) – это наименьшее
количество определяемого компонента,
которое
может
быть
надежно
зафиксировано при использовании данного
метода.
Абсолютная чувствительность
Минимальное количество определяемого
компонента в исследуемом образце (пробе)
в абсолютных величинах – масса в граммах
или парциальное давление в паскалях (для
газообразной пробы).
14.
Относительная чувствительностьМинимальное количество определяемого компонента в пробе в
относительных величинах, то есть концентрацию в процентах (%) или
промилле (‰).
При анализе микропримесей применяются также следующие единицы:
– ppm (parts per million – миллионная доля, 10-4 %),
– ppb (parts per billion – миллиардная доля, 10-7 %),
– ppt (parts per trillion – триллионная доля, 10-10 %).
2. Селективность (избирательность)
Способность обнаружить определяемый компонент в пробе без помех со
стороны других компонентов.
3. Разрешающая способность
Способность разрешить компоненты со сходным аналитическим сигналом
при их одновременной регистрации.
15.
4. СпецифичностьСпособность метода устанавливать присутствие и/или количество только
одного компонента в многокомпонентной пробе. Для специфичных методов
анализа совокупность всех компонентов пробы, кроме определяемого,
называют матрицей.
5. Универсальность
Способность метода устанавливать присутствие и/или количество множества
компонентов в одной пробе.
6. Точность
Комплексная
характеристика,
учитывающая
правильность
и
воспроизводимость результатов анализа. Правильность (систематическая
погрешность) анализа показывает отклонение результатов анализа от
истинного
содержания
определяемого
компонента
в
пробе,
а
воспроизводимость (случайная погрешность) – разброс данных при
проведении нескольких анализов одного образца. Точность обычно
характеризуют относительной погрешностью в процентах.
16.
7. ЭкспрессностьОпределяется затратами времени на проведение анализа. При определении
экспрессности необходимо учитывать время, затрачиваемое на подготовку
пробы.
8. Трудоемкость
Определяется сложностью методики его проведения, прежде всего большим
числом операций, производимых вручную. В связи с этим для массовых
однородных анализов большое значение приобретает возможность
автоматизации анализа.
9. Стоимость
Определяется стоимостью оборудования, реактивов, рабочего времени
аналитика и иногда стоимостью самой анализируемой пробы.
17.
Дополнительные характеристикиАнализ, в котором происходит разрушение образца, называется
деструктивным, а в котором не происходит разрушения –
недеструктивным.
В локальном анализе состава поверхности требуется различать близко
расположенные участи образца. Такой анализ характеризуется
пространственным разрешением, которое определяется диаметром и
глубиной области, разрушаемой при анализе.
В дистанционном анализе исследование производится на расстоянии в
отсутствии непосредственного контакта с изучаемым объектом.
18.
2. ЭЛЕКТРОХИМИЧЕСКИЕМЕТОДЫ АНАЛИЗА ВЕЩЕСТВА
2.1. Общие принципы и классификация
электрохимических методов анализа вещества
Старейшие методы инструментального анализа
1807 – Хэмфри Дэви путем электролиза открыл калий, натрий барий и
кальций, позднее еще стронций, магний и литий
1830 – Анри Беккерель разработал электрогравиметрический метод
1839 – в институте Освальда в Лейпциге (Германия) впервые было
проведено потенциометрическое титрование
Электрохимические методы анализа основаны на использовании
процессов, протекающих на поверхности электродов и межэлектродном
пространстве электролитической ячейки.
Любой
электрический
параметр
(потенциал,
сила
тока,
электропроводность и др.), величина которого зависит от концентрации
определяемого компонента, может служить аналитическим сигналом.
19.
Классификация электрохимических методовпо виду аналитического сигнала
Потенциометрия
основана на измерении
безтокового равновесного
потенциала электрода
Электрогравиметрия
основана на измерении массы
вещества, выделившегося при
электролизе
Вольтамперометрия (полярография)
основана на получении вольтамперных
(поляризационных) характеристик
Кондуктометрия
основана на измерении
электропроводности
исследуемого раствора
Кулонометрия
основанную на измерении количества
электричества, необходимого полного
превращения исследуемого вещества
Прямые методы
используется непосредственная зависимость аналитического
сигнала от концентрации определяемого компонента
Косвенные методы
аналитический сигнал используется для нахождения конечной
точки титрования
20.
Электрохимическая ячейкаОкислительно-восстановительная реакция
Red1 Ox 2 Ox1 Red 2 ,
Пример
Fe2 Ce4 Fe3 Ce3
Реакцию можно представить как сумму двух полуреакций
Ce4 e Ce3 реакция окислителя
Fe2 Fe3 e реакция восстановителя
21.
Электрохимическая ячейкаЭлектрохимические ячейки могут работать в двух режимах:
1. гальванический элемент – в электрохимической ячейке в результате
самопроизвольной химической реакции возникает электрический ток,
измерительное устройство во внешней цепи ограничивается пассивной
ролью;
2. электролитическая ячейка
– к электрохимической ячейке
подсоединяется
источник
напряжения,
регулируя
приложенное
напряжение можно изменять интенсивность протекания реакции и даже
изменять ее направление.
В электрохимической ячейке используется два типа электродов
1. Индикаторный (измерительным) электрод должен реагировать на
изменение состава исследуемого раствора. В зависимости от природы
аналитического сигнала индикаторные растворы различаются по
конструкции.
2. Электрод сравнения должен обладать постоянным, не зависящим от
состава раствора и величины протекающего тока потенциалом и не влиять
на состав анализируемого раствора.
22.
Электроды сравненияСтандартный водородный электрод (СВЭ)
Платиновый электрод, покрытый для увеличения
площади поверхности мелкодисперсной платиной,
погружен в раствор серной или соляной кислоты с
концентрацией ионов водорода H+ равной 1 моль/л.
Через эту систему пропускают газообразный
водород H2 так, чтобы давление над раствором
составляло 1 атм при температуре 298 К.
Избыточный водород выходит через водяной
затвор.
Под каталитическим влиянием платины на
электроде осуществляется обратимый переход
H 2 2 H 2e
Значение потенциала СВЭ принимают за ноль и
все измерения проводят относительно него.
23.
Электроды сравненияХлоридсеребрянный электрод
Хлоридсеребрянный электрод представляет собой
серебрянную Ag проволочку, погруженную в
раствор хлорида калия KCl, насыщенный хлоридом
серебра AgCl (4).
На электроде идет обратимая полуреация
AgCl e Ag Cl
Контакт с соляным мостиком из насыщенного
раствора KCl (2), который вводится через отверстие
(5) осуществляется через малое отверстие (3).
Контакт соляного мостика с исследуемым
раствором осуществляется с помощью асбестового
волокна (1).
Потенциал
хлоридсеребрянного
электрода
относительно СВЭ составляет 0,222 В.
24.
Электроды сравненияКаломельный электрод
Каломельный электрод имеет аналогичную
конструкцию,
но
используется
платиновая
проволочка Pt, погруженная в пасту (6) из
металлической ртути Hg и каломели Hg2Cl2.
На электроде идет обратимая полуреация
Hg 2Cl2 2e 2 Hg 2Cl
Потенциал
каломельного
электрода
относительно СВЭ составляет 0,247 В.
25.
2.2. Потенциометрия2.2.1. Общие принципы
Потенциометрический метод анализа вещества основан на измерении
равновесного потенциала индикаторного электрода электрохимической
ячейки, работающей в режиме гальванического элемента.
В качестве измерительного устройства применяют высокоомный
прецизионный вольтметр.
Равновесный окислительно-восстановительный потенциал E зависит от
температуры и определяется уравнением Нернста:
E E0
RT
a
ln ок ,
nF aвост
Е0 – стандартный потенциал электрода сравнения,
F = 96500 Кл/моль,
n – число электронов принимающее участие в электродной реакции,
аок и авост – активности окисленной и восстановленной форм вещества
соответственно.
26.
Активность иона прямо пропорциональна концентрации ионовa c
Для сильно разведенных растворов можно считать активность равной
концентрации.
Учитывая, что измерения проводятся обычно в стандартных условиях
(25 °С) и на практике удобнее использовать десятичные логарифмы,
подставим константы и получим уравнение Нернста в следующем виде:
E E0
0,059
a
lg ок .
n
aвост
Так как электрод сравнения находится в растворе с постоянным
значением активности ионов, то потенциал индикаторного электрода
будет определяться только активностью ионов исследуемого раствора:
E const s lg a const s pA,
0,059
s
n
pA lg a
– крутизна электродной реакции,
– показатель активности соответствующего иона.
27.
2.2.2. Индикаторные электродыМембранные
Металлические
(Ионноселективные)
Индикаторные
электроды
Выбор индикаторного электрода определяется
методикой анализа,
видом определяемого иона,
параметрами анализируемой среды,
режимом измерений,
точностью измерений,
ограничениями со стороны измерительных приборов
Активные
из металла (Ag, Pb, Cu, Cd) погруженного в раствор,
содержащий его ионы
Инертные
из инертного металла (Pt, Au), погруженного в
раствор, содержащий как восстановленную (Red),
так и окисленную форму вещества (Ox)
ионоселективная
мембрана – тонкая
жидкая или твердая
пленка с
преимущественной
проницаемостью
для одного типа
ионов.
пористые мембраны механически не
пропускающие крупные ионы за счет размера пор
мембраны, в материале которых целевое
соединение растворяется
ионообменный механизм в матрицах, состоящих из
ионитов (обычно синтетические органические
смолы, имеющие кислотные или щелочные группы)
28.
Основные характеристикииндикаторных электродов
Электродная функция – зависимость E от pA
Интервал выполнения электродной функции
– это область концентраций, в которой
зависимость E от
pA имеет линейный
(нернстовский) вид.
И.в.э.ф.
Предел
обнаружения
–
минимальная
определяемая
концентрация,
которая
определяется точкой перегиба электродной
функции.
Селективность электрода относительно иона А в присутствии иона В
определяется величиной КА,В. Для этого снимают электродную функцию
при постоянной концентрации иона В и определяют точку, при которой Е
перестает зависеть от рА. Тогда K A,B aA / aB
Время отклика ионоселективного электрода определяется временем
установления равновесия.
29.
Стеклянный электродПервый ионоселективный электродом для измерения рН.
1 –маленький шарик из стекла, состоящего из 72% оксида
кремния, 22% оксида натрия и 6% оксида кальция,
толщиной 0,06–0,1 мм.
2 – раствор соляной кислоты, насыщенный хлоридом
калия или натрия.
3 – токоотводом является серебряная проволока, покрытая
хлоридом серебра.
4 – защитная трубка.
Чувствительностью к ионам водорода обладает только
вымоченное (гидратизированное) стекло, в котором все
пустоты в структуре стекла заполнены ионами водорода,
вытесняющими ионы натрия. В результате на границе
стекло – кислота устанавливается равновесие
Na (стекло) H ( p p) Na ( р р) H (стекло)
30.
Другие типы электродовЭлектроды с твердыми (кристаллическими) мембранами. Мембраны
этого класса электродов изготавливаются из кристаллических пластинок,
прессованных поликристаллических таблеток или таблеток из электродноактивных кристаллов в инертной матрице (силиконовая смола).
Селективная проницаемость мембран обусловлена способностью иона с
наименьшим радиусом перемещаться по вакансиям решетки.
Газочувствительные электроды. Этот тип ионоселективных электродов
состоит из индикаторного электрода и электрода сравнения, погруженных в
промежуточный раствор, который отделен от анализируемого раствора
тонкой мембраной из тефлона или другого газопроницаемого материала.
Определяемый газ диффундирует через мембрану и вызывает изменение
какого-либо параметра промежуточного раствора, например рН, которое
фиксируется индикаторным электродом.
Ферментные электроды представляют собой ионоселективный электрод,
покрытый пленкой содержащий фермент. Фермент катализирует реакцию
определяемого соединения, как правило органического, в которой
образуются ионы, фиксирующиеся ионоселективным электродом.
31.
2.2.3. ИонометрияИонометрия представляет собой прямой потенциометрический метод,
в котором концентрация определяемого компонента находится
непосредственно по потенциалу ионоселективного электрода.
Достоинства:
Простота
Экспрессность
Возможность проведения в полевых условиях
Показатель активности иона
pA lg a
const E
.
s
Количественный анализ
1. Калибровка ионометра с помощью раствора с известным рА
2. Метод градуировочного графика
3. Метод добавок – наиболее оптимальный
32.
Метод добавок в ионометрииЗависимость концентрации от аналитического сигнала нелинейная!
Измерим первоначально потенциал E1 ионоселективного электрода от
анализируемого раствора
lg cA
const E1
.
s
Далее добавим объем Vст стандартного раствора с известной
концентрацией определяемого иона cст в объем VА анализируемого раствора
и измерим потенциал Е2.
c AVA cстVст const E2
lg
.
VA Vст
s
Решая систему уравнений получаем выражение для концентрации
определяемого иона в анализируемом растворе
Vст
c A cст
10
VA Vст
E2 E1
s
VA
VA Vст
1
33.
2.2.4. Потенциометрическое титрованиеПотенциометрическое титрование представляет собой косвенный
потенциометрический метод, в котором потенциал индикаторного
электрода используется для нахождения конечной точки титрования.
Достоинства
Легко поддается автоматизации.
Не существует искажения сигнала за счет
диффузионного потенциала, так как его
воздействие приводит к смещению кривой
титрования вверх или вниз по оси
потенциала, но не влияет на положение точки
перегиба кривой титрования.
Не требуется знать коэффициент активности
ионов.
Возможно
одновременное
определение
нескольких компонентов смеси, поскольку в
этом случае кривая титрования будет иметь
несколько точек перегиба, каждая из которых
соответствует отдельному компоненту
34.
2.3. Вольтамперометрия2.3.1. Общие принципы
Вольтамперометрией называется потенциометрический метод анализа
вещества, основанный на изучении вольтамперных характеристик,
которые получаются, если к электрохимической ячейке подключить
внешний источник ЭДС и, постепенно повышая напряжение, фиксировать
силу тока.
Метод был предложен в 1922 г. чешским ученым Ярославом Гейровским
и назван им полярографией.
В 1959 г. Гейровскому была присуждена Нобелевская премия
35.
Поляризация электродаПоляризация электрода – отклонение
потенциала электрода от равновесного при
протекании
через
электрохимическую
ячейку электрического тока.
кинетическая
поляризация
–
ограничение
скорости
передачи
электронов на границе электрод –
электролит, определяющейся скоростью
протекания
окислительновосстановительной реакции
концентрационная
поляризация
–
обеднение
приповерхностного
слоя
электроактивным
веществом,
расходующимся при этой реакции, из-за
медленной диффузии из раствора.
36.
Вольтамперометрические ячейкиДвухэлектродная ячейка состоит из
электрода сравнения ЭС и индикаторного,
обычно называемого рабочим электродом
РЭ, погруженных в исследуемый раствор.
Для уменьшения поляризации электрода
сравнения его площадь должна быть много
больше площади рабочего электрода.
В трехэлектродной ячейке добавляется
вспомогательный
электрод
ВЭ,
выполняющий функцию токоприемника и
имеющий большую площадь. В этом случае
электрод сравнения используется только для
измерения потенциала и требования к его
сопротивлению и площади снимаются.
37.
2.3.2. Классическая полярографияКлассическим
вольтамперометрическим
методом является метод ртутного капающего
электрода, разработанный Гейровским.
Двухэлектродная ячейка
ЭС – слой ртути на дне
РЭ – сосуд с ртутью, которая мелкими каплями
вытекает из него через тонкий стеклянный
капилляр
Неудобство работы с ртутью компенсируется
высокой
поляризацией
капельного
микроэлектрода и постоянным обновлением его
поверхности.
38.
ПолярограммаПлоярограмма – зависимость тока от
потенциала рабочего электрода.
На участке 1 – остаточный ток.
При достижении потенциала выделения на
поверхности ртутной капли начинается
восстановление
ионов
металла
с
образованием амальгамы
Men ne Hg Me Hg
Ток возрастает и на участке 2 достигает предельного значения,
определяющегося скоростью диффузии ионов.
Разность между предельным и остаточным током носит название
диффузионного тока Id.
Потенциал Е1/2 , соответствующий середине растущего участка называется
потенциалом полуволны.
39.
Количественный и качественный анализКоличественный
полярографический
уравнении Ильковича
анализ
основан
на
I d const nD1/2m2/3t1/6c kc.
n – число электронов, участвующих в реакции,
D – коэффициент диффузии иона в растворе,
m – массовый расход ртути,
t – временя образования капли,
c – концентрация ионов
Качественный полярографический анализ основан на потенциале
полуволны
E1/2 E 0
RT D '
ln ,
nF D
D – коэффициент диффузии иона в растворе,
D’ – коэффициент диффузии иона в амальгаме
40.
Достоинства классической полярографииВозможность
одновременного
определения нескольких веществ
потенциалы полуволн которых
отличаются на 100 мВ и больше.
Легко поддается автоматизации,
для чего на электрохимическую
ячейку
подается
линейно
возрастающее
во
времени
напряжение.
Достаточно высокая экспрессность
анализа.
Точность метода также достаточно
высокая:
для
растворов
концентрации порядка 10-4 моль/л
погрешность составляем 2 %, а для
более разбавленных – 5 %.
41.
2.3.3. Дифференциальная полярографияВ дифференциальной полярография используются дифференциальные
поляризационные кривые
dI
f E .
dE
Уравнение поляризационной кривой имеет вид
Выразим ток I:
E I E1/2
RT I d I
ln
.
nF
I
Id
Id
I E
.
E
E
E
E
1/2
1/2
1 exp
nF 1 exp
s
RT
Продифференцируем это выражение по Е:
E E1/2
exp
dI I d
s
.
2
dE s
E E1/2
1
exp
s
42.
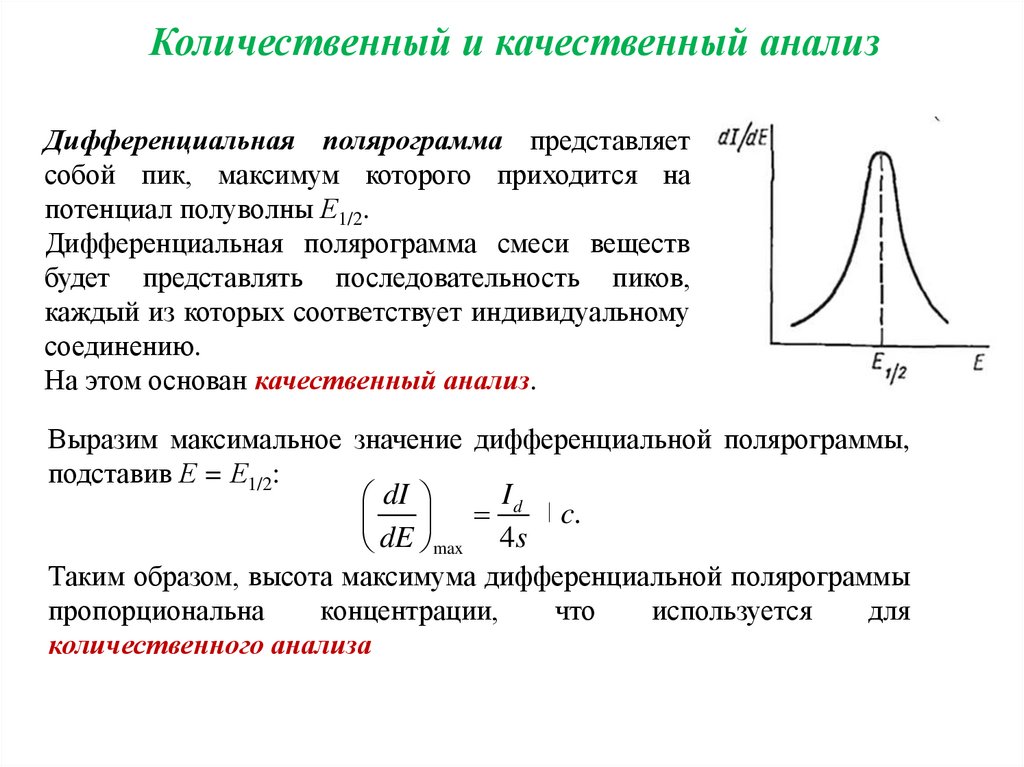
Количественный и качественный анализДифференциальная полярограмма представляет
собой пик, максимум которого приходится на
потенциал полуволны Е1/2.
Дифференциальная полярограмма смеси веществ
будет представлять последовательность пиков,
каждый из которых соответствует индивидуальному
соединению.
На этом основан качественный анализ.
Выразим максимальное значение дифференциальной полярограммы,
подставив Е = Е1/2:
Id
dI
dE max 4s
c.
Таким образом, высота максимума дифференциальной полярограммы
пропорциональна
концентрации,
что
используется
для
количественного анализа
43.
Аппаратное дифференцированиеНа линейно увеличивающееся напряжение через
равномерные
промежутки
времени,
определяющиеся временем жизни капли, подают
одинаковые добавочные импульсы ΔЕ.
Ток измеряют дважды: перед подачей импульса и
в конце него.
Зависимость разности этих токов от величины
линейно
растущего
напряжения
дает
дифференциальную полярограмму.
Достоинства
Более высокая разрешающая способность
Более высокая точность
44.
2.3.4. Амперометрическое титрованиеАмперометрическое
титрование
является
косвенным
вольтамперометрическим методом, в котором предельный
диффузионный ток используется для нахождения конечной точки
титрования.
После каждого добавления порции титранта проводят измерение тока
электрохимической ячейки при напряжении, соответствующем
предельному току. Когда определяемое вещество полностью
израсходовано на реакцию с титрантом, то фиксируется только
остаточный ток. В результате получается кривая амперометрического
титрования, состоящая из двух линейных участков, на пересечении
которых и находится конечная точка титрования.
45.
ДостоинстваВ качестве индикаторных электродов используются инертные
электроды, такие как платиновый или графитовый вращающиеся
электроды.
Более универсальный метод – если определяемое вещество не
является
электроактивным,
то
можно
использовать
электроактивный титрант либо продукт реакции определяемого
вещества с титрантом.
Селективность метода определяется подбором титранта.
Применение
для определения металлов в рудах и иных природных и
технических объектах, а также многих органических соединений.
анализ плазмы крови и других биологических материалов.
для комбинации с другими методами (например, в сочетании с
ионной хроматографией возможно определение сахаров во
фруктовых соках на уровне наномолярных концентраций).
46.
2.4. КондуктометрияКондуктометрические методы анализа основаны
электропроводности исследуемых растворов.
на
измерении
Электропроводность прямо пропорционально площади поверхности S и
обратна пропорциональна расстоянию между электродами l:
S
l
σ – удельная проводимость раствора (См/м),
l / S – величина, постоянная для данной
электрохимической ячейки, определяющаяся ее
конструкцией.
Факторы, влияющие на удельную проводимость:
• с ростом концентрации увеличивается число
ионов, которые переносят заряд.
• с
ростом
концентрации
возрастает
взаимодействие между ионами, что приводит к
уменьшению подвижности ионов.
47.
Эквивалентная электрическая проводимость λ (См·м2/моль) –проводимость слоя раствора, находящегося между параллельными
плоскими электродами, находящимися на расстоянии 1 м и имеющими
такую площадь, чтобы между ними поместилось вещество,
электрохимически эквивалентное 1 молю ионов водорода.
c
с – концентрация раствора (моль/м3)
Эквивалентная электрическая проводимость зависит λ от концентрации.
С уменьшением концентрации эквивалентная электропроводность
возрастает, стремясь к некоторой предельной величине.
Если в растворе присутствует несколько видов ионов, то удельная
электропроводность будет равна
i ci ,
i
48.
Аппаратура для кондуктометрииМостик Уитстона
В
соответствии
с
правилами
Кирхгофа
сопротивление ячейки Rx можно рассчитать по
формуле
R
l
Rx RЭ 2 RЭ 2 ,
R1
l1
RЭ – эталонное сопротивление,
R1 и R2 – сопротивления плеч реохорда,
l1 и l2 – длины плеч реохорда.
Удельная электропроводность
l1
l
,
Rx RЭ l2 RЭ 1 l
Реохорд может быть проградуирован в значениях удельной
проводимости или непосредственно в значениях концентрации с
использованием стандартных растворов.
Измерение сопротивления легко поддается автоматизации.
49.
Прямая кондуктометрияПрямой кондуктометрии основаны на том, что в области разбавленных и
умеренно концентрированных растворов удельная электропроводность
растет с увеличением концентрации.
Прямая кондуктометрия обладает малой селективностью.
Прямая кондуктометрия используются в установках по дистиляции и
деминерализации воды и качестве детекторов в жидкостной
хроматографии.
50.
Кондуктометрическое титрованиеКондуктометрическое титрование является косвенным методом,
основанным на нахождении конечной точки титрования по изменению
проводимости раствора.
H
Cl Na OH Na Cl H 2O
В отличие от прямых кондуктометрических методов в этом случае не
требуется знание постоянной ячейки θ.
Кондуктометрическое титрование применяется для высокоточных
измерений очень разбавленных растворов, для анализа окрашенных или
мутных растворов.
51.
2.5. Электрогравиметрия и кулонометрияЭлектрогравиметрия и кулонометрия основания на явлении электролиза.
Законы Фарадея
1. Масса вещества m выделившегося на электроде в процессе электролиза
прямо пропорциональна прошедшему через этот электрод количеству
электричества Q:
m kQ,
где k – электрохимический эквивалент вещества.
2.
Электрохимический эквивалент вещества прямо пропорционален
эквивалентной массе этого вещества μэ: k э ,
F
где F = eNА = 96485 Кл/моль – постоянная Фарадея F.
Эквивалентная масса вещества – масса вещества, эквивалентная одному
молю катионов водорода в рассматриваемой реакции – для атомарного
вещества, равна молярной массе μ, деленной на число электронов,
участвующих в электродной реакции n:
э .
n
52.
ЭлектрогравиметрияСтарейший электрохимический метод анализа.
В настоящее время он применяется только для анализа медных сплавов,
содержащих висмут, свинец, кадмий, цинк и олово. В отношении этих
элементов электрогравиметрия превосходит другие электрохимические
методы по точности и воспроизводимости, а также не требует
дорогостоящего оборудования.
В этом методе производится измерение массы вещества, выделившегося
на рабочем электроде, который должен быть предварительно взвешен.
В качестве рабочего электрода чаще всего используется платиновая сетка.
При использовании потенциостата, поддерживающего
разность потенциалов между электродами, возможно
определение компонентов смеси.
постоянную
селективное
53.
Прямая кулонометрияПрямая
кулонометрия
основана
на
измерении
количества
электричества, прошедшего через электролитическую ячейку при
электролизе.
Гальваностатическая кулонометрия – при постоянном токе количество
электричества, прошедшего через ячейку, пропорционально времени,
затраченному на электролиз.
Потенциостатическая кулонометрия – при постоянном потенциале
рабочего электрода сила тока будет экспоненциально спадать со временем
и для нахождения количества электричества, прошедшего через ячейку,
требуется применять интеграторы.
Достоинства
Безэталонный, чувствительный и точный метод, позволяющий определять
нанограммовые количества вещества с погрешностью порядка долей
процента.
Метод легко автоматизируется и широко используется для определения в
пробах урана, нептуния и плутония
54.
Кулонометрическое титрованиеЭтот косвенный кулонометрический метод, в котором используется
электрогенерированный титрант, образующийся на генераторным
электроде в ходе электрохимической реакции.
Генерация осуществляется при постоянном токе либо в самой ячейке с
исследуемым раствором, либо в отдельной генераторной ячейке с
последующим вводом в аналитическую ячейку.
Количество определяемого вещества находится по количеству
электричества, затраченного на генерацию титранта.
Для определения конечной точки титрования используются обычно
потенциометрический или амперометрический методы.
Достоинства
Кулонометрическое титрование легко поддается автоматизации,
поскольку в нем отсутствует механическая бюретка.
Дозирование титранта более точное – до тысячных долей процента.
Не нужно готовить и хранить титрант.





















































 chemistry
chemistry








