Similar presentations:
Твердые тела
1.
3. Твердые телаТвердые тела характеризуются
наличием значительных сил
межмолекулярного взаимодействия
и сохраняют постоянными не только
свой объем, но и форму.
1
2. Виды твёрдых тел
Аморфные тела.Полимеры.
Композиты.
Кристаллические тела.
3.
Аморфные тела- твердые тела, неимеющие строгой повторяемости во
всех направлениях.
Свойства аморфных тел:
1. Изотропия.
2. При низких температурах имеют
свойства твердых тел, при нагреваниисвойства жидкостей.
3. Не имеют определенной температуры
плавления.
4. Неустойчивое состояние: со временем
переходит в кристаллическое.
4.
Полимеры- вещества, молекулы которых
состоят из множества
одинаковых частей (мономеров),
соединенных в длинные цепи.
Хлопок, дерево, кожа,
шерсть, полиэтилен,
полистирол.
5.
Композиты- состоят из матрицы и
наполнителей.
Железобетон - сочетание бетона и стальной
арматуры.
Стеклопластик.
Железографит.
Кости человека и животных (коллаген и
минеральные вещества).
6.
Кристаллические тела можноразделить на две группы:
монокристаллы и поликристаллы.
Монокристаллы — твердые тела,
частицы которых образуют единую
кристаллическую решетку.
7. Свойства кристаллов
Упорядоченное расположениечастиц(кристаллическая решетка)
Анизотропия(монокристаллы).
Изотропия( поликристаллы)
Определенная температура плавления
Полиморфизм
8.
Типы кристаллических твердых телВ зависимости от вида частиц, расположенных
в узлах кристаллической решетки различают
четыре вида кристаллов:
ионные,
атомные,
металлические
молекулярные.
8
9.
Ионные кристаллы.В узлах кристаллической
решетки располагаются
ионы противоположного
знака.
Щелочной металл – NaCl.
Решетка представляет собой две одинаковые
гранецентрированные кубические решетки, вложенные
друг в друга.
В узлах одной из этих решеток находятся ионы Na+, в
узлах другой - ионы Cl– .
Основные свойства – высокая температура плавления,
хрупкость.
9
10.
Кристаллическаярешетка алмаза и
графита
Атомные кристаллы.
В узлах кристаллической
решетки располагаются
нейтральные атомы.
Атомы удерживаются в узлах
решетки ковалентными
связями.
Атомными кристаллами
являются алмаз, графит,
кремний.
Основные свойства – очень
высокая температура плавления,
большая твердость.
10
11.
Металлические кристаллы.В узлах кристаллической решетки располагаются
положительные ионы металла.
Между положительными ионами хаотически
движутся
«свободные»
электроны,
которые
обеспечивают электропроводность металлов.
При образовании кристаллической решетки
валентные электроны отделяются от атомов и
коллективизируются:
они
принадлежат
всему
кристаллу в целом.
Основные свойства – высокая электропроводность и
теплопроводность.
11
12.
Молекулярные кристаллы.В
узлах кристаллической решетки располагаются
нейтральные
молекулы
вещества,
силы
взаимодействия
между
которыми
(ван-дерваальсовские
силы)
обусловлены
смещением
электронов в электронных оболочках атомов.
Молекулярными кристаллами являются большинство
органических соединений, например: парафин,
нафталин, спирт, лед, сухой лед (твердая
углекислота) и т.д.
Основные свойства – низкая температура плавления,
низкая твердость.
12
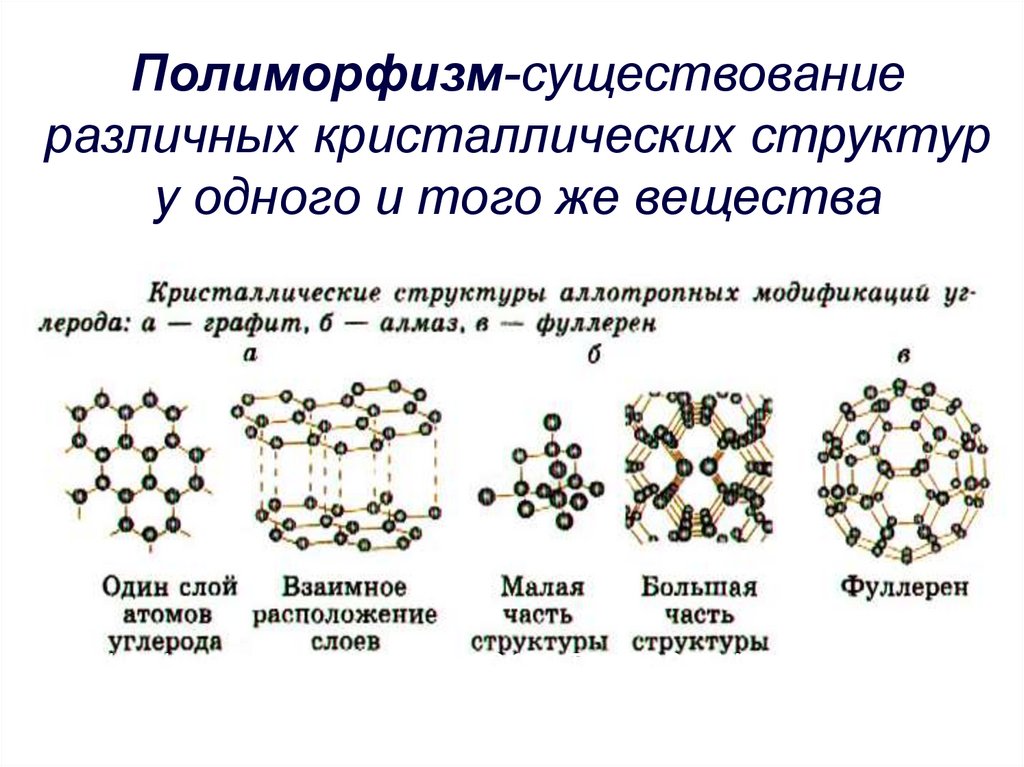
13. Полиморфизм-существование различных кристаллических структур у одного и того же вещества
Основные свойства – высокая температура плавления,хрупкость.
14.
Дефекты в кристаллахУ реальных кристаллов всегда имеются отклонения от
упорядоченного расположения частиц в узлах решетки.
Эти отклонения называются дефектами кристаллической
решетки.
Дефекты делятся на макроскопические (трещины,
поры, макроскопические включения) и микроскопические,
обусловленные микроскопическими отклонениями.
Микродефекты делятся на точечные и линейные.
Точечные дефекты нарушают лишь ближний порядок
в кристаллах, не затрагивая дальнего порядка.
Линейные дефекты нарушают дальний порядок.
14
15.
Точечные дефекты бывают трех типов:1) вакансии – отсутствие атома в узле
кристаллической решетки.
2) междоузельный атом,
внедрившийся в междоузельное
пространство;
3) примесный атом — атом примеси,
либо замещающий атом основного
вещества в кристаллической решетке.
15
16.
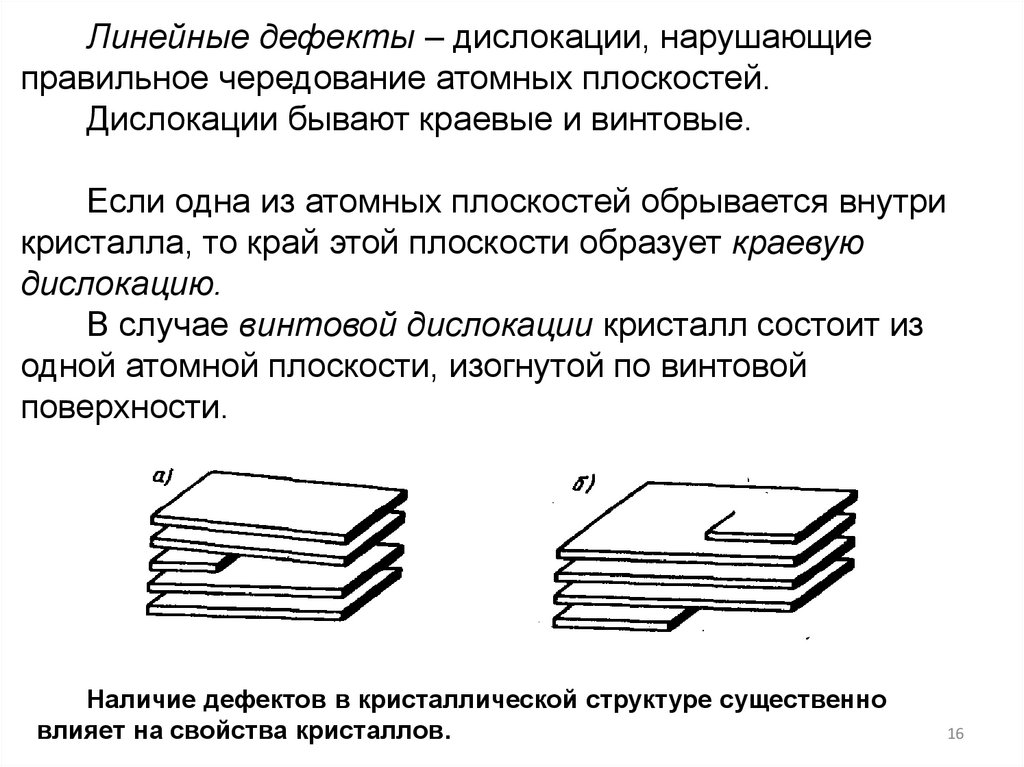
Линейные дефекты – дислокации, нарушающиеправильное чередование атомных плоскостей.
Дислокации бывают краевые и винтовые.
Если одна из атомных плоскостей обрывается внутри
кристалла, то край этой плоскости образует краевую
дислокацию.
В случае винтовой дислокации кристалл состоит из
одной атомной плоскости, изогнутой по винтовой
поверхности.
Наличие дефектов в кристаллической структуре существенно
влияет на свойства кристаллов.
16
17.
Теплоемкость твердых телВ узлах кристаллической решетки частицы
колеблются около своих положений равновесия в трех
взаимно перпендикулярных направлениях.
Каждой составляющей кристаллическую решетку
частице приписывается три колебательных степени
свободы, каждая из которых обладает энергией kT.
Внутренняя энергия моля твердого тела:
Um 3NAkT 3RT .
NA — постоянная Авогадро.
R — молярная газовая постоянная.
17
18.
Молярная теплоемкость твердого тела:dU m
Дж
CV
3R 25
dT
моль К
- закон Дюлонга и
Пти.
т. е. молярная (атомная) теплоемкость химически
простых тел в кристаллическом состоянии
одинакова и не зависит от температуры.
Молярная теплоемкость твердых химических соединений:
Дж
CV 3nR 25n
,
моль К
n — число атомов в молекуле.
т. е. равна сумме атомных теплоемкостей элементов, составляющих
это соединение.
18
















 chemistry
chemistry








