Similar presentations:
Реальные газы, жидкости и твердые тела
1.
ФизикаРеальные газы, жидкости и твердые тела
1
2.
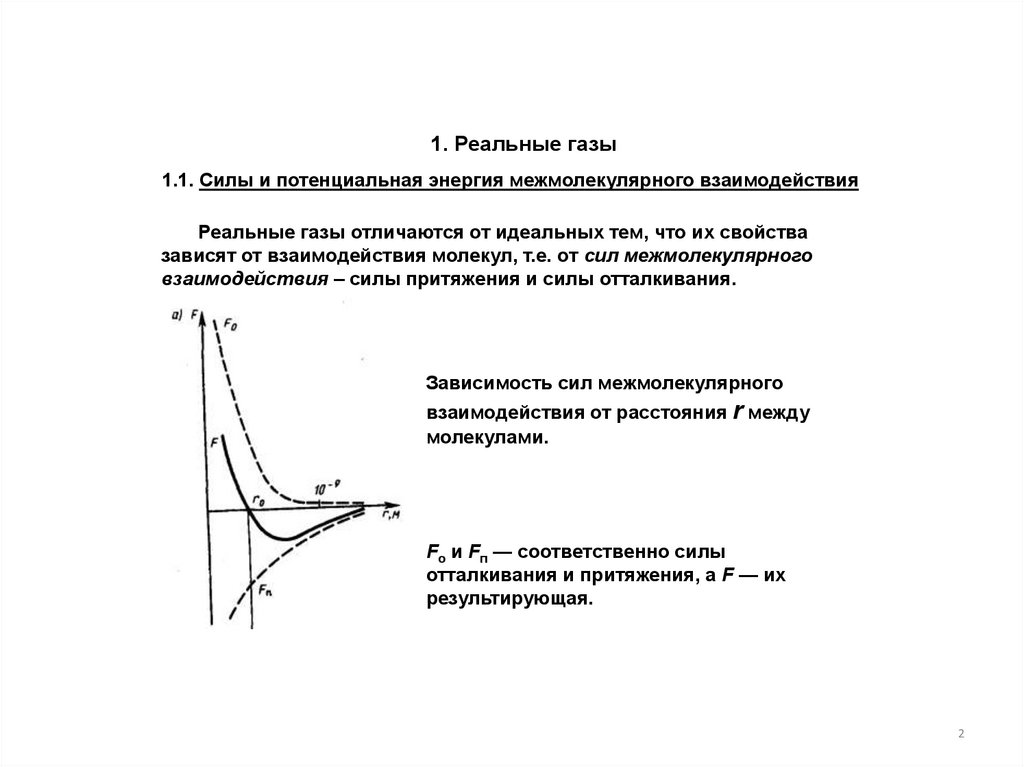
1. Реальные газы1.1. Силы и потенциальная энергия межмолекулярного взаимодействия
Реальные газы отличаются от идеальных тем, что их свойства
зависят от взаимодействия молекул, т.е. от сил межмолекулярного
взаимодействия – силы притяжения и силы отталкивания.
Зависимость сил межмолекулярного
взаимодействия от расстояния r между
молекулами.
Fо и Fп — соответственно силы
отталкивания и притяжения, a F — их
результирующая.
2
3.
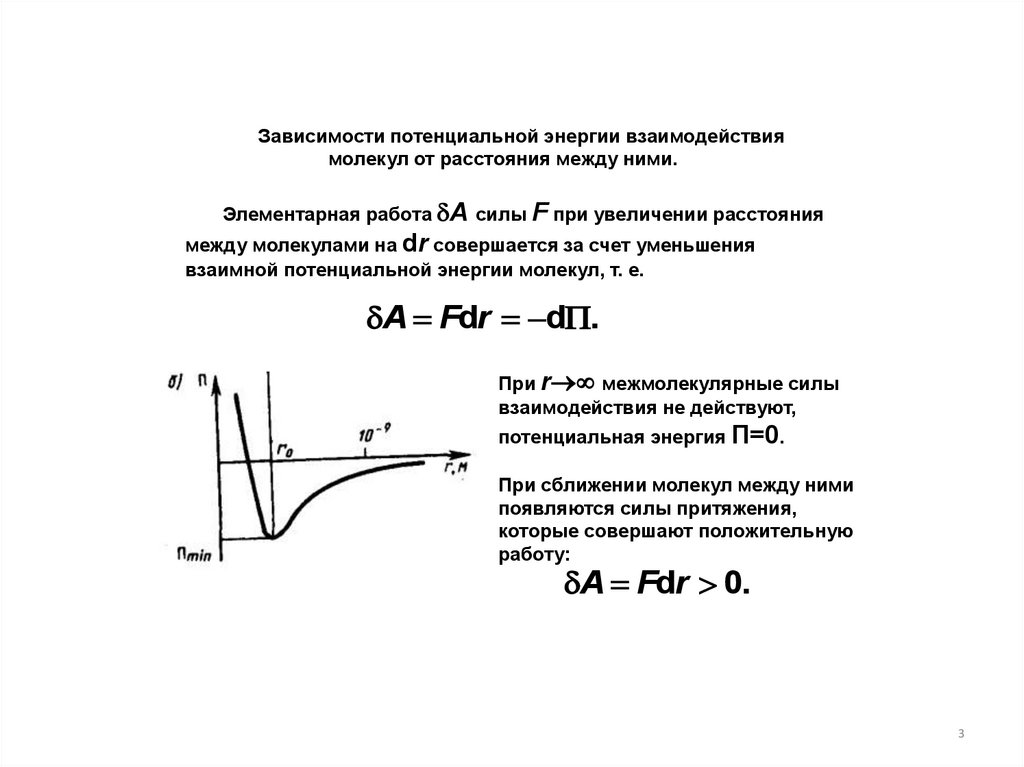
Зависимости потенциальной энергии взаимодействиямолекул от расстояния между ними.
Элементарная работа A силы F при увеличении расстояния
между молекулами на dr совершается за счет уменьшения
взаимной потенциальной энергии молекул, т. е.
A Fdr d .
При r межмолекулярные силы
взаимодействия не действуют,
потенциальная энергия П=0.
При сближении молекул между ними
появляются силы притяжения,
которые совершают положительную
работу:
A Fdr 0.
3
4.
Пmin — наименьшая потенциальная энергия взаимодействиямолекул — определяет работу, которую нужно совершить
против сил притяжения для того, чтобы разъединить
молекулы, находящиеся в равновесии
kT определяет удвоенную среднюю энергию,
приходящуюся на одну степень свободы хаотического
(теплового) движения молекул.
1.
2.
3.
Соотношение между величинами Пmin и kT является
критерием различных агрегатных состояний вещества:
Если Пmin<<kT, то вещество находится в газообразном
состоянии, так как интенсивное тепловое движение молекул
препятствует соединению молекул, сблизившихся до
расстояния r0.
Если Пmin>>kT, то вещество находится в твердом состоянии,
так как молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблются около
положений равновесия, определяемого расстоянием r0.
Если Пmin kT, то вещество находится в жидком состоянии, так
как в результате теплового движения молекулы
перемещаются в пространстве, обмениваясь местами, но не
расходясь на расстояние, превышающее r0.
4
5.
1.2. Уравнение Ван-дер-ВаальсаВан-дер-Ваальс ввел две поправки в уравнение Клапейрона —
Менделеева:
1. Учет собственного объема молекул.
Фактический свободный объем, в котором могут двигаться
молекулы реального газа, будет не Vm, а Vm – b,
где b — объем, занимаемый самими молекулами.
2. Учет притяжения молекул.
Действие сил притяжения молекул газа приводит к появлению
дополнительного давления на газ, называемого внутренним
давлением.
По вычислениям Ван-дер-Ваальса, внутреннее давление
обратно пропорционально квадрату молярного объема, т. е. :
a
p 2.
Vm
'
а — постоянная Ван-дер-Ваальса,
характеризующая силы
межмолекулярного притяжения,
Vm — молярный объем.
5
6.
С учетом поправок уравнение Ван-дер-Ваальса илиуравнение состояния реальных газов для одного моля газа
будет иметь вид:
a
p 2
VM
VМ b RT
Уравнение Ван-дер-Ваальса для произвольного количества
вещества:
2
m
a
p 2 2 V m b m RT
М
V
М М
m
, V Vm .
M
6
7.
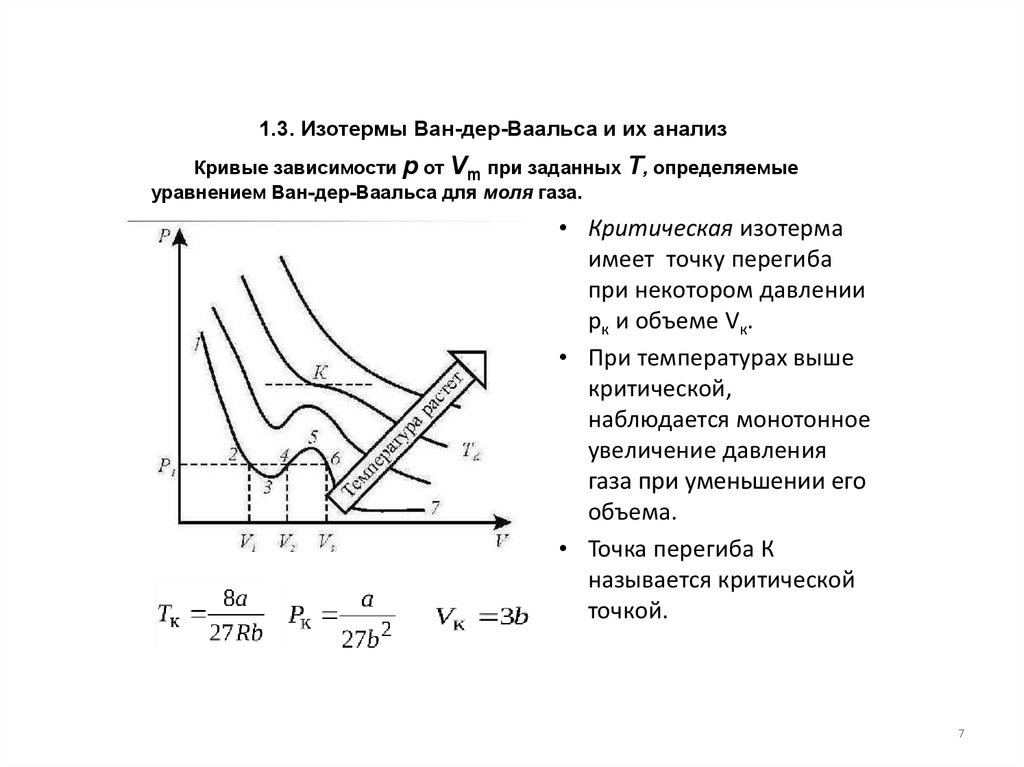
1.3. Изотермы Ван-дер-Ваальса и их анализКривые зависимости р от Vm при заданных Т, определяемые
уравнением Ван-дер-Ваальса для моля газа.
• Критическая изотерма
имеет точку перегиба
при некотором давлении
рк и объеме Vк.
• При температурах выше
критической,
наблюдается монотонное
увеличение давления
газа при уменьшении его
объема.
• Точка перегиба К
называется критической
точкой.
7
8.
Экспериментальная изотерма Т. Эндрюса• 6–7 - газообразное
состояние
• 1–2 – жидкое
• 6-2 - равновесие жидкой и
газообразной фаз
вещества (насыщенный
пар)
• 2–3 - перегретая
жидкость
• 5-6 –пересыщенный пар
• 3–4–5 не наблюдаются
экспериментально
8
9.
• Превращение реального газа в жидкость возможнотолько при температурах, меньших критической, и при
соответствующих давлениях.
9
10.
1.4. Внутренняя энергия реального газа- сумма кинетической энергии Е
хаотического теплового движения молекул
и их взаимной потенциальной энергии П.
- Кинетическая энергия (для 1 моля)
- Потенциальная энергия (для 1 моля)
10
11.
• Внутренняя энергия растет с повышениемтемпературы и увеличением давления.
11
12.
1.5. Адиабатное расширение газа в вакуум. Эффект ДжоуляТомсона.Идеальный газ: при адиабатном расширении в
вакуум его температура не изменяется
т.к.
Реальный газ:
Если
,то
, т.е. реальный газ
при адиабатном расширении в вакуум
охлаждается.
12
13.
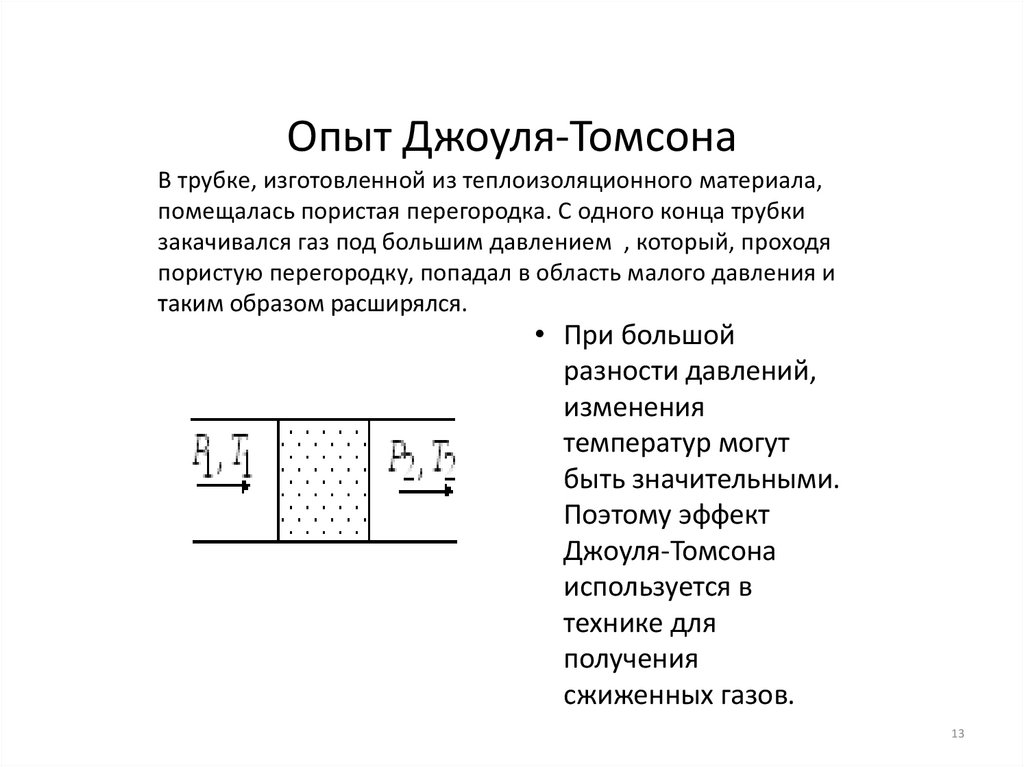
Опыт Джоуля-ТомсонаВ трубке, изготовленной из теплоизоляционного материала,
помещалась пористая перегородка. С одного конца трубки
закачивался газ под большим давлением , который, проходя
пористую перегородку, попадал в область малого давления и
таким образом расширялся.
• При большой
разности давлений,
изменения
температур могут
быть значительными.
Поэтому эффект
Джоуля-Томсона
используется в
технике для
получения
сжиженных газов.
13
14.
• Изменение температуры реального газа врезультате его адиабатического расширения, или, как говорят, адиабатического дросселирования — медленного
прохождения газа под действием перепада
давления сквозь дроссель(например, пористую перегородку), называется эффектом Джоуля — Томсона.
• Эффект Джоуля — Томсона принято
называть положительным, если газ в
процессе дросселирования охлаждается,
и отрицательным, если газ нагревается.
14
15.
1.6. Сжижение газов• самостоятельно
15











 physics
physics








